Стан ядерцевих організаторів та вміст нуклеїнових кислот у ядрах клітин епітеліальних пухлин товстої кишки
Грабовой А.Н., Антонюк С.А., Воробєй Є.А.
Резюме. Проведені дослідження показали, що самостійне застосування рівня плоїдності, клітинного спектра та стану ядерцевих організаторів для визначення ступеня злоякісності епітеліальних пухлин товстої кишки є невиправданим. Вміст ДНК у ядрах цих новоутворень, стан ядерцевих організаторів та клітинний склад можуть бути важливими вторинними показниками при визначенні властивостей пухлини і прогнозу її розвитку. Як непрямий показник ступеня життєздатності клітин та критерій для виділення їх морфофункціональних типів, здатних до подальшого розвитку, можуть бути використані зміни відносного вмісту РНК та об’єму ядерцевих організаторів у ядрах пухлинних клітин. Рівень кореляції між вмістом ДНК і сумарним об’ємом ядерцевих організаторів у ядрах клітин може бути додатковим високоінформативним критерієм для розмежування добро- та злоякісних епітеліальних новоутворень товстої кишки. Пухлини з високим рівнем анаплазії (G3) відрізняються від більш диференційованих зниженням виразності клітинної гетерогенності, що свідчить про набуття домінування в них клону/клонів зі стабільним геномом та ефективними системами життєзабезпечення.
 Ядерцеві організатори (NOR — nucleolus organizer regions) є об’єктом активного вивчення в онкології, у тому числі й стосовно пухлин товстої кишки. Показано зв’язок між кількістю NOR та виживаністю хворих на колоректальний рак [16, 19]. Проводилися дослідження, метою яких було використати кількість та стан NOR як критерій проліферативної активності в пухлині [15], ступеня її злоякісності [9], інвазивного та метастатичного потенціалу [16], прогнозу перебігу хвороби [13]. NOR використовують як критерії у гістологічній оцінці відповіді пухлин на лікування [1, 18]. Зазначені дані про можливість використання стану NOR у клітинах епітеліальних пухлин товстої кишки (ЕПТК) для визначення їх злоякісності та прогнозу на сьогодні не отримали широкого застосування, що непрямо свідчить про їх невисоку інформативність. Можливо, це пов’язано з тим, що при оцінці стану NOR у клітинах колоректального раку не враховувалася гетерогенність як самих пухлин, так і їх клітинного складу.
Ядерцеві організатори (NOR — nucleolus organizer regions) є об’єктом активного вивчення в онкології, у тому числі й стосовно пухлин товстої кишки. Показано зв’язок між кількістю NOR та виживаністю хворих на колоректальний рак [16, 19]. Проводилися дослідження, метою яких було використати кількість та стан NOR як критерій проліферативної активності в пухлині [15], ступеня її злоякісності [9], інвазивного та метастатичного потенціалу [16], прогнозу перебігу хвороби [13]. NOR використовують як критерії у гістологічній оцінці відповіді пухлин на лікування [1, 18]. Зазначені дані про можливість використання стану NOR у клітинах епітеліальних пухлин товстої кишки (ЕПТК) для визначення їх злоякісності та прогнозу на сьогодні не отримали широкого застосування, що непрямо свідчить про їх невисоку інформативність. Можливо, це пов’язано з тим, що при оцінці стану NOR у клітинах колоректального раку не враховувалася гетерогенність як самих пухлин, так і їх клітинного складу.
Зміни кількості ДНК у ядрах клітин ЕПТК є типовим явищем [1, 5, 10], що пов’язано з хромосомною нестабільністю, яка реалізується в поліплоїдії та анеуплоїдії [10]. На сьогодні отримано значну кількість даних, які показують зв’язок між змінами геному при ЕПТК та характером перебігу захворювання [11, 14]. Проведено багато досліджень з метою виявлення зв’язку між вмістом ДНК (плоїдністю) у ядрах пухлинних клітин та гістологічним типом пухлини і, перш за все, з її злоякісним потенціалом [1, 11, 17]. Отримані дані щодо кількості ДНК у ядрах клітин та прогнозу при колоректальному раку дали підґрунтя для формування уявлення про важливість цього показника, який сам собою не є абсолютним, що пов’язано з мінливістю даного явища.
Вищезазначене стало приводом до пошуку більш інформативних об’єктивних показників злоякісності та прогнозу ЕПТК, які враховують зміни кількості ДНК та/або стану NOR [5, 6, 8, 14].
Мета роботи — встановити зв’язок між вмістом нуклеїнових кислот (НК) та станом NOR в клітинах ЕПТК.
Об’єкт та методи дослідження
Дослідження проведено на матеріалі біопсій або вилученому при оперативному втручанні від 130 пацієнтів з ЕПТК: поліпи та аденоми (В) — 16; новоутворення з ознаками малігнізації (М) — 22; аденокарцинома G1 (G1) — 6; аденокарцинома G2 (G2) — 75; аденокарцинома G3 (G3) — 11. Гістологічне типування новоутворень проводили з використанням рутинного (гематоксилін й еозин) забарвлення.
Отриманий матеріал фіксували в забуференому 10% формаліні з pH 7,4 та ущільнювали у парафін із застосуванням гістопроцесора «Histos-5» («Milestone», Італія). З отриманих блоків виготовляли гістологічні зрізи товщиною 5 мкм за допомогою мікротома «Microm НМ325» («Thermo Scientific», Німеччина). Зрізи забарвлювали гематоксиліном й еозином та азур-ІІ-еозином для загальної оцінки будови пухлини, галоціанін-хромовим галуном за Ейнарсоном (pH 1,62, 37 °С, 24 год) для виявлення вмісту НК у клітинах [2, 3]. Для кожного випадку частину зрізів обробляли РНКазою («MACHEREY-NAGEL GmbH & Co. KG», Німеччина) для екстракції РНК [2]. NOR виявляли імпрегнацією азотнокислим сріблом за оригінальним способом (патент № 80458). Отримані препарати вивчали та фотографували за допомогою мікроскопа «Nikon Eclipse 80i» з камерою DS-5SMc/L2 за стандартних умов. На зображеннях з препаратів (збільшення мікроскопа х400, 1280×960 пікселів RGB) у кожній пухлині за допомогою системи аналізу зображення ImageJ 1,46 визначали: у 50 клітинах площу перетину ядра клітини (Narea), кількість (nNOR) та діаметр кожного NOR з наступним розрахунком їх об’єму (vNOR); у 60 клітинах: площу перетину ядра клітини (Narea), інтегративну оптичну щільність ядра клітини і розраховували об’єм ядра (NV) та вміст у ньому сумарної кількості нуклеїнових кислот (NНК) і ДНК (NДНК).
У якості вихідної точки відліку для оцінки вмісту NНК/NДНК у ядрах пухлинних клітин використали показники, прийняті за одиницю, притаманні ядрам лімфоцитів (2с), що знаходилися у стромі пухлин. Клітини кожної окремої пухлини ранжировано за вмістом ДНК в ядрі. Отриману послідовність поділено на ранги з кроком, що дорівнював середньому вмісту ДНК у ядрах лімфоцитів: Р1 — до 1, Р2 — 1–2, Р3 — 2–3 і т.д. Клітини кожної пухлини при забарвленні на сумарні НК та NOR ранжировано за Narea/NV. Отримані послідовності поділено на ранги за середніми значеннями Narea/NV, визначеними для рангів за вмістом ДНК. У межах кожного рангу визначали кількість клітин, середні значення Narea, NV, NДНК чи NНК. Вміст РНК у ядрах клітин обчислювали як різницю між NНК і NДНК для кожної пари рангів. Отримані цифрові дані обробляли стандартними статистичними методами.
Результати та їх обговорення
Проведені дослідження показали, що клітини ЕПТК за вмістом ДНК можуть бути поділені на ранги від Р1 до Р10. Але для більшості середніх значень параметрів, починаючи з Р6, р>0,05, тому вони не можуть бути використані для подальшого статистичного аналізу, і їх об’єднували у один ранг.
Середнє значення вмісту ДНК у ядрах клітин пухлин різного ступеня дедиференціювання коливається від 1,86 (G3) до 2,43 (М) (рис. 1). При цьому мають місце статистично достовірні відмінності між М та В і G1 (р<0,05 за критеріями Стьюдента та Фішера), а відмінності між різними G не є достовірними (р>0,05).
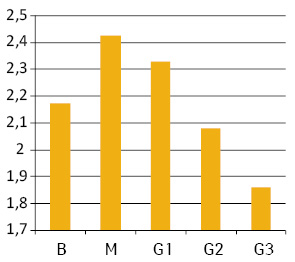
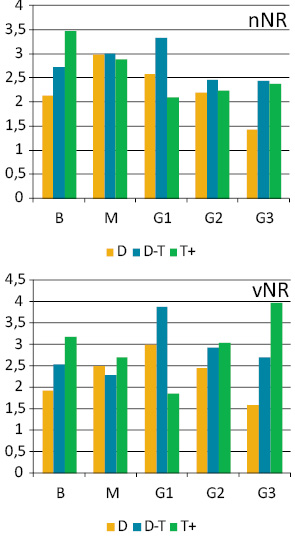
Ранжування пухлин за середнім вмістом ДНК у ядрах їх клітин дозволило поділити їх на 3 підгрупи: диплоїдні (D — середній вміст ДНК у ядрах до 1,2); проміжні між ди- та тетраплоїдними (D-T — середній вміст ДНК у ядрах від 1,2 до 2,5); гіперплоїдні (T+ — середній вміст ДНК понад 2,5) (рис. 2). З’ясувалося, що кожна з груп пухлин (за ступенем анаплазії) включає всі 3 визначені підгрупи (див. рис. 2).
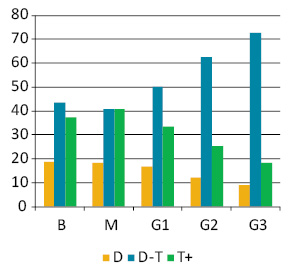
Клітинний склад (спектр) ЕПТК, визначений за вмістом ДНК у їх клітинах, має помірний ступінь залежності від ступеня анаплазії (рис. 3). У цілому, у міру зростання середнього значення плоїдності відбувається зміщення клітинного спектра пухлини до збільшення відносної кількості клітин зі збільшеним вмістом ДНК у ядрах.
Вміст РНК у ядрах пухлинних клітин виявив зворотну залежність від вмісту ДНК — тобто, у міру зростання вмісту ДНК відбувається зменшення її відносного вмісту. Ці зміни не продемонстрували залежності від ступеня анаплазії пухлини (достовірно не відрізняються) (рис. 4).
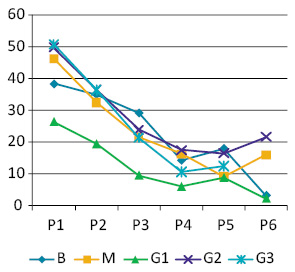
Показники вмісту ДНК, НК і розмірів ядер пухлин (Narea, NV) виявили пряму залежність, яка зберігається до рангів Р5–Р6 (коефіцієнт кореляції 0,96–0,98). У клітинах, які належать до більш високих рангів, ці пропорції порушуються, а кореляція стає нижчою за значення, що вказують на пряму залежність між цими показниками. Це може бути пов’язано як із незначною кількістю таких клітин у складі пухлин, так і суттєвою їх мінливістю. Такі клітини мають ядра з площею перетину понад 50–52 мкм2 і об’ємом понад 300 мкм3. Для цих клітин є характерними явища каріопікнозу або, навпаки, набряку ядра та лізису хроматину. Слід також зазначити, що каріопікноз порівняно часто виявляють і в малих клітинах, які були віднесені нами до рангу Р1.
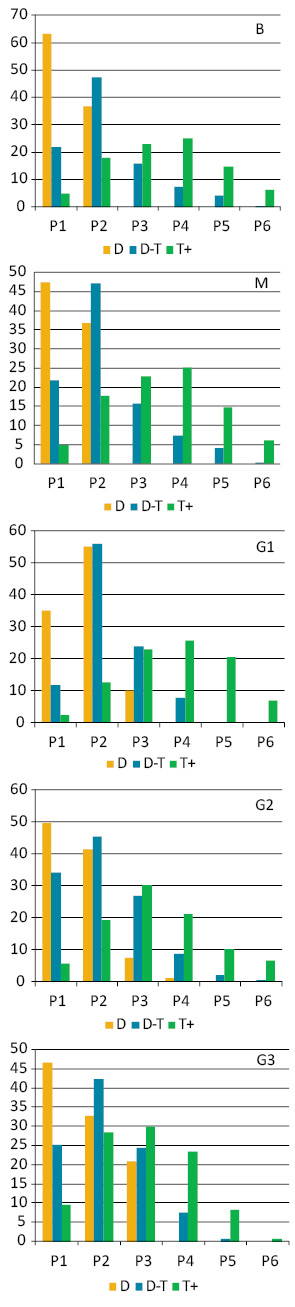
Загалом, кількість NOR у ядрах клітин ЕПТК у міру підвищення ступеня анаплазії проявляла тенденцію до зменшення, а їх сумарний обсяг зростав (рис. 5), хоча різниця між типами пухлин, які межують, у цілому є недостовірною. При цьому відсутня пряма залежність між кількістю та сумарним об’ємом NOR (індекс кореляції 0,34).
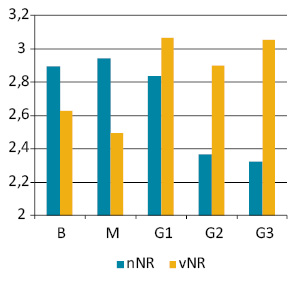
Кількість і сумарний об’єм NOR (рис. 6) в ядрах клітин доброякісних новоутворень (В) перебуває в прямій залежності від їх плоїдності (індекс кореляції 0,98), а в граничних (М) та злоякісних пухлинах (G1–2) ця залежність порушується, й кореляція є нижчою за значення, що вказують на пряму залежність між цими показниками. Але у пухлинах G3 визначається достовірна пряма залежність між vNOR і плоїдністю їх клітин (індекс кореляції 0,89).
Оцінка зв’язку між станом NOR та кількістю ДНК/НК у ранжованих рядах пухлинних клітин групи В виявила високу ступінь зв’язку між ДНК-vNOR (0,92) і М — (0,96), а також між НК-vNOR (0,87 і 0,97 відповідно). У злоякісних пухлинах пряма залежність між цими показниками відсутня.
Достовірної залежності між станом NOR та вмістом РНК у ядрах досліджених пухлин не виявлено (р>0,05).
Отже, враховуючи те, що до усіх типів ЕПТК, виділених за ступенем анаплазії (В, М, G1, G2, G3), входять пухлини з різним вмістом ДНК, який відповідає ди-, тетра- або поліплоїдному, плоїдність не може бути використана як самостійний показник для уточнення стадії розвитку пухлини, як це пропонують ряд авторів [1]. Стан (кількість та об’єм) NOR у цілому, виходячи з клітинної гетерогенності ЕПТК, не відображає ступінь пухлинної трансформації та не може бути самостійним критерієм для її оцінки.
Різноманітність клітинного складу ЕПТК за вмістом ДНК та станом NOR, які є ланками єдиного ланцюга реалізації спадкової інформації, є непрямим показником різноманітності властивостей та життєздатності пухлинних клітин. Відповідно, це є достатнім приводом для включення даних критеріїв до комплексної оцінки властивостей пухлини.
Зменшення відносного вмісту РНК та відсутність пропорційного збільшення кількості/об’єму NOR у ядрах клітин пухлини у міру зростання вмісту ДНК вказує на те, що додаткова ДНК є функціонально обмеженою або неактивною. Це може виступати у якості ознаки зниження життєздатності таких клітин, що веде до старіння, апоптозу та елімінації їх морфофункціональних типів зі складу пухлини [7, 12]. Підтвердженням цього є високий рівень кореляції між вмістом ДНК та vNOR у доброякісних новоутвореннях, що закономірно очікувалося, і після порушення цієї залежності у ряду М-G2 — її відновлення у G3.
Підвищення клітинної гетерогенності серед досліджених нами ЕПТК як за вмістом ДНК, так і за морфологічними ознаками, відзначали у ряду від B до G2. Можна припустити, що серед цього різноманіття клітин будуть такі, які зберегли ефективні системи життєзабезпечення, та такі, в яких вони порушені. Останнє підтверджується поширеністю ознак дегенерації серед клітин рангу Р6 і вище, а також порівняно частою ознакою каріопікнозу серед клітин Р1. Це свідчить про те, що у міру прогресування пухлини з її складу елімінуються нежиттєздатні морфофункціональні типи клітин. Разом з тим з клітинного різноманіття виділяються такі, які, маючи спотворений генотип, зберігають високу проліферативну активність, ефективну систему життєзабезпечення та втрачають специфічні функції інтегрування у тканинні комплекси та є основою для виникнення стійких клонів, здатних до необмеженого існування. Це підтверджується тим, що у пухлинах G3 звужується спектр її клітинного складу. При цьому переважаючими в них стають клітини D-T, що, з урахуванням високої проліферативної активності, дозволяє розглядати їх як диплоїдні, такі, в яких відбувається синтез ДНК.
Висновки
Самостійне застосування рівня плоїдності, клітинного спектра та стану NOR для визначення ступеня злоякісності ЕПТК є невиправданим. Вміст ДНК у ядрах ЕПТК, стан NOR та клітинний склад можуть бути важливими вторинними показниками при визначенні властивостей пухлини і прогнозу її розвитку.
Як непрямий показник ступеня життєздатності клітин та критерій для виділення їх морфофункціональних типів, здатних до подальшого розвитку, можуть бути використані зміни відносного вмісту РНК та об’єму NOR у ядрах клітин ЕПТК.
Рівень кореляції між вмістом ДНК і сумарним об’ємом NOR у ядрах пухлинних клітин може бути додатковим високоінформативним критерієм для розмежування добро- та злоякісних ЕПТК.
ЕПТК з високим рівнем анаплазії (G3) відрізняються від більш диференційованих зниженням виразності клітинної гетерогенності, що свідчить про набуття домінування в них клону/клонів зі стабільним геномом та ефективними системами життєзабезпечення.
Список використаної літератури
1. Автандилов Г.Г. (2006). Диагностическая медицинская плоидометрия. Медицина, Москва, 192 c.
2. Лупа Х. (1980). Основы гистохимии (Пер. с немец.). Мир, Москва, 344 с.
3. Ташке К. (1980) Введение в количественную цито-гистологическую морфологию. (Пер. с рум.). Из. Акад. Соц. Респ. Румынии, 192 с.
4. Aranganathan S., Nalini N. (2013) Antiproliferative efficacy of hesperetin (citrus flavanoid) in 1,2-dimethylhydrazine-induced colon cancer. Phytother. Res., 27(7): 999–1005.
5. Compton C.C., Fielding L.P., Burgart L.J. et al. (2000) Prognostic Factors in Colorectal Cancer. Arch. Pathol. Lab. Med., 124: 979–994.
6. Dalton W.B., Yang V.W. (2007) Mitotic Origins of Chromosomal Instability in Colorectal Cancer. Curr. Colorectal. Cancer Rep., 3(2): 59–64; 27: 585–610.
7. Davoli T., de Lange T. (2011) The Causes and Consequences of Polyploidy in Normal Development and Cancer. Ann. Rev. Cell Dev. Biol., 27: 585–610.
8. Derenzini M., Trere D., O’Donohue M.-F., Ploton D. (2003) Interphase Nucleolar Organiser Regions in Tumour Pathology. In: Molecular Biology in Cellular Pathology/ Ed.: J. Crocker and P.G. Murray. John Wiley & Sons Ltd.: 137–152.
9. Eminović-Behrem S., Trobonjaca Z., Petrovecki M. et al. (2000) Prognostic significance of DNA ploidy pattern and nucleolar organizer regions (AgNOR) in colorectal carcinoma. Croat. Med. J., 41(2): 154–158.
10. Hadjihannas M.V., Brückner M., Jerchow B. et al. (2006). Aberrant Wnt/β-catenin signaling can induce chromosomal instability in colon cancer. PNAS, 103(28): 10747–10752.
11. Hixon C., Furlong J., Silbergleit A. (1995) Flow cytometry in colon cancer: does flow cytometric cell cycle analysis help predict for short-term recurrence in patients with colorectal carcinoma? J. Natl. Med. Assoc., 87(11): 803–806.
12. Holland A.J., Cleveland D.W. (2012) Losing balance: the origin and impact of aneuploidy in cancer. EMBO, 13(6): 501–514.
13. Joyce W.P., Fynes M., Moran K.T. et al. (1992) The prognostic value of nucleolar organiser regions in colorectal cancer: a 5-year follow-up study. Ann. R. Coll. Surg. Engl., 74(3): 172–6; discussion 176–177.
14. Kørner H. (2009) Microsatellite instability and DNA ploidy in colorectal cancer. Cancer, 115, Issue 2: 271–282.
15. Losi L., DiGregorio C., Fante R. et al. (1995) Argyrophilic nucleolar organizer regions and bromodeoxyuridine and 3[H]-thymidine labelling indices in colorectal cancer. Cell Prolif., 28(9): 471–480.
16. Morita M., Kuwano H., Matsuda H. et al. (1991) Prognostic Significance of Argyrophilic Nucleolar Organizer Regions in Esophageal Carcinoma. Cancer Research, 51: 5339–5341.
17. Park S.U., Choi E.S., Jang Y.S. et al. (2011) Effects of Chromosomal Polyploidy on Survival of Colon Cancer Cells. Korean J. Gastroenterol., 57(3): 150–157.
18. Panneer S.J., Aranganathan S., Nalini N. (2008) Aberrant crypt foci and AgNORs as putative biomarkers to evaluate the chemopreventive efficacy of pronyl-lysine in rat colon carcinogenesis. Invest. New Drugs., 26(6): 531–540.
19. Rüschoff J., Bittinger A., Neumann K., Schmitz-Moormann P. (1990) Prognostic Significance of Nucleolar Organizing Regions (NORs) in Carcinomas of the Sigmoid Colon and Rectum Pathology Research and Practice,186, Issue 1: 85–91.
Состояние ядрышковых организаторов и содержание нуклеиновых кислот в ядрах клеток эпителиальных опухолей толстой кишки
Резюме. Проведенные исследования показали, что самостоятельное использование уровня плоидности, клеточного спектра и состояния ядрышковых организаторов для определения степени злокачественности эпителиальных опухолей толстой кишки неоправданно. Содержание ДНК в ядрах этих новообразований, состояние ядрышковых организаторов и клеточный состав могут быть важными вторичными показателями при определении свойств опухоли и прогноза ее развития. Как косвенный показатель степени жизнеспособности клеток и критерий для выделения их морфофункциональных типов, способных к дальнейшему развитию, могут быть использованы изменения относительного содержания РНК и объема ядрышковых организаторов в ядрах клеток. Уровень корреляции между содержанием ДНК и суммарным объемом ядрышковых организаторов в ядрах клеток может быть дополнительным высокоинформативным критерием для разграничения добро- и злокачественных эпителиальных новообразований толстой кишки. Опухоли с высоким уровнем анаплазии (G3) отличаются от более дифференцированных снижением выраженности клеточной гетерогенности, что свидетельствует о доминировании в них клона/клонов со стабильным геномом и эффективными системами жизнеобеспечения.
Ключевые слова: эпителиальные опухоли толстой кишки, нуклеиновые кислоты, ядрышковый организатор.
The nucleolus organizer regions’ state and nucleic acids contents in the colon tumor epithelial cells’ nuclei
Summary. The carried out studies have shown, that self-application of the ploidy level, cellular spectrum and the nuclear organizer regions’ state cannot fully rely to determine the colon epithelial tumors malignancy grade. DNA content in these tumors nuclei, nuclear organizer regions state and cellular composition may be important secondary indicator in determining the tumor characteristic and predict its further development. Changing’s in RNA content and nucleolus organizer regions volume within the tumor cells nuclei can be used as an indirect measure of the cell viability grade and criteria for singling out their morphofunctional types, capable of further development. The correlation level between DNA content and total nucleolus organizer regions volume within the cells nuclei may be additional highly informative criterion for distinguishing between good and malignant colon epithelial tumors. Tumors with high levels of anaplasia (G3) differentiates itself among others, more differentiated ones, by a reduction of cellular heterogenicity level, what gives evidence of clone’s dominance with a stable gene and efficient life support systems within them.
Key words: epithelial colon cancer, nucleic acids, nucleolus organizer region.














Leave a comment