Необходимоcть проведения рутинной компьютерной томографии после окончания лечения пациентов с лимфомами
Крячок И.А., Филоненко Е.С., Мартынчик А.В., Кущевой Е.В.
Резюме. После окончания лечения пациентов с лимфомами перед клиницистом стоит выбор, каким образом, как часто и надо ли вообще проводить дальнейшее наблюдение пациента. Особенно сложным решение может быть относительно необходимости проведения компьютерной томографии в связи с ее высокой стоимостью и лучевой нагрузкой. В данной статье представлен обзор литературы, посвященной рутинному проведению компьютерной томографии в период наблюдения больных, а также собственные данные относительно частоты выявления рецидивов при проведении рутинной компьютерной томографии и без нее и влияния такого обследования на дальнейшие результаты лечения.

Современный уровень оказания помощи пациентам с лимфомами позволяет достичь удовлетворительных результатов терапии с высокой частотой положительного ответа на лечение, а также длительных ремиссий. Это ставит новые задачи перед клиницистами, в том числе: как часто и с помощью каких методов следует осуществлять скрининг больных лимфомами после окончания лечения.
Необходимость самого по себе наблюдения вряд ли вызывает сомнения. Различные типы лимфом склонны к рецидивированию, также известен риск развития вторичных опухолей и других токсических эффектов химиолучевой терапии по ее завершении. Это, в свою очередь, обусловливает необходимость своевременного выявления и назначения терапии того или иного заболевания.
Данная статья в основном посвящена роли проведения компьютерной томографии (КТ) как рутинного метода обследования пациентов с лимфомами после окончания лечения. Хотя этот метод имеет высокую информативность, позволяющую в высокой степени заподозрить рецидив заболевания, лучевая нагрузка при одном КТ-исследовании, а также высокая стоимость метода являются главными его недостатками.
С момента появления КТ как диагностического метода и внедрения его в схемы рутинного обследования пациентов с лимфомами, необходимость его применения активно обсуждается клиницистами. Для анализа эффективности и целесообразности такого подхода нами произведен обзор публикаций, посвященных обследованию пациентов с помощью проведения регулярных КТ-исследований после окончания лечения лимфом с помощью поисковой базы PubMed с использованием ключевых слов «computed tomography, lymphoma, follow-up». Всего найдено 1170 публикаций за период с 1977 по 2011 г. Однако для написания данной статьи выбраны только 28 источников (с 1986 по 2011 г.), наиболее соответствующие избранной теме.
В основу современных рекомендаций по обследованию пациентов с лимфомами положены рекомендации Cotswolds, 1989 г. [1]. В них указано, что наблюдение пациента необходимо осуществлять каждые 3 мес в первые 2 года по окончании лечения, каждые 4 мес на 3-ем году и каждые 6 мес в период до 5 лет, затем — ежегодно. Авторы рекомендовали определять частоту и вид радиографического исследования в зависимости от первичного поражения опухолью. Более точные указания касательно этих исследований в данных рекомендациях не зафиксированы.
Среди других радиографических методов КТ может быть самым удобным и информативным для выявления рецидивов заболевания. Исследования 80–90-х годов ХХ века свидетельствуют о возможной важной роли рутинных КТ-исследований у пациентов как с лимфомой Ходжкина (ЛХ), так и неходжкинскими лимфомами (НХЛ).
В частности, в 1990 г. A.P. Garribba и соавторы опубликовали результаты исследования роли КТ в стадировании опухолевого процесса и наблюдении пациентов с ЛХ. Среди 120 пациентов, включенных в исследование, КТ оказалась более информативной в сравнении с рентгенографией органов грудной полости (ОГП). Особенно значимыми преимущества КТ были для пациентов, находящихся под наблюдением после окончания лечения. В результате этого авторы делают вывод о высокой информативности проведения КТ в сравнении с рентгенографией ОГК у пациентов с ЛХ, окончивших лечение по поводу ЛХ [2].
Аналогичные данные опубликованы ранее в 1986 г. L. Rezvani и соавторами в исследовании, посвященном роли КТ в диагностике, оценке ответа на терапию и выявлении рецидива заболевания у пациентов с лимфомой Беркитта [3].
Позже исследователями получены дaнные, противоречащие вышеприведенным. Так, результаты исследования J.A. Radford и соавторов показали, что 81% рецидивов у пациентов с ЛХ были выявлены на основании клинической картины [4].
E.T. Dryver и соавторы опубликовали результаты исследования, в котором среди пациентов, получивших лечение по поводу ЛХ, проводили оценку выявления рецидивов. В ретроспективный анализ включены данные 187 пациентов с ЛХ, находившихся под наблюдением в Toronto Sunnybrook Regional Cancer Centre (Онтарио, Канада) в период с 1990 по 1999 г. после окончания лечения. Данные по наблюдению после окончания лечения собраны у 107 лиц [5].
Наблюдение пациентов осуществляли каждые 3 мес первые 2 года, каждые 6 мес на протяжении 3–5 лет и далее — ежегодно. Наблюдение включало опрос больного, клинический осмотр, рентгенографию ОГП, общий анализ крови. Другие радиографические тесты проводили по рекомендации врача. Медиана наблюдения составила 38 мес (1–120 мес).
Рецидив заподозрен в 109 случаях у 68 пациентов: в 42% — на основании жалоб и опроса больного, 26% — на основании результатов осмотра врача, 28% — на основании радиографических методов и 4% случаев на основании лабораторных данных. Подтверждение рецидива получено у 22 больных. Из них у 10 пациентов рецидивы заподозрены на основании жалоб больного, у 4 — на основании результатов осмотра врача, у 6 — визуализирующих методов исследования. Среди последних 6 пациентов у 4 — на основании рентгенографии, 2 — КТ. Из 25 ложноположительных данных о рецидиве 7 заключений сделаны на основании рентгенографии, 12 — КТ, 5 — сканирования с галлием, 1 — ультразвукового исследования.
Таким образом, большинство рецидивов выявлено на основании жалоб больного, четверть — исходя из результатов радиографических исследований, но это составляет половину стоимости всего наблюдения за период исследования. 9% КТ-исследований, при которых выявлен рецидив, составляют 29% стоимости всех исследований в период наблюдения. Кроме того, рутинная КТ в 6 раз чаще, чем другие методы исследования, позволяет предположить ложный рецидив заболевания. Таким образом, авторы работы настаивают на исключении рутинного КТ-сканирования из алгоритма наблюдения пациентов с ЛХ после окончания лечения.
B.A. Guadagnolo и соавторы сконструировали модель финансовой оправданности рутинного ежегодного проведения КТ у пациентов после окончания лечения при ЛХ. Выявлено, что 92% пациентов с рецидивом имеют симптомы заболевания. Также установлено, что стоимость проведения КТ в таком режиме составляет от 149 900 до 291 500 долл. США в год жизни больного, помимо расходов на другие рутинные вмешательства. Кроме того, отмечено крайне негативное влияние ложноположительных результатов КТ на качество жизни пациентов [6].
Опубликованные в 2010 г. канадскими учеными D. Hodgson и соавторами результаты ретроспективного популяционного исследования по изучению методов обследования, проводимых в период после окончания лечения ЛХ, продемонстрировали сходные данные. Проведение КТ у этой группы пациентов редко приводило к выявлению рецидивов и началу второй линии терапии. А вот скрининговые исследования по выявлению вторичных опухолей (в частности ранний скрининг рака грудной железы) были выполнены в недостаточном количестве.
В вышеуказанное исследование были включены данные всех пациентов, которые находились под наблюдением с 1992 по 2002 г. в клинике Университета Онтарио за период от 1 до 15 лет. Эти пациенты посещали врача в среднем 4 раза в год и имели хотя бы одно радиографическое исследование. Всего больным проведено 5352 КТ-сканирований. 66% пациентов прошли это исследование в течение 2–5-го годов после окончания лечения, 44,4% — на протяжении 6–9-го годов после окончания лечения и 32,7% — в период 10–15 лет после окончания лечения.
У пациентов, которые получали химиотерапию в университетской клинике, КТ проводили значительно чаще, чем у проходивших лечение не в научно-исследовательских госпиталях. У около 40% пациентов, имевших показания к проведению скрининга возникновения злокачественных опухолей других локализаций, не применяли эти методы. После 5352 проведенных исследований в период от 2 до 5 лет после окончания терапии лишь у 125 пациентов инициировано лечение при рецидиве заболевания. В заключение авторы указывают, что избежать проведения КТ у пациентов с ЛХ в этот период возможно, а усилия пациентов и наблюдающих их врачей должны быть направлены на проведение тестов для выявления признаков других заболеваний [7].
В своей статье A. Ng, L.S. Constine, посвященной наблюдению пациентов в период после окончания лечения ЛХ, утверждают, что, принимая во внимание полученные в последнее время данные, не остается места для рутинных радиографических исследований в период первых 5 лет после окончания лечения ЛХ. Лишь для пациенток, получавших лучевую терапию на зону средостения в возрасте до 35 лет, рекомендован ежегодный скрининг по поводу рака грудной железы [8].
J.C. Weeks и соавторы проанализировали данные 108 пациентов с рецидивом агрессивных НХЛ, которые получили лечение по поводу рецидива с использованием курса ПХТ ICE и последующей высокодозной терапией с поддержкой аутологичными гемопоэтическими стволовыми клетками (ВДХТ + АТГСК). У 80% этих пациентов рецидив заподозрен на основании их жалоб или результатов клинического обследования и у 20% — на основании радиологических исследований. Авторы выявили, что пациенты из второй группы принадлежали к группе низкого риска и имели тенденцию к несколько более высоким, однако недостоверно, показателям 5-летней выживаемости (54 vs 43%) [9].
В исследовании K. Nakamura и соавторов изучены пути выявления рецидивов у 101 пациента с локализованными стадиями НХЛ (преимущественная локализация очагов лимфомы — голова и шея). У 31 пациента диагностирован рецидив заболевания. У 17 больных (56,4%) рецидив заподозрен на основании симптомов, у 10 (32,2%) — данных клинического осмотра. При проведении КТ рецидивы выявлены у 3 пациентов, сканирования с галлием — у 2 и при повышении уровня лактатдегидрогеназы (ЛДГ) — у 2 больных. 72,7% пациентов с симптомами рецидива имели распространение заболевания, соответствующее III–IV стадии, в то время как 70,6% пациентов с асимптомным течением — I–II стадии [10].
A. Elis и соавторы проанализировали данные 30 пациентов с рецидивом агрессивных НХЛ, обследование которых после успешного окончания проведения ПХТ первой линии проходило по интенсивному алгоритму, включавшему частые визиты к врачу, лабораторные тесты (общий анализ крови и уровень ЛДГ), а также рутинное КТ-исследование. 25 (83%) рецидивов выявлены при клиническом обследовании больных и 5 (17%) — при применении лабораторных или радиографических методов. Большинство рецидивов возникли в месте первичной локализации опухоли. Таким образом, исследователи делают вывод, что наиболее приемлемая схема ведения этих больных должна заключаться в частом наблюдении и клиническом обследовании [11].
В исследовании A.E. Guppy и соавторов среди пациентов с диффузной В-крупноклеточной лимфомой (ДВККЛ) только 5,7% рецидивов выявлены при проведении рутинного КТ-исследования у бессимптомных пациентов [12].
В статье J.O. Armitage, F.R. Loberiza проводят анализ источников литературы, касающейся рутинного обследования пациентов с агрессивными лимфомами после окончания первой линии терапии, и также приходят к заключению, что этот метод не стоит использовать на рутинной основе [13].
J.Y. Choi и соавторы провели исследование, посвященное роли КТ в выявлении рецидива заболевания у пациентов с индолентными лимфомами, в частности MALT-лимфомой (mucosa-associated lymphoid tissue) желудка. В этой работе среди 122 пациентов с H. pylori-позитивной лимфомой желудка зарегистрировано 7 рецидивов, ни один из них не имел распространения за пределы желудка и все верифицированы только с помощью эндоскопических исследований. В результате авторы делают выводы о нецелесообразности проведения КТ для этой группы пациентов [14].
Авторы другого исследования у 125 пациентов с рецидивом ЛХ и агрессивных НХЛ, у которых диагноз лимфомы установлен в 1993–2008 гг., также изучали применение методов, с помощью которых был выявлен рецидив заболевания. В группу включены пациенты, у которых рецидив возник по крайней мере через 1 мес после окончания лечения. 62% рецидивов выявлены на основании клинической картины, особенно у пациентов с агрессивными НХЛ и наличием экстранодального поражения при установлении диагноза (p<0.05). Среди пациентов, у которых рецидивы выявлены с помощью визуализирующих методов исследования, показатели выживаемости не были выше [15].
На ежегодной конференции ASCO (American Society of Clinical Oncology) в 2013 г. представлены результаты проспективного исследования C.A. Thompson и соавторов. Целью исследования было определение наиболее эффективной стратегии обследования пациентов после окончания лечения при ДВККЛ. Тактику обследования в период наблюдения определял лечащий врач. Среди 644 пациентов, включенных в исследование в период 2002–2009 гг., использовали данные 537 больных. Рецидив зарегистрирован у 109 пациентов, 62% лиц обратились к врачу ранее запланированного визита в связи с появлением симптомов заболевания.
Среди этой группы в момент регистрации рецидива 68% пациентов имели симптомы заболевания, у 42% обнаружены патологические изменения при физикальном обследовании, у 55% — повышение уровня ЛДГ, 87% имели один или более вышеуказанных признаков. Среди 38 больных, у которых рецидив выявлен во время планового визита, 26 пациентов имели клинические проявления рецидива, а у 12 признаки заболевания отмечены при плановом радиографическом обследовании, причем 4 из них при проведении ПЭТ-исследования (позитронно-эмиссионной томографии) во время окончания первой линии терапии имели остаточные очаги накопления радиоактивной метки.
Таким образом, проведение планового радиографического исследования позволило выявить рецидив у 8 (1,5%) пациентов. В результате авторы делают вывод о низкой информативности планового радиографического обследования в выявлении рецидивов ДВККЛ [16].
С другой стороны, по мнению M. Hutchings, проведение рутинных КТ и ПЭТ/КТ стоит практиковать у пациентов группы высокого риска. Автор рекомендует прекращать проведение этих исследований спустя 2 года после окончания лечения даже у этой группы пациентов с агрессивными НХЛ и ЛХ, так как до 90% рецидивов заболевания случается именно в этот период. Для пациентов с индолентными лимфомами вообще не имеет смысла проведение каких-либо исследований при отсутствии симптомов заболевания, так как показанием к началу терапии у этих больных является их наличие [17].
В исследовании австралийских ученых — C. Beyan и соавторов — показано влияние лучевой нагрузки на вероятность развития вторичных опухолей при проведении КТ во время стадирования при установлении диагноза, оценке ответа на терапию и в период наблюдения после окончания лечения у 15 пациентов с ЛХ.
Медиана лучевой нагрузки за 14,5 мес с момента установления диагноза составила 85,19 и 161,08 мЗв, согласно данным National Radiological Protection Board и Biological Effects of Ionizing Radiation VII report, соответственно. Кумулятивная доза, полученная вследствие применения радиографических методов исследования у пациентов, в 8,5–16 раз превысила дозу, при которой риск развития рака составляет 1:1000 согласно Biological Effects of Ionizing Radiation VII report. Эта доза равна лучевой нагрузке, полученной от природного радиационного фона за 35–70 лет. Данное исследование продемонстрировало, что лучевая нагрузка при проведении радиографических процедур с момента установления диагноза ЛХ достаточно высока для провоцирования развития вторичных опухолей, поэтому авторы считают, что привычные алгоритмы обследования пациентов с ЛХ должны быть пересмотрены [18].
Существующие в Украине и мире протоколы диагностики и лечения лимфом в некоторой степени регламентируют проведение радиографических исследований после окончания терапии. Однако они часто противоречат друг другу или недостаточно точно описывают процедуры, необходимые для проведения в период наблюдения.
Одним из зарубежных руководств, отражающих вопросы обследования пациентов с лимфомами после окончания лечения, является «Клиническое руководство по диагностике и лечению лимфом» (далее — Руководство), разработанное The Cancer Council Australia/Australian Cancer Network (Онкологическим советом Австралии и Австралийской онкологической сетью) и одобренное The National Health and Medical Research Council (Национальным советом по вопросам здоровья и медицинских исследований) на его 159-й сессии 8 декабря 2005 г. [19].
В этом Руководстве приведены данные о необходимости обследования пациентов 1 раз в 2–6 мес в зависимости от типа лимфомы. Обследование включает клинический осмотр, проведение общего и биохимического анализов крови. Другие же методы исследования для пациентов, завершивших лечение по поводу лимфомы, в том числе радиографические, рекомендованы лишь при наличии показаний к их проведению.
В Руководстве приведены ссылки на исследование, включавшее 709 пациентов с ЛХ в І и ІІ стадии, среди которых 69% рецидивов заподозрено при осмотре пациента [20]. Впрочем, авторы подчеркивают, что график наблюдения после окончания лечения и его содержание в значительной степени являются индивидуальными и нерегламентированными.
Другие зарубежные руководства содержат сходные данные. Так, наблюдение после окончания лечения ЛХ, рекомендуемое ESMO (European Society for Medical Oncology), включает опрос пациента, осмотр, проведение развернутого анализа крови, определение скорости оседания эритроцитов и биохимический анализ крови 1 раз в 3 мес первые полгода, далее — 1 раз в 6 мес до 4 лет, затем — 1 раз в год.
Рекомендуется проведение онкологического скрининга в связи с риском развития вторичных опухолей. Проведение же КТ, как и других радиографических исследований, показано лишь при наличии соответсвующих симптомов [21].
Рекомендации NCCN (The National Comprehensive Cancer Network) 2013 г. по диагностике и лечению ЛХ, наоборот, регламентируют проведение радиографических методов обследования после окончания терапии по поводу ЛХ: рентгенография или КТ ОГП каждые 6–12 мес на протяжении 2–3 лет, далее — по необходимости; КТ органов брюшной полости и органов малого таза каждые 6–12 мес на протяжении 2–3 лет. В более поздний период радиографические методы исследования используют только для скрининга развития вторичных опухолей и других поздних осложнений терапии [22].
Рекомендации ESMO по наблюдению пациентов с разными типами НХЛ имеют общие данные по клиническому и лабораторному обследованию 1 раз в 3–6 мес на протяжении первых 2 лет, далее — 1 раз в год [23, 24]. В случае фолликулярной лимфомы рекомендовано минимальное радиологическое обследование каждые 6 мес в первые 2 года по завершении лечения, затем — 1 раз в год [25]. Рекомендуется минимизировать применение радиографических методов обследования у пациентов с MALT-лимфомой, кожными лимфомами [26, 27]. Авторы подчеркивают, что эффективность рутинного радиологического обследования после окончания лечения пациентов с ДВККЛ, которое чаще всего представлено проведением КТ на 6; 12-ом и 24-ом месяце после окончания лечения, не доказана [28].
В рекомендациях NCCN 2013 г. указана необходимость клинического и лабораторного обследования пациентов с НХЛ в среднем каждые 3–6 мес в период до 5 лет, затем ежегодно или по показаниям. Проведение КТ в случае фолликулярной лимфомы, лимфомы маргинальной зоны и ДВККЛ рекомендовано не чаще 1 раза в 6 мес на протяжении первых 2 лет, затем — не чаще 1 раза в год или по показаниям. Для пациентов с MALT-лимфомой КТ не указана в качестве диагностической процедуры после окончания лечения. В этой ситуации в период наблюдения каждые 3 мес проводят гастроскопию. Аналогична ситуация и с лимфомой из клеток зоны мантии и периферическими Т-клеточными лимфомами. В качестве процедур наблюдения по окончании лечения рекомендовано клиническое обследование пациента [29].
Таким образом, надежды, возложенные на проведение регулярного КТ-исследования у пациентов с различными типами лимфом после окончания лечения, не оправданы в более поздних публикациях. Большинство авторов считают, что основным способом выявления рецидивов является сбор жалоб больного и анализ результатов объективного обследования. Эти данные позволяют выявить от 62 до 91% рецидивов.
Рутинное проведение КТ-исследования в период наблюдения после окончания лечения пациентов с лимфомами не только не позволяет с достоверной частотой выявить рецидив заболевания, а и значительно увеличивает стоимость обследования пациентов и лучевую нагрузку. Также следует отметить, что частота выявления ложных рецидивов является самой высокой при проведении КТ-исследований в период наблюдения после окончания терапии лимфом. Это, в свою очередь, влечет дополнительные финансовые затраты и ухудшает качество жизни пациентов.
Наименьшую диагностическую ценность в период наблюдения пациентов после окончания лечения рутинное КТ-исследование имеет для индолентных лимфом. При агрессивных лимфомах, наоборот, существует мнение о целесообразности проведения подобного скрининга. Впрочем, длительность такого наблюдения авторы рекомендуют ограничить 2 годами после достижения ремиссии, так как именно в этот период наиболее высок риск возникновения рецидива.
Также не отмечено влияния способа выявления рецидива на выживаемость больных. Эти результаты нашли отражение и в современных руководствах по диагностике и лечению лимфом. Однако все авторы публикаций, посвященных этой теме, акцентируют внимание на том, что для окончательного заключения проведено недостаточно исследований.
В связи с отсутствием четких алгоритмов обследования и единого мнения о необходимости проведения рутинного КТ-исследования пациентов, закончивших лечение по поводу лимфом, нами выбрана группа пациентов, получавших лечение по поводу рецидива в отделении онкогематологии Национального института рака в период 2008–2011 гг. для анализа эффективности выявления рецидива с помощью проведения планового КТ-исследования или клинического обследования.
Материалы и методы исследования
В группу включены 58 пациентов, которым первично был установлен диагноз НХЛ (36 пациентов) или ЛХ (22 пациента) в период с 1995 по 2011 гг. Группу наблюдения составили всего 30 мужчин и 28 женщин в возрасте от 21 до 78 лет, медиана — 49 лет. В исследуемую группу включены пациенты, у которых рецидив заболевания диагностирован позднее 3 мес после завершения индукционной терапии. Проведена оценка подходов, согласно которым был заподозрен рецидив заболевания: жалобы больного, данные анамнеза или объективного обследования (клинического) или данные регулярно проводимого КТ-исследования.
Наблюдение больных осуществляли в следующем режиме: регулярные визиты к врачу каждые 3–12 мес и проведение КТ-исследования каждые 6–12 мес в зависимости от длительности периода наблюдения (каждые 6 мес в первые 2 года после окончания лечения, далее — ежегодно).
Оценены клинико-гематологические показатели, частота выявления рецидивов с помощью клинических методов или регулярного проведения КТ-исследования, 5-летняя общая выживаемость (ОВ) больных, медиана ОВ в группах, в которых рецидив был заподозрен по результатам клинических исследований и с помощью проведения регулярной КТ, а также выполнен анализ факторов, потенциально влияющих на полученные результаты.
Результаты
У всех пациентов достоверно чаще рецидив заподозрен при клиническом обследовании, чем при проведении рутинной КТ (36 пациентов, 62%). Не отмечено различий в частоте клинического выявления рецидивов в зависимости от гистологического типа лимфомы: среди пациентов с ЛХ — у 14 из 22 (64%) и с НХЛ — у 22 из 36 (61%) больных (p>0,05). Эти результаты в целом соответствуют представленным выше данным литературы.
Группы пациентов, у которых рецидив заподозрен во время клинического обследования или при проведении плановой КТ, были равноценны по основным характеристикам (возраст, пол, гистологический вариант, стадия при установлении диагноза, наличие В-симптомов) (табл. 1).
Таблица 1. Основные клинико-гематологические характеристики при установлении диагноза в группах пациентов, у которых рецидив заподозрен клинически и при проведении плановой КТ
| Характеристика | Группа пациентов, у которых заподозрен рецидив | p | |
|---|---|---|---|
| клинически | при проведении плановой КТ | ||
| Пол: мужской/женский | 19/17 | 11/11 | >0,05 |
| Возраст, медиана | 51 | 49 | |
| В-симптомы | 21 из 36 (58%) | 10 из 22 (46%) | |
| Гистологический вариант: ЛХ/НХЛ | 14/22 | 8/14 | |
| Стадия при установлении диагноза: ранняя/поздняя | 17/19 (47/53%) | 10/12 (45/55%) | |
При проведении анализа частоты выявления рецидивов среди гистологических подтипов НХЛ установлено, что среди агрессивных подтипов (ДВККЛ, лимфома из клеток зоны мантии, периферические Т-клеточные лимфомы) рецидив заподозрен в ходе клинического обследования у 15 (65%) из 23 больных, у пациентов с индолентными лимфомами — у 7 (58%) из 12 пациентов (p>0,05).
Период наблюдения составил в целом в группе от 9 до 196 мес с момента установления диагноза, медиана — 34 мес. В группе ЛХ — 9–196 мес, медиана — 46 мес, в группе НХЛ — 14–89 мес, медиана — 31 мес.
Рецидивы заболевания в общей группе больных возникли в период от 4 до 190 мес, медиана — 13 мес, в группе ЛХ — в период 4–190 мес, медиана — 12 мес и в группе пациентов с НХЛ — в период 4–69 мес, медиана 27 — мес.
Достоверные отличия выявлены при анализе выживаемости пациентов. При оценке 5-летней ОВ установлено, что в группе больных, у которых рецидив заподозрен в процессе клинического обследования, этот показатель составил 58,6±9,9%, в группе пациентов, у которых рецидив выявлен при проведении планового КТ-исследования, — 81,8±9,2% (p<0,05). Медиана выживаемости в обеих группах не достигнута (рисунок).
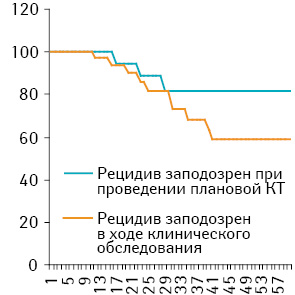
Результаты 5-летней ОВ, полученные нами в данном исследовании, противоречат данным литературы, ведь в большинстве источников сообщается об отсутствии достоверной разницы в выживаемости пациентов с лимфомами в зависимости от способа выявления рецидива заболевания.
В связи с этим нами сделаны предположения о причинах, обусловивших значительное повышение показателей 5-летней ОВ при проведении плановой КТ в исследуемой группе. Среди вероятных причин могли быть: более раннее выявление рецидивов при проведении регулярных КТ-исследований, менее распространенный процесс в рецидиве, влияние наличия пациентов с ранними/поздними рецидивами, «адекватность» терапии рецидива и терапии первой линии.
Одной из причин могло быть более раннее выявление рецидива при менее распространенном процессе в рецидиве. С этой целью нами проанализировано время возникновения рецидива после окончания индукционной терапии, количество ранних рецидивов в каждой группе, а также оценена распространенность процесса в рецидиве (соответствие ранним I–II стадии или поздним III–IV стадии по классификации Ann Arbor).
В группе, в которой рецидив заподозрен в ходе клинического обследования, время развития рецидива составило от 4 до 190 мес, медиана — 12 мес, в группе, в которой рецидив заподозрен при проведении плановой КТ, — от 4 до 132 мес, медиана — 15 мес (p>0,05). Также проанализировано влияние ранних (рецидив возник в период от 4 до 12 мес по окончании терапии первой линии) или поздних (рецидив развился в период более 12 мес по окончании терапии первой линии) рецидивов. Таким образом, большинство рецидивов в обеих группах выявлены в первые 2 года после окончания лечения.
Количество ранних рецидивов было сопоставимо в обеих группах: в первой группе ранние рецидивы развились у 18 (50%) пациентов, во второй — у 10 (45%) (р>0,05).
Большее количество пациентов с распространенным процессом в рецидиве отмечали в группе, в которой рецидив заподозрен клинически (первая группа). Соответствие процесса распространенным стадиям заболевания в этой группе отмечено у 22 (61%) из 36 пациентов в сравнении с группой, в которой рецидив заподозрен при проведении плановой КТ (вторая группа), — у 11 (50%) из 22 пациентов (р>0,05).
При оценке показателя адекватности терапии рецидива выделены следующие варианты: адекватное лечение при рецидиве (проведение второй линии терапии с или без последующей ВДХТ + АТГСК) или неадекватное лечение при рецидиве заболевания (отказ пациента от лечения, проведение паллиативной терапии, повторение первой линии терапии).
При оценке адекватности первой линии терапии использовали критерии, описанные в нашей ранее опубликованной статье: отсутствие полноценного стадирования, отсутствие верификации типа НХЛ методом иммуногистохимического исследования, несоответствие схем терапии типу лимфомы и ее стадии, отсутствие смены режима лечения при неэффективности терапии, проведение >8 курсов ПХТ первой линии, модификация дозы цитостатиков или замена препаратов в схемах ПХТ, нарушение интервалов между курсами, несоответствие объема лучевой терапии современным стандартам [30].
При анализе адекватности терапии при рецидиве установлено, что в группе, в которой рецидив заподозрен в результате клинического обследования, адекватное лечение проведено у 26 (72%) из 36 больных, а в группе, в которой рецидив заподозрен при проведении плановой КТ, — у 14 (64%) из 22 пациентов. Несмотря на более высокий показатель адекватности лечения в первой группе, разница все же не достоверна.
При анализе качества терапии первой линии в группе, в которой рецидив заподозрен в ходе клинического обследования, установлено, что адекватное первичное лечение проведено у 18 (50%) из 36 больных, а в группе, в которой рецидив заподозрен при проведении плановой КТ, — у 15 (68%) из 22 пациентов (р>0,05) (табл. 2).
Таблица 2. Основные факторы, потенциально влияющие на выживаемость больных в группах, в которых рецидив заподозрен клинически и при проведении плановой КТ
| Характеристика | Группа пациентов, у которых заподозрен рецидив | p | |
|---|---|---|---|
| клинически | при проведении плановой КТ | ||
| Медиана времени выявления рецидива | 12 мес | 15 мес | >0,05 |
| Количество ранних рецидивов | 18 (50%) | 10 (45%) | |
| Распространенность процесса в рецидиве:соответствие III–IV стадии | 22 (61%) | 11 (50%) | |
| Адекватность терапии рецидива | 26 (72%) | 14 (64%) | |
| Адекватность терапии первой линии | 18 (50%) | 15 (68%) | |
Обсуждение и выводы
Таким образом, наиболее часто рецидивы лимфом выявляют во время клинического обследования. Проведение рутиной КТ после окончания лечения при лимфомах позволяет заподозрить рецидив, по наиболее оптимистичным данным, лишь в 40% случаев. Не получено подтверждения необходимости проведения планового КТ-исследования после окончания лечения пациентов с ЛХ. Однозначно, проведение рутинной КТ нецелесообразно у пациентов с индолентными лимфомами, так как показанием к началу лечения при рецидиве является наличие симптомов у этих пациентов. Среди пациентов с агрессивными лимфомами не получено достоверных данных об улучшении результатов лечения при рецидивах в случае выявления их с помощью рутинной КТ. Однако некоторые исследователи оставляют место для планового КТ-исследования в этой группе больных, ограничивая сроки обследования 2–3 годами после окончания лечения.
Также не получено данных об улучшении выживаемости больных при проведении регулярного КТ-исследования. Таким образом, большинство авторов предлагают исключить проведение планового КТ-сканирования из алгоритма обследования пациентов с лимфомами после окончания лечения.
Согласно нашим данным при всех типах лимфом наиболее часто (в 62% случаев) рецидивы заболевания возможно заподозрить в ходе клинического обследования, а не при помощи проведения регулярного КТ-исследования.
Однако выявлена достоверная разница в 5-летней ОВ, этот показатель выше в группе пациентов, у которых рецидив выявлен при проведении планового КТ-исследования, и составляет 81,8±9,2% в сравнении с 58,6±9,9% в группе проведения клинического обследования. При анализе причин, которые могли обусловить такую разницу, нами проанализированы возраст, пол, наличие В-симптомов, гистологический тип лимфомы, стадия заболевания при установлении диагноза, распространенность процесса в рецидиве, время выявления рецидива, адекватность подходов к первичной терапии и лечению при рецидиве и др.
Невзирая на то что не получено достоверной разницы между двумя группами, все же в группе пациентов, в которой рецидив заподозрен при проведении планового КТ-исследования, отмечена тенденция к выявлению рецидива заболевания в менее распространенных стадиях (50% vs. 39% в сравниваемой группе), наличие большего количества пациентов, получивших адекватную терапию первой линии (68% vs. 50% в сравниваемой группе). Возможно, именно эти факторы и влияют на более высокие показатели ОВ больных в группе пациентов, в которой рецидив выявлен при проведении планового КТ-исследования, несмотря на более адекватное лечение при рецидивах заболевания в сравниваемой группе (64% vs. 72%).
Согласно данным литературы по-прежнему не определена наиболее эффективная схема обследования пациентов с лимфомами после окончания терапии первой линии. Наиболее часто рецидивы лимфом выявляют при появлении клинической картины заболевания.
В отличие от данных литературы, нами получены результаты, что проведение регулярного КТ-исследования в этой группе больных позволило достичь более высоких показателей выживаемости пациентов. Вероятными причинами этой особенности могут быть выявление рецидива при меньшей распространенности процесса при проведении рутинного КТ-обследования пациентов, а также наличие большего количества пациентов, получивших адекватную первичную терапию в этой группе. Погрешности, а также невысокая достоверность результатов анализа, могут быть связаны с небольшим количеством пациентов в исследуемой группе.
На наш взгляд, роль рутинной КТ как метода обследования пациентов с лимфомами после завершения лечения окончательно не определена. Несмотря на высокие разрешающую способность томографа, достоверность выявления рецидива, КТ имеет существенные недостатки — лучевую нагрузка, стоимость метода.
Кроме того, согласно проведенным исследованиям, большинство рецидивов, даже при скрупулезном КТ-скрининге, выявляют в ходе клинического обследования. Все эти факторы должны быть грамотно взвешены, прежде чем может быть дан окончательный ответ о целесообразности проведения регулярных КТ-исследований в данной группе пациентов. Получение более достоверных результатов возможно при проведении более крупных рандомизированных и длительных исследований, позволяющих оценить также отдаленные результаты наблюдения пациентов.
Список использованной литературы
1. Lister T.A., Crowther D., Sutcliffe S.B. et al. (1989) Report of a committee convened to discuss the evaluation and staging of patients with Hodgkin’s disease: Cotswolds meeting. J. Clin. Oncol., 7: 1630.
2. Garribba A.P., Ettorre G.C., Francioso G. et al. (1990) Computerized tomography in the staging and the follow-up of Hodgkin’s lymphoma of the thorax. Radiol. Med. Dec., 80(6): 859–64.
3. Rezvani L., Tully R.J., Levine C. et al. (1986) Computed tomography in the diagnosis and follow-up of American Burkitt’s lymphoma, 11(1): 36–40.
4. Radford J.A., Eardley A., Woodman C. et al. (1997) Follow up policy after treatment for Hodgkin’s disease: too many clinic visits and routine tests? A review of hospital records. BMJ, 314: 343–346.
5. Dryver E.T., Jernstrom H., Tompkins K. et al. (2003) Follow-up of patients with Hodgkin’s disease following curative treatment: the routine CT scan is of little value. Br. J. Cancer, 89: 482–486.
6. Guadagnolo B.A., Punglia R.S., Kuntz K.M. et al. (2006) Cost-effectiveness analysis of computerized tomography in the routine follow-up of patients after primary еreatment for Hodgkin’s disease. J. Clin. Oncol., 24: 4116–22.
7. Hodgson D.C., Grunfeld E., Gunraj N., Del Giudice L. (2010) A Population-Based Study of Follow-Up Care for Hodgkin Lymphoma Survivors Opportunities to Improve Surveillance for Relapse and Late Effects Cancer, 15: 3421.
8. Ng A., Constine L.S. (2010) ACR Appropriateness Criteria: follow-up of Hodgkin’s lymphoma. Curr. Probl. Cancer, 34(3): 211–27.
9. Weeks J.C., Yeap B.Y., Canellos G.P., Shipp M.A. (1991) Value of follow-up procedures in patients with large-cell lymphoma who achieve a complete remission. J. Clin. Oncol., 9: 1196–1203.
10. Nakamura K., Sasaki M., Kunitake N. et al. (2001) Relapse patterns of localized non-Hodgkin’s lymphoma of the head and neck after clinical remission: results of a strict follow-up procedure. Int. J. Clin. Oncol., 6(6): 302–305.
11. Elis A., Blickstein D., Klein O. et al. (2002) Detection of relapse in non-Hodgkin’s lymphoma: role of routine follow-up studies. Am. J. Hematol., 69(1): 41–4.
12. Guppy A.E., Tebbutt N.C., Norman A., Cunningham D. (2003) The role of surveillance CT scans in patients with diffuse large B-cell non-Hodgkin’s lymphoma. Leuk Lymphoma, 44: 123–125.
13. Armitage J.O., Loberiza F.R. (2006) Is there a place for routine imaging for patients in complete remission from aggressive lymphoma? Ann. Oncol., 17(6): 883–884.
14. Choi J.Y., Lee G.H., Ahn J.Y. et al. (2011) The role of abdominal CT scan as follow-up after complete remission with successful Helicobacter pylori eradication in patients with H. pylori-positive stage I(E1) gastric MALT lymphoma. Helicobacter., 16(1): 36–41.
15. Goldschmidt N., Or O., Klein M. et al. (2011) The role of routine imaging procedures in the detection of relapse of patients with Hodgkin lymphoma and aggressive non-Hodgkin lymphoma. Ann. Hematol., 90(2): 165–171.
16. Thompson C.A., Maurer M.J., Ghesquieres H. et al. (2013) Utility of post-therapy surveillance scans in DLBCL. J. Clin. Oncol., 31: 8504.
17. Hutchings M. (2011) Routine follow-up scanning of patients with lymphoma: who, when, how, and why? Leukemia & Lymphoma, 52(4): 552–553.
18. Beyan C., Kaptan K., Ifran A. et al. (2007) The effect of radiologic imaging studies on the risk of secondary malignancy development in patients with Hodgkin lymphoma, 7(7): 467–469.
19. Clinical Practice Guidelines for the Diagnosis and Management of Lymphoma The Cancer Council Australia/Australian Cancer Network 2005 (http://www.nhmrc.gov.au/ guidelines/publications/cp107).
20. Torrey M.J., Poen J.C., Hoppe R.T. (1997) Detection of relapse in early-stage Hodgkin’s disease: role of routine follow-up studies. J. Clin. Oncol., 15: 1123–1130.
21. Eichenauer D.A., Engert A., Dreyling M. (2011) Hodgkin’s lymphoma: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann. Oncol., 22(6): vi55–vi58.
22. NCCN Clinical practice guidelines in oncology Hodgkin’s Lymphoma. Version I. 2013.
23. Ghielmini M., Vitolo U., Kimby E. et al. (2013) ESMO Guidelines consensus conference on malignant lymphoma 2011 part 1: diffuse large B-cell lymphoma (DLBCL), follicular lymphoma (FL) and chronic lymphocytic leukemia (CLL). Ann. Oncol., 24: 561–576.
24. Dreyling M., Thieblemont C., Gallamini A. et al. (2013) ESMO Consensus conferences: guidelines on malignant lymphoma. part 2: marginal zone lymphoma, mantle cell lymphoma, peripheral T-cell lymphoma. Ann. Oncol., 1–21.
25. Dreyling M., Ghielmini M., Marcus R. et al. (2011) Newly diagnosed and relapsed follicular lymphoma: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann. Oncol., 22(6): vi59–vi63.
26. Zucca E., Dreyling M. (2010) Gastric marginal zone lymphoma of MALT type: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann. Oncol., 21(5): v175–v176.
27. Willemze R., Dreyling M. (2010) Primary cutaneous lymphomas: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann. Oncol., 21(5): v177–v180.
28. Tilly H., Vitolo U., Walewski J. et al. (2012) Diffuse large B-cell lymphoma (DLBCL): ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann. Oncol., 23(7): vii78–vii82.
29. NCCN Clinical practice guidelines in oncology Non-Hodgkin’s Lymphoma. Version I. 2013.
30. Крячок И.А., Кущевой Е.В., Мартынчик А.В. и др. (2011) Опыт применения схем терапии II линии при лечении рецидивов и рефрактерного течения лимфом. Клиническая онкология, 2(2): 62–66.
Необхідність проведення рутинної комп’ютерної томографії після завершення лікування пацієнтів з лімфомами
Резюме. Після завершення лікування пацієнтів з лімфомами перед клініцистом постає питання, яким чином, як часто або чи взагалі потрібно проводити подальше спостереження за пацієнтом. Найбільш складне рішення стосується необхідності проведення регулярної комп’ютерної томографії у зв’язку з високою її вартістю та променевим навантаженням. У даній статті представлено огляд джерел літератури, присвяченої рутинному проведенню комп’ютерної томографії в період спостереження за хворими, а також власні дані щодо частоти виявлення рецидивів при проведенні рутинної томографії та без неї та вплив такого обстеження на подальші результати лікування.
Ключові слова: лімфома, обстеження, комп’ютерна томографія, рецидив, радіографічні методи.
Necessity of routine computed tomography after the end of the lymphoma treatment
Summary. After the end of lymphoma treatment clinicians have a difficult choice: is it necessary to provide any follow-up, in which way and how often. The most complicated choice is a question about computed tomography because of its high cost and radiation dose. This article contains summery of literature on the subject of routine computed tomography in the follow-up period and our own data on frequency of relapse detection with or without routine computed tomography and its influence on the future results of the treatment.
Key words: lymphoma, examination, computed tomography, relapse, radiographic methods.














Leave a comment