Виживаність хворих на рак стравоходу залежно від локалізації первинної пухлини
Кіркілевський С.І., Крахмальов П.С., Кондрацький Ю.М., Фридель Р.І.
Резюме. Актуальність. Рак стравоходу (РС) посідає 8-ме місце серед найпоширеніших онкологічних захворювань у світі та 6-те місце за смертністю чоловіків від злоякісних новоутворень. Клінічний перебіг захворювання зумовлений швидким розвитком синдрому дисфагії, на тлі якого протягом кількох місяців розвивається кахексія, хворі зазвичай помирають від аліментарного виснаження. На сьогодні майже немає досліджень, що аналізують виживаність хворих залежно від локалізації первинної пухлини. Мета. Дослідити результати виживаності хворих на РС залежно від локалізації первинної пухлини. Матеріали та методи. Зі 1690 пацієнтів зі злоякісними пухлинами стравоходу проаналізована виживаність 1465 хворих на плоскоклітинний РС залежно від локалізації первинної пухлини за розподілом за стадіями TNM та клінічними стадіями. Результати. Серед 1690 хворих на злоякісні захворювання стравоходу, які отримували лікування у науково-дослідному відділенні пухлин органів грудної порожнини, понад 90% становили чоловіки, середній вік яких становив 58,48 року, причому вікові коливання значні — від 20 до 90 років. Серед гістологічних форм істотно переважав плоскоклітинний РС (86,69%), його частота залежала від локалізації первинної пухлини у стравоході — при ураженні верхніх відділів та середньої частини внутрішньогрудного відділу його відмічали більш ніж у 90% випадків, а при ураженні нижньої частини внутрішньогрудного та абдомінального відділів — у 76,05%. Серед інших гістологічних форм переважала аденокарцинома (82,72%). Саме хворі на плоскоклітинний РС були залучені до подальшого аналізу. Залежно від рівня локалізації первинної пухлини: більше половини становили хворі на рак середніх відділів, а хворих на рак нижніх відділів було більше у 1,5 рази, ніж хворих на рак верхніх відділів. Характерно, що під час аналізу розподілу хворих за стадіями TNM та клінічними стадіями (ВООЗ) залежно від рівня локалізації первинної пухлини у стравоході, усі групи виявилися тотожними практично за всіма показниками — більше половини хворих становили хворі з ІІА клінічною стадією, серед яких у 1,5–2 рази переважала стадія T3N0M0 над T2N0M0. Майже третину від усіх хворих становили пацієнти зі стадією ІІІ, де значно домінувала стадія T3N1M0. Майже 10% становили хворі з клінічною стадією IV, серед яких переважали пацієнти з місцевопоширеними формами первинного пухлинного процесу. А найрідше відмічали IIВ та особливо стадію I РС. Висновки. Після проведеного аналізу виживаності хворих можна сказати, що достовірно краща виживаність була у хворих на плоскоклітинний рак нижніх відділів стравоходу як при початкових стадіях, так і при місцевопоширених процесах, а виживаність хворих на рак верхніх та середніх відділів достовірно не розрізнялася. Але при клінічній стадії IV достовірної різниці у виживаності хворих залежно від локалізації первинної пухлини не спостерігали.
Одержано: 14.04.2020
Прийнято до друку: 28.04.2020
DOI: 10.32471/clinicaloncology.2663-466X.37-1.27028
Вступ
Лікування раку стравоходу (РС) є однією з найскладніших проблем сучасної світової онкології. Клінічний перебіг захворювання зумовлений швидким розвитком синдрому дисфагії, на тлі якого протягом кількох місяців розвивається кахексія, хворі зазвичай помирають від аліментарного виснаження.
Другою причиною смерті від РС є широке та раннє метастазування: у разі раку шийного та верхньогрудного відділів — у середостіння, клітинні простори шиї, надключичні зони; у разі раку грудного відділу — по ходу лімфатичних просторів підслизової оболонки стравоходу, у лімфатичні вузли середостіння і навколостравохідну клітковину; рак нижнього відділу стравоходу переважно метастазує в лімфатичні вузли верхнього відділу малого сальника [1].
РС посідає 8-ме місце серед найпоширеніших ракових захворювань у світі [2] та 6-те місце за смертністю чоловіків від злоякісних новоутворень. Захворювання характеризується високою географічною залежністю, розбіжність показників захворюваності між окремими країнами є 15–20-кратною — від 1,7–2,2 на 100 тис. випадків у Ізраїлі, Вірменії, Малі та В’єтнамі до 100,0 на 100 тис. населення у Китаї, Ірані, країнах Центральної та Середньої Азії [3]. В Україні, за даними Національного канцер-реєстру, у 2017 р. зареєстровано 1649 випадків РС, загальна захворюваність становила 4,6 на 100 тис. населення [4]. Чоловіки хворіють частіше, ніж жінки, у співвідношенні 5–10:1 (8,6:1 в Україні), пік захворюваності припадає на віковий період 50–60 років, хворі віком понад 70 років становлять 40% [5].
Лікування хворих на РС має півторавіковий досвід , якщо рахувати від накладання гастростоми хворому на РС у 1949 р. французьким хірургом Седіло [6]. В сучасному лікуванні РС використовують хірургічне втручання, променеву терапію та хіміотерапію. Історично, з початку ХХ ст. в основному використовувалась променева терапія, а з 1940-х років почався стрімкий розвиток хірургічних методів лікування. Хіміотерапія посідала скромне місце, але з 1990-х років в лікуванні РС все ширше використовується радіохіміотерапія, що дозволило істотно покращити безпосередні результати лікування. Треба зазначити, що тільки хірургічне лікування дає можливість лікувати хворого радикально та визнане «золотим стандартом» у терапії резектабельного РС [7].
У структурі захворюваності на РС переважають хворі на рак верхніх відділів стравоходу (РВВС) — шийного та верхньогрудного, за різними даними — 10–15% [8].
Доведено, що тютюнопаління та вживання алкоголю є факторами ризику розвитку РВВС. Мутації в алкогольдегідрогеназі, зокрема 1B та ALDH-2 (двох ферментах, що беруть участь в обміні алкоголю) також пов’язані з виникненням неоплазії у верхніх дихальних шляхах та верхніх відділах стравоходу [9–12].
Висока захворюваність на РВВС спостерігається в Ірані, Центральній Азії, Монголії, Північному Китаї та Південній Африці, що пов’язано з нутритивними та екологічними особливостями цих регіонів. Роль сімейного анамнезу ще не доведена [13]. Вплив професійних факторів також важко оцінити самостійно, оскільки РВВС часто відмічають у некваліфікованих працівників промисловості та сільського господарства, серед яких багато споживачів тютюну та/або алкоголю. Високий ступінь впливу поліциклічних ароматичних вуглеводнів також пов’язаний з високим ризиком РВВС [14]. Також суперечливими є результати досліджень зв’язку між інфікуванням вірусом папіломи людини та РВВС через високу захворюваність на цей вірус у регіонах, ендемічних для РВВС [15–17].
Важливо зазначити, що при РВВС гістологічно визначається саме плоскоклітинний рак (до 95%), водночас у разі онкопатології середніх та нижніх відділів стравоходу спостерігається тенденція до підвищення частоти залозистого раку (до 30%) [8, 18].
Зазвичай хворих на РВВС прийнято лікувати консервативно як на теренах СНД [1], так і у світі — Національною загальною онкологічною мережею (National Comprehensive Cancer Network — NCCN) та Європейським товариством медичної онкології (European Society for Medical Oncology — ESMO) рекомендована самостійна радіохіміотерапія [7, 19]. Треба зазначити, що пухлини верхніх відділів стравоходу представляють найбільші труднощі для хірургічного лікування, зумовлені анатомічними особливостями будови (близькість гортані, трахеї, глотки, крупних судин, глибина залягання) та характером росту пухлини (розповсюдження уздовж стравоходу, проростання в сусідні органи).
Наразі не існує уніфікованих алгоритмів радикального та паліативного лікування хворих на РВВС. Хворим проводять курси дистанційної променевої терапії, де сумарна вогнищева доза може коливатися в межах 40–75 Гр. Хіміотерапію проводять як у монорежимах, так і в різних комбінаціях цитостатиків під час поліхіміотерапії. Немає консенсусу щодо вибору схем поліхіміотерапії при РВВС та шляху введення хіміопрепаратів, а для найбільш ефективної радіохіміотерапії також немає загальноприйнятих рекомендацій та протоколів.
Найскладнішою залишається проблема хірургічного лікування хворих на РВВС. Операції при такій патології вкрай складні, з високим відсотком післяопераційних ускладнень та летальності, навіть порівняно з хірургічним лікуванням раку інших відділів стравоходу. Вони часто призводять до інвалідизації хворого та значно знижують якість життя.
Адекватна резекція при раку шийного відділу стравоходу часто потребує видалення гортані та частини глотки. Складності здебільшого виникають при відновленні пасажу в зв’язку з віддаленістю органів, необхідних для утворення трансплантата [20]. Різноманітні методики реконструкції видаленої частки стравоходу (вільним кишковим трансплантатом, шкірно-м’язовими клаптями) не набули широкого впровадження в клінічній практиці через високу складність техніки виконання.
Необхідно зауважити, що велика кількість хворих на РС, у тому числі на РВВС, на момент встановлення діагнозу має неоперабельний або ускладнений пухлинний процес, дисфагію високого ступеня, норицеві укладення, які загрожують життю хворого.
При РС немає чітких рекомендацій щодо персоніфікації та індивідуалізації лікування. Є окремі повідомлення про вплив молекулярно-біологічних предикторів на перебіг та прогноз захворювання, але до впровадження цих методів при РС у повсякденну практику ще далеко, на відміну від інших злоякісних пухлин.
Матеріали та методи
Дане дослідження базується на ретроспективних даних клінічних спостережень і вивчених та узагальнених результатах лікування 1690 хворих на злоякісні новоутворення стравоходу, які отримували лікування у науково-дослідному відділенні пухлин органів грудної порожнини Національного інституту раку у 1978–2017 рр., відомості про яких містяться в базі Національного канцер-реєстру України.
Жінок було 138 (8,17%), чоловіків — 1552 (91,83%); вік — 20–90 років, середній вік хворих становив 58,48 року.
Усіх пацієнтів було розподілено за локалізацією процесу у стравоході:
- з ураженням верхніх відділів стравоходу — 291 (17,22%) хворих;
- середньої частини внутрішньогрудного відділу — 877 (51,89%);
- нижньої частини внутрішньогрудного та абдомінального відділу — 522 (30,89%) пацієнти.
У дослідження включено лише тих хворих, у яких діагноз підтверджено, за гістологічним типом переважали пацієнти з верифікованим плоскоклітинним РС — 1465 (86,69%).
За рівнем ураження стравоходу було діагностовано РВВС — у 265 (91,07%), рак середньої частки внутрішньогрудного відділу стравоходу (РСЧВВС) — 803 (91,56%), рак нижньої частки внутрішньогрудного та абдомінального відділів стравоходу (РНЧВАВС) — у 397 (76,05%) хворих.
За висновком комісії з питань етики Національного інституту раку дослідження проведено з дотриманням етичних норм та стандартів щодо досліджень пацієнтів, які існують на сьогодні (протокол від 26.05.2015 р. № 69).
Серед неплоскоклітинних злоякісних пухлин найчастіше — 186 (82,72%) — спостерігали аденокарциному, а найрідше — гігантоклітинну пухлину, злоякісну гемангіоперицитому, веретеноподібний, лімфоепітеліальний та перехідноклітинний рак — усього по 1 (0,44%) випадку.
Поширеність процесу у хворих на плоскоклітинний рак, відповідно до міжнародної класифікації TNM, подана в табл. 1, а розподіл хворих за клінічними стадіями (ВООЗ) — у табл. 2.
Таблиця 1. Розподіл хворих на плоскоклітинний РС за стадіями TNM
| Стадія | Кількість хворих | |
| n | % | |
| T1N0M0 | 21 | 1,43 |
| T2N0M0 | 299 | 20,41 |
| T3N0M0 | 510 | 34,81 |
| T1N1M0 | 2 | 0,14 |
| T2N1M0 | 50 | 3,41 |
| T3N1M0 | 298 | 20,34 |
| T4N0M0 | 65 | 4,44 |
| T4N1M0 | 67 | 4,57 |
| T1N0M1 | 1 | 0,07 |
| T2N0M1 | 9 | 0,61 |
| T2N1M1 | 13 | 0,89 |
| T3N0M1 | 13 | 0,89 |
| T3N1M1 | 79 | 5,39 |
| T4N0M1 | 9 | 0,61 |
| T4N1M1 | 29 | 1,98 |
| Усього | 1465 | 100,00 |
Таблиця 2. Розподіл хворих на плоскоклітинний РС за клінічними стадіями (ВООЗ)
| Стадія | Кількість хворих | |
| n | % | |
| I | 21 | 1,43 |
| IIА | 809 | 55,22 |
| IIВ | 52 | 3,55 |
| III | 430 | 29,35 |
| IV | 153 | 10,44 |
| Усього | 1465 | 100,00 |
Отже, більш ніж у половини хворих 809 (55,22%) відмічали стадію ІІА, тобто хворі не мали регіонарних метастазів. Другою за частотою була стадія ІІІ — у хворих були регіонарні метастази — 430 (29,35%) пацієнтів. Стадія ІV не була рідкістю, хворі з віддаленими метастазами становили 153 пацієнти (10,44%). Хворих зі стадією I та IIВ відмічали рідко — 1,43 та 3,55% відповідно.
Після усебічного обстеження всіх хворих було проліковано у відділенні, де вони отримували спеціальне стандартне лікування з урахуванням стадії хвороби, загального стану, ускладнень основного захворювання та супутніх захворювань.
Проте в даному розділі ми обмежуємося тільки загальними характеристиками хворих і хвороби.
У зв’язку з тим, що в даному дослідженні основна увага приділяється вивченню саме проблеми хворих на РВВС, ми провели поглиблений аналіз розподілу пацієнтів залежно від рівня локалізації первинної пухлини у стравоході за стадіями міжнародної класифікації TNM та клінічними стадіями (ВООЗ). Тому розподіл хворих на плоскоклітинний РВВС за означеними критеріями відповідно до міжнародної класифікації TNM та групування за клінічними стадіями (ВООЗ) наведено в табл. 3. Таким чином, за результатами аналізу, найбільшу частину становили хворі зі стадією ІІА — 155 пацієнтів (58,49% від загальної кількості хворих на РВВС), причому хворі зі стадією T3N0M0 переважали порівняно з T2N0M0 — 95 (35,85%) порівняно з 60 (22,64%). Численною виявилася група хворих з клінічною стадією ІІІ, тобто з місцевопоширеним процесом — 75 (28,30%) хворих, у якій значно переважали пацієнти зі стадією T3N1M0 — 46 (17,36%). Чималою була кількість хворих з віддаленими метастазами — 28 (10,57%) хворих, а значно переважали хворі із стадіями T3–4N1M1 (22 з 28), тобто пацієнти, у яких відмічали, окрім віддалених метастазів, ще й більш поширений первинний процес з регіонарними метастазами. Зі стадіями І та ІІВ було всього 7 хворих (відповідно 1,51 та 1,13%), таких хворих відмічали дуже рідко.
Таблиця 3. Розподіл хворих на плоскоклітинний РВВС за стадіями TNM та клінічними стадіями (ВООЗ)
| Стадія | TNM | Розподіл хворих на плоскоклітинний РВВС | |||||
| за стадіями TNM | за клінічними стадіями (ВООЗ) | ||||||
| n | % від кількості хворих | n | % від кількості хворих | ||||
| РС | РВВС | РС | РВВС | ||||
| I | T1N0M0 | 4 | 0,27 | 1,51 | 4 | 0,27 | 1,51 |
| IIА | T2N0M0 | 60 | 4,10 | 22,64 | 155 | 10,58 | 58,49 |
| T3N0M0 | 95 | 6,48 | 35,85 | ||||
| IIВ | T1N1M0 | 0 | 0,00 | 0,00 | 3 | 0,20 | 1,13 |
| T2N1M0 | 3 | 0,20 | 1,13 | ||||
| III | T3N1M0 | 46 | 3,14 | 17,36 | 75 | 5,12 | 28,30 |
| T4N0M0 | 15 | 1,02 | 5,66 | ||||
| T4N1M0 | 14 | 0,96 | 5,28 | ||||
| IV | T1N0M1 | 0 | 0,00 | 0,00 | 28 | 1,91 | 10,57 |
| T2N0M1 | 1 | 0,07 | 0,38 | ||||
| T2N1M1 | 2 | 0,14 | 0,75 | ||||
| T3N0M1 | 2 | 0,14 | 0,75 | ||||
| T3N1M1 | 14 | 0,96 | 5,28 | ||||
| T4N0M1 | 1 | 0,07 | 0,38 | ||||
| T4N1M1 | 8 | 0,55 | 3,02 | ||||
| Усього | 265 | 18,09 | 100,00 | 265 | 18,09 | 100,00 | |
Відповідний розподіл хворих на плоскоклітинний РСЧВВС, а також РНЧВАВС, наведено в табл. 4 та 5.
Таблиця 4. Розподіл хворих на плоскоклітинний РСЧВВС за стадіями TNM та групування за клінічними стадіями (ВООЗ)
| Стадія | TNM | Розподіл хворих на плоскоклітинний РСЧВВС | |||||
| за стадіями TNM | за клінічними стадіями (ВООЗ) | ||||||
| n | % від кількості хворих | n | % від кількості хворих | ||||
| РС | РС с/3 | РС | РС с/3 | ||||
| I | T1N0M0 | 10 | 0,68 | 1,25 | 10 | 0,68 | 1,25 |
| IIА | T2N0M0 | 159 | 10,85 | 19,80 | 436 | 29,76 | 54,30 |
| T3N0M0 | 277 | 18,91 | 34,50 | ||||
| IIВ | T1N1M0 | 0 | 0,00 | 0,00 | 27 | 1,84 | 3,36 |
| T2N1M0 | 27 | 1,84 | 3,36 | ||||
| III | T3N1M0 | 164 | 11,19 | 20,42 | 243 | 16,59 | 30,26 |
| T4N0M0 | 34 | 2,32 | 4,23 | ||||
| T4N1M0 | 45 | 3,07 | 5,60 | ||||
| IV | T1N0M1 | 0 | 0,00 | 0,00 | 87 | 5,94 | 10,83 |
| T2N0M1 | 6 | 0,41 | 0,75 | ||||
| T2N1M1 | 9 | 0,61 | 1,12 | ||||
| T3N0M1 | 11 | 0,75 | 1,37 | ||||
| T3N1M1 | 44 | 3,00 | 5,48 | ||||
| T4N0M1 | 5 | 0,34 | 0,62 | ||||
| T4N1M1 | 12 | 0,82 | 1,49 | ||||
| Усього | 803 | 54,81 | 100,00 | 803 | 54,81 | 100,00 | |
Таблиця 5. Розподіл хворих на плоскоклітинний РНЧВАВС за стадіями TNM та групування за клінічними стадіями (ВООЗ)
| Стадія | TNM | Розподіл хворих на плоскоклітинний РНЧВАВС | |||||
| розподіл за стадіями TNM | групування за клінічними стадіями (ВООЗ) | ||||||
| n | % від кількості хворих | n | % від кількості хворих | ||||
| РС | РС н/3 | РС | РВВС н/3 | ||||
| I | T1N0M0 | 7 | 0,48 | 1,76 | 7 | 0,48 | 1,76 |
| IIА | T2N0M0 | 80 | 5,46 | 20,15 | 218 | 14,88 | 54,91 |
| T3N0M0 | 138 | 9,42 | 34,76 | ||||
| IIВ | T1N1M0 | 2 | 0,14 | 0,50 | 22 | 1,50 | 5,54 |
| T2N1M0 | 20 | 1,37 | 5,04 | ||||
| III | T3N1M0 | 88 | 6,01 | 22,17 | 112 | 7,65 | 28,21 |
| T4N0M0 | 16 | 1,09 | 4,03 | ||||
| T4N1M0 | 8 | 0,55 | 2,02 | ||||
| IV | T1N0M1 | 1 | 0,07 | 0,25 | 38 | 2,59 | 9,57 |
| T2N0M1 | 2 | 0,14 | 0,50 | ||||
| T2N1M1 | 2 | 0,14 | 0,50 | ||||
| T3N0M1 | 0 | 0,00 | 0,00 | ||||
| T3N1M1 | 21 | 1,43 | 5,29 | ||||
| T4N0M1 | 3 | 0,20 | 0,76 | ||||
| T4N1M1 | 9 | 0,61 | 2,27 | ||||
| Усього | 397 | 27,10 | 100,00 | 397 | 27,10 | 100,00 | |
При аналізі розподілу хворих на плоскоклітинний РСЧВВС (див. табл. 4) картина є практично ідентичною такій при розподілі хворих з плоскоклітинним РВВС. Найбільша частка хворих має стадію ІІА, що становить більше половини всіх хворих дослідної групи — 436 хворих із 803 (54,30%) від усіх пацієнтів з РСЧВВС, де домінує кількість хворих з T3N0M0 над T2N0M0 (277 (34,50%) порівняно з 159 (19,80%).
Друге місце також посідає група хворих з клінічною стадією ІІІ (243 (30,26%) хворих, де більш ніж вдвічі більше хворих зі стадією T3N1M0 (164 (20,42%) хворих, ніж разом хворих з T4N0M0 та T4N1M0 (відповідно 45 (5,60%) та 34 (4,23%) хворих). Знову чималою виявилася група хворих з віддаленими метастазами, тобто з клінічною стадією IV — 87 (10,83%) хворих, де переважали пацієнти з місцевопоширеним первинним процесом T3N0-1M1 та T4N1M1 — 67 із 87 хворих. Найрідше відмічали хворих з клінічними стадіями І та ІІВ — відповідно 10 (1,25%) та 27 (3,36%).
При аналізі розподілу хворих на плоскоклітинний РНЧВАВС отримані дані корелюють з наведеними при інших локалізаціях первинної пухлини в стравоході — більше половини хворих становили пацієнти з клінічною стадією ІІ— 218 (54,91% від усіх хворих на плоскоклітинний РНЧВАВС), з переважанням частки хворих з T3N0M0 (138 (34,96%) над T2N0M0 (80 (20,15%). Друге місце посідає група хворих з клінічною стадією ІІІ (112 (28,21%) хворих із значним переважанням пацієнтів з T3N1M0 (88 (22,17%) хворих. Третє місце — хворі з клінічною стадією IV — 38 (9,57%), де значно домінують пацієнти з місцевопоширеним первинним процесом (T3N1M1 та Т4N0-1M1) — 31 з 38 хворих. Стадії ІІ та ІІВ знову відмічали найрідше — відповідно 7 (1,76%) та 22 (5,54%).
Отже, під час аналізу розподілу хворих на плоскоклітинний рак стравоходу за клінічними стадіями та стадіями TNM можна стверджувати наступне. Усі 3 групи пацієнтів були достовірно тотожними за розподілом. Усе нижченаведене стосується як загальної кількості хворих, так і обраних дослідних груп. Більш ніж у половини хворих була ІІА клінічна стадія з переважанням частки хворих з T3N0M0 над T2N0M0. Майже у третини всіх хворих відмічали клінічну стадію ІІІ, причому значно переважали хворі із стадією T3N1M0. Чималу частку склали хворі з віддаленими метастазами, де, до того ж, переважали пацієнти з місцевопоширеними первинними процесами. Хворих з клінічними стадіями І та ІІВ відмічали значно рідше, ніж інших.
Виходячи з того, що за вказаними критеріями групи були тотожними, їх можна досліджувати.
Результати
Нам здалося доречним оцінити та проаналізувати загальну виживаність хворих на РС залежно від локалізації первинної пухлини на основі аналізу саме вищенаведених груп хворих, які лікувалися в науково-дослідному відділені пухлин органів грудної порожнини Національного інституту раку.
У табл. 6 узагальнена виживаність хворих залежно від локалізації первинної пухлини.
Таблиця 6. Виживаність хворих на плоскоклітинний РС залежно від локалізації первинної пухлини, %
| Тривалість спостереження, років | Рівень локалізації первинної пухлини | ||
| РВВС, n=265 | РСЧВВС, n=803 | РНЧВАВС, n=397 | |
| 1 | 47,76 ± 3,12 | 48,91 ± 5,79 | 58,32 ± 2,52 |
| 2 | 20,47 ± 2,60 | 23,68 ± 4,34 | 30,89 ± 2,45 |
| 3 | 15,82 ± 2,39 | 13,90 ± 1,61 | 21,67 ± 2,22 |
| 4 | 13,14 ± 2,27 | 11,45 ± 1,78 | 17,11 ± 2,06 |
| 5 | 10,57 ± 2,16 | 9,24 ± 0,82 | 15,36 ± 1,99 |
| 6 | 9,79 ± 2,13 | 8,37 ± 0,48 | 13,86 ± 1,93 |
| 7 | 8,86 ± 2,12 | 7,90 ± 0,56 | 11,83 ± 1,85 |
| 8 | 8,30 ± 2,13 | 7,38 ± 1,70 | 11,60 ± 1,84 |
| 9 | 7,03 ± 2,15 | 6,02 ± 1,90 | 9,08 ± 1,75 |
| 10 | 5,62 ± 2,13 | 4,78 ± 0,33 | 7,32 ± 1,68 |
Також виживаність хворих залежно від локалізації первинної пухлини проілюстровано на рис. 1.
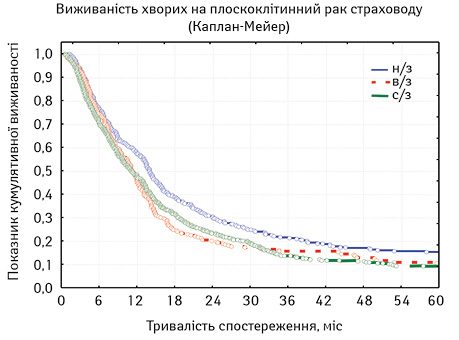
При оцінці розбіжностей виявлено — χ2 = 12,04501, p=0,00243 (p<0,05), отже розбіжності достовірні. При порівнянні лонг-рангових критеріїв між окремими групами можна стверджувати, що виживаність хворих на РНЧВАВС була достовірно кращою, ніж хворих на РВВС (p=0,01326, тобто p<0,05) та РСЧВВС (p=0,00057; p<0,05). Але при порівнянні виживаності хворих на РВВС та РСЧВВС статистичні розбіжності недостовірні (p=0,87895; p>0,05). Відповідно, на основі отриманих даних можна стверджувати, що достовірно кращою є виживаність у хворих на РНЧВАВС, ніж при інших локалізаціях первинної пухлини у стравоході. Це підтверджує вивчення медіани та середньої тривалості життя (табл. 7).
Таблиця 7. Медіана та середня тривалість життя хворих на РС залежно від локалізації первинної пухлини
| Рівень локалізації первинної пухлини | Медіана життя (міс.) | Середня тривалість життя (міс.) |
| РВВС | 10,62 | 19,15 |
| РСЧВВС | 9,90 | 18,51 |
| РНЧВАВС | 13,02 | 25,00 |
| Разом | 10,62 | 20,39 |
Виходячи з отриманих даних, закономірно випливає необхідність більш детального аналізу виживаності хворих не тільки залежно від локалізації пухлини, але й залежно від поширеності процесу. При формуванні груп дослідження ми виходили з питомої ваги різних груп хворих залежно від клінічної стадії (ВООЗ) та відповідних факторів, що можна об’єднати при подальшому досліджені.
Отже, першу групу склали хворі зі стадією І–ІІА, тобто пацієнти, у яких не виявлено регіонарних метастазів. Хворих зі стадією І було мало — 21 (1,43% від загальної кількості хворих), тобто для статистичного аналізу така кількість хворих є малоінформативною. Однак кількість хворих зі стадією ІІА була найбільшою — 809 (55,22% від загальної кількості хворих).
Другу групу склали хворі зі стадіями ІІВ та ІІІ, тобто пацієнти з місцевопоширеним процесом — регіонарні метастази або проростання первинної пухлини в суміжні органи та тканини. Знову ж таки, зі стадією ІІВ було лише 52 хворих (3,55% від загальної кількості) порівняно з 430 (29,35% від загальної кількості хворих).
Третю групу склали хворі, які мали клінічну стадію IV, тобто пацієнти з віддаленими метастазами, незалежно від рівня розповсюдження первинної пухлини. Питома вага цієї групи у дослідженні є значною — 153 пацієнти (10,44% від загальної кількості хворих).
Нижче наведений аналіз виживаності хворих на плоскоклітинний РС стадій І–ІІА залежно від локалізації первинної пухлини (табл. 8, рис. 2).
Таблиця 8. Виживаність хворих на плоскоклітинний РС 1–2А клінічних стадій (ВООЗ) залежно від локалізації первинної пухлини, %
| Тривалість спостереження, років | Рівень локалізації первинної пухлини | ||
| РВВС | РСЧВВС | РНЧВАВС | |
| 1 | 54,34 ± 3,99 | 56,96 ± 2,38 | 66,13 ± 3,22 |
| 2 | 22,14 ± 3,38 | 29,77 ± 2,24 | 38,07 ± 3,40 |
| 3 | 16,69 ± 3,05 | 19,01 ± 1,96 | 29,27 ± 3,21 |
| 4 | 13,06 ± 2,79 | 16,67 ± 1,89 | 23,74 ± 3,04 |
| 5 | 9,80 ± 2,52 | 13,40 ± 1,78 | 21,40 ± 2,96 |
| 6 | 9,31 ± 2,49 | 12,69 ± 1,75 | 19,51 ± 2,89 |
| 7 | 8,21 ± 2,43 | 11,91 ± 1,73 | 16,03 ± 2,76 |
| 8 | 7,53 ± 2,41 | 11,04 ± 1,71 | 15,64 ± 2,75 |
| 9 | 6,77 ± 2,39 | 8,74 ± 1,63 | 13,80 ± 2,72 |
| 10 | 5,42 ± 2,26 | 6,62 ± 1,54 | 11,67 ± 2,68 |
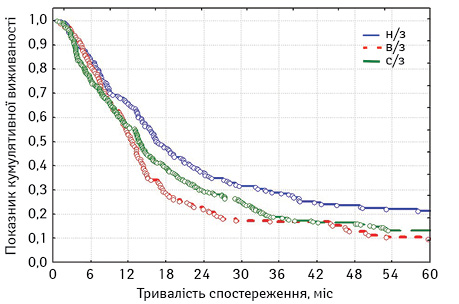
При оцінці розбіжностей виявлено: χ2 = 9,436341; p=0,00894 (p<0,05), отже розбіжності достовірні. При порівнянні лонг-рангових критеріїв між окремими групами також, як при вищенаведеному аналізі загальної виживаності, можна стверджувати, що виживаність хворих на РНЧВАВС стадій І–ІІА була достовірно кращою, ніж у хворих на РВВС (p=0,00280, тобто p<0,05) та РСЧВВС (p=0,00640; p<0,05). Але при порівнянні виживаності хворих на РВВС та РСЧВВС стадій І–ІІА статистичні розбіжності недостовірні (p=0,32320; p>0,05). Відповідно, на основі отриманих даних можна стверджувати, що достовірно кращою є виживаність у хворих на РНЧВАВС стадій І–ІІА. Це також підтверджує вивчення медіани та середньої тривалості життя (табл. 9).
Таблиця 9. Медіана та середня тривалість життя у хворих на РС 1–2А клінічних стадій (ВООЗ) залежно від локалізації первинної пухлини
| Рівень локалізації первинної пухлини | Медіана життя, міс | Середня тривалість життя, міс |
| РВВС | 12,00 | 23,11 |
| РСЧВВС | 13,15 | 23,64 |
| РНЧВАВС | 15,44 | 31,07 |
| Разом | 13,26 | 25,56 |
Нижче наведено аналіз виживаності хворих на плоскоклітинний РС стадій ІІВ–ІІІ залежно від локалізації первинної пухлини (табл. 10, рис. 3).
Таблиця 10. Виживаність хворих на плоскоклітинний РС 2B–3 клінічних стадій (ВООЗ) залежно від локалізації первинної пухлини, %
| Тривалість спостереження, років | Рівень локалізації первинної пухлини | ||
| РВВС | РСЧВВС | РНЧВАВС | |
| 1 | 41,89 ± 5,74 | 43,52 ± 3,08 | 57,36 ± 4,35 |
| 2 | 18,89 ± 4,87 | 19,10 ± 2,57 | 26,48 ± 4,08 |
| 3 | 14,69 ± 4,61 | 8,81 ± 1,93 | 14,26 ± 3,39 |
| 4 | 13,22 ± 4,59 | 5,17 ± 1,61 | 10,03 ± 2,97 |
| 5 | 11,34 ± 4,65 | 4,31 ± 1,55 | 8,85 ± 2,85 |
| 6 | 6,80 ± 4,48 | 2,58 ± 1,33 | 7,59 ± 2,71 |
| 7 | 3,40 ± 4,07 | 2,15 ± 1,24 | 6,96 ± 2,63 |
| 8 | 1,70 ± 2,65 | 1,79 ± 1,13 | 6,38 ± 2,53 |
| 9 | 1,70 ± 2,65 | 1,49 ± 1,02 | 3,19 ± 1,82 |
| 10 | 1,70 ± 2,65 | 1,25 ± 0,91 | 1,91 ± 1,47 |
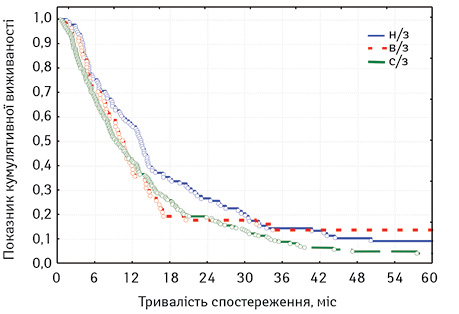
Під час оцінки розбіжностей виявлено: χ2 =7,950987; p=0,01878 (p<0,05), отже розбіжності достовірні. При порівнянні лонг-рангових критеріїв між окремими групами, так само як при вищенаведеному аналізі загальної виживаності, можна стверджувати, що виживаність хворих на РНЧВАВС стадій ІІВ–ІІІ була недостовірно кращою, ніж у хворих на РВВС (p=0,24475, тобто p>0,05), але достовірно кращою, ніж у хворих на РСЧВВС (p=0,01107; p<0,05). Однак при порівнянні виживаності хворих на РВВС та РСЧВВС стадій ІІВ–ІІІ статистичні розбіжності є недостовірними (p=0,43098; p>0,05).
Відповідно, на основі отриманих даних можна стверджувати, що достовірно кращою є виживаність у хворих на РНЧВАВС стадій ІІВ–ІІІ, ніж у хворих на РСЧВВС стадій ІІВ–ІІІ. Це також підтверджує вивчення медіани та середньої тривалості життя (табл. 11).
Таблиця 11. Медіана та середня тривалість життя у хворих на РС 2B–3 клінічних стадій (ВООЗ) залежно від локалізації первинної пухлини
| Рівень локалізації первинної пухлини | Медіана життя, міс | Середня тривалість життя, міс |
| РВВС | 9,49 | 13,89 |
| РСЧВВС | 8,44 | 13,55 |
| РНЧВАВС | 12,66 | 20,07 |
| Разом | 9,43 | 15,42 |
Нижче наведено аналіз виживаності хворих на плоскоклітинний РС з клінічною стадією хвороби IV, тобто тих пацієнтів, у яких виявили віддалені метастази (табл. 12). Надана лише 5-річна виживаність, враховуючи несприятливість цієї стадії хвороби та відсутність віддалених результатів більше 5 років, незалежно від рівня локалізації пухлини у стравоході.
Таблиця 12. Виживаність хворих на плоскоклітинний РС з клінічною стадією 4 (ВООЗ)
| Тривалість спостереження, років | Виживаність, % |
| 1 | 22,30 ± 3,42 |
| 2 | 6,61 ± 2,21 |
| 3 | 3,30 ± 1,74 |
| 4 | 2,20 ± 1,72 |
| 5 | 1,10 ± 1,40 |
Ми проаналізували виживаність хворих з клінічною стадією IV з урахуванням проявів хвороби (рис. 4).
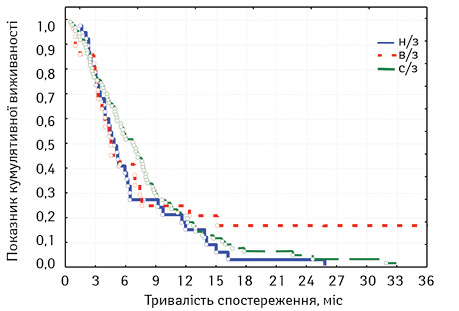
При оцінці розбіжностей виявлено: χ2 = 1,329521; p=0,51440 (p>0,05), отже розбіжності недостовірні. Під час порівняння лонг-рангових критеріїв між окремими групами виявлено, що виживаність хворих стадії IV достовірно не залежала від рівня локалізації пухлини (значення р дорівнювали 0,26298; 0,28882; 0,68250, тобто, усі p>0,05), що свідчить про вирішальне значення рівня занедбаності процесу.
Медіана та середня тривалість життя (табл. 13) при стадії IV були значно меншими, ніж при інших стадіях.
Таблиця 13. Медіана та середня тривалість життя у хворих на РС клінічної стадії 4 (ВООЗ) залежно від локалізації первинної пухлини
| Рівень локалізації первинної пухлини | Медіана життя, міс | Середня тривалість життя, міс |
| РВВС | 4,46 | 11,33 |
| РСЧВВС | 5,97 | 7,61 |
| РНЧВАВС | 4,74 | 6,47 |
| Разом | 5,31 | 8,01 |
Висновки
Таким чином, узагальнюючи все вищенаведене, маємо можливість виокремити наступні закономірності та тенденції.
- Серед 1690 хворих на злоякісні захворювання стравоходу, які отримували лікування в науково-дослідному відділенні пухлин органів грудної порожнини, понад 90% становили чоловіки із середнім віком 58,48 року, причому вікові коливання значні — 20–90 років.
- Серед гістологічних форм істотно переважав плоскоклітинний РС (86,69%), причому його частота залежала від локалізації первинної пухлини в стравоході — при ураженні верхніх відділів та середньої частини внутрішньогрудного відділу його відмічали більш ніж у 90% випадків, а при ураженні нижньої частини внутрішньогрудного та абдомінального відділів — у 76,05%.
- Серед інших гістологічних форм переважала аденокарцинома (82,72%).
- Саме хворі на плоскоклітинний РС були залучені до подальшого аналізу. Залежно від рівня локалізації первинної пухлини: більше половини склали хворі на РСЧВВС, а хворих на РНЧВАВС було більше у 1,5 раза, ніж хворих на РВВС. Характерно, що при аналізі розподілу хворих за стадіями TNM та клінічними стадіями (ВООЗ) залежно від рівня локалізації первинної пухлини у стравоході, усі групи виявилися тотожними практично за всіма показниками — більше половини пацієнтів становили хворі з клінічною стадією ІІА, серед яких у 1,5–2 рази переважала стадія T3N0M0 над T2N0M0.
- Майже третину від усіх хворих становили пацієнти зі стадією ІІІ, де значно домінувала стадія T3N1M0. Майже 10% — хворі з клінічною стадією IV, серед яких переважали пацієнти з місцевопоширеними формами первинного пухлинного процесу. А найрідше відмічали стадії РС ІІВ та, особливо, І.
- Після проведеного аналізу виживаності хворих можна сказати, що достовірно кращою виживаність була у пацієнтів з плоскоклітинним РНЧВАВС, як при початкових стадіях, так і при місцевопоширених процесах, а виживаність хворих на РВВС та РСЧВВС достовірно не розрізнялася. Але, при клінічній стадії IV достовірної різниці у виживаності хворих залежно від локалізації первинної пухлини не спостерігали.
Список використаної літератури
- 1. Ганул, В. Л., & Киркилевский, С. И. (2003). Рак пищевода: руководство для онкологов и хирургов. Киев: Книга Плюс.
- 2. Domper Arnal, M. J., Ferrandez, Arenas A., Lanas Arbeloa, A. (2015). Esophageal cancer: Risk factors, screening and endoscopic treatment in Western and Eastern countries. World Journal of Gastroenterology, 21(26), 7933–7943. doi: 10.3748/wjg.v21.i26.7933.
- 3. Jemal, A., Bray, F., Center, M. M., Ferlay, J., Ward, E., Forman, D. (2011). Global cancer statistics. CA: A Cancer Journal for Clinicians, 61(2), 69–90. doi: 10.3322/caac.20107.
- 4. Федоренко, З. П., Гулак, Л. О., Михайлович, Ю. Й., Горох, Є. Л., Рижов, А. Ю., Сумкіна, О. В., & Куценко, Л. Б. (2020). Рак в Україні, 2018–2019. Захворюваність, смертність, показники діяльності онкологічної служби/гол. ред. О.О. Колеснік. Бюлетень Національного канцер-реєстру України, 20, 101.
- 5. Янкин, А. В. (2003). Рак пищевода: от статистики к диагностике. Практическая онкология, 4(2), 61–65.
- 6. Юдин, С. С. (1995). Этюды желудочной хирургии. Москва: Медгиз.
- 7. Ajani, J. A., D’Amico, T. A., Almhanna, K., Chao, J., Corvera, C., Das, P., … Pluchino, L. A. (2015). Esophageal and esophagogastric junction cancers, version 1.2015. Journal of the National Comprehensive Cancer Network,13(2), 194–227. doi: 10.6004/jnccn.2019.0033.
- 8. Lee, D. J., Harris, A., Gillette, A., Munoz, L, & Kashima, H. (1984). Carcinoma of the cervical esophagus: diagnosis, management, and results. Southern Medical Journal, 77(11), 1365–1367. doi: 10.1097/00007611-198411000-00004.
- 9. Morita, M., Saeki, H., Mori, M., Kuwano, H., & Sugimachi, K. (2002). Risk factors for esophageal cancer and the multiple occurrence of carcinoma in the upper aerodigestive tract. Surgery, 131(1), 1–6. doi.org/10.1067/msy.2002.119287.
- 10. Pandeya, N., Williams, G., Green, A. C., Webb, P. M., & Whiteman, D. C. (2009). Australian Cancer Study. Alcohol consumption and the risks of adenocarcinoma and squamous cell carcinoma of the esophagus. Gastroenterology, 136(4), 1215–1224. doi: 10.1053/j.gastro.2008.12.052.
- 11. Popescu, B., Popescu, C. R., Grigore, R. Mogoantă, C. A., Ioniţă, E., Moculescu, C., & Berteşteanu, Ş.V. (2012). Morphology and morphopathology of hypopharyngo-esophageal cancer. Romanian Journal of Morphology and Embryology, 53(2), 243–248.
- 12. Popescu, C. R., Bertesteanu, S. V., Mirea, D., Grigore, R., Ionescu, D., & Popescu B. (2010). The epidemiology of hypopharynx and cervical esophagus cancer. Journal of Medicine and Life, 3(4), 396–401.
- 13. Morita, M., Kuwano, H., Nakashima, T., Taketomi, A., Baba, H., Saito, T., … Sugimachi, K. (1998) Family aggregation of carcinoma of the hypopharynx and cervical esophagus: special reference to multiplicity of cancer in upper aerodigestive tract. International Journal of Cancer, 76(4), 468–471. doi.org/10.1002/(SICI)1097-0215(19980518)76:4<468::AID-IJC4>3.0.CO;2-P.
- 14. van Gijssel, H. E., Schild, L. J., Watt, D. L. Roth, M. J., Wang, G. Q., Dawsey, S. M., … Poirier, M. C. (2004). Polycyclic aromatic hydrocarbon-DNA adducts determined by semiquantitative immunohistochemistry in human esophageal biopsies taken in 1985. Mutation Research, 547(1–2),55–62. doi: 10.1016/j.mrfmmm.2003.11.010.
- 15. Guo, F., Liu, Y., Wang, X., Weiss, N. S., Madeleine, M. M., Liu, F., … Ke, Y. (2012). Human papillomavirus infection and esophageal squamous cell carcinoma: a case-control study. Cancer Epidemiology, Biomarkers & Prevention, 21(5), 780–785. doi: 10.1158/1055-9965.EPI-11-1206.
- 16. Ludmir, E. B., Palta, M., Zhang, X. Wu, Y., Willett, C. G., & Czito, B.G. (2014). Incidence and prognostic impact of high-risk HPV tumor infection in cervical esophageal carcinoma. Journal of Gastrointestinal Oncology, 5(6), 401–407. doi: 10.3978/j.issn.2078-6891.2014.053.
- 17. Syrjanen, K. J. (2002). HPV infections and oesophageal cancer. Journal of Clinical Pathology, 55(10), 721–728. doi: 10.1136/jcp.55.10.721.
- 18. Brown, L. M., Devesa, S. S., & Chow, W. H. (2008). Incidence of adenocarcinoma of the esophagus among white Americans by sex, stage, and age. Journal of the National Cancer Institute, 100 (16),1184–1187. doi: 10.1093/jnci/djn211.
- 19. Muro, K., Lordick, F., Tsushima, T., Pentheroudakis, G., Baba, E., Lu, Z., … Douillard, J.-Y. (2019). Pan-Asian adapted ESMO Clinical Practice Guidelines for the management of patients with metastatic oesophageal cancer: a JSMO-ESMO initiative endorsed by CSCO, KSMO, MOS, SSO and TOS. Annals of Oncology, 30(1), 34–43. doi:https://doi.org/10.1093/annonc/mdy498.
- 20. Полинкевич, Б. С., Белянский, Л. С., Пустовит, А. А., & Калашников, А. А. (2011). Опыт лечения рака шейного отдела пищевода. Харківська хірургічна школа, 47(2), 25–27.
Выживаемость больных раком пищевода в зависимости от локализации первичной опухоли
Национальный институт рака, Киев
Резюме. Актуальность. Рак пищевода (РП) занимает 8-е место среди наиболее распространенных онкологических заболеваний в мире и 6-е место — по смертности мужчин вследствие злокачественных новообразований. Клиническое течение заболевания обусловлено быстрым развитием синдрома дисфагии, на фоне которого в течение нескольких месяцев развивается кахексия, больные обычно умирают от алиментарного истощения. На сегодня почти нет исследований, в которых анализировали выживаемость больных в зависимости от локализации первичной опухоли. Цель. Исследовать результаты выживаемости больных РП в зависимости от локализации первичной опухоли. Материалы и методы. Из 1690 пациентов со злокачественными опухолями пищевода проанализирована выживаемость 1465 больных плоскоклеточным РП в зависимости от локализации первичной опухоли по распределению по стадиям TNM и клиническим стадиям. Результаты. Среди 1690 больных злокачественными заболеваниями пищевода, получавших лечение в научно-исследовательском отделении опухолей органов грудной полости, более 90% составляли мужчины, средний возраст которых — 58,48 года, причем возрастные колебания значительны — от 20 до 90 лет. Среди гистологических форм существенно преобладал плоскоклеточный РП (86,69%), его частота зависела от локализации первичной опухоли в пищеводе — при поражении верхних отделов и средней части внутригрудного отдела его отмечали более чем в 90% случаев, а при поражении нижней части внутригрудного и абдоминального отделов — в 76,05%. Среди других гистологических форм преобладала аденокарцинома (82,72%). Именно больные плоскоклеточный РП были привлечены к дальнейшему анализу. В зависимости от уровня локализации первичной опухоли: более половины составляли больные раком средних отделов, а больных раком нижних отделов было больше в 1,5 раза, чем больных раком верхних отделов. Характерно, что при анализе распределения больных по стадиям TNM и клиническими стадиями (ВОЗ) в зависимости от уровня локализации первичной опухоли в пищеводе, все группы оказались тождественными практически по всем показателям — больше половины больных составляли больные с IIА клинической стадией, среди которых в 1,5–2 раза преобладала стадия T3N0M0 над T2N0M0. Почти треть всех больных составляли пациенты со стадией III, где значительно доминировала стадия T3N1M0. Почти 10% составляли больные с клинической стадией IV, среди которых преобладали больные с местнораспространенными формами первичного опухолевого процесса. А реже всего отмечали IIВ и, особенно, стадию I РС. Выводы. После проведенного анализа выживаемости больных можно сказать, что достоверно лучше выживаемость была у пациентов с плоскоклеточным раком нижних отделов пищевода как при начальных стадиях, так и при местнораспространенных процессах, а выживаемость больных раком верхних и средних отделов достоверно не различалась. Но при клинической стадии IV достоверной разницы в выживаемости больных в зависимости от локализации первичной опухоли не наблюдали.
Ключевые слова: рак пищевода; рак верхних отделов пищевода; рак средней доли внутригрудного отдела пищевода; выживаемость.
Адреса:
Крахмальов Павло Сергійович
03022, Київ, вул. Ломоносова, 33/43
Національний інститут раку
E-mail: ivankrah7@gmail.com
Correspondence:
Krahmalyov Pavlo
National Cancer Institute
33/43 Lomonosova Str., Kyiv 03022
E-mail: ivankrah7@gmail.com














Leave a comment