Поширеність мутацій гена EGFR в українських пацієнтів з місцево-поширеним або метастатичним недрібноклітинним раком легені
Шпарик Я.В.1, Пономарьова О.В.2, Соколов В.В.3, Кобзєв О.І.4, Суховерша О.А.5, Борисюк Б.О.6, Войтко В.О.7, Сєвєргін В.Є.8, Рослякова Т.В.9, Кузнецова О.В.10, Крулько С.І.11, Заплатіна С.В.12, Зовтун В.В.13, Шапочка Д.О.14
- 1Львівський онкологічний регіональний лікувально-діагностичний центр, Львів
- 2Київський міський клінічний онкологічний центр, Київ
- 3Київська міська клінічна лікарня № 17, Київ
- 4Харківський обласний клінічний онкологічний центр, Харків
- 5Дніпропетровська багатопрофільна клінічна лікарня № 4, онкоторакальний центр, Дніпро
- 6Національний інститут раку МОЗ України, Київ
- 7Клінічна лікарня «Феофанія», Київ
- 8Медичний дім «Одрекс», Одеса
- 9Клініка «Образцова», Київ
- 10Одеський національний медичний університет, Одеса
- 11Онкологічний центр «Томоклінік», Кропивницький
- 12Херсонський обласний клінічний диспансер, Херсон
- 13Миколаївський обласний клінічний диспансер, Миколаїв
- 14Медична лабораторія CSD, Київ
Резюме. Актуальність. Мутація рецептора епідермального фактора росту (epidermal growth factor receptor — EGFR) відіграє важливу роль у процесах онкогенезу, зокрема при недрібноклітинному раку легені (НДРЛ). Поширеність мутацій EGFR у загальній популяції пацієнтів з НДРЛ становить 15–35% і залежить від гістологічного підтипу пухлини, етнічного походження, статі та статусу щодо куріння. Пацієнтам із НДРЛ та мутаціями EGFR показано застосування таргетних препаратів — інгібіторів тирозинкінази (TKI) EGFR, які впливають на дану мутацію та значно покращують безрецидивну виживаність хворих. Тому всі провідні міжнародні рекомендації в галузі онкології (ESMO, NCCN, IASLC) пропонують проводити діагностику даної мутації у пацієнтів з місцево-поширеним НДРЛ. Мета. Метою цього ретроспективного дослідження було виявлення частоти поширеності мутацій гена EGFR серед українських пацієнтів з місцево-поширеним або метастатичним НДРЛ (гістологічний підтип — аденокарцинома), а також оцінити частоту виявлення мутацій гена EGFR залежно від віку та статі. Матеріали і методи. У дослідження включали пацієнтів із місцево-поширеним або метастатичним НДРЛ (гістологічний тип — аденокарцинома), у яких за направленням лікаря були відібрані зразки пухлини (гістологічний або цитологічний матеріал) для проведення дослідження щодо виявлення у них мутацій у гені EGFR, яке здійснювалося тест-набором SensiScreen® EGFR (EXON 19 Deletions + T790M + L858R) Multiplex FFPE Real-time PCR Kit (CE IVD), методом полімеразної ланцюгової реакції (ПЦР) у реальному часі з метою виявлення драйверних мутацій (делеції у 19-му екзоні та точкової мутацій L858R у 21-му екзоні) у пацієнтів, що не отримували препарати групи ТКІ та мутації резистентності T790M, у пацієнтів, які отримували препарати ТКІ 1-го або 2-го покоління. Результати. У ході дослідження отримано зразки матеріалу від 308 пацієнтів, середній вік пацієнтів становив 59,2 року (20–40 років — 15/281 (5%), 41–50 років — 42/281 (15%), 51–60 років — 83/281 (30%), 61–70 років — 110/281 (39%), 71–86 років — 31/281 (11%). Гістологічний матеріал становив 302/308 (98%) зразків, цитологічний матеріал — 6/308 (2%) зразків. Валідними для проведення молекулярно-генетичного аналізу визначення мутації в гені EGFR були 290/308 (94%) зразків. 282/290 (97%) зразки були від пацієнтів, які не отримували препарати групи ТКІ EGFR, 8/290 (3%) зразків були від пацієнтів, які мали прогресування захворювання на тлі лікування препаратами групи ТКІ 1-го або 2-го покоління EGFR. Мутації в гені EGFR виявлені у 58/290 (20%) пацієнтів, з них у 54/282 (19,1%) хворих виявлено драйверні мутації EGFR, а у 4/8 (50%) — мутацію резистентності T790M. У 26/54 (48,1%) пацієнтів виявлено делецію в 19-му екзоні, у 28/54 (51,9%) пацієнтів — в 21-му екзоні EGFR (L858R). Поширеність мутацій у гені EGFR у хворих на НДРЛ жінок була статистично достовірно вищою — 33,9% порівняно із чоловіками — 8,2% (р<0,0001). Найбільший номінальний відсоток виявлення мутацій EGFR (25%) відмічено у пацієнтів віком 51–60 років, але поширеність мутацій EGFR залежно від віку була статистично недостовірною (p=0,460). Висновки. Мутації гена EGFR відмічають у 1/5 українських пацієнтів із НДРЛ (аденокарцинома), при цьому їх поширеність є вищою серед жінок та не залежить від віку пацієнтів. Це акцентує увагу на важливості проведення тестування пацієнтів з НДРЛ (аденокарцинома) на наявність мутацій EGFR з метою персоналізації терапії та покращення результатів лікування захворювання.
DOI: 10.32471/clinicaloncology.2663-466X.37-1.27247
Вступ
Роль рецептора EGFR
Рецептор епідермального фактора росту (epidermal growth factor receptor — EGFR) відіграє важливу роль у нормальних біологічних процесах, включаючи проліферацію та міграцію клітин, а у разі гіперактивації внаслідок мутації бере участь у процесах онкогенезу [1–3].
EGFR, також відомий як HER1 або ErbB1 рецептор, складається з позаклітинного ліганд-зв’язуючого домену, гідрофобної трансмембранної ділянки, внутрішньоклітинного домену рецепторної тирозинкінази та С-кінцевого домену. Члени родини рецепторів ErbB/HER демонструють схожість тирозинкіназних доменів, але вони мають відмінні позаклітинні та С-кінцеві домени. EGFR — типовий трансмембранний рецептор, який ініціює сигнальний каскад за допомогою димеризації, ініційованої лігандами, що активує тирозинкінази та множинні ефектори низхідного шляху. EGFR активує реакції фосфорилювання, стимулюючи сигнальні каскади, які, в тому числі, залучені до процесів ембріогенезу та диференціювання стовбурових клітин [4–7] (рис. 1).
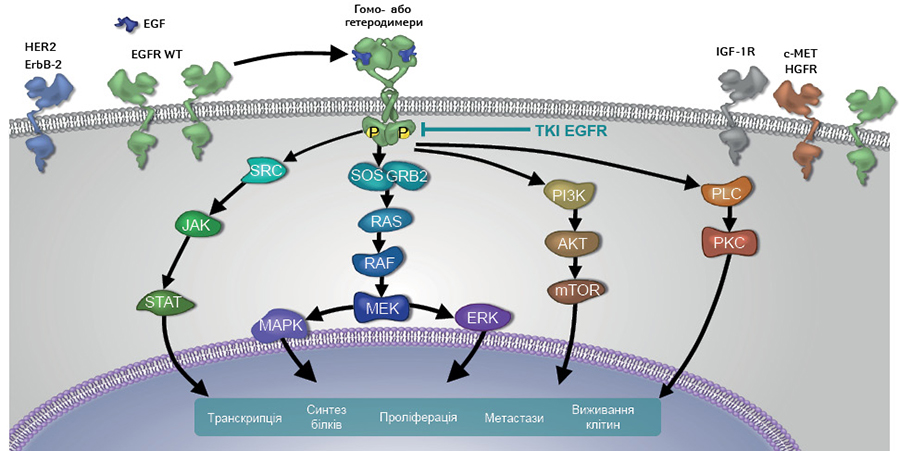
 Так, після того як специфічний ліганд, наприклад, епідермальний фактор росту (epidermal growth factor — EGF), зв’язується з позаклітинним ліганд-зв’язуючим доменом, EGFR утворює або гомодимер з EGFR, або гетеродимер з іншими членами родини ErbB/HER (HER2, HER3, HER4), що призводить до активації домену внутрішньоклітинної тирозинкінази за рахунок підвищення спорідненості зв’язування з аденозинтрифосфатом (АТФ). Це запускає сигнальний каскад, який підтримує проліферацію клітин, що за нормальних умов забезпечує відновлення епітелію бронхів. Зокрема, відбувається активація ряду низхідних сигнальних шляхів через автофосфорилювання залишків тирозину, що призводить до прискорення проліферації та міграції клітин, покращення виживаності клітин шляхом уникнення апоптозу та сприяння ангіогенезу [8]. Таким чином, сигнальний каскад, що розпочинається з активації тирозинкінази EGFR, бере участь у підтримці гомеостазу, розвитку та процесах росту епітеліальних тканин [9]. Це так звані канонічні біологічні функції EGFR.
Так, після того як специфічний ліганд, наприклад, епідермальний фактор росту (epidermal growth factor — EGF), зв’язується з позаклітинним ліганд-зв’язуючим доменом, EGFR утворює або гомодимер з EGFR, або гетеродимер з іншими членами родини ErbB/HER (HER2, HER3, HER4), що призводить до активації домену внутрішньоклітинної тирозинкінази за рахунок підвищення спорідненості зв’язування з аденозинтрифосфатом (АТФ). Це запускає сигнальний каскад, який підтримує проліферацію клітин, що за нормальних умов забезпечує відновлення епітелію бронхів. Зокрема, відбувається активація ряду низхідних сигнальних шляхів через автофосфорилювання залишків тирозину, що призводить до прискорення проліферації та міграції клітин, покращення виживаності клітин шляхом уникнення апоптозу та сприяння ангіогенезу [8]. Таким чином, сигнальний каскад, що розпочинається з активації тирозинкінази EGFR, бере участь у підтримці гомеостазу, розвитку та процесах росту епітеліальних тканин [9]. Це так звані канонічні біологічні функції EGFR.
До неканонічних функцій EGFR, що були відкриті порівняно нещодавно, належать регуляція процесу аутофагії та метаболізму. Індукція цих процесів через EGFR-сигнальний каскад зазвичай відбувається під впливом стресових факторів [10].
Роль мутацій гена EGFR у патогенезі НДРЛ
Рак легені є провідною причиною онкологічної смертності у світі, спричинюючи 1,5 млн випадків смерті щорічно. Близько 85% випадків раку легені припадає на НДРЛ, який включає такі гістологічні підтипи, як аденокарцинома легені, плоскоклітинна карцинома та крупноклітинна карцинома. За останнє десятиліття досягнуто значних успіхів у розумінні процесу розвитку раку легені, особливо НДРЛ [11].
НДРЛ визначається як група гетерогенних захворювань, онкогенним драйвером розвитку деяких з них виступає гіперактивація EGFR. Блокада EGFR за допомогою специфічних інгібіторів тирозинкінази може призводити до вираженої реакції з боку пухлини при НДРЛ та, відповідно, покращення результатів лікування захворювання [12, 13].
Мутації EGFR можуть призводити до ліганд-незалежної активації рецептора, внаслідок чого сигнал, який активує проліферацію клітин, передається без приєднання ліганда до рецептора. Таким чином, відбувається гіперактивація EGFR-сигнального каскаду, що реалізується у вигляді безперервного передавання сигналу через EGFR, та, відповідно, патологічної проліферації клітин і в результаті — розвитку онкологічної патології. Так, при раку легені, грудної залози та при гліобластомі EGFR виступає в якості драйвера онкогенезу [10, 14] (рис. 2).
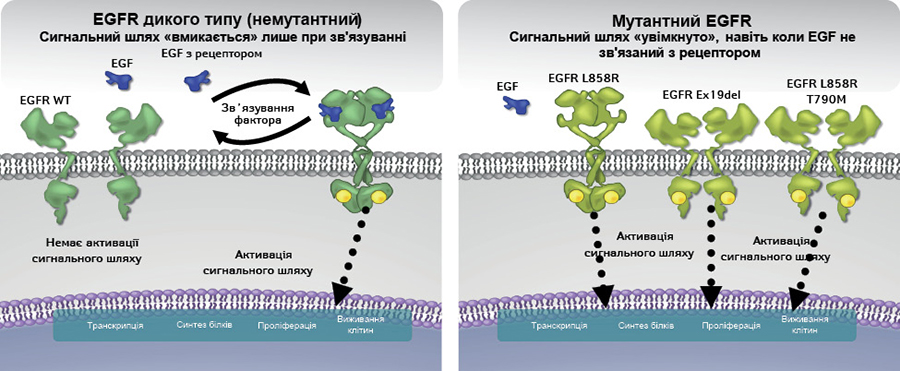
Ген EGFR складається з 28 екзонів, з яких екзони 18–21 кодують «щілину» АТФ-зв’язуючого домену тирозинкінази. У 2004 р. соматичні мутації в екзонах 18–21 гена EGFR, які спричиняли незалежну від ліганду активацію тирозинкінази EGFR, були виявлені у пухлинній тканині при недрібноклітинному раку легені (НДРЛ) [15, 16]. Потім пильна увага в контексті розвитку онкопатології була прикута до 2 онкогенних мутацій у каталітичному домені EGFR — в екзоні 19 (Del746-750) та 21 (L858R) [17, 18]. Наразі нараховується більше 200 різних онкогенних мутацій EGFR, що мають значення для розвитку, прогресування та прогнозу перебігу онкопатології. Більшість мутацій охоплюють 18–21-й екзони EGFR, що кодують тирозинкіназний домен EGFR, та мають значення для розвитку онкологічної патології різних локалізацій [19].
Найбільш поширені мутації гена EGFR при НДРЛ — делеції в екзоні 19, що призводять до усунення амінокислот із послідовності, включаючи лейцин (L) в кодоні 747, аргінін (R) в кодоні 748, глутамінову кислоту (Е) в кодоні 749 та аланін (А) в кодоні 750 (∆LREA) та точкову мутацію в екзоні 21, що призводить до заміни лейцину (L) на аргінін (R) у кодоні 858 (L858R). Ці активуючі або драйверні мутації є онкогенними у зв’язку з конститутивною тирозинкіназною активацією EGFR і відповідають за розвиток та прогресування приблизно 90% випадків аденокарциноми легені, що мають EGFR-мутацію [8, 20, 21]. Більшість інгібіторів тирозинкінази є ефективними відносно пухлин саме з цими мутаціями. На інші, менш поширені мутації, припадає лише 10% випадків НДРЛ з мутаціями EGFR. За деяким винятком мутації, що охоплюють екзони 18, 19 та 21, є чутливими до лікування інгібіторами тирозинкінази, а мутації, що зачіпають 20-й екзон, здебільшого нечутливі до такої терапії [22]. Крім того, у 50–60% випадків після терапії інгібіторами тирозинкінази можуть розвиватися вторинні мутації, зокрема точкова мутація в 20-му екзоні Т790М. Мутація Т790М є основним механізмом формування набутої резистентності до терапії інгібіторами тирозинкінази ЕGFR першого та другого покоління [23].
Епідеміологія мутацій EGFR при НДРЛ
Мутації EGFR є ранньою подією в канцерогенезі раку легені і не пов’язані зі стадією хвороби і прогресією захворювання. Поширеність мутації EGFR не відрізняється у пацієнтів з НДРЛ, що були діагностованими на різних стадіях та з/без хіміотерапії в анамнезі [24].
За результатами метааналізу, мутації EGFR виявляються більш ніж у 30% пацієнтів з НДРЛ, що походять зі Східної Азії, і лише у 10% хворих європеоїдної раси та тих, що мешкають на інших континентах. Частота мутації EGFR при аденокарциномі легені досягає 15–20% у пацієнтів у країнах Європи та Північної Америки і 65–70% — у Південно-Східній Азії [25, 26]. Найчастіше мутації EGFR відмічають при аденокарциномі у некурців [26, 27]. Рак легені у некурців становить 25% випадків раку легені в світі (10–15% — у західних країнах) і займає 7-ме місце серед причин смерті внаслідок онкологічних захворювань. Частка раку легені у некурців становить понад 50% випадків раку у жінок в Східній Азії і тільки 2–6% — у чоловіків в західних країнах [26].
Визначення мутацій EGFR при НДРЛ
Ведення пацієнтів з раком легені перейшло від узагальненого підходу до лікування, заснованого на стадії і типі пухлини, до терапії, що базується на клінічних характеристиках, гістологічному підтипі та статусі молекулярних біомаркерів [28]. Цей підхід відкриває можливості застосування персоналізованої таргетної терапії, що надає клінічні переваги в лікуванні пацієнтів з НДРЛ. Метою персоналізації є вибір оптимального лікування для пацієнтів, які, швидше за все, отримають від цього найбільшу користь [29]. Тому сьогодні мутації EGFR є необхідним предиктивним маркером у лікуванні НДРЛ та призначенні препаратів групи інгібіторів тирозинкінази. Лікування в першій лінії терапії НДРЛ інгібіторами тирозинкінази призначають тільки після виявлення мутації EGFR. Сьогодні проведення молекулярно-генетичного тестування на наявність EGFR-мутацій рекомендовано провідними онкологічними товариствами [30–32]
Так, згідно з рекомендаціями Національної загальної онкологічної мережі США (National Comprehensive Cancer Network — NCCN), при виявленні поширеної аденокарциноми (неплоскоклітинного)/великоклітинного раку або якщо гістологічний тип не визначений, рекомендовано проведення молекулярно-генетичного тестування на наявність активуючих мутацій гена EGFR (18-, 19- і 21-й екзони) і транслокації гена ALK [30]. Також необхідно розглянути можливість молекулярно-генетичного тестування при виявленні плоскоклітинного раку, особливо у пацієнтів, що не палять, або в разі якщо вдалося отримати невелику кількість матеріалу, або при виявленні змішаного гістологічного типу. Міжнародна асоціація з вивчення раку легені (International Association for the Study of Lung Cancer — IASLC), Асоціація молекулярної патології (Association for Molecular Pathology — AMP), Коледж американських патологів (College of American Pathologists — САР) рекомендує проведення молекулярно-генетичного тестування на наявність мутацій EGFR пацієнтам із метастатичною аденокарциномою легені, незалежно від клінічних характеристик (вік, анамнез куріння, етнічна приналежність) [32].
У свою чергу, Європейське товариство медичної онкології (European Society for Medical Oncology — ESMO) рекомендує проведення молекулярно-генетичного тестування на наявність мутацій EGFR у пацієнтів з неплоскоклітинним поширеним НДРЛ [31]. Тестування не рекомендується пацієнтам із діагнозом плоскоклітинного раку, за винятком хворих-некурців: не курили взагалі або курили мало (<15 пачок на рік) і не курять зараз.
Інгібітори тирозинкінази вже давно широко увійшли в практику лікування НДРЛ в Україні. Наразі в нашій країні доступні інгібітори тирозинкінази найновішого — третього покоління. Застосування інгібіторів тирозинкінази значно впливає на прогноз перебігу захворювання та безрецидивну виживаність пацієнтів, тому важливо оцінити частоту і спектр мутацій гена EGFR в українських пацієнтів. Тож, метою дослідження «Виявлення мутацій гена EGFR у пацієнтів з місцево-поширеним або метастатичним недрібноклітинним раком легені» стало визначити рівень поширеності мутацій EGFR серед українських пацієнтів з НДРЛ (аденокарцинома), а також оцінити частоту виявлення цих мутацій залежності від віку та статі хворих.
МАТЕРІАЛИ ТА МЕТОДИ
У дане ретроспективне дослідження було включено пацієнтів із місцево-поширеним або метастатичним НДРЛ (гістологічний тип — аденокарцинома), які у 2018–2019 рр. брали участь у проєкті компанії «AstraZeneca» «Виявлення мутацій гена EGFR у пацієнтів з місцево-поширеним або метастатичним недрібноклітинним раком легені», діагностичним партнером якого була лабораторія «CSD Health Care».
Пацієнти, яким було встановлено діагноз місцево-поширеного або метастатичного НДРЛ (гістологічний тип — аденокарцинома), могли пройти обстеження на підставі заповненого лікуючим лікарем направлення на обстеження. На тестування приймали гістологічний (парафінові блоки) або цитологічний матеріал (цитологічні скельця, цитоблоки, цитоспіни), що відповідав наступним критеріям прийнятності.
Критерії прийнятності гістологічного матеріалу: парафіновий блок із зразком тканини, що містить не менше 200 клітин пухлини та не менше 20% від загальної кількості всіх клітин.
Критерії прийнятності цитологічного матеріалу: цитологічні скельця або цитоблоки, або цитоспіни, що містять не менше 200 клітин пухлини. Лабораторія проводила попередню оцінку за участю патоморфолога або цитолога придатності біологічного матеріалу, що надійшов разом із заповненим направленням, перед проведенням тестування. У разі непридатності зразка пацієнту рекомендувалося провести повторний забір біоматеріалу та отримати повторне направлення від лікаря для проходження обстеження.
Виявлення мутацій у гені EGFR здійснювалося тест-набором SensiScreen® EGFR (EXON 19 Deletions+T790M+L858R) Multiplex FFPE Real-time PCR Kit (CE IVD) методом полімеразної ланцюгової реакції (ПЦР) у реальному часі. Спектр мутацій, що виявлялися, були наступними: драйверні мутації — делеції у 19-му екзоні та точкової мутацій L858R у 21-му екзоні у пацієнтів, що не отримували препарати групи інгібіторів тирозинкінази (TKI); та мутації резистентності T790M, у пацієнтів, які отримували препарати інгібіторів тирозинкінази 1-го або 2-го покоління.
РЕЗУЛЬТАТИ
Так, з 17 грудня 2018 р. до 31 грудня 2019 р. було отримано 308 зразків пацієнтів із місцево-поширеним або метастатичним НДРЛ (гістологічний тип — аденокарцинома) для обстеження, з них валідних виявилося 290/308 (94,2%) (табл. 1). Серед отриманих зразків — 302/308 (98,1%) гістологічні блоки та цитологічні зразки 6/308 (1,9%). Серед валідних зразків 282/290 зразки було отримано від пацієнтів, які не отримували препарати групи інгібіторів тирозинкінази EGFR, 8/290 (3%) зразків були від пацієнтів з прогресуванням захворювання на тлі лікування препаратами групи інгібіторів тирозинкінази EGFR 1-го або 2-го покоління. У 169 з 290 (58%) випадків було відомо походження матеріалу (табл. 2). Біопсійний матеріал становив 112/169 (66%), операційний матеріал 57/169 (34%). Трансторакальна пункція була превалюючим методом забору матеріалу первинного вогнища у легені (39 із 60 випадків (65%)). Середній термін від отримання біоматеріалу до видачі результатів — 5 днів.
Таблиця 1. Загальні відомості щодо пацієнтів та отриманих зразків біологічного матеріалу
| Період отримання зразків | Грудень 2018 р. — грудень 2019 р. |
| Середній термін від отримання біоматеріалу до обробки результатів | 5 днів |
| Усього отриманих зразків | 308 |
| Усього валідних зразків | 290 (94,2%) |
| Усього невалідних зразків | 18 (5,8%) |
| Гістологічний матеріал | 302 (98,1%) |
| Цитологічний матеріал | 6 (1,9%) |
| Кількість зразків, отриманих від пацієнтів до проходження І лінії терапії | 282 (97,2%) |
| Кількість зразків, отриманих від пацієнтів до проходження ІІ лінії терапії | 8 (2,8%) |
| Кількість пацієнтів, направлених на тестування, стать яких відома | 305 |
| Жінки | 130 (42,6%) |
| Чоловіки | 175 (57,4%) |
| Кількість валідних тестів у жінок | 121 (39,7%) |
| Кількість валідних тестів у чоловіків | 158 (51,8%) |
| Медіана віку пацієнтів, що були направлені на тестування, вік яких відомий (n=302) | 59,0 |
| Кількість пацієнтів, направлених на тестування, вік і стать яких відомі | 299 |
| Медіана віку жінок (n=129), роки | 58,0 |
| Медіана віку чоловіків (n=170), роки | 62,5 |
Таблиця 2. Походження матеріалу для аналізу
| Наявність даних | Вид матеріалу (n=290) | Місце забору | Метод забору | |||
| Невідомо 109/290 (38%) | ||||||
| Відомо 181/290 (62%) | ||||||
| Біопсійний матеріал | 112/181 (62%) | |||||
| Первинне вогнище | 60/112 (54%) | |||||
| Трансторакальна пункція | 39/60 (65%) | |||||
| Бронхоскопія | 20/60 (33%) | |||||
| Торакоскопія | 1/60 (2%) | |||||
| Інтраторакальні та екстраторакальні лімфовузли | 20/112 (18%) | |||||
| Невідомо | 17/118 (14%) | |||||
| Екстраторакальний метастаз в органах | 8/118 (7%) | |||||
| Метастаз у плеврі | 5/118 (4%) | |||||
| Плевральна рідина | 2/118 (2%) | |||||
| Операційний | 57/181 (31%) | |||||
| Первинна пухлина | 48/57 (84%) | |||||
| Екстраторакальний метастаз в органах | 9/57 (15,8%) |
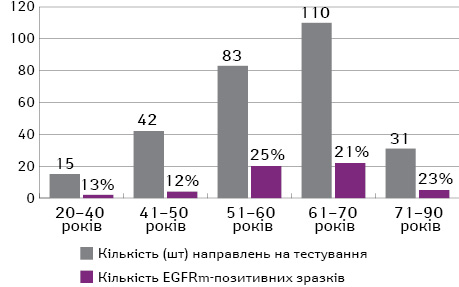
Серед хворих на НДРЛ превалювали чоловіки — 175 (57,4%) пацієнтів із 305 хворих. Середній вік протестованих пацієнтів на EGFR — 59,4 року, наймолодшому пацієнту було 20 років, найстаршому — 86 років. Найбільша кількість пацієнтів, направлених на тестування, — віком 61–70 років (39%). На вік 51–70 років припадає 69% хворих, направлених на тестування, 19,6% хворих на НДРЛ були віком 40 років і молодше.
Мутації в гені EGFR виявлені у 58 з 290 (20%) пацієнтів, чиї зразки були валідними. У табл. 3 наведені дані щодо щоквартальної динаміки надходження зразків та, відповідно, кількості EGFRm-позитивних пухлин. Із них EGFRm були виявлені у 54/282 (19,1%) пацієнтів, які не отримували препарати групи TKI EGFR, та у 4 (50%) пацієнтів, які мали прогресування захворювання на тлі лікування препаратами групи TKI EGFR 1-го або 2-го покоління, відмічали мутацію T790M в 20-му екзоні EGFR, що забезпечує резистентність до терапії інгібіторами тирозинкінази. У 26 (48,1%) пацієнтів виявлено делецію у 19-му екзоні. Мутація в 21-му екзоні EGFR, а саме типова заміна лейцину на аргінін L858R виявлена у 28 (51,9%) пацієнтів.
Таблиця 3. Динаміка тестування пацієнтів із НДРЛ
| І кв. 2019 р. | ІІ кв. 2019 р. | ІІІ кв. 2019 р. | IV кв. 2019 р. | |
| Кількість протестованих пацієнтів | 38 | 79 | 80 | 81 |
| Кількість пацієнтів, у яких виявили EGFRm (n) | 11 | 16 | 18 | 13 |
| Частка пацієнтів із EGFRm від загальної кількості протестованих, % | 29 | 20 | 22,5 | 16 |
Поширеність мутацій у гені EGFR у хворих на НДРЛ жінок була статистично достовірно вищою — 33,9% порівняно з чоловіками — 8,2% (р<0,0001). Поряд із цим серед чоловіків найбільш поширеною мутацією EGFR була делеція в 19-му екзоні, яку відмічали у 69,2% випадків (табл. 4). Серед жінок, навпаки, найбільшого поширення набула мутація L858R, частота виявлення якої становила 58,5%.
Таблиця 4. Поширеність мутацій EGFR у розрізі окремих мутацій та статево-вікової структури вибірки
| Усього мутацій EGFR+ (1L) | 54/282 | 19,1% |
| L858R | 28/54 | 51,9% |
| Del 19 | 26/54 | 48,1% |
| T790M+ (2L) | 4/8 | 50,0% |
| Поширеність EGFR-мутацій у жінок 1L | 41/121 | 33,9% |
| Поширеність EGFR-мутацій у чоловіків 1L | 13/159 | 8,2% |
| Поширеність мутації del19 у жінок | 17/41 | 41,5% |
| Поширеність мутації L858R у жінок | 24/41 | 58,5% |
| Поширеність мутації del19 у чоловіків | 9 | 69,2% |
| Поширеність мутації L858R у чоловіків | 4 | 30,8% |
1L — пацієнти, які не отримували препарати групи TKI EGFR, 2L — пацієнти, у яких відмічено прогресування захворювання на тлі лікування препаратами групи TKI EGFR 1-го або 2-го покоління.
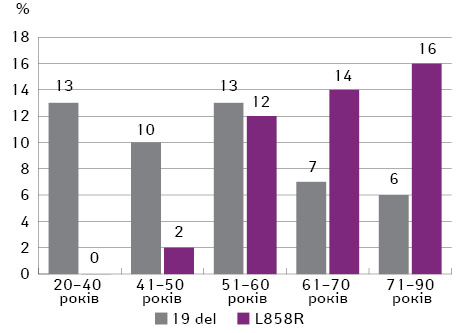
Найбільший номінальний відсоток виявлення мутацій EGFR (25%) відмічено у пацієнтів віком 51–60 років, але поширеність мутацій EGFR залежно від віку була статистично недостовірною (p=0,460). Мутації EGFR частіше виявляють у пацієнтів віком старше 50 років, при цьому з віком частота мутації L858R зростає. Так, у віці 20–50 років частота виявлення мутацій EGFR у пацієнтів з НДРЛ коливалася в межах 12–13%, а в групах пацієнтів, старших за 50 років, цей показник не опускається нижче 21% (рис. 3). При цьому, відповідно до отриманих результатів, серед пацієнтів віком 20–40 років взагалі не відмічається мутація L858R, таким чином, мутації EGFR представлені лише делецією у 19-му екзоні (рис. 4). У віці 41–50 років рівень поширеності мутації L858R також дуже низький — лише 2%, але він активно починає зростати з 12% серед пацієнтів віком 51–60 років і сягає свого піку — 16% — у хворих віком 71–90 років.
Обговорення
Таким чином, нами було показано, що у близько 1/5 українських пацієнтів з НДРЛ відмічають первинні мутації EGFR, що значно менше за середній показник — 32,3%, розрахований для загальної світової популяції [24]. Втім, треба мати на увазі, що значний внесок у формування цього показника зробили дані із Східної Азії, адже для пацієнтів азійського походження характерна висока поширеність мутацій EGFR: Китай — 38,4%; Японія — 36,6%; Корея — 32,4%. Тож середній показник поширеності мутацій EGFR для Східної Азії становить 38,4%. Наші ж дані щодо поширеності мутацій EGFR є ближчими до таких у Північній Америці та Центральні та Східній Європі (табл. 5). Загальні дані щодо поширеності EGFR-мутацій серед хворих на НДРЛ у Південній та Північній Америці дають вищий показник — на рівні 24,4%, а сумарні дані щодо Європейського регіону, навпаки, демонструють найнижчі показники щодо поширеності мутацій EGFR серед пацієнтів з НДРЛ — 14,1% [24]. Поширеність мутацій EGFR серед українських пацієнтів з НДРЛ є зіставними з такими країнами Східної та Центральної Європи, як Словачинна, Чехія, Греція та Росія, але є більшою, ніж у Польщі, Угорщині та Литві [34, 36]. Також хочемо зазначити досить низький рівень верифікації та охоплення тестуванням цієї категорії хворих в Україні порівняно з іншими країнами (див табл. 5).
Таблиця 5. Поширеність мутацій EGFR серед пацієнтів з НДРЛ з різних регіонів світу (адаптовано за 34–37)
| Країни | Частка морфологічно верифікованих діагнозів, % | Частка пацієнтів з НДРЛ, протестованих на наявність мутацій EGFR, % | Поширеність мутацій EGFR серед протестованих пацієнтів, % |
| Центральна та Східна Європа (Хорватія, Чехія, Угорщина, Словаччина, Словенія) та Ізраїль | 75–100 | Не менше 65 | ~13–20 |
| Західна Європа (Франція, Німеччина, Італія, Іспанія, Великобританія) | 73–100 | 77 | ~11–17 |
| Північна Америка (США, Канада) | 82–88 | 76 | ~22 |
| Східна Азія (Японія, Південна Корея, о. Тайвань) | 84 | ~43 | 57 |
| Україна | 60 | ~18 | 21 |
Якщо ж порівнювати поширеність мутацій EGFR залежно від етнічної приналежності пацієнтів з НДРЛ, то отримані нами дані співставні із середніми для європеоїдної раси показниками — 17,4%. Для порівняння аналогічний показник для представників монголоїдної раси становить 38,8%, а для афроамериканців — 27% [24].
Нами показано, що в загальній популяції пацієнтів із НДРЛ поширеність мутацій делеції в 19- та 21-му екзонах приблизно однакова, що співпадає з даними літератури [24].
У багатьох роботах показано, що на ймовірність виявлення мутацій EGFR майже не впливають такі показники, як стадія хвороби, статус щодо проведення хіміотерапії, методи виявлення мутацій. На противагу цьому є низка досліджень, у яких підтверджено наявність асоціації між поширеністю мутацій EGFR та статтю, статусом щодо паління, гістологічним типом пухлини та етнічною приналежністю пацієнтів. Так, загалом поширеність EGFR-мутацій вища серед жінок порівняно із чоловіками: 43,7% проти 24,0% відповідно, що співпадає з отриманими нами даними. Поширеність EGFR-мутацій серед українських пацієнтів з НДРЛ для жінок становить 33,9% порівняно з 8,2% для чоловіків.
Також слід відмітити, що поширеність мутацій EGFR загалом є вищою серед некурців — 49,3% порівняно з 21,5% серед курців. Цікаво що серед некурців, порівняно з курцями, поширеність мутацій EGFR у представників європеоїної раси (39,8% порівняно з 10,8% відповідно) була більшою, ніж у представників азіатського етносу (52,2% проти 26,3% відповідно).
У пацієнтів з аденокарциномою при НДРЛ також значно частіше відмічали мутацію EGFR (аденокарцинома проти неаденокарциноми: 38,0% проти 11,7%). Це спостереження було більш вираженим для населення Азії (аденокарцинома проти неаденокарциноми: 44,7% проти 12,5%), ніж представників європеоїдної раси (аденокарцинома проти неаденокарциноми: 19,7% проти 9,6%) [24].
За результатами нашого дослідження кореляція поширеності мутацій EGFR та віку не була статистично достовірною. Втім, слід зазначити, що НДРЛ, загалом, дуже поширений серед осіб похилого віку. Зокрема, близько 50% випадків раку легені діагностується у людей старше 65 років, та близько 30–40% — у осіб старше 70 років [33].
Висновок
Мутації гена EGFR виявлені у 20% українських хворих з аденокарциномою НДРЛ і частіше відмічаються у жінок та не залежать від віку пацієнтів. Отримані дані свідчать про те, що для індивідуалізації терапії хворих на НДРЛ необхідні повний клінічний анамнез, точне гістологічне субтипування та молекулярно-генетичний аналіз для визначення онкогенів, зокрема активуючих мутацій EGFR. Успіхи таргетної терапії останніх років завдяки появі інгібіторів тирозинкінази 3-го покоління, які активні як щодо драйверних мутацій EGFR, так і щодо мутації резистентності T790M, доводять важливість визначення мутацій EGFR у пацієнтів з НДРЛ із метою персоналізації терапії та покращення результатів лікування захворювання.
Список використаної літератури
- 1. Yarden, Y., & Sliwkowski, M. X. (2001). Untangling the ErbB signalling network. Nature reviews. Molecular cell biology, 2(2), 127–137. https://doi.org/10.1038/35052073.
- 2. Gschwind, A., Fischer, O. M., & Ullrich, A. (2004). The discovery of receptor tyrosine kinases: targets for cancer therapy. Nature reviews. Cancer, 4(5), 361–370. https://doi.org/10.1038/nrc1360.
- 3. Burgess A. W. (2008). EGFR family: structure physiology signalling and therapeutic targets. Growth factors, 26(5), 263–274. https://doi.org/10.1080/08977190802312844.
- 4. Sabbah, D. A., Hajjo, R., & Sweidan, K. (2020). Review on Epidermal Growth Factor Receptor (EGFR) Structure, Signaling Pathways, Interactions, and Recent Updates of EGFR Inhibitors. Current topics in medicinal chemistry, 20(10), 815–834. https://doi.org/10.2174/1568026620666200303123102.
- 5. Plönes, T., Engel-Riedel, W., Stoelben, E., Limmroth, C., Schildgen, O., & Schildgen, V. (2016). Molecular Pathology and Personalized Medicine: The Dawn of a New Era in Companion Diagnostics-Practical Considerations about Companion Diagnostics for Non-Small-Cell-Lung-Cancer. Journal of personalized medicine, 6(1), 3. https://doi.org/10.3390/jpm6010003
- 6. Wang, D. D., Ma, L., Wong, M. P., Lee, V. H., & Yan, H. (2015). Contribution of EGFR and ErbB-3 Heterodimerization to the EGFR Mutation-Induced Gefitinib- and Erlotinib-Resistance in Non-Small-Cell Lung Carcinoma Treatments. PloS one, 10(5), e0128360. https://doi.org/10.1371/journal.pone.0128360
- 7. Brambilla, E., & Gazdar, A. (2009). Pathogenesis of lung cancer signalling pathways: roadmap for therapies. The European respiratory journal, 33(6), 1485–1497. https://doi.org/10.1183/09031936.00014009
- 8. Yoneda, K., & Tanaka, F. (2018). Molecular diagnosis and targeting for lung cancer. In: Molecular Diagnosis and Targeting for Thoracic and Gastrointestinal Malignancy, (Shimada Y. & Yanaga K., ed). Springer Nature Singapore, Singapore, 1–32.
- 9. Jänne, P. A., Engelman, J. A., & Johnson, B. E. (2005). Epidermal growth factor receptor mutations in non-small-cell lung cancer: implications for treatment and tumor biology. Journal of clinical oncology, 23(14), 3227–3234. https://doi.org/10.1200/JCO.2005.09.985.
- 10. Sigismund, S., Avanzato, D., & Lanzetti, L. (2018). Emerging functions of the EGFR in cancer. Molecular oncology, 12(1), 3–20. https://doi.org/10.1002/1878-0261.12155
- 11. Chen, Z., Fillmore, C. M., Hammerman, P. S., Kim, C. F., & Wong, K. K. (2014). Non-small-cell lung cancers: a heterogeneous set of diseases. Nature reviews. Cancer, 14(8), 535–546. https://doi.org/10.1038/nrc3775.
- 12. Tsao, M. S., Sakurada, A., Cutz, J. C., Zhu, C. Q., Kamel-Reid, S., Squire, J., … Shepherd, F. A. (2005). Erlotinib in lung cancer — molecular and clinical predictors of outcome. The New England journal of medicine, 353(2), 133–144. https://doi.org/10.1056/NEJMoa050736.
- 13. Shaw, A. T., Kim, D. W., Nakagawa, K., Seto, T., Crinó, L., Ahn, M. J., … Jänne, P. A. (2013). Crizotinib versus chemotherapy in advanced ALK-positive lung cancer. The New England journal of medicine, 368(25), 2385–2394. https://doi.org/10.1056/NEJMoa1214886.
- 14. Cho, J., Chen, L., Sangji, N., Okabe, T., Yonesaka, K., Francis, J. M., Flavin, R. J., Johnson, W., Kwon, J., Yu, S., Greulich, H., Johnson, B. E., Eck, M. J., Jänne, P. A., Wong, K. K., & Meyerson, M. (2013). Cetuximab response of lung cancer-derived EGF receptor mutants is associated with asymmetric dimerization. Cancer research, 73(22), 6770–6779. https://doi.org/10.1158/0008-5472.CAN-13-1145
- 15. Lynch, T. J., Bell, D. W., Sordella, R., Gurubhagavatula, S., Okimoto, R. A., Brannigan, B. W. … Haber, D. A. (2004). Activating mutations in the epidermal growth factor receptor underlying responsiveness of non-small-cell lung cancer to gefitinib. The New England journal of medicine, 350(21), 2129–2139. https://doi.org/10.1056/NEJMoa040938.
- 16. Paez, J. G., Jänne, P. A., Lee, J. C., Tracy, S., Greulich, H., Gabriel, S., … Meyerson, M. (2004). EGFR mutations in lung cancer: correlation with clinical response to gefitinib therapy. Science, 304(5676), 1497–1500. https://doi.org/10.1126/science.1099314.
- 17. Sharma, S. V., Bell, D. W., Settleman, J., & Haber, D. A. (2007). Epidermal growth factor receptor mutations in lung cancer. Nature reviews. Cancer, 7(3), 169–181. https://doi.org/10.1038/nrc2088
- 18. Yatabe, Y., & Mitsudomi, T. (2007). Epidermal growth factor receptor mutations in lung cancers. Pathology international, 57(5), 233–244. https://doi.org/10.1111/j.1440-1827.2007.02098.x.
- 19. Yoneda, K., Imanishi, N., Ichiki, Y., & Tanaka, F. (2019). Treatment of Non-small Cell Lung Cancer with EGFR-mutations. Journal of UOEH, 41(2), 153–163. https://doi.org/10.7888/juoeh.41.153.
- 20. Kobayashi, Y., & Mitsudomi, T. (2016). Not all epidermal growth factor receptor mutations in lung cancer are created equal: Perspectives for individualized treatment strategy. Cancer science, 107(9), 1179–1186. https://doi.org/10.1111/cas.12996.
- 21. Saito, M., Shiraishi, K., Kunitoh, H., Takenoshita, S., Yokota, J., & Kohno, T. (2016). Gene aberrations for precision medicine against lung adenocarcinoma. Cancer science, 107(6), 713–720. https://doi.org/10.1111/cas.12941.
- 22. Castellanos, E., Feld, E., & Horn, L. (2017). Driven by Mutations: The Predictive Value of Mutation Subtype in EGFR-Mutated Non-Small Cell Lung Cancer. Journal of thoracic oncology, 12(4), 612–623. https://doi.org/10.1016/j.jtho.2016.12.014.
- 23. Jiang, T., & Zhou, C. (2014). Clinical activity of the mutant-selective EGFR inhibitor AZD9291 in patients with EGFR inhibitor-resistant non-small cell lung cancer. Translational lung cancer research, 3(6), 370–372. https://doi.org/10.3978/j.issn.2218-6751.2014.08.02
- 24. Zhang, Y. L., Yuan, J. Q., Wang, K. F., Fu, X. H., Han, X. R., Threapleton, D., … Tang, J. L. (2016). The prevalence of EGFR mutation in patients with non-small cell lung cancer: a systematic review and meta-analysis. Oncotarget, 7(48), 78985–78993. https://doi.org/10.18632/oncotarget.12587.
- 25. El-Telbany, А., Ma, P. (2012). Cancer Genes in Lung Cancer. Genes Cancer, 3(7–8), 467–80.
- 26. Couraud, S., Zalcman, G., Milleron, B., Morin, F., & Souquet, P. J. (2012). Lung cancer in never smokers — a review. European journal of cancer, 48(9), 1299–1311. https://doi.org/10.1016/j.ejca.2012.03.007.
- 27. Kosaka, T., Yatabe, Y., Endoh, H., Kuwano, H., Takahashi, T., & Mitsudomi, T. (2004). Mutations of the epidermal growth factor receptor gene in lung cancer: biological and clinical implications. Cancer research, 64(24), 8919–8923. https://doi.org/10.1158/0008-5472.CAN-04-2818.
- 28. West, H., Harpole, D., & Travis, W. (2009). Histologic considerations for individualized systemic therapy approaches for the management of non-small cell lung cancer. Chest, 136(4), 1112–1118. https://doi.org/10.1378/chest.08-2484.
- 29. U.S. Food and Drug Administration (FDA). (2013). Paving the Way for Personalized Medicine: FDA’s Role in a New Era of Medical Product Development. U.S. Department of Health and Health Services. 1 10:1 61.
- 30. NCCN Guidelines. Non-SmallCellLungcancer. Version2, 2020. nccn.org. 28/01/2020, http://www.nccn.org/professionals/physician_gls/pdf/nscl.pdf.
- 31. Planchard, D., Popat, S., Kerr, K., Novello, S., Smit, E. F., Faivre-Finn, C., … ESMO Guidelines Committee (2018). Metastatic non-small cell lung cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Annals of oncology, 29(4), iv192–iv237. https://doi.org/10.1093/annonc/mdy275.
- 32. Lindeman, N. I., Cagle, P. T., Beasley, M. B., Chitale, D. A., Dacic, S., Giaccone, G., … Ladanyi, M. (2013). Molecular testing guideline for selection of lung cancer patients for EGFR and ALK tyrosine kinase inhibitors: guideline from the College of American Pathologists, International Association for the Study of Lung Cancer, and Association for Molecular Pathology. Journal of thoracic oncology, 8(7), 823–859. https://doi.org/10.1097/JTO.0b013e318290868f.
- 33. Losanno, T., & Gridelli, C. (2017). Recent advances in targeted advanced lung cancer therapy in the elderly. Expert review of anticancer therapy, 17(9), 787–797. https://doi.org/10.1080/14737140.2017.1348232
- 34. Ryska, A., Berzinec, P., Brcic, L., Cufer, T., Dziadziuszko, R., Gottfried, M., … Timar, J. (2018). NSCLC molecular testing in Central and Eastern European countries. BMC cancer, 18(1), 269. https://doi.org/10.1186/s12885-018-4023-4.
- 35. Peters, M., Kim, E. S., & Hirsch, V. (2019). Clinical Use of Epidermal Growth Factor Receptor Testing in Patients With Advanced Lung Cancer by Physicians: Survey of US and International Patterns. Journal of global oncology, 5, 1–7. https://doi.org/10.1200/JGO.18.00057.
- 36. Midha, A., Dearden, S., & McCormack, R. (2015). EGFR mutation incidence in non-small-cell lung cancer of adenocarcinoma histology: a systematic review and global map by ethnicity (mutMapII). American journal of cancer research, 5(9), 2892.Houston, K. A., Henley, S. J., Li, J., White, M. C., & Richards, T. B. (2014). Patterns in lung cancer incidence rates and trends by histologic type in the United States, 2004–2009. Lung cancer, 86(1), 22–28. https://doi.org/10.1016/j.lungcan.2014.08.001.
- 37. Бюлетень Національного канцер реєстру № 20. Рак в Україні, 2017, 2018.
Распространенность мутаций гена EGFR у украинских пациентов с местно-распространенным или метастатическим немелкоклеточным раком легкого
1Львовский онкологический региональный лечебно-диагностический центр, Львов
2Киевский городской клинический онкологический центр, Киев
3Киевская городская клиническая больница № 17, Киев
4Харьковский областной клинический онкологический центр, Харьков
5Днепропетровская многопрофильная клиническая больница № 4, онкоторакальный центр, Днепр
6Национальный институт рака МЗ Украины, Киев
7Клиническая больница «Феофания», Киев
8Медицинский дом «Одрекс», Одесса
9Клиника «Образцова», Киев
10Одесский национальный медицинский университет, Одесса
11Онкологический центр «Томоклиник», Кропивницкий
12Херсонский областной клинический диспансер, Херсон
13Николаевский областной клинический диспансер, Николаев
14Медицинская лаборатория CSD, Киев
Резюме. Актуальность. Мутация рецептора эпидермального фактора роста (epidermal growth factor receptor — EGFR) играет важную роль в процессах онкогенеза, в частности при немелкоклеточном раке легкого (НМРЛ). Распространенность мутаций EGFR в общей популяции пациентов с НМРЛ составляет 15–35% и зависит от гистологического подтипа опухоли, этнического происхождения, пола и статуса в отношении курения. Пациентам с НМРЛ и мутациями EGFR показано применение таргетных препаратов — ингибиторов тирозинкиназы (TKI) EGFR, которые влияют на эту мутацию и значительно улучшают безрецидивную выживаемость больных. Поэтому все ведущие международные руководства в области онкологии (ESMO, NCCN, IASLC) предлагают проводить диагностику данной мутации у пациентов с местно-распространенным НМРЛ. Цель. Целью этого ретроспективного исследования было выявление распространенности мутаций гена EGFR среди украинских пациентов с местно-распространенным или метастатическим НМРЛ (гистологический подтип — аденокарцинома), а также оценить частоту выявления мутаций гена EGFR в зависимости от возраста и пола. Материалы и методы. В исследование включали пациентов с местно-распространенным или метастатическим НМРЛ (гистологический тип — аденокарцинома), у которых по направлению врача были отобраны образцы опухоли (гистологический или цитологический материал) для проведения исследования по выявлению в них мутаций в гене EGFR, которое осуществлялось тест-набором SensiScreen® EGFR (EXON 19 Deletions + T790M + L858R) Multiplex FFPE Real-time PCR Kit (CE IVD) методом полимеразной цепной реакции (ПЦР) в реальном времени с целью выявления драйверных мутаций (делеции в 19-м экзоне и точечной мутации L858R в 21-м экзоне) у пациентов, не получавших препараты группы TKI, и мутации резистентности T790M у пациентов, получавших препараты TKI 1-го или 2-го поколения. Результаты. В ходе исследования были получены образцы материала от 308 пациентов, средний возраст пациентов составил 59,2 года (20–40 лет — 15/281 (5%), 41–50 лет — 42/281 (15%), 51–60 лет — 83/281 (30%), 61–70 лет — 110/281 (39%), 71–86 лет — 31/281 (11%). Гистологический материал был представлен 302/308 (98%) образцами, цитологический материал — 6/308 (2%) образцами. Валидными для проведения молекулярно-генетического анализа по определению мутации в гене EGFR были 290/308 (94%) образцов. 282/290 (97%) образцов были от пациентов, не получавших препараты группы TKI EGFR, 8/290 (3%) образцов были от пациентов, у которых отмечено прогрессирование заболевания на фоне лечения препаратами группы TKI 1-го или 2-го поколения EGFR. Мутации в гене EGFR выявлены у 58/290 (20%) пациентов, из них у 54/282 (19,1%) больных — драйверные мутации EGFR, а у 4/8 (50%) — мутация резистентности T790M. У 26/54 (48,1%) пациентов выявлена делеция в 19-м экзоне, у 28/54 (51 9%) пациентов — в 21-м экзоне EGFR (L858R). Распространенность мутаций в гене EGFR у больных НМРЛ женщин была статистически достоверно выше — 33,9% по сравнению с мужчинами — 8,2% (р<0,0001). Наибольший номинальный процент выявления мутаций EGFR (25%) был отмечен у пациентов в возрасте 51–60 лет, но распространенность мутаций EGFR в зависимости от возраста была статистически недостоверной (p=0,460). Выводы. Мутации EGFR отмечают у 1/5 украинских пациентов с НМРЛ (аденокарцинома), при этом их распространенность выше среди женщин и не зависит от возраста пациентов. Это акцентирует внимание на важности проведения тестирования пациентов с НМРЛ (аденокарцинома) на наличие мутаций EGFR с целью персонализации терапии и улучшения результатов лечения болезни.
Ключевые слова: EGFR; мутации; немелкоклеточный рак легкого; аденокарцинома; ингибиторы тирозинкиназы; рецептор эпидермального фактора роста.














Leave a comment