Вплив поліморфізмів хемокінів на ефективність хіміотерапії у хворих на Her2/neu-негативний рак грудної залози
Сивак Л.А., Верьовкіна Н.О., Лялькін С.А., Тарасенко Т.Є., Мартинюк О.М.
Резюме. Вступ. На сьогодні ідея персоналізованого лікування кожного окремого пацієнта залежно від суми біологічних характеристик пухлини залишається актуальним питанням клінічної онкології. Пухлинні клітини та клітини мікрооточення синтезують різноманітні хемокіни, які виконують роль факторів росту, стимуляторів ангіогенезу та інвазивності, беруть участь у формуванні імуносупресивного мікрооточення. Мета — вивчити вплив поліморфізму гена С-С рецептора хемокіну 5 (CCR5(del32) на ефективність передопераційної хіміотерапії у хворих на Her2/neu-негативний рак грудної залози при місцево-розповсюдженому раку грудної залози. Матеріали та методи. У дослідження включено 62 пацієнтки з місцево-розповсюдженим РГЗ, що потребували проведення неоад’ювантної хіміотерапії. Результати. Вивчено роль поліморфізму гена С-С рецептора хемокіну 5 (CCR5(del32) в ефективності передопераційної хіміотерапії у 62 хворих на Her2/neu-негативний місцево-розповсюджений РГЗ, що залишається недостатньо вивченою. Висновки. Визначено, що рівень терапевтичного патоморфозу був вищим у пацієнток з генотипом N/del32 за геном CCR5. Проте отримані результати потребують подальшого підтвердження.
Одержано 8.11.2021
Прийнято до друку 29.11.2021
DOI: 10.32471/clinicaloncology.2663-466X.43-3.28300
Вступ
Відомим фактом є те, що рак грудної залози (РГЗ) є гетерогенною пухлиною. На сьогодні, з урахуванням особливостей експресії маркерних генів, виділяють 4 основних типи РГЗ: люмінальний А, люмінальний Б, Her2-позитивний та тричі негативний. На цій класифікації базується визначення агресивності пухлин та вибір стратегії подальшого лікування пацієнток. Проте навіть у межах одного підтипу існує певна гетерогенність пухлин, які характеризуються своїм прогнозом подальшого перебігу хвороби і чутливістю до певного лікування. Так, тричі негативний РГЗ має щонайменше вісім підтипів, серед яких три — з несприятливим прогнозом, три — з проміжним та два — зі сприятливим [1, 2]. Так само пухлини люмінального Б типу поділяють на: люмінальний Б Her2/neu+ та люмінальний Б Her2/neu–, які мають свої особливості у виборі подальшого лікування. У зв’язку із цим набуває актуальності ідея персоналізованого лікування кожного окремого пацієнта залежно від суми біологічних характеристик пухлини. На сьогодні є очевидним, що пухлинні клітини діють не самостійно, а у взаємодії з мікрооточенням пухлини [3, 4].
Мікрооточення пухлини розглядається як один з ключових факторів, що відіграє важливу роль у пухлинній прогресії, а застосування в клінічній практиці методів якісного та кількісного визначення елементів мікрооточення пухлини може сприяти виділенню групи хворих, яким буде показано застосування нових методів лікування та персоніфікації терапії.
Хемокіни — це група низькомолекулярних цитокінів, фізіологічною роллю яких є регуляція міграції імунокомпетентних клітин шляхом хемотаксису [5]. Хемокіни продукуються Т-клітинами, макрофагами та дендритними клітинами. Під час канцерогенезу як пухлинні клітини, так і клітини мікрооточення синтезують різноманітні хемокіни, які виконують роль факторів росту, стимуляторів ангіогенезу та інвазивності, а також беруть участь у формуванні імуносупресивного мікрооточення. Імунна супресія виникає як за рахунок міграції та активації пухлино-асоційованих макрофагів (tumor-associated macrophages), супресорних клітин мієлоїдного походження (myeloid-derived suppressor cells), регуляторних Т-лімфоцитів або мезенхімальних стовбурових клітин, так і за рахунок пригнічення цитотоксичних Т-лімфоцитів. У відповідь на хемокіни, синтезовані в певному органі чи тканині, пухлини, які експресують відповідний хемокіновий рецептор, швидше прогресують та призводять до утворення віддалених метастазів [6]. Неопластичні тканини містять високі рівні медіаторів запалення, включаючи C-C хемокіновий ліганд 5 (CCL5) і C-C хемокіновий рецептор типу 5 (CCR5), який є рецептором адгезії [7, 8].
Мета дослідження — вивчити вплив поліморфізму гена С-С рецептора хемокіну 5 (CCR5(del32) на ефективність передопераційної хіміотерапії у хворих на Her2/neu-негативний РГЗ при місцево-розповсюдженому раку.
Матеріали та методи дослідження
У дослідження включено 62 пацієнтки з місцево-розповсюженим РГЗ, що потребували проведення неоад’ювантної хіміотерапії (НАХТ). У всіх досліджуваних хворих було застосовано діагностичний клініко-інструментально-лабораторний комплекс досліджень, у тому числі ультразвукове дослідження грудної залози або мамографію, комп’ютерну томографію органів грудної порожнини, органів черевної порожнини та малого таза з контрастним підсиленням з метою об’єктивної оцінки відповіді пухлини на хіміотерапевтичне лікування, яке проводилося відповідно до сучасних вимог (за шкалою RECIST 1.1). Усім хворим було призначено курс НАХТ за протоколом 4 АС (доксорубіцин 60 мг/м2 + ендоксан 600 мг/м2 в 1-й день), кожен 21-й день, чотири введення; та 12 щотижневих введень Т (паклітаксел 80 мг/м2).
Вік хворих на момент включення в дослідження коливався в межах 28–70 років. Середній вік — 52,3 ± 5,1 року.
Морфологічне дослідження післяопераційного матеріалу виконувалося за стандартною методикою. Препарати фарбувалися гематоксиліном і еозином. Оцінку лікувального патоморфозу виконували на основі визначення об’єму життєздатної залишкової пухлини (ОЖЗП), наявності раку in situ, а також кількості та розмірів уражених лімфовузлів (за класифікацією Miller — Payne). Морфологічні та імуногістохімічні дослідження проводилися в патологоанатомічному відділенні Національного інституту раку МОЗ України (завідувач відділення — кандидат медичних наук М.С. Кротевич).
Під час дослідження поліморфізму гена ССR5 (del32) ДНК виділяли з периферичної крові за допомогою комерційної тест-системи «innuPREPBloodDNAMiniKit» (AnalytikJena, Німеччина). Досліджувану ділянку гена ампліфікували за допомогою специфічних праймерів («Metabion», Німеччина) із використанням комерційного набору DreamTaqGreenPCRMasterMix (фірми «ThermoScientific», США). Стан ампліфікованих фрагментів гена аналізували в 3% агарозному гелі (агароза фірми «CleaverScientific», Великобританія) з додаванням бромистого етидію. Для оцінки розміру фрагментів вносили маркер молекулярної маси GeneRuler 50 bpDNALadder («ThermoScientific», США), візуалізували розподіл фрагментів у гелі за допомогою трансілюмінатора. Обробка отриманого зображення проводилася в комп’ютерній програмі Vitran. Результати алельспецифічної полімеразної ланцюгової реакції ділянки гена ССR5 (del32) враховували залежно від довжини наявних ампліфікованих фрагментів — 172 п.н. та/або 140 п.н. За наявності ампліфікованого фрагмента розміром 172 п.н. реєстрували нормальний варіант гена ССR5 — N/N, фрагменти 172 п.н. та 140 п.н. одночасно свідчили про гетерозиготний стан — N/del32, а при довжині фрагменту 140 п.н. фіксували делеційний поліморфізм у гомозиготному стані — del32/del32 (рис. 1).
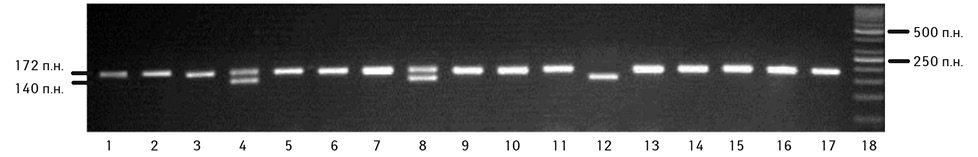
Молекулярно-генетичне дослідження виконувалося в молекулярно-генетичній лабораторії Державного закладу «Референс-центр з молекулярної діагностики МОЗ України» (завідувач — кандидат біологічних наук З.І. Россоха).
Обробка отриманих даних виконувалася з використанням пакета програм «Statistica 10.0». Для оцінки розподілу варіантів використовувався дисперсійний аналіз. Для проведення кореляційного аналізу та виявлення різниці між змінними використовували t-критерій Стьюдента та критерій χ2. Статистично значимими вважалися дані з достовірністю різниці за р<0,05.
Отримані результати та їх обговорення
Проаналізовано результати лікування 62 пацієнток з місцево-розповсюдженим РГЗ: 43 пацієнтки мали естрогенопозитивний РГЗ, 19 — естрогенонегативний РГЗ.
Проведене молекулярно-генетичне дослідження у хворих на місцево-розповсюджений РГЗ до лікування виявило генотип N/N за геном CCR5 (del32) у 46 (73,8%) пацієнток, генотип N/del32 за геном CCR5 у 15 (24,6%) пацієнток та генотип del32/del32 за геном CCR5 у 1 (1,6%) пацієнтки (табл. 1).
| Показник | Кількість пацієнток, n (%) |
| Поліморфізм гена CCR5 (del32)
-N/N -N/del32 -генотип del32/del32 |
46 (73,8)
15 (24,6) 1 (1,6) |
Варто зазначити, що у пацієнток з ураженням аксилярних лімфатичних вузлів, носіїв генотипу N/N за геном CCR5 (del32), частіше виявляли гормоннезалежні пухлини (естроген рецептор(ER)-негативні, прогестерон рецептор(PR)-негативні) (відношення ризиків 3,27; довірчий інтервал 1,05–5,49, p=0,05) (табл. 2).
| Експресія ER | Генотип NN | Генотип N/del32 | Загальна кількість випадків | ||
| n | % | n | % | ||
| ER- | 8 | 88,89 | 1 | 11,11 | 9 |
| ER+ | 22 | 70,97 | 9 | 29,03 | 31 |
| Усього | 30 | 75,00 | 10 | 25,00 | 40 |
Так, у групі рецептор-негативних пухлин, з наявністю метастазів в аксилярні лімфовузли, генотип N/N за геном CCR5 спостерігався у 88,89% пацієнток, тоді як генотип N/del32 за геном CCR5 виявлено лише у 11,11%. Проте в групі гормон-залежних пухлин з ураженням лімфовузлів, носіїв алелі N/N за геном CCR5 було лише 71% порівняно з 88,9% у пацієнток з рецептор-негативними пухлинами, а носіїв генотипу N/del32 за геном CCR5 виявлено достовірно більше: у 29% хворих порівняно з 11,1% у пацієнток з рецептор-негативними пухлинами (р=0,05). У пацієнток без метастазів у регіонарні лімфатичні вузли не було виявлено асоціації делеційного поліморфізму гена CCR5 з розповсюдженістю процесу та біологічними особливостями пухлини, такими як експресія рецепторів стероїдних гормонів.
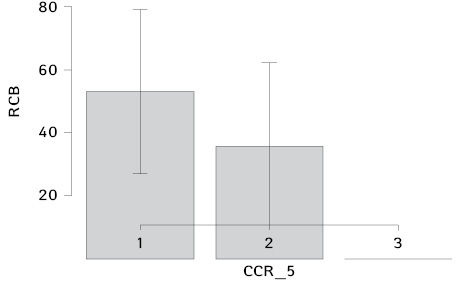
Аналізуючи результати НАХТ у пацієнток з місцево-розповсюдженим РГЗ, було встановлено, що середні значення об’єму життєздатної залишкової пухлинної тканини (ОЖЗПТ) у носіїв алелі N/N за геном CCR5 становили 52,94% (±4,06), а у носіїв алелі N/del32 за геном CCR5 — 35,63% (±7,37).
Таким чином, у хворих з генотипом N/del32 за геном CCR5 після завершення НАХТ ОЖЗПТ був достовірно нижчим порівняно з хворими з генотипом N/N за геном CCR5 (р=0,04) (табл. 3, 4, рис. 2).
| CCR5 (del32) генотип | ОЖЗПТ,
середнє значення (± SD) |
| -N/N
-N/del32 -del32/del32 |
52,94% (± 4,06)
35,63% (± 7,37) 0,0% |
Нами проаналізовано ефективність НАХТ залежно від експресії рецепторів стероїдних гормонів на пухлинних клітинах пацієнток з РГЗ (табл. 4).
| ER-статус | Кількість пацієнтів, n | ОЖЗПТ, %
(середнє значення) |
p |
| ER– | 19 | 44 | 0,047 |
| ER+ | 43 | 50 |
Висновки
Отже, за результатами нашого дослідження визначено, що рівень терапевтичного патоморфозу був кращим у пацієнток з генотипом N/del32 за геном CCR5: середні значення об’єму життєздатної залишкової пухлини у носіїв алеля N/N за геном CCR5 були 52,94 ± 4,06%, а у носіїв алеля N/del32 за геном CCR5 — 35,63 ± 7,37% (р=0,04). Необхідні подальші дослідження впливу поліморфізму хемокінів на віддалені результати лікування хворих на РГЗ.
Список використаної літератури
1. Perou, C. M. (2000). Molecular portraits of human breast tumors. Nature, 406, 747–752. doi: 10.1038/35021093.
2. Hudis, C., & Gianni, L. (2011). Triple negative breast cancer: an unmet medical need. The oncologist, 28 (2), 135–146. doi: 10.1634/theoncologist.2011-S1-01.
3. Tsai, M. J., Chang, W. A., Huang, M. S., & Kuo, P. L. (2014). Tumor Microenvironment: A New Treatment Target for Cancer. ISRN Biochemistry, 351959. doi: 10.1155/2014/351959.
4. Andre, F., Dieci, M., Dubsky, P., Sotiriou, C., Curigliano, G., Denkert, C., & Loi, Sh. (2012). Molecular Pathways: Involvement of Immune Pathways in the Therapeutic Response and Outcome in Breast Cancer. Clinical Cancer Research, 19(1), 28–33. doi: 10.1158/1078-0432.CCR-11-2701.
5. Aldinucci, D., & Colombatti, A. (2014). The Inflammatory Chemokine CCL5 and Cancer Progression, Mediators of Inflammation, 2014, 292376. doi: 10.1155/2014/292376.
6. Aldinucci, D., Borghese, C., & Casagrande, N. (2020). The CCL5/CCR5 Axis in Cancer Progression. Cancers, 12, 1765. doi.10.3390/cancers12071765.
7. Gao, D., Rahbar, R., & Fish, E. N. (2016). CCL5 activation of CCR5 regulates cell metabolism to enhance proliferation of breast cancer cells. Open Biology, 6, 160122. doi.10.1098/rsob.160122.
8. Xiang, P., Jin, S., Yang, Y., Sheng, J., He, Q., Song, Y., … Jin, J. (2019). Infiltrating CD4+ T cells attenuate chemotherapy sensitivity in prostate cancer via CCL5 signaling. Prostate, 79(9), 1018–1031. doi: 10.1002/pros.23810.
Адреса:
Верьовкіна Наталія Олегівна
03022, Київ, вул. Ломоносова, 33/43
Національний інститут раку
E-mail: 15a78nataliia@gmail.com
Сorrespondence:
Verоvkina Natalia
33/43 Lomonosova Str., Kyiv 03022
National Cancer Institute
E-mail: 15a78nataliia@gmail.com














Leave a comment