Молекулярно-біологічні принципи індивідуалізації лікування хворих на рак грудної залози молодого віку
Захарцева Л.М.1, Лобанова О.Є.2
- 1Київський міський клінічний онкологічний центр, Київ
- 2Національний медичний університет ім. О.О. Богомольца, Київ
Визначені молекулярно-біологічні принципи індивідуалізації лікування хворих на рак грудної залози молодого віку. Використані методи дослідження: клінічний, гістологічний, імуногістохімічний (білки апоптозу, рівень експресії рецепторів стероїдних гормонів, проліферації Кі-67, епідермального фактору росту, маркери ангіогенезу, BRCA1, молекулярно-генетичний (мутації генів BRCA1/2 за допомогою PCR), статистичний метод. Встановлено, що високий проліферативний індекс, базально-подібний варіант раку, порушення апоптозу, ангіогенезу, а також часті мутації генів BRCA 1/2 викликають погіршення показників виживаності хворих молодого віку. Запропоновано молекулярно-біологічні принципи для визначення стратегії лікування хворих на рак грудної залози молодого віку.

ВСТУП
Рак грудної залози (РГЗ) найбільш розповсюджене онкологічне захворювання у жінок у багатьох економічно розвинених країнах світу, у тому числі в Україні. З року в рік відмічають зростання показника захворюваності, за останні 10 років в Україні він збільшився на 19,2%. РГЗ частіше виявляють у жінок передменопаузального і постменопаузального віку. В різних країнах світу серед хворих на РГЗ пацієнтки віком до 35 років становлять 3–7%, за даними в Україні – 3,4%. Показник захворюваності серед жінок молодого віку невисокий, але є тенденція до його підвищення і темпи зростання в 1,5 раза вищі, ніж у загальній групі. Показник смертності від РГЗ в Європі найвищий у групі хворих до 35 років. За останні 15 років, завдяки впровадженню нових методів лікування, виживаність хворих на РГЗ зростає, але у пацієнток молодше 35 років вона залишається нижчою, ніж в інших вікових групах. За літературними даними, 10-річна виживаність пацієнток середнього віку становить 73%, а молодого віку — 49% [1, 6, 8, 9, 16].
За даними Національного канцер-реєстру України, рак у хворих віком молодше 35 років не відрізняється за стадіями від загальної групи. Останнім часом для прогнозування клінічного перебігу хвороби у пацієнток молодого віку більшість дослідників приділяє увагу молекулярно-біологічним особливостям пухлини, тому що вони відіграють велику роль в розумінні ступеня злоякісності новоутворення. Як відомо, ключовим моментом ракової трансформації є ланцюг генетичних порушень, який призводить до неконтрольованого росту клітин, порушення апоптозу та втрати диференціації тканини.
На даний час відомо декілька показників, що впливають на клінічний перебіг РГЗ. Ці прогностичні показники широко використовують в практичній онкології для формування груп хворих низького, проміжного та високого ризику продовження хвороби. Згідно з Європейськими і Національними стандартами в лікуванні хворих на РГЗ застосовують різні підходи до оперативного лікування, різні схеми поліхіміотерапії (ПХТ) та опромінення залежно від прогностичних і провісних показників росту пухлини [2, 3]. Такі індивідуальні протоколи лікування дозволили підвищити показники виживаності в багатьох країнах світу на 10–15% і знизити кількість ускладнень після лікування. Стосовно хворих до 35 років в стандартах методи індивідуального підходу в лікуванні не вказані і ці хворі лікуються із застосуванням всіх методів лікування, в тому числі великої кількості курсів ПХТ. Але це не дозволило покращити показники виживаності в цій віковій групі. Слід зазначити, що РГЗ у хворих молодого віку — не тільки клінічна проблема. Кожна смерть хворої на РГЗ молодого віку – втрата потенційного життя, а також збільшення кількості сиріт. Не треба забувати про економічні втрати, тому що це жінки працездатного віку. Зростає рівень естетичних вимог до наслідків протипухлинного лікування та якості життя після його завершення.
Матеріал та методи
У дослідження, проведене в Київському міському онкологічному центрі у 1997–2008 рр., включено 573 хворих на РГЗ, що були розподілені на групи: основна – 254 пацієнтки віком 18–35 років, контрольна – 319 хворих віком 36–83 років. Застосовані наступні методи дослідження: клінічний, гістологічний, імуногістохімічний (білки апоптозу, експресія рецепторів стероїдних гормонів, проліферації Кі-67, епідермального фактору росту, маркери ангіогенезу, BRCA1, молекулярно-генетичний (мутації генів BRCA1/2 за допомогою PCR), статистичний метод (визначення критеріїв Ст’юдента, Фішера і коефіцієнта кореляції, методу Каплана — Мейєра, критеріїв Гехала — Уїлкоксона, Перо — Уїлкоксона, логрангового критерію). Кількість хворих, задіяних у різних методах дослідження: імуногістохімічний – всього 573 хворих. Матеріалом для дослідження була кров, а у 62 пацієнток – тканина пухлини з парафінового блоку.
Результати та їх обговорення
Розподіл пацієнток за стадіями РГЗ показав, що вони співпадають в досліджуваних групах і переважає стадія T1-2N0M0.
Більшість хворих отримали комплексне лікування, яке включало операцію, променеву терапію (ПТ) і ПХТ. Серед оперативних втручань переважала мастектомія, співвідношення різних видів оперативного лікування в досліджуваних групах співпадало. Близько 55% хворих основної і контрольної груп отримали ПТ в неоад’ювантному і ад’ювантному режимах.
ПХТ в основній групі застосовували більш широко, її отримали згідно з існуючими стандартами близько 77% хворих, а в контрольній групі – 48% пацієнтів. Більшість хворих, що увійшли до основної групи, отримали більше 4 курсів ПХТ.
У більшості хворих був інвазивний протоковий або дольковий рак, в поодиноких випадках виявляли особливі гістологічні варіанти — медулярний, тубулярний, муцинозний. Базально-подібний рак (ЕР-, ПР-, HЕR2/neu-, CК5/6+) в 3 рази частіше виявляли у хворих основної групи, що співпадає з даними останніх публікацій [4, 12, 13]. Відсоток G2 в порівнювальних групах співпадав, але у хворих віком до 35 років — частіше G3 (р
У 49% пацієнток основної групи було визначено інвазію перитуморальних судин, що в 2,3 раза частіше, ніж у контрольній групі.
За результатом імуногістохімічного дослідження в основній групі експресія ЕР виявлена у 49%, ПР у 45% хворих, а в контрольній групі ці показники становили відповідно 73 і 65%. Таким чином, у хворих молодого віку значно рідше і в меншій кількості клітин відмічають експресію ЕР і ПР (р
Експресія HER1 і VEGFR-3 виявлена у 15% хворих основної групи, що в 2 рази вище, ніж у контрольній групі.
Експресія білка HЕR2/neu в групах значно не відрізнялась (17% — в основній, 20% — в контрольній). У разі сумнівної експресії білка HЕR2/neu було застосовано FISH-метод, який в 67% підтвердив ампліфікацію гена HЕR2 [10].
У клітинах РГЗ хворих основної групи була висока експресія білків апоптозу: р53, р21, Bag1, Mcl1, а також маркера проліферації Кі67. Але статистично істотна різниця між групами відмічена тільки за показниками р53, р63, Кі67 та білка BRCA1.
Між досліджуваними групами істотні відмінності було знайдено за показниками ЕР, ПР, HER1, VEGFR, базально-подібний варіант раку, р53 і р63. Пухлини хворих молодого віку на 23% рідше мали експресію рецепторів стероїдних гормонів, а також у 2 рази частіше експресію білків VEGFR-3 і HER1, у 1,5 раза р53 і значно частіше високі показники експресії білка р63 і Кі67. Ця інформація свідчить про більш істотні порушення механізму апоптозу і проферації в клітинах раку хворих віком до 35 років, що впливає на ступінь агресивності раку і терапевтичну відповідь.
Загальна 5-річна і безрецидивна виживаність у пацієнток основної групи була статистично істотно нижчою (р
На підставі результатів оцінки аналізу впливу кожного молекулярно-біологічного показника найбільше значення має експресія білків апоптозу р53, р63 і проліферації Кі67.
Було проведено аналіз загальної 5-річної виживаності у підгрупі базально-подібного РГЗ. На підставі результатів статистичного аналізу даних можна зробити висновок, що криві виживаності для пацієнток з базальноподібним РГЗ основної групи відрізняються, але ця різниця не є статистично істотною (р=0,071). Для пацієнток контрольної групи з базальноподібним РГЗ різниця у виживаності істотно нижча (р
Мутації генів BRCA 1/2 виявлено у 17 хворих, з них 14 — у хворих молодого віку. Криві виживаності для пацієнтів з мутаціями і без мутацій є статистично істотно відмінними (р=0,002). Можна констатувати, що виживаність пацієнтів з мутаціями є менш тривалою, ніж у пацієнтів без мутацій. Але в підгрупі хворих на базальноподібний варіант раку вплив мутації на виживаність не відмічено.
висновки
Таким чином, високий проліферативний індекс, базальноподібний РГЗ, порушення апоптозу, ангіогенезу, а також часті мутації генів BRCA 1/2 значною мірою призводять до погіршення показників виживаності у хворих молодого віку.
На основі результатів статистичного аналізу морфологічних і молекулярно-біологічних показників РГЗ у хворих віком до 35 років розроблено критерії оцінки прогнозування клінічного перебігу захворювання і розподілу хворих молодого віку на групи ризику (рисунок)
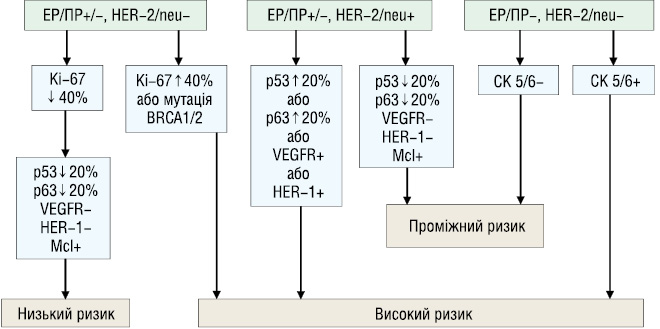
За результатом розроблених критеріїв прогнозування клінічного перебігу захворювання запропоновано стратегію лікування для пацієнток молодого віку (таблиця).
| Категорія оцінки РГЗ | Лікування |
|---|---|
| Низький ризик | |
|
ЕР/ПР+/-, HER-2/neu-, Ki-67 ↓ 40%, p53/p63 ↓ 20%, VEGFR-, HER-1-, Mcl+ |
Оперативне лікування, ГТ, ПТ (в залежності від об’єму операції) |
| Проміжний ризик | |
|
ЕР/ПР+/-, HER-2/neu+, Ki-67 ↓ 40%, p53/p63 ↓ 20%, VEGFR-, HER-1-, Mcl+ |
Оперативне лікування, ПХТ, ГТ, ПТ (в залежності від об’єму операції) |
| ЕР/ПР-, HER-2/neu-, СК5/6- | Оперативне лікування, ПХТ, ГТ, ПТ (в залежності від об’єму операції) |
| Високий ризик | |
|
ЕР/ПР+/-,HER-2/neu-, Ki-67 ↑ 40% або мутація генів BRCA1/2 |
Оперативне лікування, ПХТ, ГТ, ПТ (в залежності від об’єму операції) |
|
ЕР/ПР+/-, HER-2/neu+ p53 ↑ 20% або p63 ↑ 20% або VEGFR+ або HER-1+ |
Оперативне лікування, ПХТ, ГТ, ТТ, ПТ (в залежності від об’єму операції) |
|
ЕР/ПР-,HER-2/neu-, СК5/6+ |
Оперативне лікування, ПТ, ПХТ |
літературА
- 1. Федоренко З.П., Гулак Л.О., Горох Є.Л. та ін. (2008) Рак в Україні, 2006-2007 (захворюваність, смертність, показники діяльності онкологічної служби). Бюлетень Національного канцер-реестру України, 9: 94.
- 6. Стандарти діагностики і лікування онкологічних хворих (2007) Затверджено наказом Міністерства охорони здоров`я України «Про затвердження протоколів надання медичної допомоги за спеціальністю «онкологія» від 17.09.2007 р. № 554. [Чинний від 17.09.2007]. Київ, СПД Морозов: 202.
- 15. Goldhirsch A., Wood W.C., Gelber R.D. et al. (2007) Senn 10th St. Gallen conference. Progress and promise: highlights of the international expert consensus on the primary therapy of early breast cancer 2007. Ann. Oncol.,18(7): 1133–44.
- 22. Musolino A., Bella M.A., Bortesi B. et al. (2007) BRCA mutations, molecular markers, and clinical variables in early-onset breast cancer: a population-based study. Breast, V. 16 (3): 280–292.
- 28. Sidoni A., Cavaliere A., Bellezza G. et al. (2003) Breast cancer in young women: clinicopathological features and biological specificity. Breast., № 12 (14): 247–50.
- 33. Brinton L.A., Sherman M.E., Carreon J.D. (2008) Recent trends in breast cancer among younger women in the United States. JNCI. Brief Communications, 100: 1643–1648.
- 43. Hartley M.C., McKinley B.P., Rogers E.A. et al. (2006) Differential expression of prognostic factors and effect on survival in young (
- 51. Althuis M.D., Dozier J.M., Anderson W.F. et al. (2005) Global trends in breast cancer incidence and mortality 1973–1997. Int J Epidemiol., 34: 405–412.
- 57. Jayasinghe U., Taylor R., Boyades J. (2005) Is age at diagnosis an independent prognostic factor for survival following breast cancer? ANZ Journal of Surgery, 75(9): 762–767.
- 65. Klauber-DeMore N. (2005, 2006) Tumor biology of breast cancer in young women Breast Disease, 23(1): 9–15.
- 71. Lee W. (2002) Frequent loss of BRCA1 nuclear expression in young women with breast cancer: an immunohistochemical study from an area of low incidence but early onset. Applied immunohistochemistry& Molecular Morphology, 10(4): 310–315.
- 77. Marcus J.N., Watson P., Page L.D.L. et al. (1994) Pathology and heredity of breast cancer in younger women. Journal of the National Cancer Institute Monographs,16: 23–34.
- 85. Rennert G., Bisland-Naggan SH., Barnett- Griness O. et al. (2007) Clinical outcomes of breast cancer in carriers of BRCA1 and BRCA2 mutations. The new England journal of medicine, 357(2): 115–123.
- 92. Satagopan J.M., Offit K., Foulkes W. et al. (2001) The lifetime risks of breast cancer in Ashkenazi Jewish carriers of BRCA1 and BRCA2 mutations. Cancer Epidemiol. Biomarkers Prev., 10: 467–73.
- 98. Colleoni M., Rotmensz N., Robertson C. et al. (2002) Very young women (
- 105. De Ridder M., Vlastos G., Vinh-Hung V. et al. (2006) Young and old age are poor prognostic factors in women with advanced breast cancer. S. Aelbi, G. Storme. Abstract book 5 European Breast Cancer Conference. Nice, France. 21–25 March, abstract 298.
Молекулярно-биологические принципы в индивидуализации лечения больных раком грудной железы молодого возраста
Киевский городской клинический онкологический центр, Киев
Национальный медицинский университет имени А.А. Богомольца, Киев
Резюме. Цель исследования: определить молекулярно-биологические принципы индивидуализации лечения больных раком грудной железы молодого возраста. Методы исследования: клинический, гистологический, иммуногистохимический (белки апоптоза, экспрессия стероидных гормонов, пролиферация Кi-67, эпидермального фактора роста, маркеры ангиогенеза, BRCA1, молекулярно-генетический (мутации генов BRCA1/2 с помощью PCR), статистический метод. Результаты: определено, что высокий пролиферативный индекс, базальноподобный вариант рака, нарушение апоптоза, ангиогенеза, а также частые мутации генов BRCA1/2 вызывают ухудшение показателей выживаемости у больных молодого возраста. Выводы: предложены молекулярно-биологические принципы в стратегии лечения больных раком грудной железы молодого возраста.
рак грудной железы, пациенты молодого возраста, молекулярно-биологические принципы, индивидуализация лечения.
Kyiv City Clinical Oncological Center, Kyiv
A.A. Bohomolets National Medical University, Kyiv














Leave a comment