Реконструктивно-пластичні оперативні втручання у комплексному лікуванні злоякісних пухлин грудної стінки
Ганул В.Л., Ганул А.В., Борисюк Б.О., Семиволос А.В., Шевченко А.І., Совенко В.М., Кобзєв О.І., Бороров Л.В.
Проаналізовані результати комплексного і хірургічного лікування 61 пацієнта з первинними і вторинними злоякісними пухлинами грудної стінки. Розроблені тактичні підходи в лікуванні великих місцево-розповсюджених пухлин. У клінічній практиці при злоякісних пухлинах грудної стінки успішно застосували внутрішньоартеріальну селективну хіміотерапію (ВАХТ). При цьому лікувальний ефект — часткову або повну регресію пухлини — зареєстрований у 79,1% пацієнтів. У режимі неоад’ювантного лікування ВАХТ використана у 12 хворих і як самостійний метод лікування — також у 12 хворих. Нами вперше в Україні проведена пластика дефекту грудної стінки з повним відновленням каркасу з використанням титанових пластин. Успішно застосовано методики реконструкції та пластики дефектів після резекції грудини з використанням алотрансплантату з крила здухвинної кістки та синтетичних матеріалів. Всього прооперовано 49 пацієнтів, із них 31 — з реконструктивно-пластичним заміщенням дефекту грудної стінки.

Вступ
Злоякісні новоутворення грудної стінки представлені широким спектром як первинних пухлин скелету і м’яких тканин, так і вторинних — метастатичних, а також пухлин, які проростають грудну стінку із сусідніх органів й анатомічних структур: молочної залози, легень, середостіння. Первинні злоякісні пухлини грудної стінки виявляють відносно рідко. Первинні пухлини грудини становлять близько 3,1%, новоутворення ребра і ключиці — 10,1% загальної кількості пухлин кістки всіх локалізацій [3, 5, 12, 14]. Найчастіше пухлини кісток передньої грудної стінки представлені хондросаркомою (27%), остеосаркомою (22%), фібросаркомою (22%), а пухлини м’яких тканин з розповсюдженням на грудинореберний каркас — ангіосаркомою (18%), злоякісною багатокомпонентною мезенхімомою (25%), нейробластомою 22% [3, 6, 7, 8]. Згідно з даними деяких авторів [3, 5, 15] до 30% пухлин грудини є метастазами пухлин з інших органів. Різні за ґенезом і характером пухлини відповідно потребують різних лікувальних підходів, які об’єднуються однією загальною вимогою як стандартом лікування щодо первинних і метастатичних пухлин — комплексна терапія з використанням хіміотерапії, променевої терапії і розширених оперативних втручань.
Радикальне хірургічне втручання із додержанням всіх правил онкології продовжує залишатися основним етапом лікування і найбільш значимим відносно прогнозу захворювання. Пухлини, які локалізуються в тканинах передньої грудної стінки (грудина, ребра, ключиці) нерідко розповсюджуються на органи середостіння, паренхіму легень, магістральні судини і нервові сплетення [2, 5, 6, 9]. Тому радикальне видалення таких пухлин слід проводити в лікувальних закладах, де є можливість взаємодії торакальних судинних, пластичних хірургів [3, 7, 12, 13]. З цієї ж причини більшості таких пацієнтів відмовляють у хірургічному лікуванні, їм проводять паліативну хіміотерапію, променеву терапію, або нерадикальне видалення пухлини. Лише променева терапія та традиційна хіміотерапія в більшості випадків малоефективні. З метою підвищення лікувального ефекту і зниження токсичності хіміотерапії при лікуванні пацієнтів із злоякісними пухлинами передньої грудної стінки в нашій клініці широко застосовують метод внутрішньоартеріальної селективної хіміотерапії (ВАХТ), яка дозволяє підвищити концентрацію цитостатиків безпосередньо в тканинах пухлини. Метод також успішно застосовують при лікуванні місцево-розповсюдженого раку молочної залози, злоякісних пухлин середостіння, раку верхніх відділів стравоходу. При цитологічному і цитогенетичному дослідженнях встановлено, що рівень девіталізуючих змін найбільш виражений в пухлинах після використання ВАХТ [1]. Радикальне видалення місцево-розповсюджених пухлин призводить до розвитку проникного дефекту в плевральну порожнину або середостіння, що потребує надійного закриття дефекту, включаючи герметизацію плевральної порожнини, відновлення надійного каркасу грудної клітки, збереження фізіологічного об’єму грудної порожнини.
Усунення дефектів каркасу грудної стінки, які виникають після резекції двох і більше ребер на передньобоковій стінці, резекції грудини або тотального її видалення, а також дефектів >60 см на боковій або задній стінках, необхідна для попередження кардіореспіраторних порушень [4, 11, 14].
Для закриття післяопераційних дефектів грудної стінки застосовують як власні тканини, так і синтетичні матеріали. Для реконструкції дефекту власними тканинами використовують шматки великого грудного м’яза, найширшого м’яза спини, прямого м’яза живота. З реконструктивною метою використовують реберні аутотрансплантати з шматком найширшого м’яза спини, аутотрансплантат із здухвинної кістки, ліофілізовану тверду мозкову оболонку [7].
Ряд авторів після субтотальної резекції грудини і тотального її видалення застосовують переміщені шматки найширшого м’яза спини і великих грудних м’язів, при цьому не використовують синтетичні матеріали для відновлення каркасу грудної стінки [3, 4, 10, 15]. Інші автори для реконструкції використовують не тільки власні тканини, а й синтетичні сітки Gore-Tex (політетрафторетилен), марлекс, пролен, вікріл [4, 10, 11]. Для закриття дефектів ребер і грудини можливо використовувати ендопротези із матеріалу остек, фторопластові протези, нікелідтитанові пластини [3, 7, 14, 15].
Деякі автори використовують для реконструкції передньолатеральних відділів грудної стінки «сандвіч» марлексу з метилметакрилатом, пластиною з акрилу або сіткою із нержавіючої сталі [14, 15].
Таким чином, на сьогодні немає єдиного підходу до вибору методу реконструкції при заміщенні різноманітних дефектів грудної стінки.
Об’єкт і методи дослідження
У відділенні торакальної онкології Національного інституту раку у 1996–2011 рр. на лікуванні перебували 61 пацієнт із злоякісними пухлинами грудної стінки. Всі хворі отримали спеціальне лікування. У 49 пацієнтів було діагностовано первинні пухлини грудної стінки, у 5 — пухлини середостіння і плеври з розповсюдженням на грудну стінку, у 7 — пухлини метастатичного походження із деструкцією ребер і грудини.
При вивченні гістологічних варіантів злоякісних пухлин грудної стінки найчастіше виявляли ангіосаркоми — у 14 пацієнтів (22,9%), хондросаркоми — 12 (19,7%), злоякісні багатокомпонентні мезенхімоми — 11 (18%) і пухлини метастатичного походження — у 7 пацієнтів (11,5%) (табл. 1). Чоловіки становили 62,3% (38 хворих), жінки — 37,7% (23 хворих). Вік пацієнтів коливався у діапазоні від 14 до 76 років.
| Морфологічні варіанти пухлин | Кількість пацієнтів |
|---|---|
| Хондросаркома | 12 |
| Остеосаркома | 5 |
| Злоякісна фіброзна гістіоцитома | 2 |
| Ангіосаркома | 14 |
| Злоякісна багатокомпонентна мезенхімома | 11 |
| Лейоміосаркома | 3 |
| Екстраабдомінальний десмоїд | 2 |
| Пухлини метастатичного походження | 7 |
| Пухлини середостіння і плеври з розповсюдженням на грудну стінку | 5 |
| Всього | 61 |
У 18 (29,5%) з 61 пацієнта, які отримали спеціальне лікування в нашій клініці, зафіксовано рецидив пухлин. Метастази в інші органи були виявлені у 14 (22,9%) пацієнтів, в основному у групі хворих із рецидивними пухлинами.
Діагноз і тактика лікування базувалися на анамнезі, клінічних даних, результатах цитологічного й морфологічного досліджень, скануванні кісток скелету, точного визначення локалізації і розповсюдженості пухлинного процесу за допомогою КТ та МРТ, і при необхідності — ангіографії судин, втягнутих у пухлинний процес.
Застосовуючи комплексний підхід у лікуванні злоякісних пухлин грудної стінки, більшості пацієнтів нашого відділення було проведено неоад’ювантну терапію.
| Вид пухлини | Кількість пацієнтів | |||
|---|---|---|---|---|
| Системна хіміотерапія | ВАХТ | Променева терапія | Без лікування | |
| Первинні | 14 | 8 | – | 9 |
| Рецидивні | 8 | 4 | 1 | 1 |
| Метастатичні | – | – | 2 | 5 |
По три цикли передопераційної хіміотерапії отримали 32 пацієнти (65,3%), із них ВАХТ була застосована у 12 хворих. Передопераційна променева терапія проведена 3 пацієнтам (табл. 2).
При плануванні хірургічного етапу лікування, базуючись на даних клінічних досліджень, необхідно ретельно спланувати обсяг тканин, які обов’язково підлягають резекції. Правильне визначення складу і довжини кісткового дефекту, дефіциту м’язових і покривних тканин дозволить адекватно спланувати тип майбутньої реконструкції.
Видалення пухлини вважали радикальним, якщо краї резекції проходили в 3–5 см від макроскопічно видимого краю пухлини. У разі розповсюдження пухлини на суміжні органи виконували резекцію єдиним блоком, за наявності солітарних метастазів у легенях проводили одномоментну резекцію.
Резекцію грудини виконано 10 (20,4%) із 49 прооперованих пацієнтів, комбіновану резекцію ребер і грудини 3 (6,1%) пацієнтам, резекцію 1–3 ребер 17 (34,7%) хворим, видалені пухлини з резекцією від 4 до 8 ребер — 19 (38,7%) пацієнтам. З 39 випадків резекцій ребер передні відрізки резектовані у 11 (28,3%) пацієнтів, передньолатеральні відрізки у 16 (41%) хворих, задні відрізки у 5 (12,8%) хворих, в 7 (17,9%) випадках виконано резекцію ребер практично по всій довжині (табл. 3).
| Обсяг резекції | Число пацієнтів, n |
|---|---|
| Субтотальна резекція грудини | 3 |
| Часткова резекція грудини | 7 |
| Резекція 1–3 ребер | 17 |
| Резекція 4 ребер | 8 |
| Резекція 5–6 ребер | 7 |
| Резекція 7–8 ребер | 4 |
| Резекція ребер і грудини | 4 |
| Всього | 49 |
Розмір дефекту грудної стінки коливався від 12 до 750 см, а розмір дефекту шкіри в одному з випадків перевищив 900 см.
14 (22,9%) хворим виконані комбіновані операції: разом із резекцією грудної стінки і грудини були резектовані частини перикарду, легень, діафрагми.
Реконструкція дефектів грудної стінки була виконана у 41 (83,6%) із 49 прооперованих хворих. Вибір методу закриття дефекту, пластичного матеріалу або їх комбінацій в кожному випадку був індивідуальним, з врахуванням особливостей зони резекції. При виборі методу пластики перевагу надавали найпростішим та найнадійнішим методам. Невеликий дефіцит м’яких тканин компенсувався за рахунок місцевих тканин, а при недостатності місцевих тканин ми використовували переміщені реґіонарні м’язово-шкірні шматки: великих грудних м’язів, найширшого м’яза спини та прямого м’яза живота.
Основними цілями при реконструкції грудної стінки було досягнення стабільності та надійності реберно-грудинного каркасу, збереження об’єму плевральних порожнин, попередження парадоксального дихання, захист внутрішніх органів від травми, відсутність косметичного дефекту.
Реконструкцію жорсткого каркасу грудної стінки виконували при резекції 2 і більше ребер, й у всіх випадках резекцій грудини.
При резекції 2 або 3 ребер і розмірі дефекту ≤120 см реконструктивна операція полягала в переміщенні 1 ребра з ушиванням по краю фіксованих ребер тонкої одношарової поліпропіленової сітки. Такі операції в основному виконували з косметичною метою при резекції передніх відділів ребер у пацієнтів молодого віку.
Серед пацієнтів з реконструкцією грудної стінки резекцію грудини виконано 11 хворим, в 3 випадках — субтотальну. В 1 випадку заміщення частини грудини проведено власним шматком деепітелізованої шкіри, в 3 випадках — чотиришаровою поліпропіленовою сіткою з переміщеним м’язовим шматком, і в 6 пацієнтів використано аутотрансплантат із крила здухвинної кістки розміром 15–40 см, який фіксували звичайними лігатурами до залишків грудини та ребер.
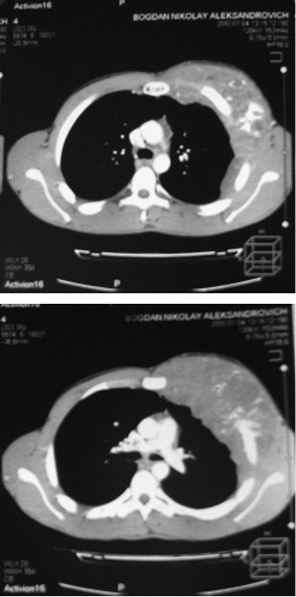
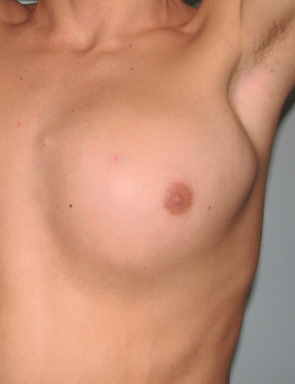
Одному пацієнту з рецидивною хондросаркомою великих розмірів, яка розповсюджувалася від 3 до 11 ребер справа по всій довжині, інтраторакальний компонент пухлини розповсюджувався на праву легеню і повністю замістив нижню й середні долі легені, та проріс у діафрагму, проведена комбінована радикальна операція. По всій довжині резековано 9 ребер, практично вся права діафрагма, а також виконана нижня білобектомія справа. Для закриття дефекту діафрагми використали матеріал Gore-Tex із переміщенням місця кріплення діафрагми на рівень 5-го ребра по бокові грудній стінці. Пластика грудної стінки здійснена за допомогою пластини Gore-Tex і поліпропіленової сітки (рис. 1–4).
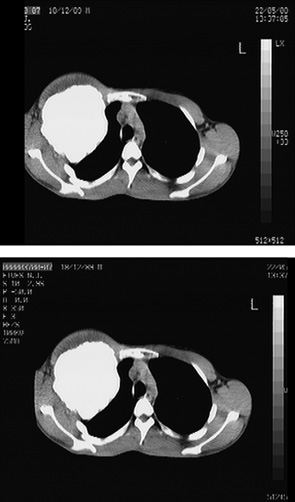
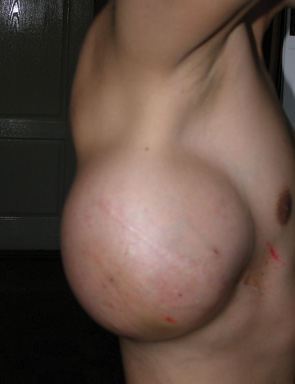
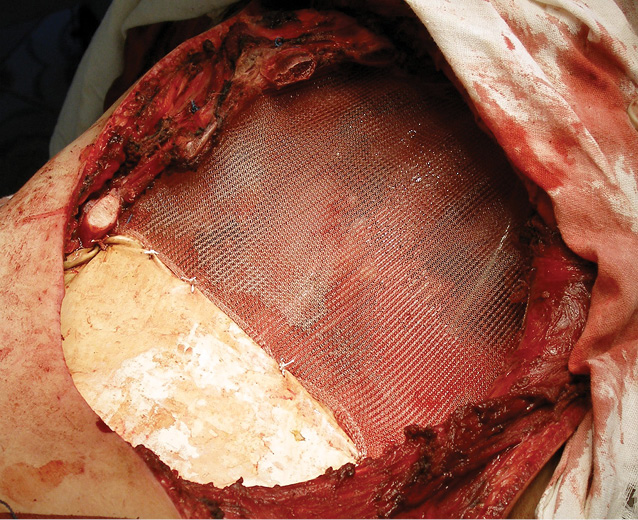
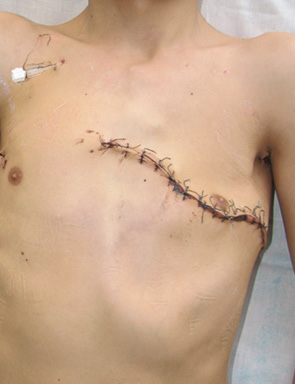
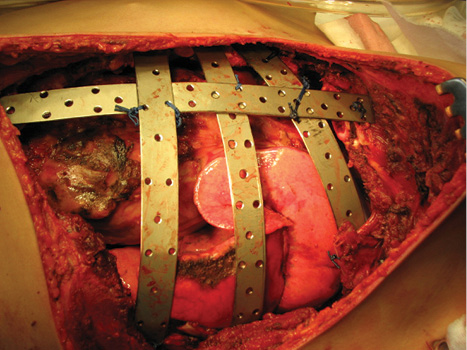
Вперше в Україні після видалення гігантської злоякісної багатокомпонентної мезенхімоми грудної стінки з резекцією 3–8 ребер зліва по всій довжині, субтотальної резекції грудини і резекції передніх відрізків 3–7 ребер справа, резекції частини перикарду і 7 атипових резекцій обох легень, з приводу солітарних метастазів пухлини, виконано реконструкцію реберно-грудинного каркасу титановими пластинами. З перфорованих титанових пластин товщиною 0,8 мм і шириною 15 мм змодельований каркас, який замістив ребра і грудину і був фіксований до залишків ребер і грудини. Металевий каркас вкритий поліпропіленовою сіткою. Дефект м’яких тканин зліва компенсований за рахунок шматка найширшого м’яза спини, а справа — за рахунок шматка великого грудного м’яза. Обидва м’язові шматки фіксувалися до поліпропіленової сітки (див. рис. 6–9).
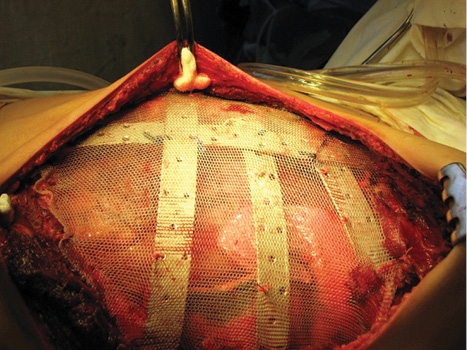
Види реконструктивно-пластичних операцій представлені в табл. 4.
| Вид реконструкції | Варіант реконструкції і пластики | Кількість хворих |
|---|---|---|
| Переміщення шматка | Шматок великого грудного м’яза | 2 |
| Шматок найширшого м’яза спини | 2 | |
| Синтетичні матеріали |
Синтетична мембрана Gore-Tex Поліпропіленова сітка |
16 |
| Комбіновані реконструкції і пластики | Синтетична мембрана Gore-Tex або поліпропіленова сітка з переміщенням м’язового шматка | 4 |
| Титанові пластини, поліпропіленова сітка з переміщенням м’язових шматків | 1 | |
| Аутотрансплантації | Аутотрансплантат із крила здухвинної кістки | 6 |
| Аутотрансплантат із деепітелізованої шкіри | 1 | |
| Переміщення ребер, діафрагми | 9 |
Після реконструктивно-пластичних операцій ускладнення в ранній післяопераційний період розвинулися у 16 (32,6%) хворих. Всі ускладнення розділені на хірургічні та терапевтичні. Хірургічні ускладнення розвинулися у 15 (30,6%) хворих. У одного пацієнта — осумкована емпієма плеври, в ділянці пластини Gore-Tex. Це стало причиною повторної операції і вимушеного видалення пластини Gore-Tex. У 11 пацієнтів відмічали осумкований плеврит, у 3 — гематоми в ділянці переміщеного шматка. В 14 випадках хірургічні ускладнення не були суттєвими, й на час перебування пацієнта в стаціонарі не вплинули (табл. 5).
| Ускладнення | Кількість хворих |
|---|---|
| Осумкована емпієма плеври з відторгненням протеза | 1 |
| Осумкований плеврит | 11 |
| Гематома в ділянці переміщеного шматка | 3 |
Терапевтичні ускладнення відмічали у 15 (30,6%) пацієнтів і в основному проявилися дихальною недостатністю у 8 (16,3%) пацієнтів, в 7 випадках зумовленою післяопераційною пневмонією, що мала короткочасний характер, після купірування явищ пневмонії дихальної недостатності не виявлено. В одного хворого дихальна недостатність розвилася як результат розширеної комбінованої операції, його стан нормалізувався на 11–12-ту добу, що практично не вплинуло на термін перебування в клініці (табл. 6).
| Ускладнення | Кількість хворих |
|---|---|
| Дихальна недостатність | 8 |
| Тромбофлебіт підключичної вени | 3 |
| Пневмонія | 7 |
| Пієлонефрит | 1 |
| Дисбактеріоз | 8 |
| Загострення виразкової хвороби шлунка | 2 |
Результати та їх обговорення
Невелика загальна кількість спостережень при значній різноманітності нозологічних форм не дає можливості вибрати коректні групи для оцінки віддалених результатів лікування через особливості захворювання, види передопераційної протипухлинної терапії і різноманіття оперативних втручань. Виконані в нашій клініці розширені комбіновані оперативні втручання нерівноцінні між собою за обсягом, локалізацією та типом виконаних резекцій, а також видом реконструктивно-пластичних етапів. У зв’язку з цим ми наводимо результати окремих етапів лікування, а також оцінюємо функціональні дані до і після оперативного лікування, а також косметичний результат. Це дає нам можливість зробити аналіз ефективності та доцільності проведеного лікування.
В результаті ВАХТ 24 пацієнтам, об’єктивна відповідь отримана у 79,1% хворих у вигляді повної або часткової регресії пухлини. У 7 (29,1%) пацієнтів зафіксовано повну регресію пухлини, у 12 (50%) — часткову регресію пухлини, і у 5 (20,9%) хворих результат оцінено як стабілізацію процесу. Після проведення системної хіміотерапії 22 пацієнтам, об’єктивна відповідь у вигляді часткової регресії пухлини отримана у 11 з них (50%), повної регресії пухлини — у 2 (9,1%) і стабілізація процесу — у 9 (40,9%). У групі пацієнтів, які отримували ВАХТ, об’єктивна відповідь пухлини на проведене лікування на 20% більша, ніж у пацієнтів, які отримували системну хіміотерапію.
Після проведеної передопераційної променевої терапії у 3 хворих отримано часткову регресію пухлини.
Всі 14 пацієнтів з ангіосаркомою грудної стінки перебували під наглядом лікаря більше 1 року. Із них прооперовано 11 хворих. Рецидиви або метастази пухлини розвинулись у 7 (50%) пацієнтів. Безрецидивний період в середньому становив 12 міс. 5 пацієнтів спостерігаються більше 44 міс без ознак прогресування хвороби.
Із 11 пацієнтів зі злоякісною багатокомпонентною мезенхімомою прооперовано 9.
Рецидиви або метастази пухлини розвинулись у 2 (18,1%) хворих. Безрецидивний період в середньому становив 32 міс. 8 пацієнтів спостерігаються більше 36 міс без ознак прогресування хвороби.
Із 12 пацієнтів з хондросаркомою грудної стінки прооперовано 9. Слід зауважити, що пухлина виявилася практично резистентною до передопераційної хіміотерапії, як системної, так і ВАХТ. У всіх випадках зафіксовано тільки стабілізацію процесу. Рецидиви або метастази пухлини розвинулись у 5 (41,6%) хворих, всі вони були прооперовані повторно. Безрецидивний період в середньому становив 22 міс 8 пацієнтів перебувають під наглядом спеціалістів більше 36 міс без ознак прогресування хвороби.
2 пацієнтів після резекції грудини з приводу злоякісної гістіоцитоми і пластики синтетичною мембраною спостерігаються більше 48 міс без ознак прогресування хвороби.
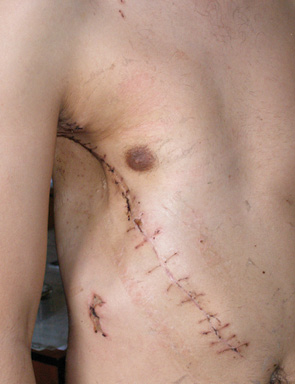
Косметичний результат після реконструктивно-пластичних операцій був задовільним практично у всіх випадках.
Якість життя онкологічних хворих і функціональні результати оцінювали на базі суб’єктивних і об’єктивних даних до початку лікування і після проведеного оперативного втручання за результатами спірографії, а також за спеціальними індексами Карновского (0–100%) і Шкалою ECOG-ВОЗ (0–4 бали).
Після всіх оперативних втручань дихальні резерви зменшувалися. Зміну дихальних резервів залежно від обсягу резекцій представлено в табл. 7.
| Осяг резекції | Зменшення функціональних дихальних резервів, % |
|---|---|
| Субтотальна резекція грудини з реконструкцією і пластикою | 10–14 |
| Резекція 1–3 ребер з пластикою | 10–12 |
| Резекція 4–5 ребер з реконструкцією і пластикою | 15–25 |
| Резекція 6 і більше ребер з реконструкцією і пластикою | 25–35 |
| Комбінована резекція ребер і грудини з реконструкцією і пластикою | 15–25 |
| Комбінована резекція ребер і грудини з реконструкцією титановими пластинами і пластикою поліпропіленовою сіткою | 25 |
| Обсяг резекції | Індекс Карновского (0–100%) | Шкала ECOG-ВООЗ (0–4 бали) | ||
|---|---|---|---|---|
| До операції | Після операції | До операції | Після операції | |
| Субтотальна резекція грудини з реконструкцією і пластикою | 70 | 90 | 2 | 1 |
| Резекція 1–3 ребер з пластикою | 90 | 90–100 | 1 | 1 |
| Резекція 4–5 ребер з реконструкцією і пластикою | 70 | 80–90 | 2 | 1–2 |
| Резекція 6 і більше ребер з реконструкцією і пластикою | 60–70 | 80–90 | 2 | 1–2 |
| Комбінована резекція ребер і грудини з реконструкцією і пластикою | 70 | 90 | 2 | 1–2 |
| Комбінована резекція ребер і грудини з реконструкцією титановими пластинами і пластикою поліпропіленовою сіткою | 70 | 90 | 2 | 1 |
Оцінка результатів після оперативного втручання за спеціальними індексами Карновского (0–100%) і Шкалою ECOG-ВООЗ (0–4 балів) представлені в табл. 8.
2 пацієнтам виконана субтотальна резекція грудини з наступною пластикою дефекту грудини поліпропіленовою сіткою і м’язовим шматком. Стан пацієнтів до і після операції практично не змінився, за винятком усунення больового синдрому. Косметичного дефекту майже не було помітно, за винятком невеликого пролабування грудної стінки. За індексом Карновського отримано до операції 70%, а після операції — 80%. Але надійного каркасу, який захищав би органи грудної порожнини від травм, не було отримано. Логічно зробити висновок, що реконструкцію грудини необхідно виконувати матеріалом, який забезпечив би не тільки косметичний результат, а й надійний жорсткий каркас: тобто аутотрансплантат кістки або титанову пластину. При резекції 2–4 ребер пропонуємо застосовувати переміщення ребра з використанням синтетичних матеріалів типу мембран Gorе-Tex або поліпропіленової сітки. Досягається хороший косметичний і функціональний результат. При виконанні резекцій 5 і більше ребер, особливо коли довжина резекції перевищує 150 мм. Вважаємо за необхідне використовувати матеріали, які дозволять відновити форму грудної стінки із збереженням об’єму плевральної порожнини. На наш погляд, таким вимогам відповідають титанові пластини, яким досить легко надати необхідну форму під час операції. Досить важливим виявився той факт, що пластини із чистого титану майже не візуалізуються при виконанні комп’ютерної томографії, що є досить суттєвим для подальшого спостереження за хворим.
Висновки
Спираючись на власний досвід, неоад’ювантну ВАХТ можна рекомендувати як високоефективний і повністю обґрунтований етап лікування злоякісних пухлин передньої грудної стінки.
Найінформативнішими дослідженнями, які дозволяють точно визначити розповсюдженість пухлинного процесу на грудній стінці, скласти правильний план резекції та обрати метод реконструкції дефекту, є КТ з можливістю 3D-реконструкції і МРТ.
Застосування методів реконструктивної хірургії у хворих з місцево-розповсюдженими пухлинами грудної стінки дозволяють значно розширити показання до оперативних втручань.
Показання до проведення одномоментної реконструктивної операції хворим з місцево-розповсюдженим пухлинним процесом грудної стінки слід визначати за допомогою комплексної оцінки розповсюдженості пухлини, прогнозу захворювання і соматичного стану пацієнта.
Радикальне видалення пухлини з резекцією грудної стінки в поєднанні з наступною реконструкцією дефекту і створення жорсткого каркасу дозволяють досягти хороших функціональних і косметичних результатів, а також значно покращити якість життя хворих з цією патологією.
Література
- 1. Болгова Л.С., Туганова Т.М., Алексеєнко О.І., та ін. (2007) Ефективність неоад’ювантної терапії хворих на рак молочної залози за цитологічними, цитогенетичними і молекулярно-біологічними критеріями. Онкологія, 9(1): 25–28.
- 11. Бохян А.Ю., Мехтиева Н.И., Колоколов Д.Д., и др. (2004) Возможности КТ и МРТ навигации в планировании хиургического лечения сарком мягких тканей конечностей. Материалы III Конгресса онкологов закавказских государств. 22–24 сентября, Ереван, 122–123.
- 16. Давыдов М.И., Алиев М.Д., Соболевский В.А. и др. (2008) Хирургическое лечение злокачественных опухолей грудной стенки. Вестник онкологии, № 1: 35–40.
- 21. Соболевский В.А., Егоров Ю.С., Илюшин А.Л.(2006) Выбор оптимального метода реконструкции при опухолях опорно-двигательного аппарата. Материалы Х Российского Онкологического конгресса, 112–113.
- 25. Соболевский В.А., Кропотов М.А., Илюшин А.Л. (2006) Выбор оптимального метода реконструкции в хирургическом лечении местно-распространенных опухолей костей, кожи и мягких тканей. IV Съезд онкологов и радиологов стран СНГ, Баку, 197.
- 30. Илюшин А.Л., Соболевский В.А., Алиев М.Д. и др. (2008) Хирургическое лечение больных с злокачественными опухолями грудной стенки. V Съезд онкологов и радиологов СНГ, Ташкент, 192.
- 36. Aliev M., Sokolovsky I., Solovyev E. et al. (2003) Endoprosthetic reconstruction in bone tumors. Analisys of 245 patients. 16 Annual Meeting of the European Musculoskeletal Oncology Society, 97.
- 43. Bokhyan B., Stepanova E., Keshta R. et al. (2003) C-Kit expression in soft tissue sarcomas: perspectives of usage Glivec. 16 Annual Meeting of the European Musculoskeletal Oncology Society, 98.
- 49. Chapelier А.R., Missana M.-Ch., Conturaud B. et al. (2004) Sternal resections and reconstruction for primary malignant tumors. Ann. Thorac. Surg., № 77: 1001–7.
- 54. Coeugniet E., Danino A., Malka G. et al. (2007) Reconstruction strategy in chest wall defect relating to the localization of the lost substances: retrospective study of 18patients. Chirurgia (Bucur), V. 100(2): 143–8.
- 60. Lequaglie С., Brega P.P., Guidice G. et al. (2002) Gold Standart for Sternoctomies and Plastic Reconstructions After Resections for Primary or Secondary’ sternal Neoplasms. Annals of Surgical Oncology, V. 9.: 472–479.
- 66. Ilyushin A., SobolevskiyV. , Aliev M. et al. (2006) Surgical resection and reconstruction for malignant chest wall tumors. Вестник РОНЦ им. Н.Н. Блохина РАМН, т. 17, № 1: 7.
- 75. Novoa N., Benito P., Jimenez M.F. et al. (2005) Reconstruction of chest wall defect after resectin of large neoplasms: ten-year experience. Cardio Vasе Thorac Surg., V. 4: 250–255.
- 80. Sacurai Н., Suzuki H., Doboshi Y. et al. (2005) Chоndrosarcoma of chest wall. Kyobu Geka. Aug., V. 58(9): 779–82.
- 84. Tan Z., Nirmal L., Liu D. (2005) Reconstruction of chest wall after resection. Zhongguo Xiu Fu Chong Jian Wai Ke Za Zhi., V. 19(5): 338–40.
Реконструктивно-пластические оперативные вмешательства в комплексном лечении злокачественных опухолей грудной стенки
Национальный институт рака, Киев
Резюме. Проанализированы результаты комплексного и хирургического лечения 61 пациента с первичными и вторичными злокачественными опухолями грудной стенки. Разработаны тактические подходы в лечении больших местно-распространенных опухолей. В клинической практике при злокачественных опухолях грудной стенки успешно применили внутриартериальную селективную химиотерапию (ВАХТ). При этом лечебный эффект — частичную или полную регрессию опухоли — зарегистрирован в 79,1% пациентов. В режиме неоадъювантной терапии ВАХТ использовали у 12 пациентов и как самостоятельный метод — также у 12 больных. Нами впервые в Украине выполнена пластика дефекта грудной стенки с полным восстановлением каркаса с использованием титановых пластин. Успешно применены методы реконструкции и пластики дефектов после резекций грудины с использованием аутотрансплантата из крыла подвздошной кости и синтетических материалов. Всего прооперировано 49 пациентов, из них 31— с реконструктивно-пластическим замещением дефекта грудной стенки.
грудная стенка, злокачественные опухоли, внутриартериальная селективна химиотерапия, реконструктивная пластическая операция.














Leave a comment