Тотальне видалення крижа при пухлинному ураженні
Мусаев Э.Р., Сушенцов Е.А., Щипахин С.А., Алиев М.Д.
Резюме. У статті узагальнено досвід клініки онкоортопедії РОНЦ при виконанні тотальної сакректомії при пухлинних ураженнях крижа. Детально описані етапи операції, приведено клінічне спостереження тактики лікування пацієнта з рецидивом епендимоми крижа.
Резюме. В статье обобщен опыт клиники онкоортопедии Российского онкологического научного центра (РОНЦ)) по выполнению тотальной сакрэктомии при опухолевых поражениях крестца. Подробно описаны этапы операции, приведено клиническое наблюдение тактики лечения пациента с рецидивом эпендимомы крестца.
Опухолевые поражения крестца — редкие случаи в клинической практике. По данным L. Whittaker, выявляют 1 пациента с опухолью крестца на 40 тыс. госпитализаций [6]. Клиническое течение болезни при данной патологии отличается особой тяжестью. Часто опухоль диагностируют в запущенных стадиях, операции проводят в непрофильных учреждениях, что вызывает частые рецидивы и ухудшает прогноз. Резекции крестца при опухолях относятся к одним из наиболее травматичных оперативных вмешательств в онкоортопедии [2].
Тотальное удаление крестца (сакрэктомия) часто сопровождается большой кровопотерей, высок риск развития инфекционных осложнений, заживления раны вторичным натяжением, неврологического дефицита. Кроме осложнений, особую трудность вызывает проблема выполнения адекватной стабилизации позвоночно-тазового сегмента и эндопротезирования крестца [3]. Эндопротезирование позволяет улучшить функциональные и психологические результаты противоопухолевого лечения и не влияет на прогноз заболевания [1]. Известен способ реконструкции дефекта после тотальной сакрэктомии, предложенный Z. Gokaslan (1997) [4]. Методика заключается в выполнении пояснично-крестцового спондилодеза путем остеосинтеза с применением L-образных стержней Galveston, которые крепятся к транспедикулярным винтам, установленным в тело поясничных позвонков и в подвздошные кости. Такой метод пояснично-крестцовой фиксации впервые предложен в 1982 г. при сколиозах [11]. Остеосинтез подвздошных костей между собой не выполняется, что может приводить к нестабильности конструкции вплоть до ее переломов. В 2003 г. M. Zileli предложил заменить L-образные стержни Galveston продольными стержнями, крепящимися при помощи замков только к поперечному верхнему стержню, соединяющему подвздошные кости, которые фиксированы между собой двумя поперечными стержнями [5].
Методика операции (клиника онкоортопедии РОНЦ)
Операции по тотальному удалению крестца требуют мультидисциплинарного подхода, необходимо участие онкоортопедов, нейрохирургов и пластических хирургов. Хирургическое вмешательство разделяется на несколько основных этапов.
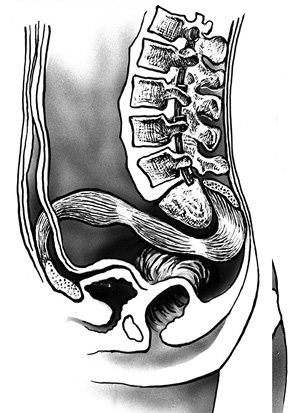
Этап I. Положение пациента — на спине. Передний доступ. Забирают ректоабдоминальный лоскут, мобилизируют передний полюс опухоли. Для этого выполняют разметку кожи на передней брюшной стенке. Разрез кожи подкожно-жировой клетчатки и фасции для забора ректоабдоминального лоскута проходит в проекции прямой мышцы живота (m. rectus abdominis) (рис. 1). Последнюю отсекают у реберной дуги и выделяют на всем протяжении из собственного влагалища. Выделяют кровоснабжающие ее нижнеэпигастральные артерию и вену (a. et v. epigastrales inferiorts), являющиеся ветвями наружных подвздошных сосудов. Мышцу отсекают в области прикрепления к лобковому симфизу (symphis pubis). Внебрюшинно производят доступ к пресакральной области. Мобилизуют бифуркацию общих подвздошных сосудов. Внутренние подвздошные сосуды (a. et v. iliaces interni) перевязывают и пересекают с целью уменьшения кровопотери во время резекции крестца и удаления опухоли. При необходимости мобилизуют передний полюс опухоли от прилежащих органов малого таза. Ректоабдоминальный лоскут помещают в сформированный туннель, при этом необходимо контролировать сосудистую ножку и не допустить ее перекручивания, что может привести к некрозу всего лоскута. Рану передней брюшной стенки послойно ушивают, оставляют дренаж.
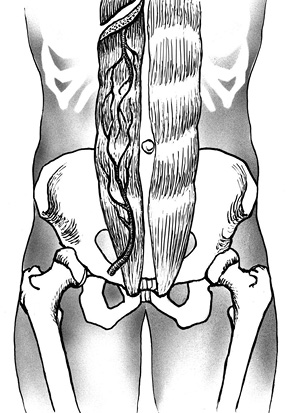
Этап II. Положение пациента — на животе (поворот) с подложенными валиками под грудь и таз. Производят разрез кожи вдоль остистых отростков (tubercula spinalis) на уровне LIII–SII, продлевая разрез дугообразно на ягодичные области (рис. 2). Тупым и острым способом сепарируют мышцы спины, на уровне LIII–SII скелетируют позвоночник.
Этап III. Далее выполняют нейрохирургический этап операции, корешки и элементы спинного мозга освобождают от опухолевых тканей, при необходимости перевязывают и пересекают.
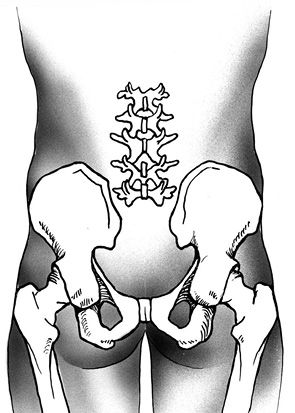
Затем визуализируют подвздошные кости. Выделяют копчик, пересекают крестцово-бугорные и крестцово-остистые связки (ligg. sacrotuberous et sacrospinalis). Выполняют ревизию пресакральной области с целью исключения врастания опухоли в прилежащие органы. При распространении опухоли на ягодичные мышцы (mm. glutei) последние широко иссекают. Далее выполняют мобилизацию и тотальную резекцию крестца (рис. 3).
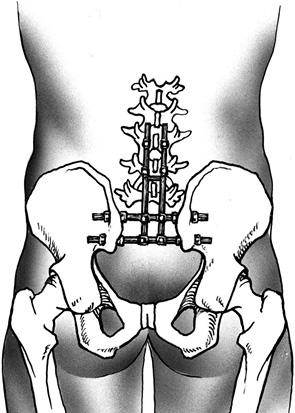
Этап IV. В тела поясничных позвонков, минимум на двух уровнях, устанавливают транспедикулярные винты, к которым крепятся продольные стержни. В подвздошных костях с помощью фрезы выполняют технологические отверстия, через которые проводят и фиксируют шайбами в подвздошных костях поперечные стержни. Продольные стержни фиксируют на поперечных при помощи замков (рис. 4).
С помощью костного цемента с антибиотиком выполняют пластику костного дефекта крестца (рис. 5).
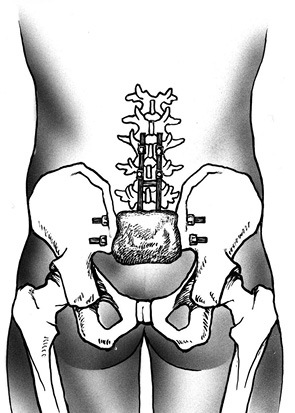
Перемещенный ректоабдоминальный лоскут выводят из пресакральной области в область раны и укладывают на эндопротез крестца с отграничением ампулы (ampula recti) прямой кишки (рис. 6). Паравертебрально в ложе удаленной опухоли с двух сторон выводят дренажи. Рану послойно ушивают.
Клинический пример
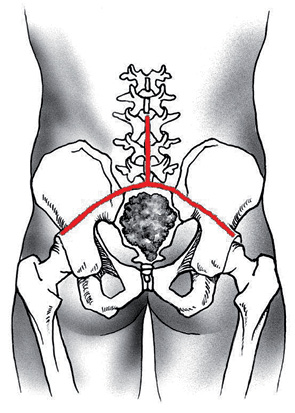
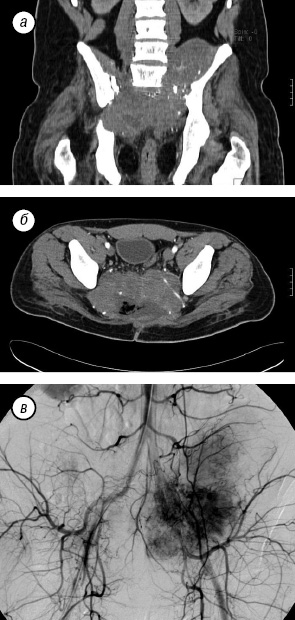
Пациент З., 30 лет, находился на стационарном лечении в отделении вертебральной хирургии НИИ КО РОНЦ им. Н.Н. Блохина РАМН с диагнозом «рецидив эпендимомы крестца». Из анамнеза: в течение 11 лет пациенту было выполнено 6 операций различного объема по удалению опухоли крестца, проводилась лучевая терапия (СОД 60 Гр) в неонкологической клинике. При поступлении в РОНЦ пациент предъявлял жалобы на боль в области крестца с иррадиацией в левую ногу, нарушение функции тазовых органов. В течение 6 мес до госпитализации больной не ходил вследствие выраженного болевого синдрома, который возникал при вертикальном положении тела. По данным рентгенологических обследований определяли многоузловую высоковаскуляризированную опухоль c практически полной деструкцией крестца переходом на LV позвонок и крыло подвздошной кости (рис. 7).
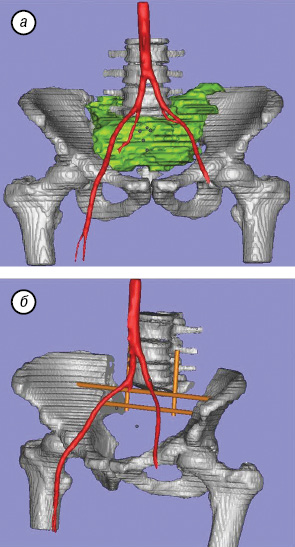
В предоперационный период пациенту было проведено компьютерное моделирование объема удаляемых тканей и предполагаемой системы стабилизации оперированного сегмента (рис. 8).
По описанной методике пациенту была выполнена операция тотального удаления крестца с эндопротезированием и пластикой мягкотканного дефекта ректоабдоминальным лоскутом. Основные этапы операции представлены на рис. 9, 10.
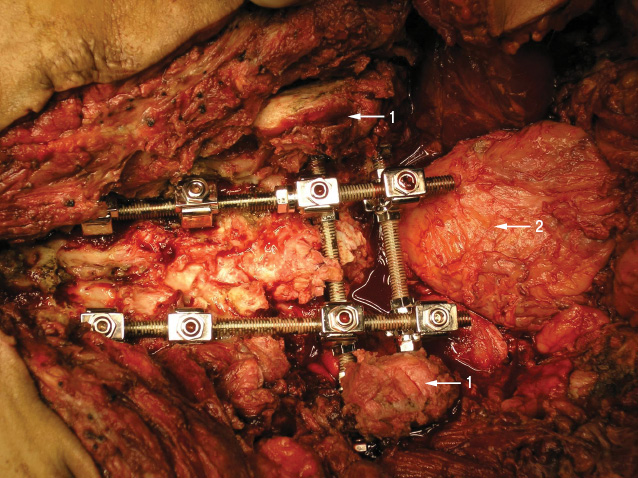
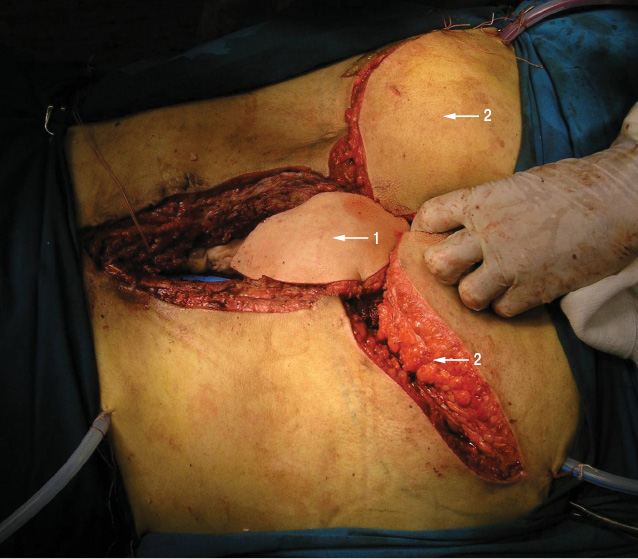
Продолжительность операции — 14 ч хирургического времени, кровопотеря — 12 000 мл, использовали метод аутоинфузии собственных эритроцитов (Cell-saver). После удаления опухоли пациенту был введен рекомбинантный VII фактор свертываемости крови (NovoSeven), что позволило добиться стабильного гемостаза в области ложа удаленной опухоли, выполнить реконструктивный этап операции в полном объеме, а в послеоперационный период — избежать образования обширных гематом.
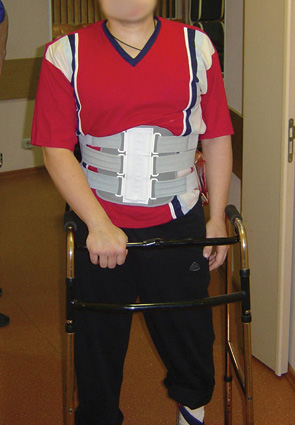
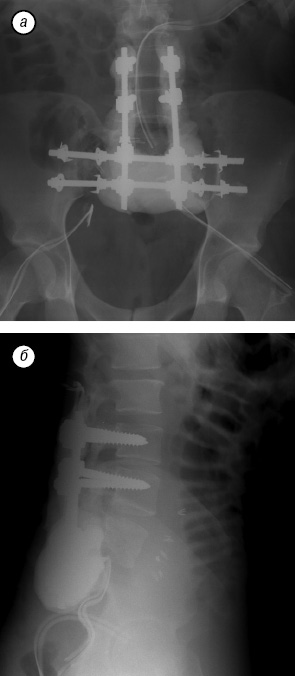
В послеоперационный период пациент был активизирован на 4-е сутки, на 7-е сутки он самостоятельно передвигался с ходунками в корсете (рис. 11). Рана зажила первичным натяжением, перемещенный лоскут без признаков ишемии. Неврологический статус после операции — сохранялись парезы стоп с двух сторон; анестезия в области дерматомов LV–SI с двух сторон на стопах; анестезия в аногенитальной зоне справа, слева глубокая гипестезия, до операции — анестезия. Пациент стал частично контролировать функцию мочеиспускания. По данным стандартной рентгенографии, признаков нестабильности металлоконструкции не выявлено (рис. 12).
Обсуждение
Радикальные хирургические вмешательства при опухолях крестца наиболее оправданы при низкозлокачественных или агрессивных доброкачественных опухолях, либо в случаях, когда процесс резистентен к химиолучевому лечению. Выполнение радикальных операций на костях таза сопряжено со значительными трудностями, поэтому показания следует рассматривать группе специалистов на мультидисциплинарном консилиуме, включающем хирургов, ортопедов, нейрохирургов, анестезиологов, лучевых диагностов, химио- и лучевых терапевтов.
Эпендимома крестца происходит из клеток эпендимы, распространяется в крестцовом канале и обычно имеет доброкачественную морфологическую форму. Боль в области крестца с иррадиацией или без — наиболее частые первые симптомы болезни, отмечаемые главным образом в возрасте 30–40 лет. Нарушение чувствительности и двигательной активности, а также нарушение функции тазовых органов являются следствием компрессии элементов конского хвоста, и время от начальных проявлений до установления диагноза может составлять обычно 2–3 года [7, 8].
Одну из ключевых ролей в хирургическом лечении опухолей крестца играет современное анестезиологическое пособие, что позволяет создать условия для оперирующей бригады, справиться с массивным кровотечением и обеспечить стабильную гемодинамику. Массивные кровотечения из ложа удаляемой опухоли, патологических и магистральных сосудов — основная угроза жизни пациента во время операции, в литературе опубликованы сообщения о массивных кровопотерях — от 7 до 80 л [9, 10].
Выбор оперативной тактики требует мультидисциплинарного подхода с использованием современных компьютерных технологий, тщательного предоперационного обследования и планирования хода операции и оперирующих бригад хирургов, высокую квалификацию специалистов на всех этапах оказания медицинской помощи.
Заключение
Данный вид хирургического вмешательства является современным, высокотехнологичным методом лечения опухолевого поражения крестца с использованием последних достижений науки и техники.
Тотальная сакрэктомия требует комплексного подхода с участием специалистов разного профиля, что возможно только в условиях специализированного учреждения. Предлагаемый метод хирургического лечения позволяет улучшить качество жизни больных с опухолевым поражением крестца, активизировать пациентов уже на 3-и сутки после операции, уменьшить время пребывания в стационаре, снизить риск развития нестабильности и инфекционных осложнений.
Литература
- 1. Алиев М.Д. (2010) Эндопротезирование как основа онкоортопедии. Саркомы костей, мягких тканей и опухоли кожи, 4: 7–12.
- 2. Трапезников Н.Н., Григорова Т.М. (1978) Первичные опухоли костей таза. М., Медицина.
- 3. Gunterberg B. (1976) Effects of major resection of the sacrum. Clinical studies on urogenital and anorectal function and a biomechanical study on pelvic strength. Acta Orthop Scand. Suppl. 162: 1–38.
- 4. Gokaslan Z., Romsdahl M., Kroll S. et al. (1997) Total sacrectomy and Galveston L-rod reconstruction for malignant neoplasms. J. Neurosurg, Vol. 87: 781–787.
- 5. Zileli M., Hoscoskun C., Brastianos P. et al. (2003) Surgical treatment of primary sacral tumors: complications associated with sacrectomy. Neurosurg Focus, Vol. 15(5): article 9.
- 6. Whittaker L.D., Pemberton J.J. (1938) Tumors ventral to the sacrum. Ann. Surg., 107: 96–106.
- 7. Fourney D.R., Fuller G.N., Gokaslan Z.L. (2000) Intraspinal extradural myxopapillary ependymoma of the sacrum arising from the filum terminale externa. Case report. J. Neurosurg (Spine 2), 93: 322–326.
- 8. Gerston K.F., Suprun H., Cohen H. et al. (1985) Presacral myxopapillary ependymoma presenting as an abdominal mass in a child. J. Pediatr Surg., 20: 276–278.
- 9. Dahlin D.C., Cupps R.E., Johnson E.W. Jr. (1970) Giant-cell tumor: a study of 195 cases. Cancer., 25: 1061–970.
- 10. Tomita K., Tseuchia H. (1990) Total sacrectomy and reconstruction for huge sacral tumors. Spine, 15: 1223–1227.
- 11. Allen B.L., Ferguson R.L. (1982) The Galveston technique for L rod instrumentation of the scoliotic spine. Spine, 7: 276–274.














Leave a comment