Досвід застосування схем терапії ІІ лінії при лікуванні рецидивів і рефрактерного перебігу лімфом
Кущевой Е.В., Мартынчик А.В., Филоненко Е.С., Новосад И.О., Пастушенко Я.В., Кадникова Т.В. , Титоренко И.Б., Алексик Е.М.
Резюме. Проведено ретроспективний аналіз ефективності і токсичності терапії ІІ лінії у пацієнтів з лімфмою Ходжкіна і неходжкінськими лімфомами, що отримали лікування в Національному інституті раку, продемонстровано можливість проведення адекватної терапії ІІ лінії силами стандартного штату медичного персоналу відділення онкогематології. Встановлено ефективність курсів поліхіміотерапії за схемами DHAP, GVP, MINЕ при лікуванні рецидивів і первинно-рефрактерних форм лімфоми Ходжкіна та неходжкінських лімфом. У статті обґрунтовано проведення правильного стадіювання лімфом, а також необхідність повторної біопсії пухлини перед початком терапії ІІ лінії. Підкреслено важливість вчасного припинення терапії першої лінії при реєстрації первинної рефрактерності чи прогресії захворювання у зв’язку з її неефективністю. Отримані дані свідчать про те, що при несприятливому перебігу лімфоми терапія ІІ лінії дозволяє досягти повної чи часткової ремісії у більшості хворих.
Резюме. Проведен ретроспективный анализ эффективности и токсичности терапии II линии у пациентов с лимфомой Ходжкина и неходжкинскими лимфомами, получавших лечение в Национальном институте рака. Показана эффективность курсов полихимиотерапии по схемам DHAP, GVP, MINЕ при лечении рецидивов и первично рефрактерных форм лимфомы Ходжкина и неходжкинских лимфом. В статье обосновано проведение правильного стадирования лимфом, а также повторной биопсии опухоли перед началом терапии II линии. Подчеркнута важность своевременного прекращения проведения терапии I линии при регистрации первичной рефрактерности или прогрессии заболевания ввиду ее неэффективности. Полученные данные свидетельствуют о том, что при неблагоприятном течении лимфом терапия II линии позволяет добиться полной или частичной ремиссии у большей части пациентов.

Введение
Подходы к лечению пациентов с лимфомами, не ответивших на индукционную терапию (терапию I линии) или с рецидивом, имеют ряд особенностей. В первую очередь, важно обязательно зарегистрировать первично-рефрактерное течение (ПРТ). На этом этапе проводимая индукционная терапия должна быть прекращена как малоэффективная [13, 3, 9]. Принципиально важной является гистологическая верификация рецидива, а в ряде случаев повторную биопсию проводят и при ПРТ лимфом [13]. Это позволяет исключить неопухолевое поражение лимфатических узлов, дифференцировать остаточную опухолевую массу без жизнеспособной опухоли от истинного опухолевого роста, изменить тип лимфомы. Существенную роль при этом может сыграть позитронно-эмиссионная томография всего тела [18].
Терапевтическая программа при лечении ПРТ и рецидивов лимфом должна быть комплексной. Нередко терапию II линии определяют как высокодозовую химиотерапию, так как для большинства лимфом при диагностике рецидива и ПРТ проведение высокодозовой терапии (ВДХТ) с аутологичной трансплантацией гемопоэтических стволовых клеток (ТГСК) является терапией выбора и стало стандартом [10]. Однако ВДХТ наиболее эффективна при достижении полного (ПО) или частичного ответа (ЧО) после предшествующей полихимиотерапии (ПХТ) II линии. Непосредственно ВДХТ — лишь заключительный этап терапии рецидива или ПРТ, цель которого — подавление минимальной остаточной болезни (MRD). Большинство проведенных рандомизированных исследований, изучавших эффективность ВДХТ и влияние прогностических факторов на исход терапии, продемонстрировало решающую роль статуса заболевания перед ВДХТ. Достижение ПО или ЧО ассоциируется со значительно более высокой частотой длительной безрецидивной выживаемости после проведения ВДХТ по сравнению с группой пациентов, у которых отмечали лишь стабилизацию заболевания или прогрессию лимфомы перед трансплантацией. Для достижения ответа лимфомы на терапию применяют схемы с использованием цитостатиков, к которым у опухолевых клеток нет перекрестной резистентности.
Таким образом, стандартная терапия II линии — сальвадж-терапия (salvage-therapy) — играет ключевую роль в лечении при рецидиве и ПРТ. Она позволяет уменьшить опухолевую массу и оценить химиочувствительность опухоли перед проведением ВДХТ, и уже на этом этапе добиться ремиссии у 30–50% пациентов. Лечение с использованием схем ПХТ II линии является терапией выбора при невозможности проведения пациенту ВДХТ.
Применяемые схемы ПХТ II линии у кандидатов на дальнейшую ВДХТ кроме высокой эффективности должны обладать приемлемой токсичностью и высоким потенциалом мобилизации гемопоэтических стволовых клеток (ГСК). Для успешного восстановления гемопоэза после ВДХТ необходимо количество CD34-клеток не менее 2·10/кг массы тела пациента.
В качестве схем ПХТ II линии в настоящее время используют такие схемы, как DHAP, ESHAP, MINE, ICE, GVP, GDP и др. [6, 14, 17]. Некоторые схемы ПХТ II линии, как DexaBEAM, Mini-BEAM, обладая высокой эффективностью, в последние годы не используют в качестве предтрансплантационной химиотерапии ввиду высокой токсичности и незначительного мобилизационного потенциала [4, 16].
Оценка их эффективности, токсичности, мобилизационной эффективности представлена в ряде работ зарубежных и украинских исследователей. Сравнению курсов ПХТ II линии посвящено несколько крупных обзоров [1, 3, 8]. В табл. 1 приведена сводная информация по общей эффективности и мобилизационной способности основных курсов ПХТ II линии.
Роль схем терапии II линии при неблагоприятном течении лимфом доказана многочисленными рандомизированными исследованиями. Их применение является общепризнанным мировым стандартом, не требующим подтверждения. Однако в Украине лечение пациентов этой группы имеет ряд особенностей. Основные из них представлены ниже. В ряде случаев проводят неадекватное стадирование лимфом: не проводят исследование костного мозга, компьютерную томографию (КТ) всех необходимых зон, не используют внутривенное (в/в) усиление при КТ. Гистологическая верификация материала биопсии не всегда достаточна (не выполняют иммуногистохимическое исследование). Терапию I линии нередко проводят с отклонением от стандартных доз и сроков введения, а порой используют нестандартные схемы. Оценку ответа на терапию на промежуточных этапах лечения или не проводят, или выполняют не в соответствии с принятыми критериями (International Working Group Response Criteria, 1999). Возможность проведения ВДХТ с ауто-ТГСК крайне ограничена ввиду того, что на сегодня в Украине существует только один центр трансплантации гемопоэтических стволовых клеток. Ввиду этого стандартная ПХТ II линии нередко является завершающим этапом терапии.
Цель исследования
Целью данного исследования была оценка эффективности и токсичности применения сальвадж-терапии у больных с рецидивом и рефрактерным течением лимфомы Ходжкина (ЛХ) и неходжкинской лимфомы (НХЛ) и сравнение их с мировыми данными.
объект и методы исследования
Был проведен ретроспективный анализ эффективности и токсичности терапии II линии по схемам DHAP, GVP, MINE у пациентов с ПРТ и рецидивами ЛХ и НХЛ, которые находились на лечении в отделении онкогематологии Национального института рака в период с августа 2008 по февраль 2011 г.
ПРТ лимфомы устанавливали при отсутствии ПО или ЧО после 4 курсов индукционной ПХТ при ЛХ или после 3 курсов — при НХЛ, а также при развитии рецидива в течение 3 мес после окончания терапии. Рецидив заболевания диагностировали согласно общепринятым критериям (International Working Group Response Criteria, 1999). Рецидив расценивался как ранний, если он развился до 1 года от окончания индукционной терапии, поздний — после 1 года. Оценка эффективности терапии II линии проводилась после двух курсов ПХТ. Пациентам, достигшим ПО или ЧО, проводилась ВДХТ или продолжалась терапия по тем же схемам. При отсутствии ПО или ЧО после 2 курсов ПХТ II линии пациентам проводилась смена сальвадж-терапии на схемы, содержащие препараты других групп либо на схемы паллиативной терапии. Оценка ответа опухоли на терапию проводилась по критериям International Working Group Response Criteria, 1999.
За указанный период в качестве кандидатов для проведения ПХТ по схемам II линии было рассмотрено 98 пациентов с ПРТ и рецидивами ЛХ и НХЛ. Протоколы терапии II линии получили 64 пациента. Из 34 больных, которым не была проведена ПХТ II линии, два были исключены, так как у них при повторной биопсии по поводу ПРТ или рецидива диагноз лимфомы не был подтвержден (в одном случае гистологически верифицирован инфекционный процесс в легких, в другом — лимфатические узлы при сомнительных данных о прогрессии по результатам КТ демонстрировали отсутствие метаболической активности по данным позитронно-эмиссионной томографии). Остальным 32 пациентам ПХТ II линии не была проведена из-за несогласия пациента (n=4) или вследствие несоответствия критериям включения по данным функциональных проб сердечно-сосудистой и респираторной систем (n=28).
Критерием включения в исследование были: нормальное состояние сердечной деятельности (отсутствие клинически значимых нарушений сердечного ритма по данным ЭКГ, фракция изгнания левого желудочка >50% по данным эхоКГ), диффузионная способность легких >50%, креатинин сыворотки крови ?120 мкмоль/л, отсутствие сопутствующих заболеваний в стадии декомпенсации.
Для всех пациентов, которым планировали ПХТ II линии с последующей ВДХТ, обязательным требованием было проведение повторной биопсии для подтверждения диагноза лимфомы. При невозможности биопсии периферического лимфатического узла проводили торакоскопическую, лапароскопическую, открытую биопсию, трепанобиопсию очага поражения под контролем КТ. При невозможности проведения биопсии или ее неэффективности выполняли повторное исследование первичного материала биопсии. У 27 пациентов осуществляли дополнительное иммуногистохимическое исследование первичного материала. Для верификации рецидива у 8 пациентов была выполнена позитронно-эмиссионная томография всего тела. Гистологически диагноз лимфомы был подтвержден во всех случаях, однако у 6 пациентов был изменен ее тип.
Проводили анализ лечения, который пациенты получали ранее в качестве терапии I линии или противорецидивной терапии, в том числе ее соответствие общепринятым стандартам. В результате проведенного анализа был выявлен ряд отклонений от стандартов диагностики и лечения лимфом. Неадекватные подходы к терапии включали в:
- не исследовали костный мозг;
- не проводили КТ всех зон — шеи, грудной и брюшной полостей, малого таза;
- КТ проводили без в/в усиления;
- отсутствовала верификация типа НХЛ методом иммуногистохимического исследования;
- схемы терапии не соответствовали типу лимфомы и ее стадии;
- терапию рецидива не проводили по схемам ПХТ II линии;
- при неэффективности терапии пациенты продолжали лечение по тем же схемам;
- при инициальной терапии проводили >8 курсов ПХТ I линии;
- модифицировали (как правило снижали) дозы цитостатиков или заменяли препараты в схемах ПХТ;
- нарушали интервалы между курсами;
- объем лучевой терапии не соответствовал современным стандартам.
Исследуемая группа пациентов была однородна по гендерному признаку — из 64 пациентов мужчины составили 56% (36), женщины — 44% (28), возраст больных составил 17–74 лет. ЛХ была диагностирована у 58% (37) и НХЛ — у 42% (27 человек). Распределение пациентов по стадиям заболевания было равномерным: I/II стадию на момент первичного установления диагноза лимфомы отмечали у 53% (n=34), III/IV — у 47% (n=30) (p>0,05).
Характеристика статуса заболевания перед началом ПХТ II линии в исследуемой группе приведена в табл. 2.
| Показатель | Вся группа, % (n) | ЛХ, % (n) |
НХЛ, % (n) |
|---|---|---|---|
| Ранний рецидив | 33 (21) | 30 (11) | 37 (10) |
| Поздний рецидив | 22 (14) | 21,5 (8) | 22 (6) |
| Рецидив ?2 | 12 (8) | 21,5 (8) | — |
| ПРТ | 33 (21) | 27 (10) | 41 (11) |
Большую опухолевую массу при ЛХ выявляли у 29,7% (n=11), при НХЛ — у 62,9% (n=17) пациентов. В-симптомы при диагностике лимфомы зафиксированы у 29,6% больных (n=19), которые были равномерно распределены в группах: ЛХ — 24,3% пациентов (n=9), НХЛ — 37,0% (n=10) (p>0,05).
Фактор «неадекватная первичная диагностика и терапия» при оценке по вышеописанным критериям выявляли у 28% пациентов (n=18).
Следует отметить, что в группе пациентов, которые не соответствовали критериям включения в терапию II линии, 78,5% (n=22) получили неадекватную первичную терапию. При этом количество предшествующих курсов ПХТ I линии и их «модификаций» составило от 10 до 34.
ПХТ линии II по схеме DHAP (цисплатин 100 мг/м в/в 24-часовая инфузия в день 1-й, цитарабин 4000 мг/м в/в в 2 введения с интервалом 12 ч в день 2-й, дексаметазон 40 мг/сут в/в в дни 1–4-й) получили 84% (n=54); GVP (гемцитабин 1000 мг/м в/в в дни 1–8-й, винорельбин 30 мг/м в/в в дни 1–8-й, преднизолон 100 мг рer оs в дни 1–8-й) — 23% (n=15); MINE (ифосфамид 1330 мг/м в/в в дни 1–3-й, этопозид 65 мг/м в/в в дни 1–3-й, митоксантрон 8 мг/м в/в 1-й день, месна 1330 мг/м в/в в дни 1–3-й) — 9% (n=6). У 11 пациентов было проведено две линии сальвадж-терапии (после неудачной терапии по схеме DHAP 7 пациентов получили ПХТ по схеме GVP, 4 — по схеме MINE).
После проведения стандартной ПХТ II линии 21 пациенту из 23 кандидатов была выполнена ВДХТ с аутоТГСК (Киевский центр трансплантации костного мозга – 20, отделение трансплантации костного мозга больницы «ОХМАТДЕТ» — 1 пациент). У 2 пациентов не удалось собрать достаточного для выполнения трансплантации количества CD34-клеток.
Результаты
Анализ эффективности терапии с использованием сальвадж-режимов показал, что общий ответ (ОО) на терапию составил 62,5% (n=40), в том числе ПО был достигнут у 28,2% больных (n=18), ЧО — у 34,3% (n=22).
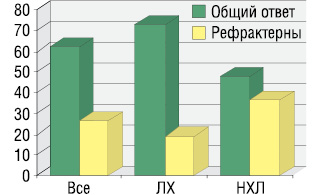
При оценке общей эффективности терапии в целом в группе и в зависимости от типа лимфомы были получены следующие результаты (табл. 3, рис. 1).
| Показатель | Всего, % (n) | ЛХ, % (n) |
НХЛ, % (n) | Р |
|---|---|---|---|---|
| ОО | 62,5 (40) | 73 (27) | 48,2 (13) | <0,05 |
| ПО | 28,2 (18) | 41 (15) | 11%(3) | <0,05 |
| ЧО | 34,3 (22) | 32 (12) | 37,2 (10) | >0,05 |
| Стабилизация заболевания | 11 (7) | 8,1 (3) | 14,8 (4) | >0,05 |
| Рефрактерны к терапии | 26,5 (17) | 18,9 (7) | 37 (10) | >0,05 |
Таким образом, у пациентов с ЛХ по сравнению с больными НХЛ статистически значимо выше частота достижения ОО на терапию (63 и 48% соответственно, p<0,05) и ПО (41 и 11% соответственно, p<0,05).
У 11 пациентов после неудачного курса DHAP была проведена II линия сальвадж-терапии по схеме MINE или GVP. После смены схемы терапии II линии ОО составил 36%, в том числе ПО был достигнут у 9% (n=1), ЧО — у 27% (n=3). Рефрактерными ко II линии сальвадж-терапии остались 55% пациентов (n=6), стабилизацию заболевания (СЗ) отмечали у 9% (n=1).
При анализе эффективности терапии в зависимости от статуса заболевания перед началом терапии II линии были получены следующие результаты (табл. 4, рис. 2).

| Вся группа | ЛХ | НХЛ | |||||||
|---|---|---|---|---|---|---|---|---|---|
| ОО, % (n) |
СЗ, % (n) |
Реф, % (n) |
ОО, % (n) |
СЗ, % (n) |
Реф, % (n) |
ОО, % (n) |
СЗ, % (n) |
Реф, % (n) |
|
| Ранний рецидив |
47,6* (10) |
4,8 (1) |
47,6 (10) |
63,6 (7) |
– |
36,4 (4) |
30** (3) |
10 (1) |
60 (6) |
| Поздний рецидив |
78,5* (11) |
14,2 (2) |
7,1 (1) |
75 (6) |
12,5 (1) |
12,5 (1) |
83,4** (5) |
16,6 (1) |
0 |
| Рецидив ?2 |
62,5 (5) |
12,5 (1) |
25 (2) |
62,5 (5) |
12,5 (1) |
25 (2) |
– | – | – |
| ПРТ |
(66,6) (14) |
14,4 (3) |
19 (4) |
90 (9) |
10 (1) |
– |
45,4 (5) |
18,2 (2) |
36,4 (4) |
| Всего |
62,5(40) |
11(7) |
26,5(17) |
73(27) |
8,1(3) |
18,9(7) |
48,2(13) |
14,8(4) |
37(10) |
В исследуемой группе пациентов с лимфомами тенденция частоты ответа на терапию в зависимости от статуса заболевания в целом соответствовала результатам ранее опубликованных исследований [6, 14, 17]. Статистически значимо выше ОО при позднем рецидиве по сравнению с ранним рецидивом во всей исследуемой группе (78,5 и 47,6% соответственно, p<0,05), и отдельно в группе НХЛ (83,4 и 30% соответственно, p<0,05). При сравнении ответа на терапию при ПРТ и позднем рецидиве лимфом было выявлено, что ОО на терапию при ПРТ и позднем рецидиве был сопоставим, а при раздельном анализе в группе ЛХ составил, соответственно, 90 и 75% (p>0,05). Разница не была статистически значимой, однако отмечена тенденция к лучшему эффекту терапии в группе ПРТ по сравнению с поздним рецидивом ЛХ.
Таким образом, анализ результатов терапии в зависимости от статуса заболевания показал высокие показатели достижения ОО в самой неблагоприятной подгруппе больных с рефрактерностью к первичной терапии. Эффективность при этом была сопоставима с самой курабельной группой пациентов с поздними рецидивами лимфом.
Полученные данные отличаются от результатов опубликованных ранее исследований, согласно которым более высокий процент достижения ответа на терапию II линии отмечают у пациентов с поздним рецидивом ЛХ и НХЛ и минимальный — при ПРТ. В связи с этим был проведен анализ факторов, которые могли бы оказать влияние на полученные результаты. При сравнении групп пациентов с ПРТ и поздним рецидивом установлено, что они однородны по полу, возрасту, стадиям заболевания, типу лимфомы (ЛХ/НХЛ). Однако было выявлено статистически значимое отличие по критерию «неадекватные подходы к диагностике и терапии» (рис. 3). Он составил 19% в группе ПРТ и 71,4% при позднем рецидиве (p<0,05).

Таким образом, данный критерий может объяснить сравнительно высокую эффективность терапии II линии при ПРТ по сравнению с группой пациентов с поздним рецидивом.
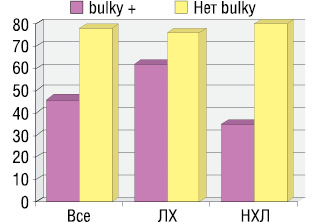
Кроме того, было оценено прогностическое значение большой опухолевой массы («bulky»), выявленной на момент установления диагноза лимфомы, для эффективности терапии II линии. Во всей группе частота достижения ОО на терапию II линии была выше у пациентов без «bulky» (77,6% против 46,6% при ее отсутствии), однако разница не была статистически значимой (p>0,05). При анализе влияния «bulky» на исход терапии II линии раздельно в группах ЛХ и НХЛ было установлено, что в группе НХЛ частота достижения ОО статистически значимо выше у пациентов без «bulky» по сравнению с больными с «bulky» на момент установления диагноза лимфомы (p<0,05). ОО на терапию у пациентов с ЛХ и НХЛ с наличием большой опухолевой массы и без нее представлен на рис. 4.
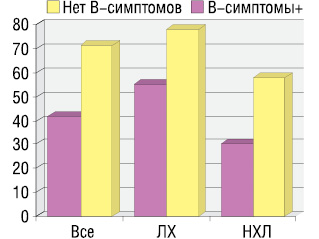
Анализ ответа на терапию в зависимости от наличия В-симптомов лимфомы на момент установления диагноза показал, что частота достижения ОО статистически значимо выше в группе пациентов без В-симптомов по сравнению с теми пациентами, у которых при диагностике лимфомы были выявлены В-симптомы: 71 и 42% соответственно (p<0,05). Общий ответ на терапию у пациентов с ЛХ и НХЛ в зависимости от наличия В-симптомов представлен на рис. 5.
Анализ ответа на терапию II линии в зависимости от стадии лимфомы на момент установления диагноза не показал статистически значимых отличий при I/II стадии по сравнению с III/IV стадией в целом в группе и при ЛХ и НХЛ отдельно (p>0,05).
Анализ токсичности проводимой терапии свидетельствует, что независимо от схемы сальвадж-терапии доминирующей была гематологическая токсичность. Оценивали токсичность терапии средней и тяжелой степени. Гематологическая токсичность III/IV степени развилась в 60–83% случаев (при терапии по схеме DHAP, GVP, MINE – в 63; 60 и 83% соответственно) и была представлена преимущественно нейтропенией (рис. 6). Анемия III/IV на фоне терапии была диагностирована у 5 пациентов (7,8%), тромбоцитопения III/IV — у 4 больных (6,25%).
Среди других токсических проявлений терапии зарегистрирована гастроинтестинальная токсичность III/IV степени (тошнота, рвота) у 8 пациентов (12,5%) и неврологическая в виде головокружение III/IV степени — у 2 пациентов (3,1%), нарушение моторики — у 2 пациентов (3,1%). Все проявления токсичности купированы с помощью соответствующей симптоматической терапии и не привели к прекращению плана лечения.
Выводы
Лечение рецидивов и первично-рефрактерных форм ЛХ и НХЛ по схемам II линии DHAP, GVP, MINE имеет высокую эффективность. ОО на терапию в группе лимфом достигает 62,5%.
Частота достижения ОО статистически значимо выше при ЛХ по сравнению с НХЛ (p<0,05).
Частота достижения ОО статистически значимо выше при позднем рецидиве по сравнению с ранним рецидивом во всей исследуемой группе (78,5 и 47,6% соответственно, p<0,05) и отдельно в группе НХЛ (83,4 и 30% соответственно, p<0,05).
Частота достижения ОО в группе пациентов с ПРТ лимфом была сопоставимой с относительно более благоприятной группой пациентов с поздним рецидивом. Отдельно в группе ЛХ была тенденция к лучшему ответу на терапию при ПРТ по сравнению с группой пациентов с поздним рецидивом — ОО составил 90 и 75% соответственно (p>0,05).
Эффективность терапии II линии зависела от проводимого ранее лечения и была ниже у больных с наличием одного или более факторов «неадекватного подхода к диагностике и терапии».
У пациентов с НХЛ без большой опухолевой массы при диагностике лимфомы частота достижения ОО статистически значимо выше в сравнении с пациентами, имевшими большую опухолевую массу: 80 и 35% соответственно (p<0,05).
При отсутствии В-симптомов на момент диагностики лимфомы ответ на терапию был достоверно выше по сравнению с группой пациентов с В-симптомами, с частотой достижения ОО 71 и 42% соответственно (p<0,05).
Заключение
У пациентов с неблагоприятным течением лимфом проведение лечения по схемам ПХТ II линии позволяет достичь высокой частоты ответа. Очень важно своевременно прекратить проведение терапии I линии при регистрации первичной рефрактерности или прогрессии заболевания ввиду ее неэффективности. При диагностике рецидива проведение ПХТ по ранее применяемым схемам или их «усиление» или «модификация» путем повышения дозы цитостатических препаратов или назначения дополнительных не позволяет достичь высокой частоты длительной безрецидивной выживаемости.
Проведение ВДХТ пациентам при рецидивах и ПРТ ЛХ и НХЛ является терапией выбора. Однако при невозможности ее выполнения стандартная терапия по схемам II линии позволяет достичь высокой частоты ответа, значительно превышающей эффективность индукционных схем.
Токсичность проводимой терапии приемлема. Собственный опыт показал, что проведение сальвадж-терапии возможно в условиях обычного стационара при соблюдении правил и принципов сопроводительной терапии.
При диагностике рецидива или ПРТ лимфомы необходимо проведение повторной биопсии опухоли. Важным является выполнение адекватного стадирования, назначение риск-адаптированной терапии I линии, оценка эффективности лечения на промежуточных этапах. При диагностировании ПРТ пациенты должны быть незамедлительно переведены на терапию по сальвадж-схемам.
литература
- 1. Караманешт Е.Е., Крячок И.А. (2009) Место гемцитабина в комплексной терапии рецидивов и первично-рефрактерных форм агрессивных неходжкинских лимфом и лимфомы Ходжкина. Український журнал гематології та трансфузіології, 6(9): 5–13.
- 2. Крячок И.А., Караманешт Е.Е., Кущевой Е.Е., и др. (2010) Опыт применения химиотерапии второй линии в лечении лимфом. Онкология, 12(1): 61–65.
- 3. Brusamolino E., Orlandi E., Canevari A. et al. (1994) Results of CAV regimen (CCNU, melphalan, and VP-16) as third-line salvage therapy for Hodgkin’s disease. Ann. Oncol., 5: 427–432.
- 4. Colwill R., Crump M., Couture F. et al. (1995) Mini-BEAM as salvage therapy for relapsed or refractory Hodgkin’s disease before intensive therapy and autologous bone marrow transplantation. J. Clin. Oncol., 3: 396–402.
- 5. Dreger P., Marquardt P., Haferlach T. et al. (1993) Effective mobilisation of peripheral blood progenitor cells with ‘Dexa-BEAM’ and G-CSF: timing of harvesting and composition of the leukapheresis product. Br. J. Cancer, 68: 950–957.
- 6. Josting A., Rudolph C., Reiser M. et al. (2002) Time-intensified dexamethasone/cis-platin/cytarabine: an effective salvage therapy with low tox-icity in patients with relapsed and refractory Hodgkin‘s disease. Ann. Oncol., 13:1628–1635.
- 7. Kewalramani T., Zelenetz A., Bertino J. et al. (2001) Rituximab significantly increases the complete response rate in patients with relapsed or primary refractory DLBCL receiving ICE as second-line therapy (SLT). American Society of Hematology, 2: 24–26.
- 8. Kuruvilla J. (2009) Standard therapy of advanced Hodgkin lymphoma. Hematology. Am. Soc. Hematol. Educ. Program, р. 497–506.
- 9. Longo L., Duffey P., Young R. et al. (1992) Conventional-dose salvage combination chemotherapy in patients relapsing with Hodgkin’s disease after combination chemotherapy: the low probability for cure. J. Clin. Oncol., 10: 210–218.
- 10. Ljungman P., Urbano-Ispizua A., Cavazzana-Calvo M. et al. (2006) Allogeneic and autologous transplantation for haematological diseases, solid tumours and immune disorders: definitions and current practice in Europe. Bone Marrow Transplantation, р. 439–449.
- 11. Mayer J., Vasova I., Koristek Z. et al. (2001) Ifosfamide- and etoposide-based chemotherapy as salvage and mobilizing regimens for poor prognosis lymphoma. Eur. J. Haematol. Suppl., 64: 21–27.
- 12. Moskowitz C., Bertino J., Glassman J. et al. (1999) Ifosfamide, carboplatin, and etoposide: a highly effective cytoreduction and peripheral-blood progenitor-cell mobilization regimen for transplant-eligible patients with non-Hodgkin’s lymphoma. J. Clin. Oncol., 17: 3776–3785.
- 13. Moskowitz C., Kewalramani T., Nimer S. et al. (2004) Effectiveness of high dose chemoradiotherapy and autologous stem cell transplantation for patients with biopsy-proven primary refractory Hodgkin’s disease. Br. J. Haematol., 124(5): 645–652.
- 14. Moskowitz C., Nimer S., Zelenetz A. et al. (2001) A 2-step comprehensive high-dose chemoradiotherapy second-line program for relapsed and refractory Hodgkin disease: analysis by intent to treat and development of a prognostic model. Blood, 97: 616–623.
- 15. Pavone V., Gaudio F., Guarini A. et al. (2002) Mobilization of peripheral blood stem cells with high-dose cyclophosphamide or the DHAP regimen plus G-CSF in non-Hodgkin’s lymphoma. Bone Marrow Transplant., 29: 285–290.
- 16. Pfreundschuh M., Rueffer U., Lathan B. et al. (1994) Dexa-BEAM in patients with Hodgkin’s disease refractory to multidrug chemothera¬py regimens: a trial of the German Hodgkin’s Disease Study Group. J. Clin. Oncol., 12: 580–586.
- 17. Rodriguez J., Rodriguez M., Fayad L. et al. (1999) ASHAP: a regimen for cytoreduction of refractory or recurrent Hodgkin’s disease. Blood, 93: 3632–3636.
- 18. Romer W., Hanauske A., Ziegler S. et al. (1998) Positron emission tomography in non-Hodgkin’s lymphoma: Assessment of chemotherapy with fluorodeoxyglucose. Blood, 91: 4464–4471.
- 19. Watts M., Ings S., Leverett D. et al. (2000) ESHAP and G-CSF is a superior blood stem cell mobilizing regimen compared to cyclophosphamide 1.5 g/m2 and G-CSF for pre-treated lymphoma patients: a matched pairs analysis of 78 patients. Br. J. Cancer., 82: 278–282.














Leave a comment