Комбінація хіміотерапії і таргетної терапії у хворих на рак яєчника, резистентний до препаратів платини: клінічний випадок
Кузнецова О.В.1, Марцинківська Н.В.2, А.І. Рибін1, Чеботарьова Г.М.1
Резюме. Незважаючи на існуючий стандарт хіміотерапії 1-ї лінії, результати лікування хворих на рак яєчника (РЯ) залишаються незадовільними. Виживаність без прогресування становить в середньому 16–23 міс, а загальна виживаність — 31–65 міс. Схему хіміотерапії 2-ї лінії підбирає лікар індивідуально, спираючись на чинні рекомендації, а також ураховуючи побажання і матеріальні можливості пацієнтки. Великий прогрес у лікуванні платино-резистентного РЯ намітився в останні роки завдяки дослідженням комбінації хіміотерапії та таргетної терапії. Таким чином, у веденні пацієнток із платино-резистентним РЯ слід дотримуватися персоналізованого підходу до вибору методу спеціального лікування. Комбінація хіміотерапії (паклітаксел + циклофосфамід) і таргетної терапії (бевацизумаб) має високу ефективність і переносимість, виживаність без прогресування становить понад 12 міс.

Рак яєчника (РЯ) займає 7-ме місце у структурі загальної онкологічної захворюваності та 4-те — серед причин смерті від злоякісних захворювань у жінок у світі. Щорічно реєструють 200 000 нових випадків РЯ, 125 000 жінок помирають внаслідок цього онкологічного захворювання. За останні 10 років стандартом лікування пацієнток із поширеним РЯ є адекватне хірургічне втручання в обсязі оптимальної циторедукції та курси поліхіміотерапії на основі препаратів платини [1]. Результати метааналізу багатьох рандомізованих досліджень показали, що загальна та безрецидивна виживаність хворих на РЯ підвищується, якщо лікування починається з похідних платини, на відміну від хіміотерапії іншими цитостатичними препаратами [3].
Активний пошук ефективних препаратів 1-ї лінії хіміотерапії продовжується у різних напрямах: вивчення трикомпонентних комбінацій, створення нових схем і модифікацій режимів на основі існуючих стандартів, вивчення режимів та способів введення цитостатиків, які передбачають послідовне введення препаратів, застосування ендоабдомінальної хіміотерапії, вивчення нових цитостатиків з таргетною дією [2]. Спроба підвищити ефективність золотого стандарту двокомпонентної хіміотерапії на основі препаратів платини шляхом додавання третього цитостатика (циклофосфамід, гемцитабін, топотекан, епірубіцин, іринотекан) не увінчалася успіхом як з погляду підвищення загальної та безрецидивної виживаності, так і статистично підтвердженого підвищення токсичності, у першу чергу нефрологічної та кардіологічної [3–5]. Складається враження, що за допомогою вказаних цитостатиків (паклітаксел, карбоплатин, цисплатин та ін.) досягнуто межі сучасних можливостей поліхіміотерапії в лікуванні хворих із розповсюдженим РЯ. Тому необхідні нові режими вводу цитостатиків або нові препарати з фармацевтичною дією на інші мішені пухлинних клітин [2]. Згідно з отриманими результатами одного з рандомізованих досліджень великі надії щодо підвищення ефективності поліхіміотерапії розповсюдженого РЯ покладаються на щотижневий режим введення паклітакселу на фоні застосування карбоплатину кожні 3 тиж [6].
Незважаючи на існуючий стандарт хіміотерапії 1-ї лінії «паклітаксел + карбоплатин», результати лікування хворих на РЯ залишаються незадовільними. Виживаність без прогресування становить у середньому 16–23 міс, а загальна виживаність — 31–65 міс. Таким чином, від 65 до 70% хворих на РЯ потребують терапії 2-ї лінії.
При проведенні хіміотерапії 2-ї лінії існує також певний стандарт призначення протипухинних препаратів. При платиночутливому рецидиві захворювання (бесплатиновий інтервал перевищує 6 міс) показано призначення комбінації похідного платини (цисплатин або карбоплатин) у поєднанні з іншим протипухлинним препаратом, раніше не застосовуваним для лікування хворої. При тривалості бесплатинового періоду більше 12 міс можливе повторне призначення комбінації похідного платини і таксанів для лікування рецидиву. У разі бесплатинового інтервалу 6–12 міс можлива монохіміотерапія неплатиновим препаратом, але це передбачає призначення похідного платини в подальшому при виникненні другого рецидиву. Якщо бесплатиновий період триває менше 6 міс (платино-резистентий рецидив) або наявне прогресування пухлинного процесу під час проведення хіміотерапії 1-ї лінії чи відразу після її завершення (платино-рефрактерний рецидив), показана монохіміотерапія неплатиновим препаратом або симптоматична терапія [7].
Таким чином, на сьогодні немає єдиного алгоритму ведення пацієнток із платино-резистентним РЯ. Схему хіміотерапії 2-ї лінії підбирає лікар індивідуально, спираючись на чинні рекомендації та враховуючи побажання і матеріальні можливості пацієнтки. Це зумовлено тим, що ефективність поліхіміотерапії рецидиву РЯ залежить від багатьох факторів: не лише від стадії та агресивності пухлинного процесу, об’єму хірургічного втручання, а й від класу протипухлинного препарату або включення в схему лікування таргетної терапії [2]. Тому у веденні пацієнток із платино-резистентним РЯ слід дотримуватися персоналізованого підходу до вибору методу спеціального лікування.
Великий прогрес у лікуванні платино-резистентного РЯ намітився в останні роки завдяки дослідженням комбінації хіміотерапії та таргетної терапії. Одним з таких препаратів є бевацизумаб. Авастин® (бевацизумаб) є широко відомим і давно застосовуваним препаратом для лікування хворих на метастатичний колоректальний рак у комбінації з хіміотерапією на основі похідних фторпіримідину; хворих на метастатичний рак грудної залози як 1-ша лінія терапії в комбінації з паклітакселом та 1-ша лінія терапії в комбінації з капецитабіном (коли лікування іншими схемами, включаючи таксани або антрацикліни, вважається недоречним); хворих на розповсюджений нерезектабельний, метастатичний чи рецидивуючий недрібноклітинний рак легені; хворих на розповсюджений та/чи метастатичний нирково-клітинний рак як 1-ша лінія терапії.
Авастин також добре зарекомендував себе в лікуванні пацієнтів із вторинними пухлинами головного мозку та хворих на розповсюджений епітеліальний РЯ, рак фаллопієвої труби і первинний рак очеревини як 1-ша лінія терапії у комбінації з карбоплатином і паклітакселом, а також для лікування пацієнтів із першим рецидивом епітеліального РЯ, раком фаллопієвої труби і первинним раком очеревини, чутливим до терапії препаратами платини у комбінації з карбоплатином і гемцитабіном, які не отримували попередньої терапії бевацизумабом або іншими інгібіторами фактора росту ендотелію судин (vascular endothelial growth factor — VEGF).
Бевацизумаб являє собою моноклональне антитіло з антиангіогенною дією, основним ефектом якого є блокування VEGF — ключового фактора утворення і розвитку судин, і пригнічує зв’язування VEGF з його рецепторами Flt-1 (VEGFR-1) і KDR (VEGFR-2) на поверхні ендотеліальних клітин. Клітини епітеліального РЯ досить часто експресують VEGF [8]. Ангіогенез безпосередньо пов’язаний з гематогенним метастазуванням солідних пухлин, а значить, швидким прогресуванням захворювання. Таким чином, цілком зрозумілим здається додавання до хіміотерапії таргетного агента з антиангіогенною дією. Нейтралізація біологічної активності VEGF призводить до зниження васкуляризації пухлин, нормалізує не уражені пухлиною судини, пригнічує утворення нових судин у пухлині, таким чином пригнічуючи ріст пухлини. Зниження експресії VEGF асоційоване з редукцією васкуляризації первинної пухлини та ангіогенезу, включенням апоптозу в пухлинних клітинах, а отже, від цього ефекту безпосередньо залежить підвищення загальної виживаності хворих.
З 2006 по 2009 р. було проведено 2 великі багатоцентрові рандомізовані дослідження GOG-0218 і ICON7 з вивчення додавання бевацизумабу до стандартної хіміотерапії 1-ї лінії «паклітаксел + карбоплатин» в лікуванні хворих на РЯ. Результати цих досліджень вказують, у першу чергу, на високу частоту об’єктивної відповіді (частота повних та часткових ремісій становила 67% і була вищою на 17% в групі хворих, що отримують бевацизумаб на тлі хіміотерапії). Додавання бевацизумабу суттєво не впливало на якість життя хворих і добре переносилося.
GOG-0218 — рандомізоване подвійне сліпе багатоцентрове дослідження додавання бевацизумабу до стандартної хіміотерапії 1-ї лінії хворих на РЯ. Первинна точка ефективності дослідження GOG-0218 — виживаність без прогресування, що становила в групі хворих, які отримували хіміотерапію, 10,3 міс, у групі хворих, у яких застосовували хіміотерапію та бевацизумаб, — 14,1 міс. Додаткова точка ефективності дослідження GOG-0218 — це загальна виживаність хворих на розповсюджений РЯ (IV стадія): в групі хворих, що отримували лише хіміотерапію, цей показник становив 32,8 міс, в групі пацієнтів, які одержували хіміотерапію та бевацизумаб, — 40,6 міс.
ICОN7/AG0-0VAR 11 — рандомізоване відкрите багатоцентрове дослідження додавання бевацизумабу до стандартної хіміотерапії 1-ї лінії хворих на РЯ. Первинною точкою ефективності дослідження ICОN7 була виживаність без прогресування, що становила в групі хворих, у яких проводили хіміотерапію, 10,5 міс, у групі пацієнтів, що отримували хіміотерапію та бевацизумаб, — 16 міс. Додаткова точка ефективності дослідження ICОN7 — загальна виживаність хворих на розповсюджений РЯ (IV стадія): у групі хворих, які одержували лише хіміотерапію, цей показник становив 30,3 міс, а в групі пацієнтів, у яких застосовували хіміотерапію та бевацизумаб, — 39 міс.
OCEANS — ще одне масштабне рандомізоване дослідження з вивчення ефективності комбінації хіміотерапії та таргетної терапії у хворих на РЯ, чутливий до препаратів платини, результати якого опубліковано в квітні 2012 р. у «Journal of Clinical Oncology». Згідно з отриманими даними загальна відповідь (частота повних та часткових ремісій) у групі хворих, які одержували курси поліхіміотерапії за схемою GemC (гемцитабін + карбоплатин) на тлі бевацизумабу, становила 78,5% порівняно з 57,4% у групі хворих, у яких застосовували хіміотерапію без бевацизумабу. Експериментальний аналіз бесплатинового інтервалу показав, що бевацизумаб збільшує медіану бесплатинового періоду після останнього введення карбоплатину з підвищенням цього показника до 24 міс. Ці результати підтверджують позитивне співвідношення показника користь/ризик у разі використання схеми GemC + бевацизумаб для лікування рецидивуючого РЯ, чутливого до препаратів платини. Первинна точка ефективності дослідження OCEANS — також виживаність без прогресування, що становила в групі хворих, яким призначали лише хіміотерапію, 8,4 міс, а в групі пацієнтів, що отримували хіміотерапію та бевацизумаб, — 12,4 міс.
AURELIA — перше рандомізоване дослідження III фази з вивчення РЯ, резистентного до препаратів платини, результати якого опубліковано 1 травня 2014 р. у «Journal of Clinical Oncology». Дослідження AURELIA продемонструвало, по-перше, перевагу таргетної терапії (бевацизумаб), а по-друге, — перевагу призначення комбінованої терапії (хіміотерапії з таргетною терапією) порівняно з монохіміотерапією. На підставі отриманих результатів AURELIA доведено, що бевацизумаб у комбінації з хіміотерапією є новою стратегією лікування хворих на РЯ, резистентний до препаратів платини. Крім того, останній метааналіз результатів AURELIA засвідчив, що немає статистично значущої різниці у застосуванні бевацизумабу у високих і низьких дозах, вказуючи також на відсутність зв’язку між частотою виникнення побічних ефектів і призначеною дозою бевацизумабу [9].
Проаналізовані нами результати масштабних рандомізованих досліджень з вивчення проблем лікування хворих на РЯ — ICON7, GOG-0218, AURELIA, OCEANS підтвердили також, що підбір пацієнток групи таргетної терапії має бути персоналізованим. Індивідуалізований підхід до вибору методу лікування є одним з нових напрямів у терапії низки онкологічних захворювань. Він заснований не на загальноприйнятих даних про найвищу ефективність і безпеку тієї чи іншої схеми хіміотерапії чи сучасної таргетної терапії, а залежить насамперед від індивідуальних генетичних особливостей пацієнта. Персоналізована медицина обіцяє суттєво підвищити в найближчі десятиліття якість і тривалість життя пацієнтів онкологічного профілю.
В останні роки у світі накопичено певний досвід у вивченні підтримувальної терапії розповсюдженого РЯ, яку застосовують після досягнення максимального клінічного результату, а саме — повної регресії пухлини. Підтримувальною називають таку терапію, яку проводять впродовж тривалого часу після закінчення основного виду спеціального лікування. Вона може включати монохіміотерапію, імунотерапію, гормонотерапію чи таргетну терапію. Можливо, застосування бевацизумабу як підтримувальної терапії включать у майбутньому в стандарт лікування пацієнток із РЯ, резистентним до похідних платини.
На підставі проведеного аналізу даних літератури та результатів багатьох рандомізованих досліджень, присвячених лікуванню хворих на платино-резистентний РЯ, ми зробили вибірку хворих, що отримували лікування в Одеському обласному онкологічному диспансері. Найбільш вражаючий клінічний випадок представлено в цій статті.
Пацієнтка Л., 1966 р.н., перебуває під спостереженням та на лікуванні в Одеському обласному онкологічному диспансері з червня 2010 р. по теперішній час з діагнозом: Cr ovariorum стадія ІІІС рT3сN0M0, стан після оптимальної циторедуктивної операції, поліхіміотерапії (X.2010), метастази в печінці (з IV.2013, продовжений ріст з VII.2013), стан після операції (IV.2013), хіміотерапії, таргетної терапії. Клінічна група II. Кіста правої частки печінки. Доліхосигма. Стеноз антрального відділу шлунка.
31.05.10 р. у гінекологічному відділенні міської клінічної лікарні № 9 пацієнтці було проведено операцію — діагностичну лапароскопію, нижньосерединну лапаротомію, екстирпацію матки з придатками за Вертгеймом, екстирпацію великого сальника, ревізію органів черевної порожнини (патогістологічне дослідження № 12612-48 від 31.05.10 р.: G3 цистаденокарцинома яєчника, що проростає в товщу кісти і лівої маткової труби з метастазами в 3 із 5 виявлених лімфатичних вузлів тазової клітковини зліва). Імуногістохімічне дослідження № 3318 від 09.06.10 р.: G3 ендометріальна аденокарцинома з ознаками серозної та ендометріоїдних аденокарцином, з позитивним статусом гормонорецепторів прогестерону і наявністю клітин, що містять ген р53. З 23.06.10 р. по 11.10.10 р. хворій було проведено 6 курсів хіміотерапії за схемою ТР (доцетаксел + карбоплатин). Протягом 28 міс після закінчення спеціального лікування у пацієнтки відзначали стабілізацію процесу. 23.03.13 р., за даними клініко-інструментального обстеження, виявлено прогресування захворювання з ураженням печінки (рис. 1, 2).
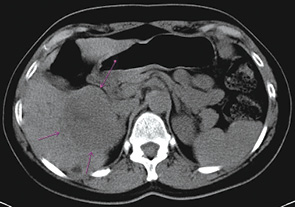
Рис. 1. Дослідження від 23.03.2013 р.
(без контрасту)
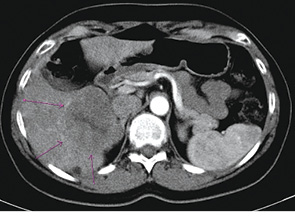
Рис. 2. Дослідження від 23.03.2013 р.
(з контрастом)
03.04.13 р. у відділенні хірургії з інвазивними методами діагностики і лікування університетської клініки Одеського національного медичного університету пацієнтці була виконана операція — атипова резекція V–VIII сегментів печінки з пухлиною (патогістологічне дослідження № 6491-92 від 11.04.13 р.: ділянки G3 папілярної аденокарциноми з великими некрозами). З 19.04.13 р. по 14.06.13 р. хвора одержала 3 курси поліхіміотерапії за схемою ТР (доцетаксел + карбоплатин). Після проведеного лікування відмічали прогресування пухлинного процесу в печінці (рис. 3, 4).
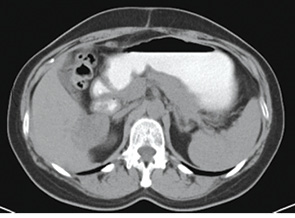
Рис. 3. Дослідження від 09.07.2013 р.
(без контрасту)
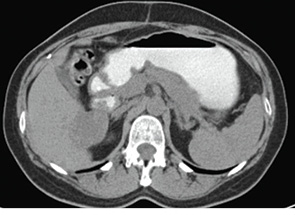
Рис. 4. Дослідження від 09.07.2013 р.
(з контрастом)
Пацієнтку проінформовано про медичне втручання, отримано інформовану згоду на продовження спеціального лікування, а саме — проведення курсів поліхіміотерапії та таргетної терапії згідно із запропонованою лікарем схемою. З 15.07.13 р. по 31.10.13 р. пацієнтці проведено 6 курсів хіміотерапії за схемою ТС (паклітаксел 280 мг внутрішньовенно крапельно в 1-й день, циклофосфамід 150 мг перорально щоденно № 14) на тлі таргетної терапії бевацизумабом 400 мг внутрішньовенно крапельно в 0-й день (рис. 5). Згідно з результатами AURELIA, що довели відсутність статистично значущої різниці у призначенні високих і низьких доз бевацизумабу [9], а також враховуючи матеріальні можливості пацієнтки, застосовували бевацизумаб у дозі 7,5 мг/кг.
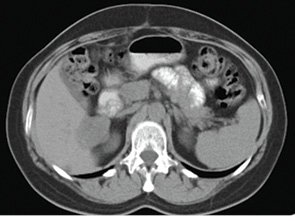
Рис. 5. Дослідження від 02.10.2013 р.
(без контрасту)
З 18.11.13 р. і до цього часу пацієнтка продовжує підтримувальну таргетну терапію — бевацизумаб 400 мг внутрішньовенно крапельно кожен 21 день. Таким чином, після досягнення максимального клінічного ефекту та закінчення спеціального лікування у хворої протягом 12 міс відзначається стійка стабілізація процесу (рис. 6–10).
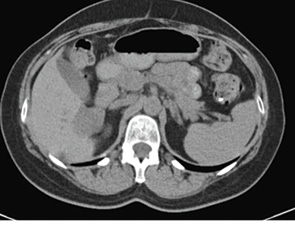
Рис. 6. Дослідження від 22.12.2013 р.
(без контрасту)

Рис. 7. Дослідження від 26.02.2014 р.
(без контрасту)
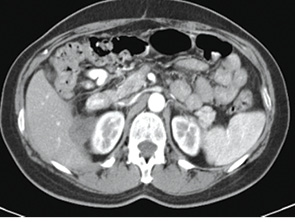
Рис. 8. Дослідження від 26.02.2014 р.
(з контрастом)

Рис. 9. Дослідження від 26.08.2014 р.
(без контрасту)
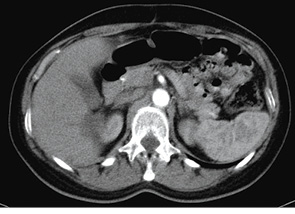
Рис. 10. Дослідження від 26.08.2014 р.
(з контрастом)
Наразі за результатами повного клініко-інструментального обстеження (магнітно-резонансна томографія органів малого таза, комп’ютерна томографія органів черевної порожнини та грудної порожнини, СА-125) і огляду гінеколога даних про прогресування основного захворювання немає. Протягом всього періоду проведення таргетної терапії, який становить до сьогодні 15 міс, у пацієнтки не зареєстровано жодного негативного прояву, безпосередньо пов’язаного із введенням бевацизумабу, таких як гіпертензія, кровотеча та ін.
На підставі проведеного аналізу результатів інструментального дослідження протягом року від початку таргетної терапії можна зробити висновок, що у пацієнтки розвинулася часткова регресія, а саме — регресія розмірів пухлини на 39% (рис. 11).
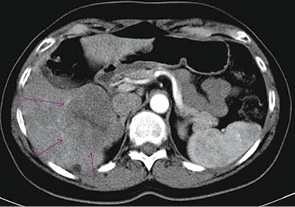
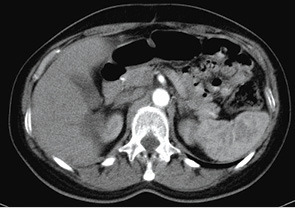
Рис. 11. Динаміка процесу з 23.03.2013 р. по 26.08.2014 р.
На прикладі розглянутого клінічного випадку ми підтвердили такі клінічні дані:
- при додаванні бевацизумабу в схему лікування хворої на платино-резистентний РЯ виживаність до прогресування становить понад 12 міс;
- комбінація хіміотерапії (паклітаксел + циклофосфамід) та таргетної терапії (бевацизумаб) має високу ефективність і задовільну переносимість, не погіршує якості життя пацієнток.
Таким чином, РЯ розглядають як хронічне, часто рецидивуюче захворювання. Спеціальне лікування, що дозволяє, з одного боку, підвищити безрецидивну виживаність, а з іншого — не супроводжується призначенням токсичної хіміотерапії, має обов’язково входити в стандарти, бути розглянутим лікарем-онкологом і запропонованим пацієнтці з урахуванням її індивідуальних особливостей.
Список використаної літератури
1. Perren T.J., Swart A-M., Pfisturer J. et al. (2014) A Phase III Trial of Bevacizumab in Ovarian cancer. New Engl. J. Med.: 2484–2495.
2. Свінціцький В.С. (2013) Хіміотерапія хворих зі злоякісними пухлинами яєчника. Клин. онкол., №3 (11): 73–76.
3. Bookman M.A., Brady M.F., McGuire W.P. et al. (2009) Evaluation of new platinum-based treatment regimens in advanced-stage ovarian cancer: a Phase III trial of the Gynecologic cancer intergroup. J. Clin. Oncol., 27: 1419–1425.
4. du Bois A., Weber B., Rochon J. et al. (2006) Addition of epirubicin as a third drug to carboplatin-paclitaxel in first-line treatment of advanced ovarian cancer: a prospectively randomized Gynecologic cancer intergroup trial by the Arbeitsgemeinschaft Gynaekologische Onkologie Ovarian cancer study group and the Group d’Investigateurs Nationaux pour l’Etude des cancers ovariens. J. Clin. Oncol., 24: 1127–1135.
5. Pfisterer J., Weber B., Reuss A., et al. (2006) Randomized phase III trial of topotecan following carboplatin and paclitaxel in first-line treatment of advanced ovarian cancer: a gynecologic cancer intergroup trial of the AGO-OVAR and GINECO. J. Nat. Cancer Inst., 98: 1036–1045.
6. Katsumata N., Yasuda M., Takahashi F. et al. (2009) Dose-dense paclitaxel once a week in combination with caqrboplatin every 3 weeks for advanced ovarian cancer: a phase III, open-label, randomized controlled trial. Lancet, 374: 1331–1338.
7. Практические рекомендации по лекарственному лечению злокачественных опухолей (RUSSCO) (2013) Под ред.: В.М. Моисеенко. М.: Общество онкологов-химиотерапевтов: 121–122.
8. Yoneda J., Kuniyasu H., Crispens M.A. et al. (1998) Expression of angiogenesis-related genes and progression of human ovarian carcinomas in nude mice. J. Nat. Сancer Inst., 90: 447–454.
9. Pujade-Lauraine E., Hilpert F., Weber B. et al. (2014) Bevacizumab combined with chemotherapy for platinum-resistent reccurent ovarian cancer: The AURELIA open-label randomized phase III trial. J. Clin. Oncol., 82: 1302–1308.
Комбинация химиотерапии и таргетной терапии у больных раком яичника, резистентным к препаратам платины: клинический случай
Одесский областной онкологический диспансер
Одесский национальный медицинский университет
Резюме. Несмотря на существующий стандарт химиотерапии 1-й линии, результаты лечения больных раком яичника (РЯ) остаются неудовлетворительными. Выживаемость без прогрессирования составляет в среднем 16–23 мес, а общая выживаемость — 31–65 мес. Схему химиотерапии 2-й линии подбирает лечащий врач индивидуально, опираясь на действующие рекомендации, а также учитывая пожелания и материальные возможности пациентки. Большой прогресс в лечении платино-резистентного РЯ наметился в последние годы благодаря исследованию комбинации химиотерапии и таргетной терапии. Таким образом, в ведении пациенток с платино-резистентным РЯ следует говорить о персонализированном подходе к выбору метода специального лечения. Комбинация химиотерапии (паклитаксел + циклофосфамид) и таргетной терапии (бевацизумаб) обладает высокой эффективностью и хорошей переносимостью, выживаемость без прогрессирования составляет более 12 мес.
химиотерапия, таргетная терапия, комбинация, платино-резистентный рак яичника, бевацизумаб.
Адреса:
Кузнецова Ольга Володимирівна
65026, Одеса, Валіховський пров., 2
Одеський національний медичний університет
Тел.: (067) 302-52-28
E-mail: ol-ka-80@mail.ru














Leave a comment