«Колоректальний скринінг» як консенсусне вирішення проблеми місцево-поширеного раку товстої та прямої кишки в Україні. Дискусії і питання
Михайлович Ю.И., Звірич В.В., Колеснік О.О.
Резюме. У структурі онкологічної захворюваності та смертності колоректальний рак продовжує утримувати одну з лідируючих позицій в Україні. Високий темп приросту захворюваності на колоректальний рак, істотні зрушення у віковому складі пацієнтів за рахунок переважання осіб старше 60 років, помітне збільшення числа хворих із різними ускладненнями та поширенням пухлинного процесу, особливо молодого віку, високі цифри післяопераційних ускладнень і летальності, невисокі показники загального та безрецидивного виживання свідчать про необхідність нагального вирішення цього питання. В Україні вже давно назріла медико-соціальна потреба у запровадженні програми популяційного скринінгу колоректального раку. У роботі проаналізовано фінансові аспекти, що стосуються вартості хіміопроменевого лікування місцево-поширеного колоректального раку порівняно з витратами на скринінг. Акценти у стратегії сучасної діагностики та лікування раку товстого кишечнику зроблено на доказову базу NCCN та PubMed.

Останні десятиліття характеризуються значним підвищенням соціальних стандартів життя загалом у світі та розширенням доступу для різних верств населення до належної медичної допомоги з адекватною системою її надання. Це, безумовно, поліпшило діагностику та лікування, покращило якість життя, особливо в онкологічній галузі охорони здоров’я. Заходи, що запроваджені міжнародною онкологічною спільнотою, вплинули на збільшення середньої тривалості життя онкологічного хворого у більшості регіонів світу. Однак у глобальному масштабі протягом останніх 40 років рівень смертності від злоякісних новоутворень (ЗН) зріс майже на 40%. За прогнозними оцінками, у найближчі 15 років очікується подальше 60% збільшення, причому від раку загинуть у 2030 р. майже 13 млн людей [1].
Показник смертності від ЗН у світовому масштабі також змінився у більш-менш позивному напрямі. Перше за все, це пояснюється змінами у стадійності захворюваності — її зниженням, що безпосередньо пов’язане з удосконаленням методів хірургічного та терапевтичного — хіміопроменевого лікування, а також із запровадженням і тривалим проведенням цільових програм скринінгу [1–3].
Незважаючи та вищезазначені медико-соціальні заходи, світова статистика розвинених країн свідчить про неухильне зростання кількості вперше виявлених випадків раку саме товстої і прямої кишки порівняно зі ЗН будь-якої іншої локалізації. І тому показники безрецидивного та загального виживання хворих на колоректальний рак (КРР) не зазнали суттєвих змін [4, 5].
У світі КРР залишається найбільш поширеною нозологічною формою ЗН, частота якої має тенденцію до швидкого підвищення. Загалом у структурі злоякісних пухлин шлунково-кишкового тракту КРР у поєднанні обох ста́тей знаходиться на третьому місці за частотою захворюваності та становить 9,7% всіх видів раку та на другому — за рівнем смертності — 8,5% усіх смертей від раку [4–6].
За проведеними у 2012 р. оцінками Міжнародного агентства з дослідження раку (International Agency for Research on Cancer — IACR), захворюваність та смертність від КРР чоловіків та жінок у країнах Європи становить 60,3 на 100 тис. населення (0/00000) (грубий показник), або 29,50/00000 (стандартизований показник), та 29,00/00000 і 12,50/00000 відповідно [1].
За персоніфікованими даними 2015–2016 рр. Національного канцер-реєстру України (НКРУ), захворюваність та смертність від КРР у 2015 р. для обох ста́тей склала 47,80/00000 і 26,60/00000 (грубий показник) та/або 26,2 і 13,70/00000 (стандартизований показник) відповідно. Щорічно виявляють 15–17 тис. нових випадків КРР. Для підтвердження, що наразі КРР в Україні є соціально значимим онкологічним захворюванням, ми порівнювали вищенаведені епідеміологічні показники з показниками ЗН легень, оскільки захворюваність на КРР на сьогодні займає перше рангове місце за рівнем приросту (рис. 1, 2) [7].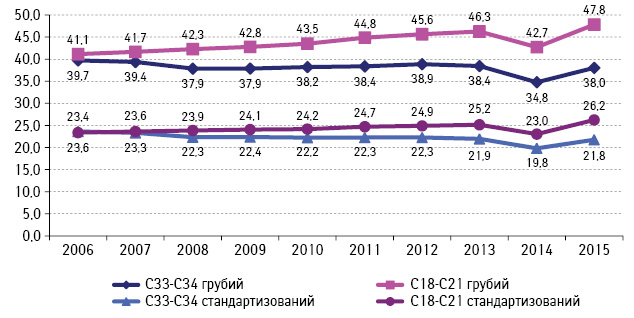
Рис. 1. Захворюваність на КРР порівняно зі ЗН легень, Україна (показник на 100 тис. населення)
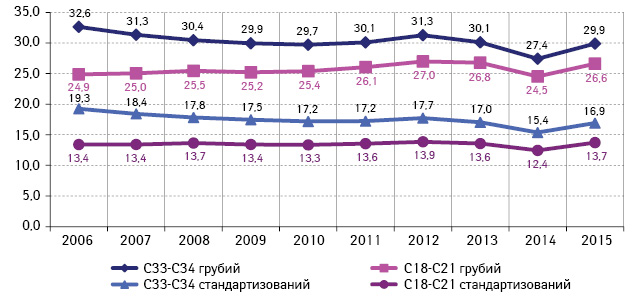
Рис. 2. Смертність від КРР порівняно зі ЗН легень, Україна (показник на 100 тис. населення)
За останні роки суттєво не змінився відсоток виявлення хворих на КРР на профоглядах, що в середньому становить для раку товстої кишки (РТК) 8%, раку прямої кишки (РПК) — 18%, внаслідок чого високий показник запущених стадій — 21,%. Невтішні дані й щодо діагностики «cancer in situ». За 10 років виявлено лише 289 хворих (табл. 1).
| «Cancer in situ» | 2006 | 2007 | 2008 | 2009 | 2010 | 2011 | 2012 | 2013 | 2014 | 2015 |
| Кількість випадків | 26 | 36 | 29 | 30 | 28 | 23 | 27 | 32 | 26 | 32 |
| D01.0–D01.2, грубий на 100 тис. населення | 0,06 | 0,08 | 0,06 | 0,07 | 0,06 | 0,05 | 0,06 | 0,07 | 0,06 | 0,09 |
У той час як більше половини вперше виявлених хворих на момент встановлення діагнозу мали І–ІІ стадію (64,3%), не проживають року з числа вперше виявлених — майже третина (29,3%). Коефіцієнт смертність/захворюваність, який характеризує якість надання онкологічної допомоги, для КРР становить 58,6%. Тобто, на 100 хворих, у яких діагностовано КРР, вмирають 60,0% [7].
Серед 40 країн Європи Україна за захворюваністю та смертністю від КРР у чоловіків та жінок займає 37-ме місце. Це пояснюється насамперед тим, що середня тривалість життя популяції у нашій державі невисока: чоловіків — 63 роки, жінок — 72, а пік захворюваності припадає на вік 75–80 років [8].
У країнах Центральної та Західної Європи у 1950-х роках КРР був досить рідкісним онкологічним захворюванням. Суттєве підвищення захворюваності на КРР відзначалося після 1950 р. і подвоювалося у кожну подальшу декаду. Ризик розвитку КРР в європейській популяції протягом усього життя становить у чоловіків 6,0%, у жінок — 5,8% з тенденцією зростання в динаміці з кожним прожитим роком [9]. РТК частіше діагностують у жінок, а РПК — у чоловіків. Близько 5% хворих на РТК або РПК мають декілька злоякісних пухлин колоректальної зони одночасно [3, 10].
Тепер в країнах Євросоюзу КРР став домінуючим, на нього припадає близько 10% усіх смертей від раку, в Україні — 12,1%. Причому показники смертності у 6 разів вищі у чоловіків [7, 11].
З огляду на оцінки аналізу розвитку онкоепідеміологічного процесу останні десятиріччя у розвинених країнах Північної Америки та Центральної Європи характеризуються підвищенням захворюваності на КРР у молодих осіб. За повідомленням Центрів контролю і профілактики захворювань (Centers for Disease Control and Prevention — CDC), канцер-реєстром SEER були проаналізовані дані ретроспективного когортного дослідження поширення раку. Встановлено, що у Сполучених Штатах захворюваність на КРР у пацієнтів молодше 50 років значно зросла. Науковці підрахували, що показники захворюваності на РТК та РПК до 2030 р. підвищаться на 90,0 і 124,2% для пацієнтів віком від 20 та 39 років відповідно. Наразі причина цієї тенденції невідома [3, 4].
За оцінками IACR, серед дорослого населення віком від 20 до 39 років підвищення захворюваності на РПК почалося із середини 1970-х років. Це зростання тривало значно довший період і було інтенсивнішим, ніж підвищення захворюваності на РТК, яке почалося із середини 80-х років минулого сторіччя. При порівнянні осіб, які народилися у 1950-х роках, із народженими у 1990-х ризик захворіти на РТК для останніх — у 2 рази вищий, на РПК — у 4 [3, 12].
Для того щоб порівняти вищенаведені відомості з даними по Україні, ми використали метод, що називається періодно-когортно-віковим аналізом (age-period-cohort analysis — APCA) [13] (довірчий інтервал 95%). Оскільки загальний показник захворюваності — це поєднання середнього значення рівнів зростання та зниження захворюваності серед різних вікових груп та різних верств населення, застосування APCA дає розуміння того, в яких підгрупах спостерігається збільшення чи зменшення цих рівнів. За даними НКРУ встановлено, що в Україні, починаючи з 2013 р., також відбувається зростання захворюваності на КРР у вікових групах 20–49 років (рис. 3).
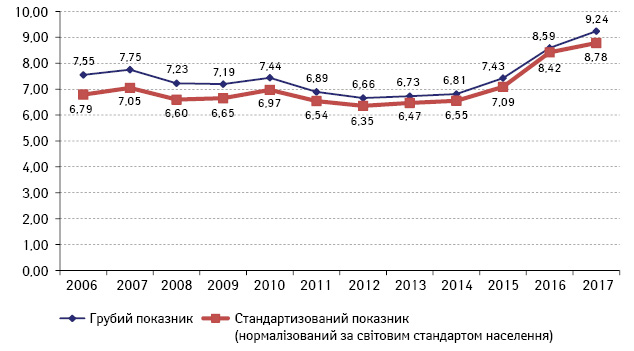
Рис. 3. Захворюваність на КРР (код МКХ С18-С20) населення вікової групи 20–49 років, Україна (показник на 100 тис. населення)
Оскільки нашою метою є порівняльна оцінка соціально-економічних затратних параметрів проведення популяційного скринінгу та хіміопроменевого лікування з приводу КРР, ми проаналізували ретроспективно показники захворюваності на КРР у молодих вікових групах 20–49 років як найбільш продуктивній частині населення, у яких виявлено місцево-поширений рак прямої кишки (МПРПК) за період 2006–2017 рр., саме лікування якого є високозатратним, складним та довготривалим процесом, що потребує мультимодального підходу. За десятирічний період відзначено зростання захворюваності у 1,7 раза, що корелює з міжнародними даними (рис. 4).
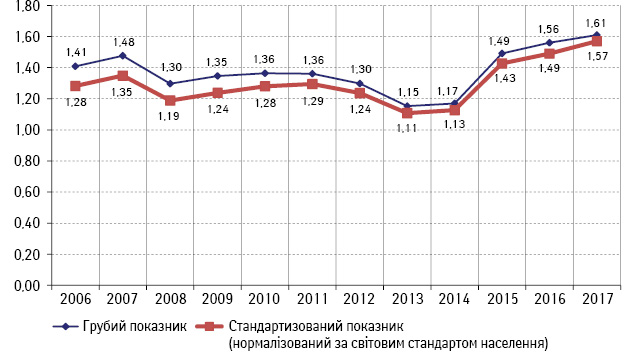
Рис. 4. Захворюваність на МПРПК (код МКХ С19-С20, T3–4N1–2M0) населення вікової групи 20–49 років, Україна (показник на 100 тис. населення)
Необхідно відзначити, що смертність від КРР у світі знизилася майже на 35% з 1990 по 2007 р. і наразі знижується приблизно на 50% порівняно з піковими коефіцієнтами смертності. Вважається, що ці поліпшення у поширеності та смертності від КРР є результатом профілактики раку та ранньої діагностики шляхом скринінгу і підвищення ефективності методів лікування [2, 14].
Експерти Американського онкологічного товариства (American Cancer Society — ACS) та комітету Національного дослідження поліпів (The National Polyp Study — NPS) стверджують, що, якби кожен дорослий віком ≥50 років пройшов скринінг, тоді можна було б запобігти 60% смертей від КРР [15].
Ґрунтуючись на вищевикладених даних та результатах нашого попереднього дослідження, можна зазначити, що в Україні назріла нагальна потреба у запровадженні програми скринінгу КРР із визначенням його виду (популяційний чи рутинний), а також в адекватному соціально-економічному обґрунтуванні доцільності його проведення з окресленням очікуваних вигод і обчисленням затрат на скринінг порівняно із затратами на лікування [16].
Сучасна лікувальна тактика локалізованого КРР є стандартизованою та чітко регламентованою міжнародними стандартами. Наразі для місцево-поширеного КРР, на відміну від локалізованого, немає чітко сформульованих діагностично-лікувальних рекомендацій. В Україні серед хворих із первинно виявленим РПК частка місцево-поширених форм становить від 21 до 34%, а первинно нерезектабельних — до 10% [8].
МПРПК (primary rectal cancer beyond total mesorectal excision planes — PRC-bTME) — це обмежена в мобільності або нерухома пухлина із залученням чи пошкодженням власної фасції, без явних ознак віддаленого метастазування у хворих, яким у зв’язку з поширенням її за межі органа неможливо виконати радикальну операцію без високого ризику розвитку місцевого рецидиву у найближчі терміни після операції. При цьому захворюванні, за даними магнітно-резонансної томографії (МРТ), для досягнення R0-резекції необхідно проводити дисекцію за межами мезоректальної площини. Для хворих на РПК із прогностично несприятливим фактором «мобільність пухлини» не є визначальною. Більш значимою є локалізація пухлини, а саме в нижньоампулярному відділі, поширення її за межі стінки кишки, МРТ-симптоматика судинної та/або периневральної інвазії, множинне ураження лімфатичних вузлів малого таза, позитивна циркулярна межа резекції, що свідчать про високий ризик місцевого рецидивування і віддаленого метастазування при виконанні радикальної операції [17, 18].
Радикальне лікування КРР у більшості випадків є комбінованим або комплексним. Радикальному оперативному втручанню у випадках МПРПК, як правило, передує неоад’ювантна променева або хіміопроменева терапія та курс ад’ювантної хіміотерапії (АХТ), показання до якої за останні 5 років мають тенденцію до розширення.
Стадія TNM залишається золотим стандартом для інформування про прогноз у пацієнта. Визначення стадії пухлинного процесу необхідно для вибору адекватного лікування, формулювання прогнозу, а також представлення результатів оцінки пухлинного росту за стандартизованою формою. З огляду на оновлення Міжнародним союзом протиракової боротьби (The Union for International Cancer Control — UICC) стадіювання TNM (8-ме видання), класифікацію для РТК та РПК наводимо в оригіналі у табл. 2, 3 [19].
| TNM Clinical Classification | |
|---|---|
| T — Primary tumour | |
| Tx | Primary tumour cannot be assessed |
| T0 | No evidence of primary tumour |
| Tis | Carcinoma in situ: invasion of lamina propria |
| T1 | Tumour invades submucosa |
| T2 | Tumour invades muscularis propria |
| T3 | Tumour invades subserosa or into non‐peritonealised pericolic or perirectal tissues |
| T4 | Tumour directly invades other organs or structures and/or perforates visceral peritoneum |
| T4a | Tumour perforates visceral peritoneum |
| T4b | Tumour directly invades other organs or structures |
| N — Regional lymph nodes | |
| Nx | Regional lymph nodes cannot be assessed |
| N0 | No regional lymph node metastasis |
| N1 | Metastasis in 1–3 regional lymph nodes |
| N1a | Metastasis in 1 regional lymph node |
| N1b | Metastasis in 2–3 regional lymph nodes |
| N1c | Tumour deposit(s), i.e. satellites, in the subserosa, or in non‐peritonealised pericolic or perirectal soft tissue with/out regional lymph node metastasis |
| N2 | Metastasis in 4 or more regional lymph nodes |
| N2a | Metastasis in 4–6 regional lymph nodes |
| N2b | Metastasis in 7 or more regional lymph nodes |
| M — Distant metastasis | |
| M0 | No distant metastasis |
| M1 | Distant metastasis |
| M1a | Metastasis confined to one organ (liver, lung, ovary, non‐regional lymph node(s)) without peritoneal metastases |
| M1b | Metastasis in more than one organ |
| M1c | Metastasis to the peritoneum with or without other organ involvement |
| TNM Pathological Classification | |||
|---|---|---|---|
| The pT and pN categories correspond to the T and N categories | |||
| pN0* | |||
| Stage | |||
| Stage 0 | Tis | N0 | M0 |
| Stage I | T1, T2 | N0 | M0 |
| Stage II | T3, T4 | N0 | M0 |
| Stage IIA | T3 | N0 | M0 |
| Stage IIB | T4a | N0 | M0 |
| Stage IIC | T4b | N0 | M0 |
| Stage III | Any T | N1, N2 | M0 |
| Stage IIIA | T1, T2 | N1 | M0 |
| T1 | N2a | M0 | |
| Stage IIIB | T1, T2 | N2b | M0 |
| T2, T3 | N2a | M0 | |
| T3, T4a | N1 | M0 | |
| Stage IIIC | T3, T4a | N2b | M0 |
| T4a | N2a | M0 | |
| T4b | N1, N2 | M0 | |
| Stage IV | Any T | Any N | M1 |
| Stage IVA | Any T | Any N | M1a |
| Stage IVB | Any T | Any N | M1b |
| Stage IVC | Any T | Any N | M1c |
*Гістологічне дослідження регіональної лімфаденектомії повинно включати 12 або більше лімфатичних вузлів. Якщо лімфатичні вузли є негативними у досліджуваних зразках, класифікується як pN0.
| Depth of invasion beyond the muscularis propria (in mm) | |
|---|---|
| T3a** | <1 |
| T3b | 1–5 |
| T3c | 6–15 |
| T3d | >15 |
**Підкласифікація базується на оцінці застосування МРТ перед прийняттям рішення про лікування, є клінічно значимою і використовується у рекомендаціях UICC. ЇЇ також можна застосовувати в гістопатологічній класифікації. Зверніть увагу, вона була відсутня у попередніх версіях TNM (5–7-го переглядів) [20].
Світовий прогрес диктує нові вимоги до діагностики та лікування КРР. Ця класифікація демонструє, що для її виконання необхідна новітня потужна медико-технологічна база з високопрофесійними кадрами у кожному лікувальному онкологічному закладі. Лише за таких умов її можна реалізувати.
На сьогодні в онкологічній галузі України впроваджені стандарти діагностики та лікування, уніфіковані клінічні настанови, локальні клінічні протоколи, що затверджені наказом Міністерства охорони здоров’я (МОЗ) України від 29.04.2011 р. № 247 «Про внесення змін до наказу МОЗ України від 17.09.2007 р. № 554 (зі змінами) «Про затвердження протоколів надання медичної допомоги за спеціальністю «онкологія», наказу МОЗ України від 28 вересня 2012 р. № 751 «Про створення та впровадження медико-технологічних документів зі стандартизації медичної допомоги в системі Міністерства охорони здоров’я України», а також адаптована клінічна настанова «Діагностика та лікування колоректального раку» (2016 р.), які регламентують надання діагностичної та лікувальної допомоги онкологічним пацієнтам. Однак, незважаючи на значну кількість нормативних актів, у нашій державі дотепер відсутня тарифікація онкологічних послуг. Тому для проведення фінансового аналізу порівняльної оцінки затрат на проведення популяційного скринінгу та лікування КРР вирішено визначити вартість застосування хіміопроменевого лікування МПРПК як більш дороговартісного порівняно з хірургічним.
З огляду на вищенаведені законодавчі документи в Національному інституті раку у відділенні онкопроктології хворі з діагностованим МПРПК отримують курс передопераційної неоад’ювантної хіміопроменевої терапії, яка дозволяє досягти максимальної регресії, у прогностично несприятливому варіанті знизити агресивний потенціал пухлини з метою створення умов для виконання R0 резекції.
Променева терапія (ПТ) має кращий ефект у добре оксигенованих тканинах у доопераційний період, а в післяопераційний у результаті хірургічного втручання тканини є гіпоксичними і, як наслідок, можуть бути більш стійкими до ПТ [21].
ПТ виконується у 2 етапи, обсяг опромінення визначається на підставі поширеності пухлинного процесу з урахуванням локорегіонарних шляхів лімфовідтоку. Топометрія, розробка плану ПТ проводяться для хворого 1 або 3–4 рази. Сумарна вогнищева доза становить 50–60 Гр, разова вогнищева доза — 2 Гр, до зон опромінення входять первинна пухлина, мезоректум та здухвинні лімфатичні вузли. Курс становить 28 сеансів. Хіміотерапевтичне лікування при комбінованому застосуванні з ПТ проводиться за схемою «XELOX»: оксаліплатин із розрахунку 85 мг/м2 одноразово; капецитабін — 2000 мг/м2 на добу 2 цикли при безперервному курсі ПТ чи щоденному 6-тижневому курсі ПТ, що дозволяє знизити частку токсичних реакцій і дає можливість достовірно підвищити частоту повних регресій пухлини [22, 23].
За даними авторів та деяких рандомізованих досліджень, загалом передопераційний курс ПТ із фракціонуванням доз опромінення з інтеграцією оксаліплатину до стандартного режиму неоад’ювантної хіміотерапії (НАХТ) з капецитабіном, за умови дотримання точного період лікування, покращує безрецидивне виживання з 71,2 до 75,9% (р=0,03), знижує ризик рецидивів у віддаленій перспективі, дозволяє зменшити кількість токсичних реакцій і дає можливість достовірно підвищити частоту повних регресій пухлини [23–26].
Оскільки АХТ з приводу МПРПК покращує виживання, хворі з ураженням лімфатичних вузлів N1–2 після повної резекції первинної пухлини отримують ад’ювантний курс поліхіміотерапії (ПХТ) за схемою «XELOX» — 8 циклів [27–29].
Рекомендована доза оксаліплатину становить 85 мг/м2 поверхні тіла внутрішньовенно кожні 2 тиж 6–12 курсів (загальна тривалість лікування 6 міс), капецитабіну — 2200 мг/м2 поверхні тіла, застосовується у вигляді тритижневих циклів, приймають щодня протягом 2 тиж, після чого роблять тижневу перерву. Сумарну добову дозу капецитабіну розподіляють на 2 прийоми (по 1250 мг/м2 поверхні тіла — зранку і ввечері). Загальна тривалість ад’ювантної схеми становить 6 міс [30]. Середню дозу хіміотерапевтичного препарату розраховано на середньостатистичного українця з масою тіла 70 кг та ростом 170 см.
Вартість променевого лікування визначали на основі Переліку платних послуг, які надаються у державних та комунальних закладах охорони здоров’я, вищих медичних навчальних закладах, затвердженого Постановою Кабінету Міністрів України від 17 вересня 1996 р. № 1138, пункт 13 розділу І, на основі тарифної сітки платних медичних послуг, які надаються на договірних засадах у Клінічній лікарні «Феофанія» Державного управління справами (http://feofaniya.org/tsini-na-platni-medichni-poslugi).
Вартість препаратів ПХТ, використаних при розрахунках, взято з Реєстру оптово-відпускних цін на лікарські засоби МОЗ України станом на 19 вересня 2017 р. Для забезпечення однорідності групи препарати супроводу не враховувалися (http://www.moz.gov.ua).
Пошук та відбір хворих здійснювався на підставі персоніфікованих даних НКРУ (2015 р.) за критерієм індексу сTNM-pTNM (T3–4N1–2M0). Відповідно до проведеного відбору та аналізу, хворих, у яких діагностовано МПРПК у 2015 р. у віці 20–49 років, зареєстровано 268 випадків, у віці понад 50 років — 1656, загалом — 1924. Загальна вартість ПТ (з одноразовою топометрією) та ПХТ (2 цикли НАХТ та 8 циклів АХТ за схемою «XELOX») становить: для 1 хворого — від 74 550,0 до 81 450,0 грн., для 1924 хворих — від 143 434 200,0 до 156 709 800,0 грн. Фінансово-вартісний аналіз хіміопроменевого лікування хворих на МПРПК наведено в табл. 4–6.
| Вид лікування | Вартість лікування, грн. | ||||
| ПТ (кількість хворих) | Топометрія, розробка плану ПТ з використанням довгої маски, одноразова | Топометрія, розробка плану ПТ з використанням довгої маски, трьохразова | Проведення сеансу опромінення з використанням ІМRT методики (28 фракцій)* | Усього | |
| опромінення з одноразовою топометрією | опромінення з трьохразовою топометрією | ||||
| n=1 | 3 450,0 | 10 350,0 | 22 400,0 | 25 850,0 | 32 750,0 |
| n=1924 | 6 637 800,0 | 19 973 400,0 | 43 097 600,0 | 49 735 400,0 | 63 011 000,0 |
*Вартість однієї фракції — 800 грн.
| Схема лікування | Вартість лікування, грн. | |||
| ПХТ За схемою «XELOX» | 1 цикл НАХТ | 2 цикли НАХТ | 1 цикл АХТ | 8 циклів АХТ |
| Оксаліплатин 150 мг | 2570,0 | 5140,0 | 2570,0 | 20 560,0 |
| Капецитабін 500 мг | 2300,0 | 4600,0 | 2300,0 | 18 400,0 |
| Кількість хворих:n=1 | 4870,0 | 9740,0 | 4870,0 | 38 960,0 |
| n=1924 | 9 369 880,0 | 18 739 760,0 | 9 369 880,0 | 74 959 040,0 |
| Вид лікування | Вартість лікування, грн. | |||
| n=1* | n=1** | n=1924* | n=1924** | |
| ПТ | 25 850,0 | 32 750,0 | 49 735 400,0 | 63 011 000,0 |
| + НАХТ | 9 740,0 | 9 740,0 | 18 739 760,0 | 18 739 760,0 |
| Усього: | 35 590,0 | 42 490,0 | 68 475 160,0 | 81 1750 760,0 |
| + АХТ | 9 740,0 | 9 740,0 | 74 959 040,0 | 74 959 040,0 |
| Загальна сума | 74 550, 0 | 81 450,0 | 143 434 200,0 | 156 709 800,0 |
*Вартість променевого лікування з одноразовою топометрією.
**Вартість променевого лікування з трьохразовою т
Розрахунок витрат на проведення скринінгу КРР за допомогою тесту на вміст прихованої крові у калових масах базувався на вартості тест-смужок та на імунохроматографічному методі (quantitative immunochemical Fecal Occult Blood — FOB Gold + Transferrin) і більш сучасній методиці, яка включає дослідження на гемоглобін і трансферин, що значно перевищує за чутливістю менш специфічні хімічні методи (гваякову, бензидинову проби) без урахування колоноскопії [31, 32]. Враховуючи кількість осіб, які підлягають скринінгу, та вартість 1 тест-смужки, на проведення скринінгу КРР необхідно витратити 226 562 281 грн./рік або 788 940 352,00 грн./рік — при FOB Gold тесті (табл. 7).
| Вид дослідження | Кількість осіб, що підлягають скринінгу, n (вік 50–74 роки) | Вартість 1 дослідження**, грн. | Загальна сума, грн. |
| Тест на вміст прихованої крові у калі | 12 327 193* | 17 | 115 435 393,2 |
| Тест за імунохроматографічним методом (FOB) | 64 | 788 940 352,0 |
*Дані про кількість населення віком 50–74 роки Державної служби статистики України «Розподіл постійного населення України за статтю та віком» на 1 січня 2017 р. (без урахування тимчасово окупованої території Автономної Республіки Крим і м. Севастополя).
**Ціни наведено за даними †ТОВ «Фармаско» та ††«Меd Test» станом на вересень 2017 р.
Необхідно відзначити, що витрати держави на сплату пенсій у зв’язку з інвалідністю та несплачені податки внаслідок смерті від КРР не були включені в обчислення, оскільки детальний аналіз був проведений у попередній статті [17].
При порівнянні витрат на хіміопроменеве лікування хворих на МПРПК з витратами на скринінг КРР стає очевидним, що державні вклади у ранню діагностику КРР є вигідними та обґрунтованими як з економічного, так і з соціального погляду. Безсумнівно, виживання хворих на РПК є вищим при ранній діагностиці. Показники загального 5-річного виживання при РПК такі: стадія I — 90%, II — 60–85%, III — 27–60%, IV — 5–7% [33]. Тому запровадження популяційного скринінгу в Україні дасть змогу з плином часу реально знизити смертність від КРР до 80%.
Крім вищевисвітленого, хотіли б відзначити ще один важливий аспект. Варіабельність клінічних результатів лікування КРР пов’язана з молекулярною гетерогенністю цього захворювання. У цій статті ми не ставили за мету аналізувати дослідження генетичних і епігенетичних змін пухлинної клітини при канцерогенезі РТК, проте хотіли б звернути увагу на роль мікросателітної нестабільності (microsattelite instability — MSI), яка розвивається в результаті дефектів системи репарації некомплементарно спарованих основ ланцюгів ДНК (mismatch repair — MMR) як незалежного прогностичного фактора, що визначає ступінь злоякісності РТК. Виявлення MSI одночасно з оцінкою гістологічного диференціювання пухлини — серйозний аргумент, який визначає доцільність призначення таргетної та імунотерапії [33, 34]. Для цього виконується імуногістохімічне дослідження (ІГХД) генів репарації ДНК (MSH2, MSH6, MLH1, PMS2; прогностична значимість негативного результату близька до 100%). З огляду на останні міжнародні дані та рекомендації, його необхідно виконувати усім хворим на КРР [34, 35]. Вартість дослідження — оцінки активності білків репарації помилок комплементарності ДНК (MLH1 + MSH2 + PMS2) в карциномах товстого кишечнику імуногістохімічним методом — становить 1400,0 грн., за даними прайс-листа від 22.03.2017 р. патоморфологічної лабораторії «СSD Health Care» (м. Київ). Для вищезгаданих 1924 хворих на ПМРПК вартість ІГХД становитиме 2 718 800,0 грн. Якщо зазначену вартість сумувати з вартістю хіміопроменевої терапії (див. табл. 6), отримуємо 159 428 600 грн.
Таким чином, загальна вартість хіміопроменевої терапії та ІГХД становить 159 428 600,0 грн. (розраховано на 1924 хворих) проти 115 435 393,2 грн. (розраховано на 12 327 193 осіб віком 50–74 роки) вартості тесту на вміст прихованої крові у калі.
Висновки
Представлене дослідження з висвітленням елементів економічного прогнозування вартості хіміопроменевого лікування КРР із визначенням пріоритету вартість/ефективність порівняно із тестовою скринінговою методикою демонструє переваги профілактичного напрямку у вирішенні проблеми КРР, а саме у запровадженні в Україні на популяційному рівні скринінгу КРР. Це ще раз підтверджує те, що необхідно досягнути консенсусу владним структурам із більшістю зацікавлених сторін, якою є населення, саме з позиції крайньої життєвої необхідності з метою збереження генофонду нації.
СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ
1. Rohani-Rasaf M., Abdollahi M., Jazayeri S. et al. (2013) Correlation of cancer incidence with diet, smoking and socio-economic position across 22 districts of Tehran in 2008. Asian. Pac. J. Cancer Prev.,14: 1669–1676.
2. Kuipers E.J., Rösch T., Bretthauer M. (2013) Colorectal cancer screening — optimizing current strategies and new directions. Nat. Rev. Clin. Oncol., 10: 130–142.
3. Vasen H.F.A., Tomlinson I., Castells A. (2015) Clinical management of hereditary colorectal cancer syndromes. Nat. Rev. Gastroenterol. Hepatol., 12: 88–97.
4. Papamichael D., Audisio R.A., Glimelius B. et al. (2014) Treatment of colorectal cancer in older patients: International Society of Geriatric Oncology (SIOG) consensus recommendations 2013. Ann. Oncol., 26: 463–476.
5. Murray C.J.L. (2015) Global, regional, and national age-sex specific all-cause and cause-specific mortality for 240 causes of death, 1990-2013: a systematic analysis for the Global Burden of Disease Study 2013. Lancet, 385: 117–171.
6. Wang H., Naghavi M., Allen C. et al. (2016) Global, regional, and national life expectancy, all-cause mortality, and cause-specific mortality for 249 causes of death, 1980-2015: a systematic analysis for the Global Burden of Disease Study 2015. Lancet, 388(10053): 1459–1544.
7. Ferlay J., Steliarova-Foucher E., Lortet-Tieulent J. et al. (2013) Cancer incidence and mortality patterns in Europe: Estimates for 40 countries in 2012. Eur. J. Cancer, 49: 1374–1403.
8. Федоренко З.П., Михайлович Ю.Й., Гулак Л.О. та ін. (2017) Рак в Україні, 2015–2016. Захворюваність, смертність, показники діяльності онкологічної служби. Бюл. Нац. канцер-реєстру України. Київ, 18: 130.
9. Ferlay J., Soerjomataram I., Dikshit R. et al. (2015) Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012. Int. J. Cancer, 136(5): E359–E386.
10. Ferlay J., Hai-Rim S., Bray F. et al. (2010) Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008. Int. J. Cancer, 127(12): 2893–2917.
11. Freisling H., Arnold M., Soerjomataram I. et al. (2017) Comparison of general obesity and measures of body fat distribution in older adults in relation to cancer risk: meta-analysis of individual participant data of seven prospective cohorts in Europe. Br. J. Cancer, 116(11): 1486–1497.
12. Arnold M., Sierra M.S., Laversanne M. et al.(2017) Global patterns and trends in colorectal cancer incidence and mortality. Gut., 66(4): 683–691.
13. Bray F., Ren J.S., Masuyer E. et al. (2013) Estimates of global cancer prevalence for 27 sites in the adult population in 2008. Int. J. Cancer, 132(5): 1133–1145.
14. Keyes K. M., Nicholson R., Kinley J. et al. (2014) Age, period, and cohort effects in psychological distress in the United States and Canada. Am. J. Epidemiol., 179(10): 1216–1227.
15. Fidler M.M., Bray F., Vaccarella S., Soerjomataram I. (2017) Assessing global transitions in human development and colorectal cancer incidence. Int. J. Cancer, 140(12): 2709–2715.
16. van Steenbergen L.N., Elferink M.A.G., Krijnen P. et al. (2010) Improved survival of colon cancer due to improved treatment and detection: a nationwide population-based study in The Netherlands 1989–2006. Ann. Oncol., 21: 2206–2212.
17. Михайлович Ю.Й., Журбенко А.В., Сумкіна О.В. (2013) Практичні аспекти впровадження скринінгу колоректального раку в Україні. Соціально-економічне обґрунтування. Клин. онкол., 3(11): 6–10.
18. Trakarnsanga A., Ithimakin S., Weiser M.R. (2012) Treatment of locally advanced rectal cancer: Controversies and questions. W.J.G., 18(39): 5521–5532.
19. Glynne-Jones R., Wyrwicz L., Tiret E. et al. (2017) Rectal Cancer: ESMO Clinical Practice Guidelines. Ann. Oncol., 28(4): іv.22–iv.40.
20. Brierley J.D., Gospodarowicz M.K., Wittekind C. (2016) TNM Classification of Malignant Tumours. 8th ed. Oxford: John Wiley & Sons, Inc.: 272 p.
21. Edge S.B., Byrd D.R., Compton C.C. et al. (2010) AJCC Cancer Staging Handbook. 7th ed. New York: Springer-Verlag: 718 p.
22. Jakobsen A., Ploen J., Vuong T. et al. (2012) Dose-effect relationship in chemoradiotherapy for locally advanced rectal cancer: a randomized trial comparing two radiation doses. Int. J. Radiat. Oncol. Biol. Phys., 84(4): 949–954.
23. Cabebe С.E. (2017) Colorectal Cancer Guidelines (https://emedicine. medscape.com/article/2500006-
overview#showall).
24. Bosset J.-F., Bosset M., Nguyen F. et al. (2008) Defining preoperative treatment strategies in T3 rectal cancer. Gastrointest. Cancer Res., 2(2): S54–S57.
25. Rödel C., Liersch T., Becker H. et al. (2012) Preoperative chemoradiotherapy and postoperative chemotherapy with fluorouracil and oxaliplatin versus fluorouracil alone in locally advanced rectal cancer: initial results of the German CAO/ARO/AIO-04 randomised phase 3 trial. Lancet Oncol., 13: 679–687.
26. Колеснік О.О., Безносенко А.П., Шудрак А.А., Махмудов Д.Е. (2015) Локальний контроль і фактори ризику виникнення рецидиву раку прямої кишки. Клин. онкол., 3(19): 13–17.
27. De Felice F., Musio D., Izzo L. et al. (2014) Neoadjuvant chemoradiotherapy for locally advanced rectal cancer: The debate continues. World J. Gastrointest. Oncol., 6(12): 438–440.
28. André T., Boni C., Navarro M. et al. (2009) Improved overall survival with oxaliplatin, fluorouracil, and leucovorin as adjuvant treatment in stage II or III colon cancer in the MOSAIC trial. J. Clin. Oncol., 27(19): 3109–3116.
29. Haller D.G., Tabernero J., Maroun J. et al. (2011) Capecitabine plus oxaliplatin compared with fluorouracil and folinic acid as adjuvant therapy for stage III colon cancer. J. Clin. Oncol., 29: 1465–1471.
30. NCCN. Clinical Practice Guidelines in Oncology. Rectal Cancer. NCCN Evidence Blocks. National Comprehensive Cancer Network, Versoin 3, march 2017 (https://www.nccn.org/professionals/physician_gls/default.aspx).
31. Kotwal A., Schonberg A., Mara A. (2017) Cancer screening in the elderly: a review of breast, colorectal, lung, and prostate cancer screening. Cancer J., 23(4): 246–253.
32. Bibbins-Domingo K., Grossman D.C., Curry S.J. et al. (2016) Screening for colorectal cancer: US Preventive Services Task Force recommendation statement. JAMA, 315: 2564–2575.
33. Stitzenberg K.B., Sanoff H.K., Penn D.C. et al. (2013) Practice patterns and long-term survival for early-stage rectal cancer. J. Clin. Oncol., 31(34): 4276–4282.
34. Tietz R. N. (2017) Textbook of Clinical Chemistry and Molecular Diagnostics, 6th Ed. Saunders, Philadelphi: 1888 p.
35. Kawakami H., Zaanan A., Sinicrope F.A. (2015) MSI testing and its role in the management of colorectal cancer. Curr. Treat. Options Oncol., 16(7): 1–14.
«Колоректальный скрининг» как консенсусное решение проблемы местно-распространенного рака толстой и прямой кишки в Украине. Дискуссии и вопросы
Национальный институт рака, Киев
Резюме. В структуре онкологической заболеваемости и смертности колоректальный рак продолжает удерживать одну из лидирующих позиций в Украине. Высокий темп прироста заболеваемости колоректальным раком, существенные изменения возрастного состава пациентов за счет преобладания лиц старше 60 лет, значительное увеличение числа больных с различными осложнениями и распространением опухолевого процесса, особенно молодого возраста, высокие цифры послеоперационных осложнений и летальности, невысокие показатели общей и безрецидивной выживаемости свидетельствуют о необходимости неотложного решения этого вопроса. В Украине уже давно назрела медико-социальная необходимость во внедрении программы популяционного скрининга колоректального рака. В работе проанализированы финансовые аспекты, касающиеся стоимости химиолучевого лечения местно-распространенного колоректального рака по сравнению с затратами на скрининг. Акценты в стратегии современной диагностики и лечения рака толстого кишечника сделаны на доказательную базу NCCN и PubMed.
колоректальный рак, местно-распространенный рак прямой кишки, химиолучевое лечение, популяционный скрининг, стоимость/эффективность.
Адреса:
Михайлович Юрій Йосипович
03022, Київ, вул. Ломоносова, 33/43
Національний інститут раку МОЗ України
Тел.: +38 (044) 257-60-68
E-mail: michailovich@unci.org.ua














Leave a comment