Комплексне лікування хворих на резектабельний рак порожнини рота III–IV стадії. Сучасний стан проблеми
Резюме. Протягом тривалого часу в країнах Європи та США стандартом лікування пацієнтів із резектабельним раком порожнини рота III–IV стадії є хірургічне втручання з подальшою променевою чи одночасною хіміопроменевою терапією. Нині органозберігаючі підходи застосовують при лікуванні хворих на рак гортані, гортаноглотки, ротоглотки, але стандарт лікування раку порожнини рота не змінюється. У статті представлений огляд рандомізованих досліджень, присвячених проблемі комплексного лікування пацієнтів із плоскоклітинним раком голови та шиї у цілому та резектабельними злоякісними новоутвореннями порожнини рота III–IV стадії зокрема.
Вступ
За останні десятиріччя підходи до комплексного лікування пацієнтів із плоскоклітинним раком більшості локалізацій голови та шиї суттєво змінилися. Так, одночасну хіміопроменеву терапію (ОХПТ) або індукційну хіміотерапію з подальшою променевою терапією (ПТ) чи ОХПТ розглядають як можливі варіанти лікування хворих зі злоякісними новоутвореннями гортані та гортаноглотки з метою збереження гортані [1]. Аналогічні підходи пропонуються при комплексному лікуванні раку ротоглотки [2]. Проте протягом багатьох років поспіль у країнах Європи та США стандартом лікування хворих на резектабельний рак порожнини рота III–IV стадії залишається хірургічне втручання з подальшою ПТ або ОХПТ [3]. Метою проведеного аналізу основних рандомізованих досліджень, присвячених проблемі комплексного лікування пацієнтів із плоскоклітинним раком голови та шиї (ПРГШ), було визначити можливість застосування органозберігаючого підходу при лікуванні резектабельного раку порожнини рота III–IV стадії.
Сучасні методи комплексного лікування хворих на ПРГШ III–IV стадії. Нині у пацієнтів із ПРГШ III–IV стадії застосовують такі методи комплексного лікування:
- ОХПТ із подальшим хірургічним лікуванням хворих із залишковою первинною пухлиною та/або регіонарними метастазами (рис. 1);
- хірургічне лікування з подальшою ПТ або ОХПТ (рис. 2);
- індукційна хіміотерапія з подальшою ПТ або ОХПТ та хірургічним лікуванням хворих із залишковою первинною пухлиною та/або регіонарними метастазами (рис. 3).
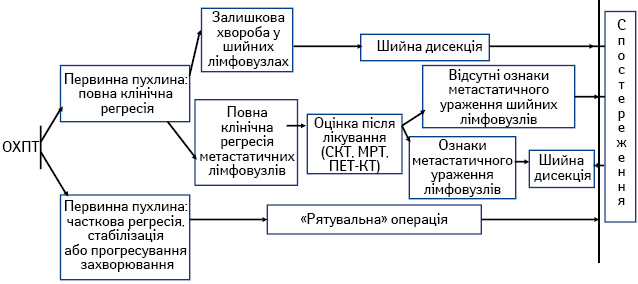
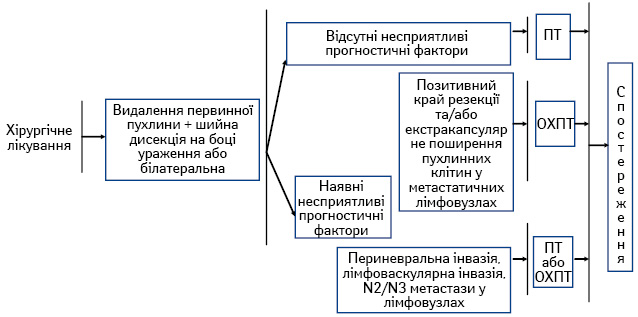
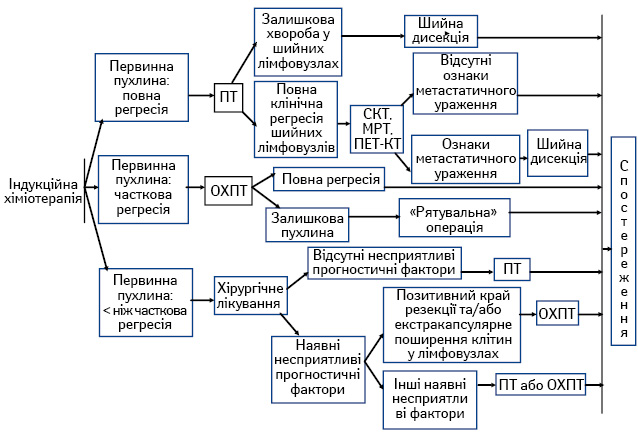
Сучасні підходи до системного лікування хворих на ПРГШ III–IV стадії. За останні три десятиріччя роль хіміотерапії при лікуванні пацієнтів із ПРГШ значно зросла [4, 5]. Застосовують різні варіанти системного лікування: ОХПТ; індукційну хіміотерапію; послідовне лікування (індукційна хіміотерапія з подальшою ОХПТ); таргетна терапія.
ОХПТ стала загальноприйнятим стандартом лікування пацієнтів із місцево-поширеним ПРГШ після публікації результатів великого метааналізу хіміотерапії раку голови та шиї (MACH-NC), у який були включено 10 741 хворого, що брали участь у 63 рандомізованих дослідженнях [6]. У 2009 р. у метааналіз включено 17 346 пацієнтів із 93 рандомізованих досліджень. Згідно з оновленими даними, ОХПТ, порівняно з ПТ, забезпечує абсолютний приріст 5-річної виживаності на 6,5%, індукційна хіміотерапія — на 2,4%, а ад’ювантна хіміотерапія погіршує її на 1%. ОХПТ покращує виживаність хворих як у стандартному режимі проведення ПТ, так і в режимах гіперфракціонування та прискореного фракціонування. Метааналіз також показав, що ефективність хіміотерапії знижується з віком. Стандартним режимом вважають введення цисплатину в дозі 100 мг/м2 у 1; 22-й та 43-й день на фоні проведення неперервного курсу ПТ у сумарній вогнищевій дозі 60–74 Гр [7].
У дослідженні Radiation Therapy Oncology Group (RTOG) 91–11 вивчали ефективність індукційної хіміотерапії за схемою цисплатин + флуороурацил (PF) з подальшою ПТ при зіставленні з ОХПТ та самостійною ПТ у хворих на резектабельний рак гортані III–IV стадії. Результати дослідження показали, що індукційна хіміотерапія з подальшою ПТ та ОХПТ мають подібну ефективність стосовно виживаності без ларингектомії. Проте показники локорегіонарного контролю та збереження гортані були значно кращими при застосуванні ОХПТ, аніж індукційної хіміотерапії з подальшою ПТ та самостійною ПТ. Статистично достовірних відмінностей у загальній виживаності між 3 групами хворих не виявлено [8]. Результати дослідження RTOG 91–11 наведено у табл. 1.
Таблиця 1. Результати дослідження RTOG 91–11
| Показник | Методи лікування | ||
|
Індукційна хіміотерапія + ПТ |
ОХПТ | ПТ | |
| Виживаність без ларингектомії, %5-річна10-річна | 44,128,9 | 47,023,5 | 34,017,2 |
| Збереження гортані, %5-річне10-річне | 70,867,5 | 83,681,7 | 65,863,8 |
| Локорегіонарний контроль, %5-річний10-річний | 54,848,9 | 67,765,3 | 51,247,2 |
| Виживаність без прогресування, %5-річна10-річна | 37,720,4 | 38,021,6 | 28,014,0 |
| Загальна виживаність, %5-річна10-річна | 58,138,8 | 55,127,5 | 53,831,5 |
Ефективність післяопераційної ОХПТ вивчали у 2 рандомізованих дослідженнях III фази: European Organization for Research and Treatment of Cancer (EORTC) 22931 та RTOG 9501. В обох дослідженнях порівнювали ефективність післяопераційної ОХПТ та ПТ у пацієнтів із несприятливими прогностичними факторами (наявність пухлинних клітин у краях резекції, екстракапсулярне поширення пухлинних клітин у регіонарних лімфатичних вузлах). Крім того, у дослідження RTOG 9501 були включені хворі з метастазами у 2 та більше лімфатичних вузлах, а у EORTC 22931 — пацієнти з такими несприятливими прогностичними чинниками, як лімфоваскулярна, периневральна інвазія та метастази раку порожнини рота у IV–V групах лімфатичних вузлів. У дослідженні RTOG 9501 продемонстровано, що застосування ОХПТ порівняно з ПТ має тенденцію до поліпшення 5-річного показника локорегіонарного контролю (79,5 і 71,3% відповідно) та безрецидивної виживаності (37,4 і 29,1% відповідно) [9]. У дослідженні EORTC 22931 відмічено достовірне покращення 5-річної виживаності без прогресування (47 і 36%) та загальної виживаності (53 і 40%), а також зниження частоти локорегіонарних рецидивів (18 і 31%) при застосуванні ОХПТ порівняно із ПТ [10]. Результати об’єднаного аналізу RTOG 9501 та EORTC 22931 показали, що у пацієнтів з екстракапсулярним поширенням пухлинних клітин у регіонарних лімфатичних вузлах і/або наявністю пухлинних клітин у краях резекції ОХПТ покращує локорегіонарний контроль, безрецидивну та загальну виживаність. Аналіз також засвідчив ймовірну ефективність ОХПТ у хворих із лімфоваскулярною, периневральною пухлинною інвазією та метастазами раку порожнини рота у IV–V групах лімфатичних вузлів [11].
Отже, ОХПТ — це єдиний режим, який при зіставленні з ПТ показав переваги:
- у загальній виживаності хворих на місцево-поширений рак голови та шиї;
- при проведенні ад’ювантної терапії після хірургічного лікування;
- у рамках стратегії збереження гортані.
Індукційна хіміотерапія має деякі теоретичні переваги, зокрема — оптимальний розподіл препарату в пухлині в умовах непорушеного кровопостачання, ранню дію на мікрометастази та кращу переносимість препаратів [12]. Крім того, індукційна хіміотерапія дає можливість оцінити відповідь пухлини та відібрати хворих для органозберігаючого лікування [13]. Різні схеми індукційної хіміотерапії застосовували протягом багатьох років, проте метааналіз MACH-NC показав, що схема PF виявилася найбільш ефективною (дослідження режиму доцетаксел + цисплатин + флуороурацил (ТPF) не включено у метааналіз) [7]. Ставлення до індукційної хіміотерапії змінювалося. Величезний ентузіазм, викликаний вражаючим зменшенням об’єму пухлини, змінився на тверезу оцінку, оскільки індукційна хіміотерапія не покращувала виживаності. Відновлення інтересу до індукційної хіміотерапії пов’язане з опублікуванням результатів 3 рандомізованих досліджень III фази, в яких вивчали роль таксанів при лікуванні пацієнтів із ПРГШ [14–16].
Перше рандомізоване дослідження опубліковано у 2005 р. групою іспанських вчених. У ньому 384 пацієнти з резектабельним та нерезектабельним місцево-поширеним ПРГШ були рандомізовані на 2 групи. Хворі 1-ї групи отримували 3 цикли індукційної хіміотерапії за схемою PF, 2-ї групи — за схемою паклітаксел + цисплатин + флуороурацил (PPF). Пацієнтам обох груп, які мали повну або часткову (>80%) регресію пухлини, призначали ОХПТ, а хворим зі стабілізацією захворювання або регресією <80% — хірургічне лікування з подальшою ОХПТ. Результати дослідження продемонстрували значне підвищення частоти повних відповідей та поліпшення виживаності без прогресування у пацієнтів, у яких проведено індукційну хіміотерапію за схемою PPF, але покращення загальної виживаності було достовірним лише у неоперабельних хворих [14].
У дослідження EORTC 24971 / TAX 323 було включено 358 пацієнтів із нерезектабельним ПРГШ III–IV стадії. Хворих рандомізовано на 2 групи. Пацієнти 1-ї групи отримували по 4 цикли індукційної хіміотерапії за схемою PF, 2-ї — за схемою ТPF. Через 4–7 тиж після закінчення хіміотерапії пацієнтам обох груп проводили ПТ. Дослідження показало статистично достовірне покращення виживаності без прогресування та загальної виживаності хворих, які одержували індукційну хіміотерапію за схемою ТPF [15].
У дослідженні TAX 324 порівнювали ефективність 3 циклів індукційної хіміотерапії за схемою PF та 3 циклів — за схемою ТPF у пацієнтів із резектабельним та нерезектабельним ПРГШ III–IV стадії. Після закінчення індукційної хіміотерапії у хворих обох груп проводили ОХПТ зі щотижневим введенням карбоплатину в дозі 1,5 AUC. Слід зазначити, що такий режим ОХПТ не підтверджений у жодному рандомізованому дослідженні III фази, тому незрозуміло, чи буде розглядатися цей підхід як альтернатива стандартній ОХПТ. Результати дослідження показали статистично достовірне поліпшення виживаності без прогресування та загальної виживаності у пацієнтів, що отримували індукційну хіміотерапію за схемою ТPF [16]. Оновлені дані підтвердили одержані раніше, продемонструвавши абсолютний приріст 5-річної виживаності на 10% у хворих, яким проведено індукційну хіміотерапію за схемою ТPF [17]. Характеристика та результати досліджень TAX 323 та TAX 324 наведено у табл. 2.
Таблиця 2. Характеристика та результати досліджень TAX 323 та TAX 324
| Дослідження | Кількість пацієнтів | Характеристика пацієнтів | Порівнювані методи лікування | Режим ПТ | Медіана виживаності без прогресування, міс | Медіана загальної виживаності, міс |
| TAX 323 | 358 | Нерезектабельний ПРГШ | ТPF + ПТ проти PF + ПТ |
Стандартний, прискорений або гіперфакціонування | 11,0 проти 8,2 | 18,8 проти 14,5 |
| TAX 324 | 501 | Резектабельний та нерезектабельний ПРГШ | ТPF + ОХПТ проти PF + ОХПТ |
Стандартний зі щотижневим введенням карбоплатину | 36 проти 13 | 71 проти 30 |
Таким чином, дослідження TAX 323 та TAX 324 показали, що найкращим режимом індукційної хіміотерапії нині є ТPF. Подібні дослідження, в яких порівнювали б ефективність індукційної хіміотерапії з подальшою ПТ і ОХПТ, досі не проводили.
При послідовному лікуванні (індукційна хіміотерапія з подальшою ОХПТ) метою було поєднання позитивних якостей індукційної хіміотерапії та ОХПТ. Досі немає відповіді на запитання: чи дійсно індукційна хіміотерапія та ОХПТ взаємодоповнюють одна одну? чи послідовне лікування ефективніше, ніж ОХПТ? Опубліковано результати 2 рандомізованих досліджень III фази, в яких порівнювали ефективність послідовного лікування та ОХПТ [18, 19].
У дослідженні PARADIGM 145 пацієнтів із ПРГШ III–IV стадії рандомізовано на 2 групи. Хворі 1-ї групи отримували ОХПТ (2 курси цисплатину на фоні ПТ у режимі прискореного фракціонування). Такий підхід обґрунтований, оскільки у дослідженні III фази RTOG 0129 було показано, що ефективність 3 курсів цисплатину на фоні ПТ у режимі стандартного фракціонування зіставна з 2 курсами цисплатину на фоні ПТ у режимі прискореного фракціонування [20]. Пацієнти 2-ї групи одержували по 3 цикли індукційної хіміотерапії за схемою ТPF із подальшою ОХПТ (щотижневе введення карбоплатину на фоні стандартної ПТ, як у дослідженні TAX 324, або щотижневе введення доцетакселу на фоні ПТ у режимі прискореного фракціонування). Не виявлено переваг послідовного лікування. Слід відзначити високі показники 3-річної загальної виживаності в обох групах хворих. У пацієнтів, які отримували послідовне лікування, 3-річна загальна виживаність становила 73%, у хворих, яким проводили ОХПТ, — 78% [18].
E. Cohen та співавтори у рандомізованому дослідженні III фази порівнювали ефективність послідовного лікування та ОХПТ у пацієнтів із ПРГШ з N2–3 метастазами. На жаль, дослідження достроково зупинено через повільний набір учасників. Попередні результати, як і у дослідженні PARADIGM, не показали покращення загальної виживаності у хворих, які отримували послідовне лікування. Проте відзначено достовірне зниження частоти віддалених метастазів у пацієнтів, яким призначали послідовне лікування, на відміну від хворих, яким проводили ОХПТ [19].
Таким чином, послідовне лікування не поліпшило загальної виживаності хворих порівняно із ОХПТ. Обидва методи лікування є ефективними при лікуванні ПРГШ III–IV стадії.
Таргетна терапія. Нині з усіх препаратів таргетної терапії найбільш багатообіцяючими є ті, які діють на рецептори епідермального фактора росту (EGFR). EGFR є мішенню для багатьох моноклональних антитіл та інгібіторів тирозинкіназ, які перебувають на різних стадіях клінічної розробки. У 2006 р. J. Bonner та співавтори опублікували результати міжнародного рандомізованого дослідження III фази, у якому вивчали роль цетуксимабу при лікуванні пацієнтів із ПРГШ III–IV стадії. У цьому дослідженні 424 хворих рандомізовано на 2 групи. Учасники 1-ої групи отримували лише ПТ, 2-ї — ПТ у поєднанні зі щотижневим введенням цетуксимабу. Результати дослідження продемонстрували статистично достовірне зниження частоти рецидивів і поліпшення виживаності за відсутності збільшення виражених токсичних реакцій з боку слизової оболонки у пацієнтів, які отримували ПТ у поєднанні з цетуксимабом [21]. Оновлені результати дослідження показали достовірне підвищення 5-річної загальної виживаності пацієнтів, яким призначали застосування ПТ і цетуксимабу, порівняно з хворими, які отримували лише ПТ (45,6 проти 36,4% відповідно) [22]. Однак поки що невідомо, як співвідносяться переваги додавання цетуксимабу та препаратів платини до ПТ, оскільки поки що не проведено жодного дослідження, в якому б порівнювали ефективність ОХПТ на основі цисплатину та комбінації ПТ із цетуксимабом.
Комплексне лікування хворих на резектабельний рак порожнини рота III–IV стадії. Стандартом лікування хворих на резектабельний рак порожнини рота III–IV стадії залишається хірургічне втручання з подальшою ПТ або ОХПТ. Аналіз рандомізованих досліджень III фази, в яких вивчали роль системного лікування пацієнтів із ПРГШ III–IV стадії, демонструє ефективність ОХПТ та індукційної хіміотерапії з подальшою ОХПТ. Нині обидва підходи можуть бути застосовані при лікуванні хворих на рак гортані та гортаноглотки з метою збереження гортані. Чи ефективні органозберігаючі підходи у пацієнтів із резектабельним раком порожнини рота III–IV стадії? На жаль, однозначної відповіді на це запитання досі немає, оскільки не проведено жодного рандомізованого дослідження III фази, в якому б порівнювали ефективність:
- хірургічного лікування з подальшою ОХПТ та ОХПТ з хірургічним лікуванням хворих із залишковою первинною пухлиною та/або регіонарними метастазами;
- хірургічного лікування з подальшою ОХПТ та індукційною хіміотерапією з подальшою ПТ або ОХПТ і хірургічним лікуванням хворих із залишковою первинною пухлиною та/або регіонарними метастазами.
Опубліковано результати 2 рандомізованих досліджень III фази, в яких вивчали роль індукційної хіміотерапії перед хірургічним втручанням при лікуванні пацієнтів із резектабельним раком порожнини рота. В італійському дослідженні 195 хворих на резектабельний плоскоклітинний рак порожнини рота II–IV стадії рандомізовано на 2 групи. Пацієнти 1-ї групи отримували 3 курси індукційної поліхіміотерапії за схемою PF із подальшим хірургічним лікуванням. Хворим 2-ї групи проводили хірургічне лікування. Пацієнти обох груп, у яких були несприятливі прогностичні фактори, отримували ПТ після оперативного втручання. Незважаючи на те що у 27% хворих після 3 циклів індукційної хіміотерапії досягнуто повної клінічної відповіді, жодних відмінностей у загальній виживаності, частоті локорегіонарних рецидивів і віддалених метастазів не виявлено. Однак L. Licitra та співавтори відзначають зниження частоти резекції нижньої щелепи після індукційної хіміотерапії [23].
У дослідженні L. Zhong 256 пацієнтів із резектабельним плоскоклітинним раком порожнини рота III–IV стадії також рандомізовано на 2 групи. Хворі 1-ї групи отримували 2 курси індукційної поліхіміотерапії за схемою ТPF із подальшим хірургічним лікуванням та післяопераційною ПТ. У хворих 2-ї групи проводили хірургічне втручання та післяопераційну ПТ. Повну клінічну відповідь, на відміну від попереднього дослідження, відмічено у 13,4% пацієнтів, які отримували індукційну хіміотерапію. Як і в італійському дослідженні, жодної різниці у загальній виживаності та частоті локорегіонарних рецидивів автори не відзначили. Зниження частоти віддалених метастазів у хворих, які отримували індукційну хіміотерапію, було статистично недостовірним [24]. Результати рандомізованих досліджень III фази, в яких вивчали ефективність індукційної хіміотерапії у комплексному лікуванні пацієнтів із резектабельним раком порожнини рота, наведено в табл. 3.
Таблиця 3. Характеристика та результати досліджень, в яких вивчали роль індукційної хіміотерапії у комплексному лікуванні пацієнтів із резектабельним раком порожнини рота
| Автор | Кількість пацієнтів | Характеристика пацієнтів | Порівнювані методи лікування | Показник | ||
| Загальна виживаність, % | Локорегіонарний рецидив, % | Частота віддаленого метастазування, % | ||||
| L. Licitra (2003) | 195 | Резектабельний рак порожнини рота II–IV стадії | ІХ за схемою PF + ХЛ + ПТ проти ХЛ + ПТ | 55 проти 55(5-річний) | 31 проти 32(5-річний) | 7 проти 9(5-річний) |
| L. Zhong (2013) | 256 | Резектабельний рак порожнини рота III–IV стадії | ІХ за схемою ТPF + ХЛ + ПТ проти ХЛ + ПТ | 68,8 проти 68,2(2-річний) | 31,3 проти 30,5(5-річний) | 5,5 проти 8,7(5-річний) |
ІХ — індукційна хіміотерапія; ХЛ — хірургічне лікування
Оскільки рандомізованих досліджень III фази, в яких вивчали б роль ОХПТ на першому етапі лікування пацієнтів із раком порожнини рота, не проводили, нами здійснено аналіз ретроспективних досліджень, присвячених цій проблемі. K. Stenson та співавтори проаналізували результати лікування 111 хворих на рак порожнини рота III–IV стадії, яким проводили ОХПТ. Шийну дисекцію після завершення ОХПТ виконано в осіб з повною регресією первинної пухлини. У групу порівняння ввійшли 27 пацієнтів, які одержали хірургічне лікування з подальшою ОХПТ. 5-річна загальна виживаність і виживаність без прогресування хворих, у яких проведено ОХПТ, становили 65,9 і 66,9% відповідно, а у групі з хірургічним лікуванням та подальшою ОХПТ — 53,0 і 53,6% відповідно. Різниця між групами була статистично недостовірною. 18% пацієнтів уникли глосектомії, яка могла б бути проведена при хірургічному лікуванні на першому етапі. Усього 7,8% хворих, які одержали ОХПТ після завершення лікування, використовували для харчування назогастральний зонд. Частота остеорадіонекрозу у цій групі пацієнтів становила 18% [25].
E. Cohen та співавтори у ретроспективному дослідженні проаналізували результати лікування 39 пацієнтів із місцево-поширеним (Т4) раком порожнини рота, яким проводили ОХПТ. У 16 (42%) із 39 хворих первинна пухлина розповсюдилася на кістку. Шийну дисекцію виконували у пацієнтів із повною регресією первинної пухлини. Загальна 5-річна виживаність, виживаність без прогресування та локорегіонарний контроль становили 56; 51 і 75% відповідно. Частота остеорадіонекрозу — 18%. Автори дійшли висновку, що ОХПТ є ефективною в лікуванні хворих на місцево-поширений (Т4) рак порожнини рота, оскільки виживаність і частота ускладнень зіставні з відповідними показниками при стандартному лікуванні [26].
У дослідженні C. Liao та співавторів 5-річна загальна виживаність хворих на місцево-поширений (Т4) рак порожнини рота, яким проводили хірургічне лікування з подальшою ОХПТ, становила 47% [27].
У рандомізованому дослідженні II фази J. Giralt та співавтори вивчали роль індукційної хіміотерапії з подальшою ОХПТ у хворих на рак порожнини рота та ротоглотки III–IV стадії. Автори проаналізували ефективність такого підходу у 62 пацієнтів, з яких у 67% діагностовано рак порожнини рота. У хворих застосовували 1 цикл індукційної хіміотерапії за схемою PF з подальшою ОХПТ (3 цикли поліхіміотерапії за тією самою схемою на фоні ПТ у сумарній вогнищевій дозі 60 Гр). Повної клінічної відповіді досягнуто у 50% хворих. Органозберігаючі резекції виконано у 14 (22,5%) пацієнтів, розширені резекції з реконструкцією — у 25 (40%). Хоча функціональний статус пацієнтів не був досліджений, автори зазначають, що збереження органа досягнуто у 60% випадків, а 73% із цих хворих без ознак рецидиву захворювання перебували під спостереженням протягом 3 років [28].
Таким чином, індукційна хіміотерапія, проведена перед хірургічним лікуванням, не покращує загальну та безрецидивну виживаність. Рандомізованих досліджень III фази, в яких вивчали б роль ОХПТ у пацієнтів із резектабельним раком порожнини рота III–IV стадії, не проводили. Аналіз ретроспективних досліджень і рандомізованого дослідження II фази продемонстрував, що загальна виживаність і частота ускладнень при застосуванні ОХПТ із подальшим хірургічним лікуванням залишкової пухлини і/або регіонарних метастазів зіставні з аналогічними показниками при стандартному лікуванні. Проте використання ОХПТ на першому етапі лікування дозволяє досягти збереження органа у значної кількості пацієнтів.
Нині ми проводимо дослідження, метою якого є порівняння ефективності ОХПТ із подальшим хірургічним видаленням залишкової пухлини і/або регіонарних метастазів та хірургічного лікування з подальшою ОХПТ у хворих на резектабельний рак порожнини рота III–IV стадії.
ВИСНОВКИ
1. ОХПТ та індукційна хіміотерапія з подальшою ОХПТ є ефективними методами лікування хворих на ПРГШ III–IV стадії, які забезпечують високі показники виживаності та збереження органа. Перспективним може бути застосування таргетних препаратів у поєднанні з ПТ, проте наразі немає даних, як співвідноситься така схема зі стандартною ОХПТ на основі препаратів платини.
2. Стратегію збереження органа у пацієнтів із резектабельним раком порожнини рота III–IV стадії не вивчали у рандомізованих дослідженнях III фази. Стандартом лікування цієї категорії хворих вважають хірургічне втручання з подальшою ПТ або ОХПТ. У невеликій кількості досліджень вивчали можливість застосування ОХПТ на першому етапі лікування, продемонстровано зіставну зі стандартним підходом виживаність при високих показниках збереження органа. Потрібні масштабніші дослідження для вивчення органозберігаючих підходів при лікуванні хворих на резектабельний рак порожнини рота III–IV стадії.
СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ
- Forastiere A.A., Goepfert H., Maor M. et al. (2003) Concurrent chemotherapy and radiotherapy for organ preservation in advanced laryngeal cancer. N. Engl. J. Med., 349: 2091–2098.
- Domenge C., Hill C., Lefebvre J.L. et al. (2000) Randomized trial of neoadjuvant chemotherapy in oropharyngeal carcinoma. French Groupe d’Étude des Tumeurs de la Téte et du Cou (GETTEC). Br. J. Cancer, 83: 1594–1598.
- Shah J., Gil Z. (2009) Current concepts in management of oral cancer surgery. Oral Oncol., 45: 394–401.
- Vermorken J.B. (2005) Medical treatment in head and neck cancer. Ann. Oncol., 16(2): 258–264.
- Specenier P., Vermorken J.B. (2007) Targeted Therapies in head and neck cancer. Target. Oncol., 2(2): 73–78.
- Pignon J.P., Bourhis J., Domenge C. et al. (2000) Chemotherapy added to locoregional treatment for head and neck squamous-cell carcinoma: three meta-analyses of updated individual data. MACH-NC Collaborative Group. Meta-Analysis of Chemotherapy on Head and Neck Cancer. Lancet, 255: 949–955.
- Pignon J.P., Maitre A., Maillard E. et al. (2009) Meta-analysis of chemotherapy in head and neck cancer (MACH-NC): An update on 93 randomised trials and 17,346 patients. Radioth. Oncol., 92: 4–14.
- Forastiere A., Zhang Q., Weber R.S. et al. (2013) Long-Term Results of RTOG 91–11: A Comparison of Three Nonsurgical Treatment Strategies to Preserve the Larynx in Patients with Locally Advanced Larynx Cancer. J. Clin. Oncol., 31(7): 845–852.
- Cooper J.S., Pajak T.F., Forastiere A.A. et al. (2004) Postoperative concurrent radiotherapy and chemotherapy for high-risk squamous-cell carcinoma of the head and neck. N. Engl. J. Med., 350(19): 1937–1944.
- Salama J.K., Saba N., Quon H. et al. (2011) ACR appropriateness criteria adjuvant therapy for resected squamous cell carcinoma of the head and neck. Oral Oncol., 47: 554–559.
- Bernier J., Cooper J.S., Pajak T.F. et al. (2005) Defining risk levels in locally advanced head and neck cancers: a comparative analysis of concurrent postoperative radiation plus chemotherapy trials of the EORTC (22931) and RTOG (9501). Head Neck, 27(10): 843–850.
- Specenier P., Vermorken J.B. (2007) Neoadjuvant chemotherapy in head and neck cancer: Should it be revisited? Cancer Lett., 256(2): 166–177.
- Urba S., Wolf G., Eisbruch A. et al. (2006) Single-cycle induction chemotherapy selects patients with advanced laryngeal cancer for combined chemoradiation: a new treatment paradigm. J. Clin. Oncol., 24(4): 593–598.
- Hitt R., Lopez-Pousa A., Martinez-Trufero J. et al. (2005) Phaze III study comparing cisplatin plus fluorouracil to paclitaxel, cisplatin, and fluorouracil induction chemotherapy followed by chemoradiotherapy in locally advanced head and neck cancer. J. Clin. Oncol., 23(34): 8636–8645.
- Vermorken J.B., Remenar E., Herpen C. et al. (2007) Cisplatin, fluorouracil, and docetaxel in unresectable head and neck cancer. N. Engl. J. Med., 357(17): 1695–1704.
- Posne M.R., Hershock D.M., Blajman C.R. et al. (2007) Cisplatin and fluorouracil alone or with docetaxel in head and neck cancer. N. Eng. J. Med. 357(17): 1705–1715.
- Lorch J.N., Goloubeva O., Haddad R.J. et al. (2011) Induction chemotherapy with cisplatin and fluorouracil alone or in combination with docetaxel in locally advanced squamous-cell cancer of the head and neck: long-term results of the TAX324 randomised phase 3 trial. Lancet Oncol., 12: 153–159.
- Haddad R., O’Neill A., Rabinovits G. et al. (2013) Induction chemotherapy followed by concurrent chemoradiotherapy (sequential chemoradiotherapy) versus concurrent chemoradiotherapy alone in locally advanced head and neck cancer (PARADIGM): a randomized phase 3 trial. Lancet Oncol., 14: 257–264.
- Cohen E., Karrison T., Kocherginsky M. et al. (2012) DeCIDE: A phase III randomized trial of docetaxel (D), cisplatin (P), 5-fluorouracil (F) (TPF) induction chemotherapy (IC) in patients with N2/N3 locally advanced squamous cell carcinoma of the head and neck (SCCHN). Proc. Am. Soc. Clin. Oncol., 30 (suppl): abstr. 5500.
- Ang K., Zhang Q., Wheeler R.H. et al. (2010) A phase III trial (RTOG 0129) of two radiation-cisplatin regimens for head and neck carcinomas (HNC): impact of radiation and cisplatin intensity on outcome. J. Clin., 28(suppl): abstr. 5507.
- Bonner J.A., Harari P.M., Giralt J. et al. (2006) Radiotherapy plus cetuximab for squamous cell carcinoma of the head and neck. N. Engl. J. Med., 354: 567–578.
- Bonner J.A., Harari P.M., Giralt J. et al. (2010) Radiotherapy plus cetuximab for locoregionally advanced head and neck cancer: 5-year survival data from a phase 3 randomised trial, and relation between cetuximab-induced rash and survival. The Lancet Oncol., 11(1): 21–28.
- Licitra L., Grandi C., Guzzo M. et al. (2003) Primary chemotherapy in resectable oral cavity cancer: a randomized clinical trial. J. Clin. Oncol., 21: 327–333.
- Zhong L.P., Zhang C.P., Ren G.X. et al. (2013) Randomized phase III trial of induction chemotherapy with docetaxel, cisplatin, and fluorouracil followed by surgery versus up-front surgery in locally advanced resectable oral squamous cell carcinoma. J. Clin. Oncol., 31: 744–751.
- Stenson K.M., Kunnavakkam R., Cohen E. (2010) Chemoradiation for patients with advanced oral cavity cancer. Laryngos.,120: 93–99.
- Cohen E., Baru J., Huo D. et al. (2009) Efficacy and safety of treating T4 oral cavity tumors with primary chemoradiotherapy. Head Neck, 31: 1013–1021.
- Liao C.T., Chang J.T., Wang H.M. et al. (2006) Surgical outcome of T4a and resected T4b oral cavity cancer. Cancer, 107: 337–344.
- Giralt J., Gonzalez J., Campo J. et al. (2000) Preoperative induction chemotherapy followed by concurrent chemoradiotherapy in advanced carcinoma of the oral cavity and oropharynx. Cancer, 89: 939–945.
Комплексное лечение больных резектабельным раком полости рта III–IV стадии. Современное состояние проблемы
Резюме. На протяжении длительного времени в странах Европы и США стандартом лечения пациентов с резектабельным раком полости рта III–IV стадии является хирургическое вмешательство с последующей лучевой или одновременной химиолучевой терапией. На сегодня органосохраняющие подходы применяют при лечении больных раком гортани, гортаноглотки, ротоглотки, но стандарт лечения рака полости рта не меняется. В статье представлен обзор рандомизированных исследований, посвященных проблеме комплексного лечения пациентов с плоскоклеточным раком головы и шеи в целом и резектабельными злокачественными новообразованиями полости рта III–IV стадии в частности.
резетабельный рак полости рта, комплексное лечение.














Leave a comment