Реконструкція грудей з використанням вільної пересадки TRAM-клаптя в різних модифікаціях при раку грудної залози: аналіз результатів і ускладнень
Галич С.П.1, Смоланка И.И. (старший)2, Дабижа А.Ю.1, Самко К.А.1, Костенко А.А.1, Симулик Е.В., Боровик Д.В.1, Гребень Н.И.1, Терницкая Ю.П.1, Смоланка И.И. (младший)2
- 1ГУ «Национальный институт хирургии и трансплантологии им. А.А. Шалимова» НАМН Украины, Киев
- 2Національний інститут раку, Київ
Резюме. Сучасна концепція хірургічного лікування при раку грудної залози передбачає радикальне оперативне втручання з одномоментним або відстроченим відновленням форми і об’єму груді. Ефективність лікування визначається не тільки кількістю, а й якістю прожитих років. В Україні близько 70% всіх радикальних операцій при раку грудної залози становлять мастектомії в різних модифікаціях. Вільна пересадка MS-TRAM- і DIEP-клаптів є найбільш ефективним методом реконструкції грудної залози із застосуванням власних тканин.
Резюме. Современная концепция хирургического лечения при раке грудной железы предполагает радикальное оперативное вмешательство с одномоментным или отсроченным восстановлением формы и объема груди. Эффективность лечения определяется не только количеством, но и качеством прожитых лет. В Украине около 70% всех радикальных операций при раке грудной железы составляют мастэктомии в различных модификациях. Свободная пересадка MS-TRAM- и DIEP-лоскутов является наиболее эффективным методом реконструкции грудной железы с использованием собственных тканей.
 Современная концепция хирургического лечения при раке грудной железы предполагает радикальное оперативное вмешательство с одномоментным или отсроченным восстановлением формы и объема груди. Эффективность лечения определяется не только количеством, но и качеством прожитых лет. В Украине около 70% всех радикальных операций при раке грудной железы составляют мастэктомии в различных модификациях. Методом выбора при восстановлении формы и объема грудной железы (>500 г) являются реконструкции при помощи собственных тканей.
Современная концепция хирургического лечения при раке грудной железы предполагает радикальное оперативное вмешательство с одномоментным или отсроченным восстановлением формы и объема груди. Эффективность лечения определяется не только количеством, но и качеством прожитых лет. В Украине около 70% всех радикальных операций при раке грудной железы составляют мастэктомии в различных модификациях. Методом выбора при восстановлении формы и объема грудной железы (>500 г) являются реконструкции при помощи собственных тканей.
Реконструкция грудной железы с использованием собственных тканей позволяет получить грудь естественной формы, пластичную, с птозом и нормальной температурой кожных покровов, что редко удается в случае применения синтетических материалов [1, 2].
Наиболее часто для реконструкции грудной железы используют ткани нижних отделов передней брюшной стенки (поперечный лоскут прямой мышцы живота — transverse rectus abdominis myocutaneous, или TRAM-лоскут) [3–5].
В последнее десятилетие ввиду своей травматичности транспозиция TRAM-лоскута на мышечной «ножке» уступает место его свободной пересадке, оставаясь резервным, а не основным методом реконструкции грудной железы.
Свободную пересадку TRAM-лоскута выполняют в различных модификациях: кожно-мышечный TRAM-лоскут, его мышечносохраняющий вариант (muscle-sparing, или MS-TRAM лоскут) и перфорантный TRAM-лоскут (deep inferior epigastric perforator — DIEP). Все эти трансплантаты сходны как по своим анатомическим параметрам, так и характеристикам тканей, получают прямое кровоснабжение от a. epigastrica inferior и позволяют реконструировать грудную железу достаточного объема и хорошей формы. Однако анализ отдаленных результатов операций показал, что пациентки, которым выполнялась реконструкция грудной железы с помощью DIEP-лоскута, отмечали уменьшение болевых ощущений в послеоперационном периоде [6]. Кроме того, снижался риск развития осложнений в донорской зоне и, как следствие, сокращались сроки пребывания пациенток в клинике [7]. Поэтому не удивительно, что DIEP-лоскут приобрел в последние годы особую популярность [3–7]. Так, только в 2015 г., по данным Американского общества пластических хирургов (American Society of Plastic Surgeons), использование перфорантного TRAM-лоскута составило 42% из всех реконструкций грудной железы собственными тканями [9].
Однако многие авторы отмечают высокий риск развития очагов липонекроза в тканях DIEP-лоскута, что, по данным литературы, составляет до 35% и даже более [6, 11, 12]. Это объясняют как менее высоким перфузионным давлением в тканях этого трансплантата за счет одной или нескольких перфорантных артерий в сравнении с TRAM-лоскутом, так и пересечением сосудистых связей между отдельными зонами кровоснабжения («перфорасомами») при выделении лоскута [3, 10, 13, 14].
Кроме того, требуется тщательная хирургическая техника при выделении перфорантных артерий и всего тканевого комплекса, что занимает много времени.
Данные литературы противоречивы в отношении как показаний, так и уровня осложнений при реконструкции грудной железы с использованием двух наиболее перспективных трансплантатов — MS-TRAM- и DIEP-лоскутов [13, 15, 16]. Между тем, клинический опыт свидетельствует, что оба метода реконструкции являются безопасными и надежными, и при правильно выбранных показаниях позволяют добиться максимальных эстетических результатов операции [2–4, 8, 17].
Целью настоящего исследования был анализ результатов свободной пересадки MS-TRAM- и DIEP-лоскутов с уточнением показаний к каждому из этих методов реконструкции, исходя из необходимого объема трансплантата и особенностей кровоснабжения его тканей.
Объект и методы исследования
Под нашим наблюдением находились 90 пациенток в возрасте от 19 до 52 лет, которым выполнялась реконструкция грудной железы после мастэктомии с использованием свободной пересадки MS-TRAM-лоскута и перфорантного лоскута (DIEP-лоскут).
У 12 пациенток выполнена первичная реконструкция и у 78 — вторичная.
При выборе метода первичной (одномоментной) реконструкции прежде всего учитывали объем удаленных при мастэктомии тканей. При отсроченной (вторичной) реконструкции основополагающей была правильная оценка исходных данных: особенностей тканевого дефекта в зоне мастэктомии, состояния окружающих тканей, наличия или отсутствия субмаммарной складки и параметров контралатеральной грудной железы.
Оценивали также состояние и объем тканей в донорской зоне, наличие или отсутствие послеоперационных рубцов.
Наряду с общепринятыми клиническими тестами у всех пациенток изучали ангиоархитектонику донорской зоны и оценивали состояние артерий реципиентного участка. С этой целью проводили ультразвуковое (УЗ)-исследование, компьютерную или магнитно-резонансную томографию с ангиографией и термометрию. Анализ полученных данных давал возможность предоперационно оценить состояние и определить параметры a. и v. мammaria internae, a. и v. thoracodorsalis, a. и v. epigastrica inferior, места выхода и параметры наиболее значимых перфорантных артерий донорской зоны, а также состояние прямых мышц живота и степень диастаза между ними (рис. 1).
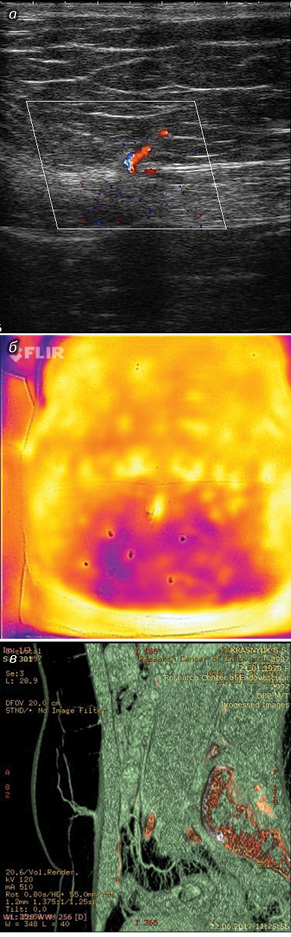
УЗ-сканирование сосудов проводили с помощью аппаратов «Technos MPX» («Escaote» MyLab 25, Италия) c линейными датчиками частотой 7,5; 10 и 12,5 МГц. Использовали также «CE OPTIMACT 660» — высокоскоростной мультиспиральный компьютерный томограф с возможностью получения 64 изображений-срезов за один оборот комплекса «излучатель-детекторы».
Термографию выполняли с помощью термографа «FLIR», подключенного к iPhone 5 или 6S. Данные обрабатывали по специальным программам «FLIR ONE» и «FLIR ONE PAINT», позволяющим определить локализацию перфорантных сосудов в разных цветовых спектрах.
На основании всестороннего анализа полученных данных определяли оптимальный метод реконструкции.
Выполнили пересадку MS-TRAM- лоскута у 7 пациенток с первичной и у 42 — с вторичной реконструкцией (в одном случае проведена двухсторонняя пересадка). В таких случаях в состав лоскута включался лишь небольшой фрагмент мышцы с участком передней стенки апоневроза в местах выхода основных перфорантных артерий (рис. 2).
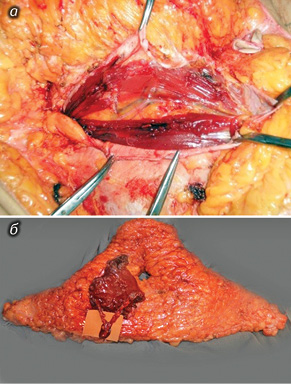
Пересадку DIEP-лоскута произвели в 41 случае: в 5 — при первичной (в одном случае двухсторонняя пересадка) и 36 — при вторичной реконструкции грудной железы. В этих случаях в состав лоскута мышца не включалась, а сохранялась лишь тонкая мышечная «муфта» вокруг мобилизированных перфорантных сосудов (рис. 3).

У пациенток, придерживающихся интенсивного режима питания, при растянутых прямых мышцах живота с диастазом >2 см и необходимости реконструкции грудной железы значительного объема (>900 г) предпочтение отдавали свободной пересадке MS-TRAM-лоскута.
На основании своего предыдущего клинического опыта DIEP-лоскут использовали в основном у пациенток молодого возраста с наличием избытка тканей в области передней брюшной стенки, но без значительного растяжения прямых мышц живота, с небольшим или средним объемом контралатеральной грудной железы (до 700–800 г) [8]. Безусловное предпочтение DIEP-лоскуту отдавали у нерожавших женщин, поскольку подъем данного трансплантата вызывал минимальные нарушения в донорской зоне и сводился, по сути, к эстетической абдоминопластике.
В 6 случаях при первичной реконструкции грудной железы и в 3 случаях при вторичной в качестве донорских сосудов использовали a. и v. thoracodorsalis. У всех остальных пациенток предпочтение отдавали a. mammaria internaе, коротая обеспечивает более высокое перфузионное давление в тканях трансплантата по сравнению с a. thoracodorsalis (соответственно 27±12 и 5±2 мл/мин), что подтверждено рядом исследований [18].
В трех случаях после включения DIEP-лоскута в кровоток отметили выраженный венозный стаз в его тканях, что потребовало наложения дополнительного анастомоза между v. epigastrica superficialis и ветвью поверхностной вены реципиентной зоны.
При закрытии донорской зоны у пациенток, которым выполняли пересадку TRAM-лоскута или MS-TRAM-лоскута, в большинстве случаев закрывали дефект апоневроза прямой мышцы живота с помощью синтетической сетки. При подъеме DIEP-лоскута апоневроз ушивали первично.
У всех пациенток обеих клинических групп в послеоперационный период осуществляли постоянный мониторинг за состоянием пересаженных комплексов тканей с использованием общепринятых клинических тестов и УЗ-контроля области микроанастомозов. В отдаленный послеоперационный период стандартные контрольные осмотры проводили в сроки 1; 3; 6 и 12 мес.
Через 3–4 мес после первого этапа реконструкции восстанавливали сосково-ареолярный комплекс и при необходимости выполняли корригирующие операции как на реконструированной (коррекция рубцов, субмаммарной складки, липофиллинг и т.д.), так и на здоровой контралатеральной грудной железе (увеличивающая или редукционная маммопластика, мастопексия).
В 7 случаях (5 наблюдений MS-TRAM- и 2 наблюдения DIEP-лоскут) пациентки отказались от выполнения II этапа реконструкции, ограничившись сформированным возвышением грудной железы.
Результаты
Оценку результатов проводили отдельно в каждой группе пациенток.
В I группе (MS-TRAM-лоскут) осложнения раннего послеоперационного периода со стороны лоскута отмечены в 11 случаях. Они включали гематому в области реконструированной грудной железы (1), серому (2), частичное расхождение швов и инфицирование раны (2). В одном случае отмечен тотальный некроз пересаженного лоскута; в 3 — частичный некроз и в 2 — краевой.
Со стороны донорской зоны у 2 пациенток зафиксирован частичный некроз пупка, еще у 2 — серома и у 3 — частичное инфицирование и расхождение краев раны.
Необходимо отметить, что количество перфорантных артерий, включенных в состав MS-TRAM-лоскута, во всех случаях составляло не менее 3 (с диаметром до 1 мм). При анализе отдаленных результатов реконструкции липонекроз различной степени в тканях пересаженных и прижившихся лоскутов отмечен в 4 случаях.
Липонекроз определяли как уплотненные участки или узлы в тканях лоскута не менее 1,5–2 см в диаметре, образовавшиеся не ранее 1–1,5 мес после операции без вовлечения в процесс прилегающих кожных покровов.
Для более объективной оценки степени липонекроза использовали шкалу M. Nahabedian и соавторов (2001): незначительный липонекроз (<5% объема), умеренный (5–20%) и выраженный (>20%).
У 2 пациенток отметили умеренный липонекроз и еще у 2 без видимых признаков нарушения кровообращения в тканях лоскута в ранний послеоперационный период выявлены отдельные очаги незначительного и умеренного липонекроза. Отмеченные отдельные плотные узлы в тканях по линии швов у некоторых пациенток во внимание не принимали, связывая это с реакцией организма на рассасывающиеся нити, что неоднократно наблюдалось при выполнении других различных операций.
Таким образом, общий уровень липонекроза в тканях MS-TRAM-лоскута составил 8,16%.
При функциональном исследовании донорской зоны в отдаленный послеоперационный период истинных грыж не выявлено. В 2 случаях отмечен послеродовой пролапс передней брюшной стенки в месте забора TRAM-лоскута, потребовавший корригирующей операции с использованием сетчатого протеза.
Во ІІ клинической группе (DIEP-лоскут) в ранний послеоперационный период различные осложнения со стороны лоскута отмечены у 8 пациенток, гематома — у 2, расхождение краев раны с инфицированием — у 1; в 2 случаях зафиксирован тотальный некроз пересаженного лоскута, в 2 — частичный и в 1 — краевой. Кроме того, в донорской зоне отмечены: гематома (1), серома (1), инфицирование и частичный некроз пупка в одном наблюдении.
Необходимо подчеркнуть, что у 3 пациенток ІІ группы кровоснабжение лоскута осуществлялось за счет одной крупной перфорантной артерии (1,2; 1,5 и 2 мм); в 19 случаях — за счет двух перфорант диаметром >1 мм; в 16 случаях — трех (одна или две из них диаметром >1 мм) и в 3 наблюдениях — четырех перфорант.
В отдаленный послеоперационный период анализ состояния прижившихся лоскутов выявил очаги липонекроза в 8 наблюдениях. В 2 случаях отмечен незначительный некроз, в 5 — умеренный и в 1 — выраженный. Необходимо отметить, что у 3 из 8 пациенток с очагами липонекроза в состав трансплантата входили частично ткани III зоны.
Таким образом, общий уровень липонекроза составил 20%.
Анализ результатов также показал, что ни в одном случае не наблюдался липонекроз, если в состав лоскута включали только ткани I и II зон, объем трансплантата не превышал 700 г, с одной или двумя доминантными (≥1,5) перфорантными артериями. С увеличением объема трансплантата риск липонекроза возрастал: при объеме трансплантата до 900 г в 3 случаях отмечен липосклероз на 3 перфорантах и в одном случае — при объеме лоскута около 1000 г на 4 перфорантных артериях (одна диаметром >1 мм и три — до 1 мм). В остальных случаях липонекроз развился при использовании сравнительно небольших трансплантатов (до 800 г) на 2–3 перфорантах, однако диаметр перфорантных артерий составлял ≤1 мм.
Обсуждение
На сегодня свободная пересадка MS-TRAM- и DIEP-лоскутов является наиболее популярным методом реконструкции грудной железы с использованием собственных тканей.
Однако основной проблемой при применении этих лоскутов является риск развития очагов липонекроза в их тканях в связи с особенностью кровоснабжения различных участков трансплантата. Липонекроз вызывается ишемией подкожно-жировой клетчатки, приводящей к некрозу клеток жировой ткани и последующему рубцеванию, что симулирует рецидив заболевания как клинически, так и рентгенологически [13]. На маммограммах это может проявляться неоднородной плотностью тканей и микрокальцификатами [19]. В литературе риск развития липонекроза при использовании комплексов тканей их нижних отделов брюшной стенки колеблется от 3,0% (при пересадке TRAM-лоскута) до 42,9% (DIEP-лоскута) [12, 15].
I. Khansa и соавторы (2013) проанализировав 172 англоязычных источника, базирующихся на 10 764 реконструктивных операциях у 8970 пациенток с использованием комплексов тканей из нижних отделов передней брюшной стенки, и пришли к выводу, что средний уровень липонекроза составляет 11,3%. Если исключить TRAM-лоскут на мышечной «ножке», то частота развития липонекроза при пересадке TRAM-лоскута составляет 6,9%, а DIEP-лоскута — 14,4% [6].
Метаанализ 13 исследований, проведенный X.-L. Wang и соавторами в 2014 г. с изучением данных 1843 пациенток, не выявил статистически достоверной разницы в уровне общих осложнений при использовании MS-TRAM- и DIEP-лоскутов [5].
Некоторые авторы не находят особого различия в степени липосклероза при использовании MS-TRAM- и DIEP-лоскутов [16]. Однако другие, напротив, четко демонстрируют разницу, подчеркивая, что липонекроз развивается в 4–5 раз чаще при применении DIEP-лоскута [12]. В ходе своих исследований мы попытались проанализировать результаты обеих методик на примерно одинаковых по численному составу группах пациенток.
Анализируя осложнения раннего послеоперационного периода, не отмечали статических достоверных отличий в уровне и характере осложнений у пациенток обеих групп, что совпадает с данными других исследователей [5, 10, 17].
При пересадке DIEP-лоскута обращали на себя внимание признаки затрудненного венозного оттока, главным образом на периферии трансплантата (17 наблюдений). Эти симптомы появлялись обычно к концу операции и исчезали через 3–4 дня. Очевидно, это объясняется временным спазмом тонких коммитантных вен при выделении перфорантных сосудистых пучков. Однако, как уже отмечалось выше, в 3 случаях ввиду выраженного венозного стаза интраоперационно потребовалось наложение дополнительного анастомоза между v. epigastrica superficialis и ветвью поверхностной вены реципиентной зоны.
По мнению ряда авторов, в таких случаях ввиду особенностей строения венозной системы отток из тканей в донорской зоне идет преимущественно по системе v. epigastrica superficialis, и мелкие перфорантные вены не в состоянии обеспечить адекватный венозный дренаж [20]. Очевидно, в наших 3 случаях мы столкнулись с аналогичной проблемой.
Анализ отдаленных результатов исследования показал, что важную роль в выборе вида лоскута играет как общее количество перфорантных артерий, входящих в состав трансплантата, так и их диаметр.
J. Lindsay (2011), напротив, не считает важным критерием профилактики липосклероза количество перфорантных артерий. Главным является диаметр перфорант, который в исследованиях автора варьировал от 1,5 до 3 мм. Автор подчеркивает, что количество перфорант не в состоянии снизить степень липонекроза, если их диаметр <1,5 мм, и пересадка DIEP-лоскута в таких случаях бесперспективна [16].
Действительно, при отсутствии дополнительных перфорантных артерий с диаметром >1 мм предпочтительнее использование TRAM- либо MS-TRAM-лоскута. Эти лоскуты могут использоваться для реконструкции грудной железы практически любого объема, но особенно показаны при грудной железе >1000 г, когда требуется включение в состав трансплантата части тканей контралатеральной стороны, что подтверждается результатами исследований других авторов [10, 15, 17].
Безусловно, DIEP-лоскут, при наличии крупных перфорантных артерий, также может использоваться при реконструкции грудной железы значительного объема [21].
В наших исследованиях 1–2 доминантные перфорантные артерии (с диаметром >1 мм) обеспечивали достаточную перфузию тканей лоскута объемом 700–800 г. Однако с увеличением объема лоскута повышался и риск развития очагов липонекроза. В таких случаях отмечалась прямая зависимость степени липонекроза от количества крупных перфорантных артерий, входящих в состав трансплантата.
Нельзя не согласиться с D. Baumann и соавторами (2010) в том, что и количество перфорантных артерий, и связи между ними также играют значительную роль в обеспечении адекватного кровоснабжения всего объема тканей пересаженного лоскута. Так, в нескольких случаях при использовании DIEP-лоскута достаточного объема с крупными перфорантными артериями мы выявили очаги липонекроза, в то время как при наличии 4–5 перфорантных артерий <1 мм при MS-TRAM-лоскуте соответствующего объема таких осложнений не отмечали.
Очевидно, важную роль играют не только отдельно взятые перфорантные артерии достаточного диаметра, а и особенности внутритканевой ангиоархитектоники и связи между отдельными «перфорасомами», на что указывают исследования ряда авторов [22, 23].
В целом же можно согласиться с мнением большинства исследователей, что при отсутствии доминантной перфорантной артерии (≥1,5 мм) и наличии >4 перфорант преимущество следует отдавать пересадке MS-TRAM-лоскута [11, 16, 17].
С нашей точки зрения идеальной кандидаткой для DIEP-лоскута является молодая некурящая женщина нормостенического телосложения с избытком тканей в области нижней трети живота и контралатеральной грудной железой малого или среднего объема.
В своих исследованиях мы не отметили значительного преимущества DIEP-лоскута в сравнении с MS-TRAM-лоскутом при оценке функциональных нарушений в донорской зоне. Только у 2 пациенток в своих ранних исследованиях отметили послеродовой пролапс в месте подъема свободного TRAM-лоскута. Необходимо отметить, что в обоих случаях не применяли синтетический имплантат, первично ушив апоневроз прямой мышцы живота. В дальнейшем при использовании небольших фрагментов сетки ни в одном случае не выявили функционального дефицита со стороны брюшной стенки. После подъема свободного TRAM- или MS-TRAM-лоскута не отмечают существенной разницы при выполнении теста «sit-up» у пациенток с DIEP- и MS-TRAM-лоскутами и другие авторы [24]. В то же время в некоторых исследованиях регистрируют частые осложнения в донорской зоне при выделении DIEP-лоскута, в частности некрозы пупка и длительное заживление ран [4].
Мы не нашли достоверной разницы при оценке этого вида осложнений у пациенток обеих групп.
Подводя итог можно заключить, что реконструкция грудной железы с применением DIEP- и MS-TRAM-лоскутов является надежной и безопасной операцией. При взвешенном, дифференцированном подходе оба метода позволяют качественно выполнить реконструкцию грудной железы (рис. 4, 5).
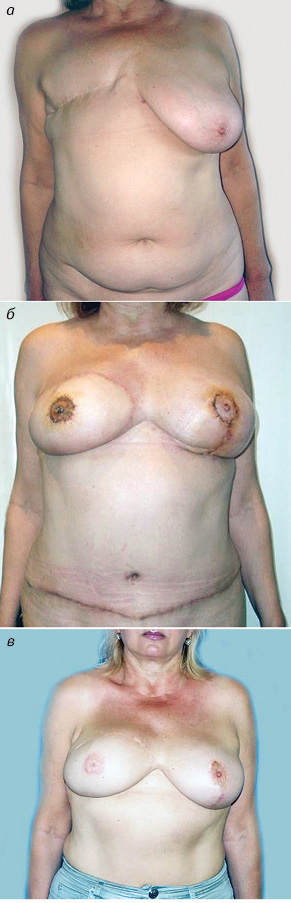
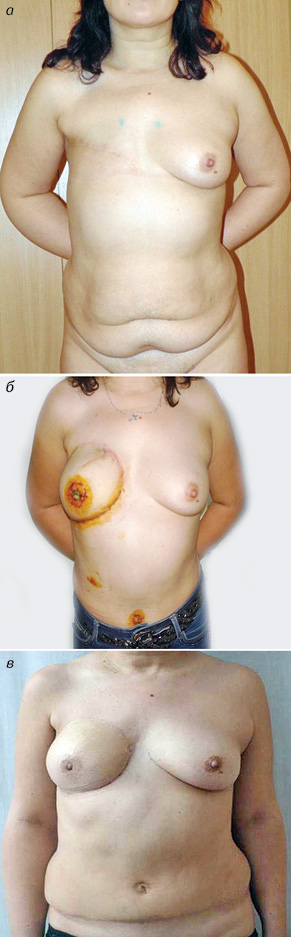
Для достижения максимальных эстетических результатов необходимо тесное сотрудничество онкологов и пластических хирургов, а операции должны выполняться на базе специализированных учреждений, имеющих значительный опыт подобных вмешательств.
Выводы
1. При минимальных нарушениях в донорской зоне риск развития липонекроза при применении DIEP-лоскута достоверно выше в сравнении с MS-TRAM-лоскутом.
2. Основными факторами, определяющими выбор между DIEP- и MS-TRAM-лоскутом, являются количество и диаметр перфорантных сосудов (в том числе вен), а также объем трансплантата.
3. При наличии 1–2 крупных перфорантных артерий (диаметром >1 мм) и требуемом объеме тканей до 700–800 г предпочтение следует отдавать DIEP-лоскуту.
4. При необходимости использования для реконструкции значительного объема тканей (более ⅔ стандартного TRAM-лоскута), отсутствии доминантных перфорант и наличии 3–4 и более перфорантных артерий методом выбора следует считать MS-TRAM-лоскут.
5. При правильно выбранных показаниях оба метода позволяют достичь максимально высоких результатов операции.
Список использованной литературы
1. Bresser P., Seyhaeve C., Van Gool A. et al. (2006) Satisfaction with prophylactic mastectomy and breast reconstruction in genetically predisposed women. Plast. Reconstr. Surg., 117: 1675–1682.
2. Eltahir Y., Werners L., Dreise M. et al. (2015) Which breast is the best? Successful autologous or alloplastic breast reconstruction: patient-reported quality-of-life outcomes. Plast. Reconstr. Surg., 35: 43–50.
3. Kamali P., Lee M., Becherer B. et al. (2017) Medial row perforators are associated with higher rates of Fat necrosis in Bilateral DIEP flap breast reconstruction. Plast. Reconstr. Surg., 140(1): 19–24.
4. Chao M.-J., Teotia S.S., Haddock N. (2017) Predictors, classification, and management umbilical complication in DIEP flap breast reconstruction. Plast. Reconstr. Surg., 140(1): 11–18.
5. Wang X.-L., Lin L.-B., Song F.-M. et al. (2014) Meta-analysis of the safety and factors contributing to complications of MS-TRAM, DIEP and SIEA flaps for breast reconstruction. Aesth. Plast. Surg., 38: 681–691.
6. Khansa I., Momoh A., Patel P. et al. (2013) Fat necrosis in autologeous abdomen-based breast reconstruction: a systematic review. Plast. Reconstr. Surg., 131: 443–452.
7. Wu L., Bajaj A., Chang D., Chevray P. (2008) Comparison of donor-site morbidity SIEA, DIEP and muscle-sparing TRAM flaps for breast reconstruction. Plast. Reconstr. Surg., 122: 702–709.
8. Галич С.П., Дабижа А.Ю., Смоланка И.И. и др. (2008) Вторичная реконструкция молочных желез после мастэктомии по поводу рака. Онкология, 10(3): 328–332.
9. American Society of Plastic Surgeons. Plastic surgery statistics report 2015. Available at: https: //d2wirczt3b6wjm.cloudfront. net/news/statistics/2015/plastic-surgery-statistic- full-report-2015.pdf. Accessed November 1, 2016.
10. Kroll S. (2000) Fat necrosis in free transverse rectus abdominismyocutaneous and deep inferior epigastric perforator flaps. Plast. Reconstr. Surg., 106: 576–583.
11. Chen C., Halvorson E., Disa J. et al. (2007) Immediate postoperative complication in DIEP versus Free/Muscle-Sparing TRAM flaps. Plast. Reconstr. Surg., 120: 1477–1482.
12. Scheer A., Novak C., Naligan P. et al. (2006) Complications associated with breast reconstruction using a perforator flap compared with a free TRAM flap. Ann. Plast. Surg., 56: 355–358.
13. Baumann D.P., Lin H., Chevray P. (2010) Perforator number predicts fat necrosis in a prospective analysis of breast reconstruction with free TRAM, DIEP and SIEA flaps. Plast. Reconstr. Surg., 125: 1335–1341.
14. Holm C., Mayr M., Hӧfter E. et al. (2006) Perfusion zones the DIEP flap revisited: a clinical study. Plast. Reconstr. Surg., 117: 37–43.
15. Vega S., Smart J., Jiang S. et al. (2008) 500 consecutive patients with free TRAM flap breast reconstruction: a single surgeon experience. Plast. Reconstr. Surg., 122: 329–339.
16. Lindsey J. (2011) Perforator number does not predict fat necrosis. Plast. Reconstr. Surg., 127: 1391–1392.
17. Nahabedian M., Momen B., Galdino G. et al. (2001) Breast reconstruction with the free TRAM or DIEP flap: patient selection, choice of flap, and outcome. Plast. Reconstr. Surg., 10(2): 466–475.
18. Lorenzetti F., Salmi A., Von K. et al. (1999) Transit time and ultrasonic flowmeter and color Doppler to evaluate hemodynamic changes in the free TRAM flap and its donor site. XII Congress of the Int. Conf. Plast. Rec. Aesth. Surg., 170.
19. Kim S., Park J. (2004) Mammographic and ultra-sonographic features after autogenous myocutaneus flap reconstruction mammoplasty. J. Ultrasound Med., 23: 275–282.
20. Blondeel P., Arnstein M., Verstraete K. et al. (2000) Venous congestion and blood flow in free transverse rectus abdominis myocutaneous and deep inferior epigastric perforator flaps. Plast. Reconstr. Surg., 106: 1295–1301.
21. Garvey P., Buchel E., Pockaj E. et al. (2005) The deep inferior epigastric perforator flap for breast reconstruction in overweight and obese patient. Plast. Reconstr. Surg., 115: 447–453.
22. Wong C., Saint-Cyr M., Arbique G. et al. (2009) Three- and four-dimensional computed tomography angiographic studies of commonly used abdominal flaps in breast reconstruction. Plast. Reconstr. Surg., 124: 18–27.
23. Rahmanian-Schwarz A., Rothenberger J., Hirt B. et al. (2011) A combined anatomical and clinical study for quantitative analysis of the microcirculation in the classic perfusion zones of the deep inferior epigastric artery perforator flap. Plast. Reconstr. Surg., 127: 505–513.
24. Bajaj A., Chevray P., Chang D. (2006) Comparison of donor-site complications and functional outcomes in free muscle-sparing TRAM flap and free DIEP flap breast reconstruction. Plast. Reconstr. Surg., 117: 737–741.
Адрес:
Смоланка Иван Иванович
03022, Киев, ул. Ломоносова, 33/43
Национальный институт рака
E-mail: iismolanka@gmail.com














Leave a comment