Сравнительный анализ результатов хирургического лечения больных раком пищевода с использованием традиционного и мини-инвазивного метода
Резюме. Статья посвящена определению роли мини-инвазивной техники оперирования. Данные основываются на опыте выполнения 127 операций на пищеводе и кардиоэзофагеальной зоне, проведенных с 2001г. по 2013 г. Больные разделены на 2 группы: 53 пациентам (контрольная группа) выполнена мобилизация грудного отдела пищевода по традиционной технике и 74 больным (основная группа) медиастинальный этап операции осуществлен с видеоассистированием с применением эндохирургического инструментария. Вмешательства выполнены при локализации процесса на уровне средне- и нижнегрудного отдела. Оценку эффективности методики проводили в зависимости от времени, затраченного на вмешательство, объема кровопотери, количества койко-дней, частоты легочных осложнений. В контрольной группе на операцию затрачено 363±20 мин, в основной — 303±20 мин. Объем интраоперационной кровопотери в контрольной группе составил 578,2 мл, в основной — 361±25 мл (р<0,05). Отмечено снижение частоты легочных осложнений с 10,5 до 3,4%, а количества койко-дней — с 22,2±2,1 до 18,4±2,1 дня. Таким образом, преимуществом изучаемой методики являлись меньшая травматичность, хорошая визуализация, раннее восстановление функции легких, уменьшение количества послеоперационных осложнений.
 Введение
Введение
Моноблочная расширенная лимфодиссекция по принципиальным соображениям с учетом путей регионарного лимфогенного метастазирования — идеология современной хирургии рака пищевода [1]. Именно поэтому в настоящее время актуальным и очень важным для достижения успеха хирургического лечения остается вопрос выбора онкологически адекватного оперативного доступа у больных раком грудного отдела пищевода. Широко применяемые в различных клиниках варианты — далеко не равноценны с точки зрения повышения уровня радикализма.
В структуре заболеваемости злокачественными новообразованиями рак пищевода занимает в Узбекистане 7-е место. Стандартизованный показатель заболеваемости раком пищевода в 2013 г. составил 2,8 на 100 000 населения, смертность достигла 1,3%. У выявленных за 2013 г. 2337 больных III и IV стадия процесса установлена у 67 и 22,1% соответственно.
При традиционной технике оперирования при реконструктивно-восстановительных операциях на пищеводе и кардиоэзофагеальной зоне все этапы операции выполняют острым путем, то есть мобилизацию органа (пищевода, желудка, большого сальника и т.д.), диссекцию тканей осуществляют ножницами, или тупым путем, гемостаз выполняют перевязкой или прошиванием тканей. Острая мобилизация пищевода с медиастинальной лимфодиссекцией часто становится причиной ранения органов грудной клетки, повышения крово- и лимфопотери, увеличения количества интра- и послеоперационных осложнений. Острая мобилизация желудка с абдоминальной лимфодиссекцией повышает травматичность оперативного вмешательства (повреждение органов и структур, кровотечение) и снижает радикальность операции при опухолевом процессе (возможность оставления жировой ткани с метастатическими лимфатическими узлами). Значительное количество крово- и лимфопотери, травматичность и длительность операции приводят к возникновению тяжелых осложнений в послеоперационный период, таких как тромбоэмболия легочной артерии, аритмия, пневмония и плевриты, внутриполостные кровотечения, длительные лимфореи, инфекционные осложнения и т.д.
Стремление минимизировать травматичность и количество послеоперационных осложнений хирургических вмешательств по поводу рака грудного отдела пищевода стимулировало развитие видеоэндоскопических подходов. Однако целесообразность и преимущества эндоскопических вмешательств перед стандартными требуют дальнейшего изучения.
В настоящий момент существуют разные подходы и методики видеоэндоскопических операций на пищеводе [2]. Первой и наиболее распространенной методикой стала торакоскопическая резекция грудного отдела пищевода с последующим его замещением желудком или кишкой традиционным или лапароскопическим способом.
Другая методика — видеоассистирующая резекция пищевода, которая дополняется мини-торакотомией, не превышающей 5 см, облегчающей мобилизацию пищевода и лимфодиссекцию [3]. Ряд хирургов, выполняя субтотальную резекцию пищевода трансхиатальным способом, осуществляют только лапароскопическую [4] мобилизацию желудка и выкраивание из него трансплантата при помощи эндоскопических сшивателей либо сочетают ее с мини-лапаротомным доступом. Выделение пищевода в средостении и проведение через него подготовленного трансплантата также производят под контролем введенного через пищеводное отверстие диафрагмы видеотелескопа.
В анализе публикаций последних лет есть данные о вмешательствах, выполненных с помощью роботизированной техники; отдаленные результаты находятся в стадии изучения [5].
Учитывая вышесказанное, целью нашего исследования стал сравнительный анализ результатов хирургического лечения больных раком пищевода с использованием традиционных и мини-инвазивных методов [6].
В своей работе мы, как и многие другие авторы [7], использовали методику медиастиноскопического выделения пищевода с формированием искусственного пищевода из лапаротомного доступа, так как при операциях по поводу рака пищевода, особенно локализованного на уровне и ниже бифуркации трахеи, есть возможность достичь необходимого радикализма без выполнения торакотомии, кроме того, сохраняется стабильность положения больного на операционном столе. Методика операции включает три основных этапа: 1) лапаротомию для выполнения гастропластики, с лимфодиссекцией в объеме D2; 2) видеоассистированную мобилизацию пищевода с адекватной лимфодиссекцией; 3) наложение цервикального эзофагогастроанастомоза.
Для снижения риска развития интраоперационных осложнений и повышения радикальности операции за счет улучшения визуализации зон оперирования и увеличения зон лимфодиссекции мы предлагаем медиастинальный трансхиатальный этап операции выполнять под видеоконтролем с применением эндохирургического инструментария. При видеоассистированной методике оперирования достигается хорошая визуализация всех отделов средостения, что позволяет безопаснее выполнить медиастинальную лимфодиссекцию. После лапаротомии и ревизии зон возможного метастазирования выполняется широкая сагиттальная диафрагмотомия. Под видеоконтролем осуществляем мобилизацию пищевода. При этом хорошо визуализируются структуры средостения и плевра, что позволяет выполнить адекватную лимфодиссекцию и визуально контролировать безопасность операции.
Объект и методы исследования
Проанализированы результаты лечения 378 больных, получавших терапию в отделении торакальной онкохирургии Республиканского онкологического научного центра МЗ Республики Узбекистан в период с 2000 по 2012 г. В табл. 1 приведены выполненные вмешательства.
Таблица 1. Лечение в отделении торакальной онкохирургии
| № | Операции | n | % |
| 1 | Трансторакальная резекция пищевода — операция по типу Льюиса | 72 | 19 |
| 2 | Трехдоступная эзофагэктомия — операция МакКьюна | 57 | 15,1 |
| 3 | Трансхиатальная эзофагэктомия | 249 | 65,9 |
| Всего | 378 | 100 |
Из общего количества пациентов мужчин было 170 (44,8%), женщин — 208 (55,2%). Протяженность опухолевого процесса в грудном отделе пищевода: 3–5 см — у 92, 5–8 см — у 259, >8 см — у 27 больных.
Важной задачей было обеспечение сопоставимости основной и контрольной групп, без чего невозможно объективное сравнение результатов лечения. Сопоставимость была достигнута путем индивидуального подбора пациентов контрольной группы по параметрам отдельных пациентов основной группы, при этом учитывали только пол, возраст, основное заболевание, стадию и способ хирургического лечения, бригаду хирургов, выполнявших вмешательство.
В зависимости от уровня поражения пищевода у 40 (10,6%) больных опухоль локализовалась в верхнегрудном отделе, у 196 (51,8%) — в среднегрудном (проекция бифуркации трахеи) и у 142 (37,6%) — нижнегрудном.
В табл. 2 показано распределение больных по ТNM классификации. Гистологическая структура опухоли: плоскоклеточный рак — 312 (82,5%), аденокарцинома — 66 (17,5%).
Таблица 2. Распределение больных по ТNM классификации
| Стадия | TNM | Количество больных (n=378) | |
| n | % | ||
| I | T1N0M0 | 2 | 0,5 |
| IIА | T2N0M0 | 2 | 0,5 |
| T3N0M0 | 1 | 0,26 | |
| IIB | Т1N1М0 | − | − |
| Т2М1М0 | 2 | 0,50 | |
| III | ТЗN1М0 | 222 | 58,90 |
| Т4NлюбаяМ0 | 149 | 39,3 | |
| IV | ТлюбаяNлюбаяМ1 | 0 | 0 |
Выбор типа операции зависел от локализации опухолевого процесса пищевода, возраста и общего состояния больного. Трансхиатальную (абдоминоцервикальную) экстирпацию пищевода выполняли больным с низкими функциональными показателями, при локализации опухолевого процесса в средне- и нижнегрудном отделах пищевода.
Для сравнения выбрана группа больных с трансхиатальной эзофагэктомией, которым до 2005 г. операцию выполняли по традиционной методике, а начиная с 2006 г. — с применением видеоассистирования, эндоскопического инструментария и эндоскопической техники оперирования.
У всех больных эзофагогастроанастомоз сформирован на шее по методу отделения «конец в бок», поэтому обладает антирефлюксными свойствами, позволяющими осуществлять раннее энтеральное питание за счет формирования шейной гастростомы.
После выполнения лапаротомии и установки ранорасширителя Сигала проводили диафрагмотомию по Савиных. При мобилизации пищевода с помощью эндохирургического инструментария применяли биполярную коагуляцию. Отслоение жировой клетчатки от перикарда, нижних легочных связок, пересечение боковых связок пищевода осуществляли путем диссекции с помощью эндохирургического биполярного эндодиссектора, после чего поэтапно мобилизовали переднюю и боковые стенки пищевода с опухолью до и выше бифуркации трахеи (рис. 1)

Далее аналогичным образом мобилизовали заднюю поверхность пищевода, отделяя ее от предпозвоночной фасции и аорты. Всю мобилизацию пищевода проводили с одновременным моноблочным разъединением параэзофагеальной клетчатки с лимфатическими узлами и лимфоколлекторами (не только с лимфатическими узлами, но и всем лимфатическим аппаратом — лимфатическими сосудами, нервными сплетениями с окружающей жировой клетчаткой) путем поэтапной коагуляции тканей (рис. 2).

Удаляли следующие группы лимфоузлов: параэзофагеальные, задние медиастинальные, левые и правые паратрахеальные, бифуркационные, правые трахеобронхиальные.
Визуализация с помощью эндохирургического инструментария значительно упрощает и делает менее травматичным трансхиатальное выделение пищевода. Коагуляцию и рассечение тканей производили в основном торакоскопическими инструментами. При возникновении трудностей для дифференцировки тканей в области опухоли потребовалась пальпация (большинство пациентов оперировали в III стадии заболевания).
Результаты и их обсуждение
Оценку эффективности предлагаемой методики проводили в зависимости от объема кровопотери, времени, затраченного на выполнение оперативного вмешательства, количества послеоперационных койко-дней, частоты легочных осложнений, а также от частоты ранних послеоперационных вмешательств соответственно виду операции.
На рис. 3 показана частота ранних послеоперационных осложнений. Одним из критериев оценки эффективности методики являлось определение общего объема гемотрансфузии; доказана статистически значимая разница при применении предлагаемой методики по сравнению с традиционной (р<0,05): в контрольной группе объем гемотрансфузии составил 562,2 мл, в основной — 308 мл.
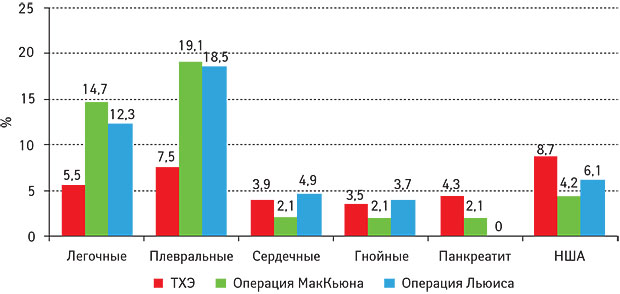
Выявлена статистически значимая разница во времени, затраченном на вмешательство, при применении предлагаемой методики по сравнению с традиционной (р<0,05): в контрольной группе — 363±20 мин, основной — 303±20 мин. При этом на основной этап (мобилизацию пищевода) потрачено в основной группе 25–30 мин, в контрольной — до 45–50 мин. Объем интраоперационной кровопотери в контрольной группе составил 578,2 мл, в основной — 361±25 мл (р<0,05).
Послеоперационная активизация отмечена на 2–3-и сутки. Дренажи из плевральной полости удалены на 3–4-е сутки. Частота послеоперационных легочных осложнений снизилась с 10,5 до 3,4%. Послеоперационный койко-день в основной группе составил 18,4±2,1 дня, в контрольной — 22,2±2,1 дня.
Общая послеоперационная летальность отмечена у 4 (5,1%) пациентов, из них в 3 случаях причиной смерти явилась тромбоэмболия легочной артерии, в 1 — острый трансмуральный инфаркт миокарда. Несостоятельность шейного эзофагогастроанастомоза наблюдали в 5 (6,3%) случаях.
По нашему мнению, показанием к видеоассистированной трансхиатальной экстирпации пищевода являются локализация опухолевого процесса преимущественно в средне- и нижнегрудном отделе пищевода (ниже уровня бифуркации трахеи), пациенты с более низкими функциональными показателями, пациенты пожилого возраста.
На наш взгляд, при локализации процесса выше бифуркации трахеи (в верхнегрудном отделе пищевода) у больных с нормальными показателями функциональных проб, с целью адекватной мобилизации пищевода и лимфодиссекции, целесообразнее выполнять операцию типа Льюиса с формированием анастомоза в куполе правой плевральной полости или трехдоступную операцию МакКьюна (при локализации в верхнегрудном отделе) с наложением анастомоза на шее.
Выводы
Таким образом, применение мини-инвазивной методики на этапе выделения пищевода и медиастинальной лимфодиссекции, видеоассистирования, эндохирургического инструментария и эндоскопической техники оперирования позволяет соблюсти онкологические принципы оперативного вмешательства, значительно повысить адекватность выполняемой лимфодиссекции, гемостаза, снизить риск повреждения прилегающих структур, не увеличивая при этом общую травматичность хирургического вмешательства.
Список использованной литературы
1. Давыдов М.И., Ганцев Ш.Х. (2010) Онкология. ГЭОТАР-Медиа, Москва. 342 с.
2. Марийко В.А., Нечай B.C., Гаврилов В.В. (2002) Видеоторакоскопическая эзофагэктомия при раке пищевода. Эндоскоп. хир., 3: 32.
3. Bonavina L., Bona D., Abraham M. et al. (2002) Esophagectomy by video-assisted laparoscopic and transmediastenal approach. ChirItal., 54 (3): 285–288.
4. Wong S.K.H., Chan A.C.W., Lee D.W.H. (2003) Minimal invasive approach of gastric and esophageal mobilisation in total pharingolaryngoesophagectomy. Surg. Endosc., 17(5): 798–862.
5. Boone J.I. Borel H.M., van Hillegersberg R. (2008) Transhiatal robot-assisted esophagectomy. Surg. Endosc., 22(4): 1139–1140.
6. Montenovo M.I., Oelschlager B.K. (2008) Laparoscopic-Assisted Esophagectomy for Adenocarcinoma of the Esophagus. Medscape J. Med., 10(12): 277.
7. Santin B.J., Price P. (2011) Laparoscopic Transhiatal Esophagectomy at a Low-Volume Center. JSLS. Journal of the Society of Laparoendoscopic Surgeons, 15(1): 41–46.
Порівняльний аналіз результатів хірургічного лікування хворих на рак стравоходу з використанням традиційного та міні-інвазивного методу
Республіканський онкологічний науковий центр МОЗ Республіки Узбекистан, Ташкент
Резюме. Стаття присвячена визначенню ролі міні-інвазивної техніки оперування. Дані ґрунтуються на досвіді виконання 127 операцій на стравоході та кардіоезофагеальній зоні, проведених з 2001 по 2013 р. Хворі розділені на дві групи: 53 пацієнтам (контрольна група) проведено мобілізацію грудного відділу стравоходу за традиційною технікою та 74 хворим (основна група) медіастинальний етап операції здійснено з відеоасистуванням із застосуванням ендохірургічного інструментарію. Втручання виконано при локалізації процесу на рівні середньо- і нижньогрудного відділу. Оцінку ефективності методики проводили залежно від часу, витраченого на втручання, об’єму крововтрати, кількості ліжко-днів, частоти легеневих ускладнень. У контрольній групі на операцію витрачено 363±20 хв, в основній — 303±20 хв. Обсяг інтраопераційної крововтрати в контрольній групі становив 578,2 мл, в основній — 361±25 мл (р<0,05). Відзначено зниження частоти легеневих ускладнень з 10,5 до 3,4%, а кількості ліжко-днів —з 22,2±2,1 до 18,4±2,1 дня. Таким чином, перевагою досліджуваної методики є менша травматичність, хороша візуалізація, раннє відновлення функції легень, зменшення кількості післяопераційних ускладнень.
Ключові слова: рак стравоходу, кардіоезофагеальна зона, трансхіатальна езофагектомія, міні-інвазивна техніка, реконструктивно-відновна операція.
Comparative analysis of results of surgical treatment of patients with esophageal cancer using conventional and minimally invasive method
National Cancer Research Center of the Ministry of Health of Republic of Uzbekistan, Tashkent
Summary. The article is devoted to defining the role of minimally invasive techniques. The data are based on the experience of 127 operations on the esophagus and cardioesophageal zone, made since 2001 to 2013. The patients were divided into two groups: in 53 patients (the control group) mobilization of the thoracic esophagus was performed in using traditional techniques; and in 74 patients (the main group) mediastinal stage of the operation was executed with the use of video-endosurgical tools. Interventions were performed if the localization process was at the level of the mid-lower thoracic department. They carried out the evaluating of the procedure effectiveness according to the time spent on the intervention, the blood loss, the number of bed-days, and the frequency of pulmonary complications. In the control group, the intervention took 363±20 min, in the main group — 303±20 min. The volume of intraoperative blood loss in the control group made 578.2 ml, in the main group — 361±25 ml (p<0.05). They noted the decrease in the frequency of pulmonary complications from 10.5 to 3.4%, and bed-days from 22.2±2.1 to 18.4±2.1 days. Thus, low injury rate, good visualization, early recovery of lung function, reduction of the number of postoperative complications were advantages.
Key words: esophageal cancer, cardioesophageal zone, transhiatal esophagectomy, minimally invasive technique, reconstructive surgery.
Адрес:
Сабиров Джахангир Рузиевич
Республика Узбекистан, 110600, Ташкентская область, Бука,
ул. О. Эшматов, 37
E-mail: mr.yusupov85@mail.ru














Leave a comment