Необходимость и выбор неоадъювантной терапии у больных раком пищевода
Ганул В.Л., Киркилевский С.И., Крахмалев С.Н., Кондрацкий Ю.Н., Зайцев С.Л., Фридель Р.И.
Резюме. Рак пищевода (РП) является одним из наиболее тяжело протекающих онкологических заболеваний, а лечение больных этой патологией — одна из самых сложных проблем. Результаты самостоятельного хирургического лечения РП остаются неудовлетворительными — 5 лет и более переживают не более 50% пациентов, а при поражении лимфатических узлов средостения — не более 10–25%. Проведен анализ отдаленных результатов лечения 1041 больного РП, лечившихся в отделении опухолей органов грудной полости Национального института рака Украины. Комбинированное лечение больных РП средне- и нижнегрудных отделов пищевода (предоперационная лучевая терапия и оперативное вмешательство через 2 нед) должно быть методом выбора: 1-летняя выживаемость больных РП II-III стадии составила 59,1%, 3-летняя — 40,1%, 5-летняя — 37,7% (только операция — 57,6; 28,0 и 24,6% соответственно). Применение разработанной в отделении методики комплексного лечения с использованием внутриартериальной полихимиотерапии позволило еще более улучшить отдаленные результаты лечения — однолетняя выживаемость составила 70,4%; 3-летняя — 51,8%, что является основанием для продолжения исследований в этом направлении.

Рак пищевода (РП) является одним из наиболее тяжело протекающих онкологических заболеваний, а лечение больных этой патологией — одна из самых сложных проблем. Тяжесть заболевания обусловлена быстро возникающим нарушением прохождения пищи, развитием кахексии на фоне дисфагии. В течение первого года с момента выявления первых признаков заболевания без проведения специального лечения умирает 68% больных.
Терапия РП имеет более чем полуторавековой опыт. В 1849 г. Седилло выполнил гастростомию больному РП, но больной умер через час после операции. Затем последовала череда неудачных попыток (Леви, Микулич, Черни) резекции опухоли пищевода. Только в 1913 г. Торек успешно выполнил трансторакальную экстирпацию пищевода при раке его средней части. Гарлок (1937), Свит (1942), Льюис (1946) объединили экстирпацию пищевода с его одномоментным пластическим замещением. Успешное развитие хирургии пищевода стало возможным благодаря не только усовершенствованию хирургической техники, но и качественному развитию анестезиологии. В СССР первую успешную операцию типа Торека сделал В.И. Казанский (1945), а первую успешную резекцию пищевода с наложением внутригрудного пищеводно-желудочного соустья — Б.В. Петровский (1946). В этом контексте невозможно не упомянуть фамилии таких известных русских и советских хирургов, как П.А. Герцен, С.С. Юдин, А.А. Русанов, Е.Л. Березов, А.Г. Савиных и многих других. Сегодня в России эти традиции продолжают М.И. Давыдов, A.C. Мамонтов и др. [1].
В Украине хирургия пищевода также начала развиваться в 50-х годах. У ее истоков стояли такие выдающиеся хирурги, как Н.М. Амосов, И.П. Дедков, A.A. Шалимов, О.М. Авилова. Сегодня украинская школа, возглавляемая В.Л. Ганулом, хорошо известна в Украине и во многих странах СНГ.
Целенаправленно методы хирургического и комбинированного лечения больных раком внутригрудного отдела пищевода в Украине начали развиваться с 1971 г. В том году к клиническому отделу КРРОИ (ныне Национальный институт рака Украины) был присоединен клинический отдел Киевского НИИ экспериментальной и клинической онкологии, в котором имелось торакальное отделение. За это время по поводу рака внутригрудного отдела пищевода выполнено более 1500 оперативных вмешательств.
Этапы нескольких первых лет становления хирургии пищевода в нашем отделении характеризуются высокой частотой послеоперационных осложнений (51,1%), послеоперационной летальности (26,3%) и несостоятельности пищеводных анастомозов (26,3%). К 1980 году эти показатели значительно улучшились. Частота осложнений снизилась до 34,5%, летальность — до 15,8%, несостоятельность анастомозов — до 15,8%.
В те годы в других онкологических учреждениях СССР, в которых занимались лечением РП, ситуация была значительно хуже. Даже во Всесоюзном онкологическом научном центре (ВОНЦ) выполнение оперативных вмешательств по поводу РП было запрещено. Хирургия пищевода в ВОНЦ была разрешена в 1980 году после посещения нашего отделения директором ВОНЦ академиком Н.Н. Блохиным, зав. торакальным отделением, проф. А.И. Пироговым и стажировкой к.м.н. М.И. Давыдова.
В нашем отделении до 1983 года в зависимости от уровня поражения пищевода применялись различные оперативные вмешательства. При раке средней трети пищевода выполнялись экстирпации пищевода по Тореку с последующей через 6 мес пластикой пищевода кишкой, а при раке нижней трети пищевода — операция Льюиса. После 1983 года при всех внутригрудных локализациях опухоли пищевода выполняется операция Льюиса [2].
В результате применения разработанной нами оригинальной методики наложения пищеводных анастомозов, адекватного анестезиологического обеспечения, удалось добиться значительного улучшения непосредственных результатов. На более чем 1000 операций количество послеоперационных осложнений снизилось до 10,2%, летальность после операции — до 1,1% и несостоятельность пищеводных анастомозов — до 1,2%.
Сегодня отношение к хирургическому вмешательству при РП в мировой клинической практике варьирует от полного его отрицания при любой стадии заболевания до выполнения суперкомбинированных операций при распространенном процессе [1]. Результаты хирургического лечения в первую очередь зависят от распространенности опухолевого процесса. РП характеризуется высоким потенциалом раннего лимфогенного метастазирования. По данным литературы, уже при прорастании подслизистого слоя (T1) частота метастатического поражения лимфатических узлов составляет 40%, при поражении опухолью адвентиции — до 90% [3–6].
Операбельность при РП не превышает 20–25%. Радикальные операции удается выполнить не более чем у 60–70% больных, взятых на операцию. Это связано с тем, что даже при помощи сложных диагностических методов определить врастание опухоли пищевода в соседние органы и структуры — аорту, трахею, бронхи, легочные сосуды не всегда удается. Также большое прогностическое значение имеет количество пораженных лимфатических узлов. Например, многие авторы «критическим» числом пораженных лимфатических узлов считают 7. По данным Российского онкологического научного центра, ни один больной с 7 и более метастатически измененными лимфатическими узлами не пережил 3 года после самостоятельного хирургического лечения [7].
По данным мировой литературы, после только оперативного лечения при I стадии заболевания 5 лет и более переживают более 50% пациентов, а при поражении лимфоузлов средостения — не более 10–25% [8]. К сожалению, РП диагностируется во II–III стадии заболевания у 75% больных [1]. Согласно нашим данным однолетняя выживаемость после самостоятельного хирургического лечения больных II–III стадии составила 57,6%, 3-летняя — 28,0%, 5-летняя — 24,6%.
Исходя из вышесказанного, самостоятельное хирургическое лечение больных РП остается неудовлетворительным. Это диктует необходимость поиска комбинации хирургического метода с другими. На сегодняшний день для лечения РП используют лучевую терапию и химиотерапию. Как самостоятельный метод лучевая терапия РП господствовала до 40-х гг. ХХ века, однако успешное развитие хирургии пищевода, дающее возможность радикального лечения, оттеснило ее на второй план, где она осталась основной только при лечении нерезектабельных форм рака [1].
Современные технические средства и методики облучения, применяемые для лечения больных РП, позволяют достичь удовлетворительных непосредственных результатов, однако отдаленные результаты самостоятельного лучевого лечения все еще малоудовлетворительны: медиана выживаемости составляет 9 мес, 2-летняя выживаемость — около 10%, 5-летняя — около 5% [9]. Таким образом, лучевая терапия как альтернатива хирургическому лечению не конкурентноспособна. На сегодняшний день она применяется при локализации опухоли в шейном и верхнегрудном отделе пищевода.
Предоперационная лучевая терапия принята как стандарт лечения больных РП в Украине. С нашей точки зрения предоперационная лучевая терапия имеет большое значение, поскольку она увеличивает резектабельность и улучшает отдаленные результаты лечения, не сказываясь в то же время на непосредственных результатах.
Комбинированное лечение больных РП с использованием предоперационной лучевой терапии на область опухоли и пищевода с последующим оперативным лечением применяют в нашем отделении с 1969 г. и активно используют до настоящего времени. Методики предоперационной лучевой терапии за эти годы последовательно развиты и трансформированы. Важную роль в развитии методик сыграли В.А. Черниченко, И.П. Дедков, В.Л. Ганул и др.
Изначально, предоперационное облучение проводилось на кобальтовой (Со60) установке «РОКУС» в режиме секторного качания по интенсивной методике: ежедневно 5 раз в неделю с разовой очаговой дозой (РОД) 5 Гр до суммарной очаговой дозы (СОД) 30 Гр. В 1969–1974 гг. на небольшом количестве больных были изучены 2 схемы лечения:
- лучевая терапия и применение оперативного вмешательства через 24–48 ч;
- применение расщепленного курса (сплит-курс) облучения.
С 1975 г. хирургическое вмешательство начали проводить через 2 нед после окончания курса лучевой терапии. Целесообразность такой отсрочки показали наблюдения за больными, которых нельзя было оперировать через 1–2 сут после окончания облучения, им было необходимо продолжение предоперационной подготовки. Как показали наблюдения за такими больными, на протяжении 2 нед после облучения восстанавливалась проходимость пищевода, улучшалось самочувствие, а опухоль продолжала уменьшаться. Реализация радиобиологического эффекта, то есть повреждения клеток опухоли, и уменьшение опухоли как раз и достигались к концу 2-й недели. Уменьшались не только размеры опухоли, но и ее связь с окружающими органами. К этому же времени завершается и репарация поврежденных окружающих тканей.
С 1987 по 1998 гг. зона облучения была расширена на области регионарного метастазирования, а с 1998 г. РОД снижена с 5 до 2,4–3 Гр, СОД — 30 Гр.
Однако большее увеличение интервала между окончанием облучения и операцией опасно тем, что начинает восстанавливаться популяция жизнеспособных клеток.
Согласно нашим наблюдениям после применения комбинированного лечения — предоперационной лучевой терапии и операции — однолетняя выживаемость больных РП II–III стадии составила 59,1%, 3-летняя — 40,1%, 5-летняя — 37,7% (по сравнению с только хирургическим 57,6; 28,0 и 24,6% соответственно).
Значительное улучшение отдаленных результатов лечения можно связать с лечебным патоморфозом, возникающим в результате лучевой терапии, как в самой опухоли пищевода, так и в регионарных лимфатических узлах. Кроме того, применение лучевой терапии приводит к уменьшению объема опухоли, и следовательно, к повышению ее резектабельности, а также уменьшает возможность диссеминации раковых клеток по раневой поверхности во время выделения, что повышает радикализм вмешательства, снижает частоту возникновения местных рецидивов при сохранении толерантности нормальных тканей [1].
Можно надеяться, что предоперационная лучевая терапия, проводимая на линейных ускорителях, еще более повысит эффективность лечения больных РП.
Установлено, что химиотерапия как самостоятельный метод по воздействию на РП занимает более скромное место, чем лучевая терапия.
Что касается данных о применении химиотерапии как неоадъювантной так и адъювантной, то они достаточно противоречивы. Наиболее эффективна традиционная схема — цисплатин, 5-фторурацил [10, 11]. При выборе химиотерапевтических препаратов для комбинации с лучевой терапией следует ориентироваться на биологические параметры опухоли, определяющие ее устойчивость к излучению, и на механизм действия препарата, позволяющего в той или иной степени преодолеть эту резистентность [12]. Известно, что митомицин-С повышает эффективность химиолучевого лечения за счет цитотоксического эффекта в отношении гипоксических или аноксических клеток, представляющих самую радиорезистентную их фракцию. Как синхронизаторы клеточного цикла используют винка-алкалоиды, таксаны, 5-фторурацил и некоторые другие. Многие препараты с разным механизмом действия тормозят процессы восстановления сублетальных лучевых повреждений, оказывая потенцирующий эффект, помимо прямого противоопухолевого действия. Особую роль в ингибировании процессов репарации опухолевых клеток в пострадиационный период в современной химиолучевой терапии отводят препаратам платины. Подобными свойствами обладают, но в меньшей степени, и алкилирующие препараты, антиметаболиты, противоопухолевые антибиотики.
Накопленный к концу 80-х гг. опыт показал, что как самостоятельная лучевая терапия, так и комбинация с хирургическим лечением недостаточно эффективна. К этому времени уже было установлено, что химиотерапия, слабоэффективная при РП сама по себе, в комбинации с лучевой терапией оказывает выраженное радиосенсибилизирующее действие [12]. В связи с неудовлетворительными отдаленными результатами самостоятельного лучевого и хирургического лечения для их улучшения разрабатываются методы комбинированной и комплексной терапии, включающей, как правило, неоадъювантные курсы радио- или радиохимиотерапии.
В 1998 г. J.F. Bosset и соавторы заявили, что «дополнительная радиохимиотерапия полностью изменила лечение РП» [13]. Они подытожили результаты работ многих исследователей и пришли к заключению, что «выполнимость, эффективность и способность улучшить выживаемость» нового метода доказаны. По их мнению, предоперационная (неоадъювантная) радиохимиотерапия продлевает жизнь больным аденокарциномой пищевода, удлиняет безрецидивный период при плоскоклеточном раке, а при местно-распространенном процессе уже сейчас должна рассматриваться как стандартная методика. Это самая оптимистичная оценка. Другие сторонники радиохимиотерапии не столь категоричны. J.M. Каnе и соавторы подтверждают ее высокую местную эффективность, но считают, что только операция продлит жизнь [14]. Другие авторы утверждают, что неоадъювантная радиохимиотерапия повышает выживаемость только у тех больным, у которых она обеспечивает полную регрессию опухоли, либо у больных раком I—II стадии [15, 16].
Но кроме положительного эффекта, большинство авторов отмечают большое количество токсических осложнений полихимиотерапии (ПХТ) — 80%, от 1,9 до 10% летальных исходов. В последние 10 лет усиленно проводятся исследования по сочетанному применению предоперационной химиолучевой терапии, в которых химиотерапию, во избежание серьезных осложнений, применяют в достаточно заниженных дозах с целью потенцирования лучевой терапии [17].
C целью повышения эффективности предоперационной химиолучевой терапии при раке средне- и нижнегрудного отдела пищевода и самостоятельного лечения верхнегрудного и шейного отдела пищевода нами была разработана методика внутриартериальной ПХТ, которая позволяет достичь максимальной концентрации химиопрепарата непосредственно в опухоли.
Существенным преимуществом этого метода является возможность создания высокой концентрации цитостатиков непосредственно в опухолевых тканях, что повышает эффект лечения. При этом разработка методик лечения для конкретных локализаций РП направлена на поиск артериальных сосудов, катетеризация которых обеспечит эффективную перфузию цитостатиков в патологический очаг.
Пищевод является органом, который имеет довольно специфическую васкуляризацию (рис. 1).
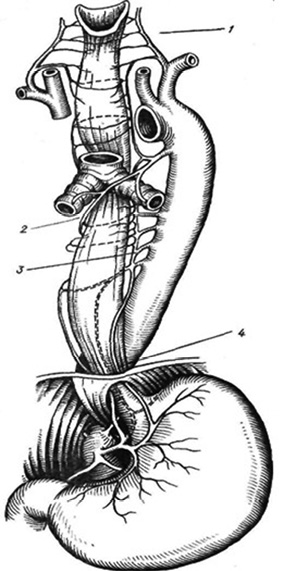
Его шейный и верхнегрудной отделы кровоснабжаются нижней щитоподобной артерией (бассейн щитошейного ствола), средняя часть внутригрудного отдела — пищеводными артериями, которые берут начало непосредственно от грудного отдела аорты, а нижняя часть — пищеводными ветвями левой желудочной артерии (из бассейна брюшного ствола) и нижней диафрагмальной артерии.
Мы разработали методику болюсного и инфузионного селективного введения химиопрепаратов для лечения больных РП различных локализаций. Полученные в нашем отделении непосредственные результаты свидетельствуют о высокой эффективности этой методики.
Для оценки эффективности комбинированного и комплексного лечения больных РП мы проанализировали собственный опыт, базирующийся на результатах радикального лечения.
Нам удалось проследить за 1041 больным РП II–III стадии, которые были радикально пролечены в отделении опухолей органов грудной полости с 1977 по 2011 гг. Из них 321 пациенту (контрольная группа) проведено только хирургическое лечение (операции типа Льюиса и Гарлока со стандартной лимфодиссекцией D2). 666 больных перед хирургическим вмешательством получили курс лучевой терапии на пищевод РОД 2,4–3 Гр, СОД 30 Гр (основная группа 1). Больным этой группы оперативное вмешательство выполняли через 2–3 нед после окончания лучевой терапии. 54 пациентам (основная группа 2) лучевую терапию дополняли также циклами неоадъювантной ПХТ. Из них 37 пациентам ПХТ проводили селективно (внутриартериально), а 17 — системно (внутривенно).
Результаты
Согласно данным канцер-реестра Национального института рака проведен анализ 1-, 3- и 5-летней выживаемости больных РП у пациентов контрольной и основных групп. Отдаленные результаты в основной группе 2 в связи с коротким временем от начала применения комплексной терапии прослежены до 3 лет. Однолетняя выживаемость в контрольной и основных группах 1 и 2 соответственно составила 57,6±2,8; 59,1±1,9 и 70,4±6,2%; 3-летняя — 28±2,6%; 40,1±1,9 и 51,8±6,8% соответственно; 5-летняя — 24,6±2,4% в контрольной группе и 37,7±1,9% в основной группе 1 (рис. 2, 3, 4).

Выводы
Отдаленные результаты комбинированного лечения больных РП средне- и нижнегрудных отделов пищевода значительно лучше, чем при применении только хирургического лечения.
Комбинированное лечение больных РП средне- и нижнегрудных отделов пищевода (предоперационная лучевая терапия и оперативное вмешательство через 2 нед) должно быть методом выбора.
Обнадеживающие результаты комплексной терапии больных раком внутригрудного отдела пищевода, то есть сочетание предоперационных лучевой и селективной (внутриартериальной) ПХТ и оперативного вмешательства, являются основанием для продолжения исследований в этом направлении.
Литература
1. Ганул В.Л., Киркилевский С.И. (2003) Рак пищевода. Руководство для хирургов и онкологов. — К.: Книга плюс, 199 с.
2. Ганул В.Л. (1982) Хирургическое и комбинированное лечение больных раком пищевода и кардиоэзофагеальным раком: Автореф. дисс. д.мед.н. — К., 32 с.
3. Isono K., Ochiai T., Okuyama K., Onoda Sh. (1990) The Treatment of Lymph Node Metastasis from Esophageal Cancer by Extensive Lymphadenectomy. Jpn. J. Surg., 2 (20).
4. Kato H., Tachimori Y., Watanabe H. et al. (1991) Lymph Node Metastasis in Thoracic Esophageal Carcinoma. J. Surg. Oncol., 48: 106–111.
5. Nishimaki T., Tanaka O., Suzuki T. et al. (1994) Patterns of lymphatic spread in thoracic esophageal cancer. Cancer., 74(1): 4–11.
6. Rise Th.W., Zuccaro Gr., Adelstein D.J. et al. Esophageal carcinoma: Depth of tumor invasion is prediction of regional lymph node status. In the Seventh World Congress of the International Society for Diseases of the Esophagus, Montreal, Canada, 01–04.09.98.
7. Стилиди И.С., Бохян В.Ю., Тер-Ованесов М.Д. (2003) Результаты и перспективы хирургического лечения больных раком грудного отдела пищевода. Практич. Онкология, 2 (4): 70–75.
8. Enzinger P.C, Mayer R.J. (2003) Esofahageal Cancer. N. Engl. J. Med., 349: 2241–2252.
9. Al-Sarraf M, Martz K. Herskovic A et al. (1997) Progrès report of combined chemoradiotherapy versus radiotherapy alone in patients with esophageal cancer. An intergroup study. J.ClinOncol., 15: 277–284.
10. Ide H., Eguchi R., Nakamura T., Hayashi K. (1996) Effective combined injection method of fluoropyrimidine and platinumapplication for advanced esophageal cancer. Gan To Kagaku Ryoho, 13 (23): 1757–1762.
11. Saji S., Aiba K., Araki H. (1997) Current status of low-dose CDDP. 5-FU therapy for solid malignant tumors nation wide questionnaire survey. Gan To Kagaku Ryoho., 13 (24): 1892–1900.
12. Bessell J.R., Devitt P.G., Gill P.G. et al. (1996) Prolonged survival follows resection of oesophageal SCC downstaged by prior chemoradiotherapy. Aust. 2. J. Surg., 4 (66): 214–217.
13. Bosset J.F., Gignoux M., Mantion G. et al. (1998) Combined radiochemotherapy in treatment of esophageal cancers. Ann. Chir., 2 (52): 185–191.
14. Kane J.M. 3rd, Shears L.L., Ribeiro U. et al. (1997) Is esophagectomy following upfront chemoradiotherapy safe and necessary? Arch. Surg., 5 (132): 481–485.
15. Thomas C.R. Jr. (1997) Biology of esophageal cancer and the role of combined modality therapy. Surg. Clin. North. Am., 5 (77): 1139–1167.
16. Hernandez Lizoain J.L., Cienfuegos J.A, Pardo F. et al. (1998) Preoperative chemotherapy followed by esophagectomy compared with surgery alone in the treatment of squamous cell carcinoma of the esophagus. Rev. Esp. Enferm. Dig., 4 (90): 275–290.
17. Putnam J.B. Jr. (1998) Complications of multimodality therapy. Chest. Surg. Clin. N. Am., 3 (8): 663–680.
Необхідність та вибір неоад’ювантної терапії у хворих на рак стравоходу
Національний інститут раку, Київ
Резюме. Рак стравоходу є одним з найбільш важких онкологічних захворювань, а лікування хворих на цю патологію — одна з найскладніших проблем. Результати самостійного хірургічного лікування раку стравоходу залишаються незадовільними — 5 років і більше переживають не більше 50% пацієнтів, а при ураженні лімфатичних вузлів середостіння — не більше 10–25%. Проведено аналіз віддалених результатів лікування 1041 хворого на рак стравоходу, що лікувалися у відділенні пухлин органів грудної порожнини Національного інституту раку України. Комбіноване лікування хворих на рак стравоходу середньо-і нижньогрудних відділів стравоходу (передопераційна променева терапія і оперативне втручання через 2 тиж) повинно бути методом вибору: 1-річна виживаність хворих на рак стравоходу II–III стадії становила 59,1%, 3-річна — 40,1%, 5-річна — 37,7% (тільки операція — 57,6; 28,0 і 24,6% відповідно). Застосування розробленого у відділенні методики комплексного лікування з використанням внутрішньоартеріальної поліхіміотерапії дозволило ще більше покращити віддалені результати лікування — 1-річна виживаність становила 70,4%; 3-річна — 51,8%, що є підставою для продовження досліджень у цьому напрямку.
Ключові слова: рак стравоходу, хірургічне лікування, променева терапія, хіміотерапія, радіохіміотерапія, внутрішньоартеріальна (селективна) хіміотерапія.
Necessity and choice of preoperative therapy for patients with esophageal cancer
National Сancer Institute, Kyiv
Summary. Esophageal cancer is one of most heavily aleak oncologic diseases, and treatment of patients this pathology one of the most thorny problems. The results of independent surgical treatment of esophageal cancer remain unsatisfactory — 5 years and more than 50% patients more experience, and at the defeat of lymph nodes of mediastinum no more than 10–25%. The analysis of remote results of treatment of a 1041 patient with a esophageal cancer, treating oneself in the department of tumours organs of pectoral cavity of the Ukrainan National Cancer Institute is conducted. Combined treatment of patients with esophageal cancer from medium- and lower-thoracal departments of esophagus (preoperative radiotherapy and operative intervention in 2 weeks) must be the method of choice: 1-year survivability of patients by the esophageal cancer of II–III stage made 59,1% 3-years — 40,1% 5-years — 37,7% (only operation — 57,6; 28,0, and 24,6% accordingly). Application of the methodic of worked out in a department with the use of intraarterial chemotherapy allowed yet more to improve the remote results of treatment — one-year survivability made 70,4%; 3-years-old — 51,8%, that is founding for continuation of researches in this direction.
Key words: esophageal cancer, surgical treatment, radiotherapy, radiochemotherapy, intraarterial (selective) chemotherapy.














Leave a comment