Експериментальна розробка і клінічна апробація нової тест-системи для моніторингу пухлинних процесів товстого кишечнику
Кузьменко А.П.1, Диденко Г.В. 1, Шпак Е.Г.1, Круць A.А.1, Приймак В.В.2, Потебня Г.П.1
- 1Інститут експериментальної патології, онкології і радіобіології ім. Р.Є. Кавецького НАН України, Київ
- 2Національний інститут раку, Київ
Резюме. Мета роботи полягає в експериментальній розробці та клінічній апробації нової тест-системи для моніторингу пухлинного процесу товстої кишки у хворих. Дослідження проведено з використанням сироваток крові тварин із саркомою 37 та карциномою легені Льюїс, сироваток крові хворих на колоректальний рак, аденоматозні поліпи товстої кишки та здорових донорів. Застосовували методи експериментальної онкології, імунології (імуноферментний аналіз — ІФА) та методи статистичного аналізу. Відібрано та охарактеризовано білкові компоненти культуральної рідини та цитоплазми B. megaterium H, білкові компоненти культуральної рідини B. subtilis В-7025 та ембріональні пептиди курки, які реагували в ІФА-тесті з антитілами сироватки крові мишей з пухлинами різного гістогенезу та антитілами сироватки крові досліджуваних пацієнтів. Встановлено, що з відібраних білкових компонентів для сконструйованої тест-системи найбільшу чутливість мають антигени культуральної рідини та цитоплазми B. megaterium H (92 и 87% відповідно). Одержані результати вказують на перспективність використання тест-системи для моніторингу перебігу колоректального раку у пацієнтів у процесі лікування.
Резюме. Целью работы является экспериментальная разработка и клиническая апробация новой тест-системы для мониторинга опухолевого процесса толстого кишечника у больных. Исследования проведены с использованием сывороток крови животных с саркомой 37 и карциномой легкого Льюис, сывороток крови больных колоректальным раком, аденоматозными полипами толстого кишечника и здоровых доноров. Использованы методы экспериментальной онкологии, иммунологии (иммуноферментный анализ — ИФА) и методы статистического анализа. Отобраны и охарактеризованы белковые компоненты культуральной жидкости и цитоплазмы B. megaterium H, белковые компоненты культуральной жидкости B. subtilis В-7025 и эмбриональные пептиды курицы, реагирующие в ИФА-тесте с антителами сыворотки крови мышей с опухолями разного гистогенеза и с антителами сыворотки крови исследуемых пациентов. Установлено, что из отобранных белковых компонентов для сконструированной тест-системы наибольшей чувствительностью обладают антигены культуральной жидкости и цитоплазмы B. megaterium H (92 и 87% соответственно). Полученные результаты указывают на перспективность использования тест-системы для мониторинга течения колоректального рака у пациентов в процессе лечения.

Заболеваемость колоректальным раком (КРР) в Украине достаточно высока — 34,9 случая на 100 тыс. населения. Это наибольший показатель из всех стран СНГ. В структуре смертности от злокачественных новообразований в Украине эта патология занимает одну из лидирующих позиций после рака легкого, желудка и грудной железы. К сожалению, до сих пор около трети всех случаев КРР выявляют в запущенных стадиях заболевания. Недостатки в диагностике и лечении приводят к тому, что 35–45% всех больных со злокачественными опухолями прямой и ободочной кишки не проживают и года с момента установления диагноза и начала лечения. Таким образом, оказание своевременной и качественной медицинской помощи больным раком толстой кишки остается важной проблемой для практического здравоохранения Украины. Наиболее актуальными вопросами являются своевременная диагностика и оказание патогенетически адекватного специального лечения, что способствует повышению выживаемости больных раком толстой кишки (среднеевропейский показатель 5-летней общей выживаемости — 50%) [1].
Для мониторинга состояния пациентов с КРР используют опухолевые маркеры, наиболее распространенным для этой локализации является раково-эмбриональный антиген (РЭА). Существует мнение о целесообразности его определения в качестве критерия эффективности проводимого лечения при КРР. Однако следует иметь в виду, что в 20% случаев снижение РЭА может совпадать с прогрессированием опухолевого процесса [1]. В настоящее время в онкологии наиболее удобными мишенями для создания диагностических тест-систем являются онкофетальные, или эмбриоспецифические антигены. Важно, что одни и те же онкофетальные антигены могут экспрессироваться в опухолях разного гистогенеза, поэтому в некотором смысле являются «универсальными». Эта «универсальность» обусловлена тем, что трансформация нормальной клетки в злокачественную часто сопровождается экспрессией эмбриональных антигенов [2, 3].
Использование антигенной общности опухолевых и эмбриональных тканей стало перспективным направлением для разработки тест-систем мониторинга течения опухолевого процесса и оценки эффективности проводимого лечения, а также для поиска путей иммунологического влияния на злокачественные клетки [2, 4]. Еще одним перспективным направлением для создания диагностической тест-системы могут быть белковые метаболиты микроорганизмов Bacillus megaterium H и Bacillus subtilis В-7025.
Обоснованием для работы с этими культурами послужили исследования профессора Д.Г. Затулы, в которых показано наличие связывания антител сывороток крови (СК) больных онкологического профиля с антигенами B. megaterium H [5].
Целью настоящих исследований была экспериментальная разработка и клиническая апробация новой тест-системы для мониторинга опухолевого процесса толстого кишечника.
Объект и методы исследований
Для конструирования тест-системы выделены и очищены белковые фракции из эмбриональных тканей курицы 4; 7 и 10 сут гестации и микроорганизмов B. megaterium H и B. subtilis В-7025, которые реагировали на специфические (противоопухолевые) антитела СК животных с перевивными опухолями.
Белки куриных эмбрионов получали методом ЭДТА-экстракции. Экстракты из фильтрата культуральной жидкости микроорганизмов получали методом осаждения белков сульфатом аммония. Цитоплазматические экстракты микробных клеток получали методом их ультразвуковой дезинтеграции с дальнейшим осаждением белков сульфатом аммония [6, 7]. Экстракт клеточных стенок микроорганизмов получали, используя лизирующий буфер (pH=8,0) на основе тритона Х-100 и ЕДТА с последующей экстракцией белков путем осаждения сульфатом аммония. Методики выделения исследуемых экстрактов детально описаны в работах [6, 8]. Белковый спектр экстрактов анализировали с использованием SDS-электрофореза [9]. Концентрацию белка в пробах определяли по методике [10].
Предварительный отбор антигенов разного происхождения для конструирования тест-системы проводили с помощью иммуноферментного анализа (ИФА) [11]. Доза антигенов, используемых для сорбции на планшетах, составляла 0,3 мг/мл. Перекрестную реактивность микробных и эмбриональных антигенов с антителами СК животных-опухоленосителей, а также пациентов с верифицированным диагнозом КРР, полипами толстого кишечника и здоровых доноров оценивали в ИФА-тесте [11]. В качестве контроля чувствительности сконструированной тест-системы использовали РЭА производства «Вектор-Бест» (Россия).
Исследованы СК 30 больных КРР, 10 — с аденоматозными полипами и 10 практически здоровых людей. Возраст больных составлял от 53 до 70 лет. Среднее значение — 61,5±7,8 года. Возраст практически здоровых людей составлял 48–73 года (60,5±6,9 года). Мужчин было 28, женщин 22. Стадия заболевания у пациентов c КРР соответствовала Т2–Т3, N0–N1, Mх. Во всех исследованных группах у пациентов проводили забор крови из вены в объеме 5 мл. Полученную кровь центрифугировали при 3000 об./мин с экспозицией 10 мин, отбирали СК и сохраняли при −20 °С.
Диагностическую чувствительность системы определяли по формуле:
ДК = (ОПп/ОПд) − 0,3,
где ДК — диагностический коэффициент; ОПп — оптическая плотность раствора в лунках с СК больных КРР или полипами толстого кишечника; ОПд — оптическая плотность раствора в лунках с СК практически здоровых доноров.
Показатели считали диагностически значимыми, если диагностический коэффициент был выше 1,2. При построении графиков уровень реакции СК практически здоровых доноров (или интактных животных) принимали за 0.
Статистическую обработку результатов проводили с использованием критериев Фишера — Стьюдента и χ.
Результаты исследований
Первый этап работы заключался в исследованиях частоты выявления специфических противоопухолевых антител в СК мышей с модельными опухолями, которые связывались с ксеногенными эмбриональными протеинами курицы (ЭПК) разного периода гестации (4-е, 7-е и 10-е сутки), белоксодержащими компонентами культуральной среды, цитоплазмы и клеточных стенок B. subtilis B-7025 и B. megaterium H.
Установлено, что самая высокая частота выявления антител имела место относительно компонентов экстракта 7-суточных куриных эмбрионов, белковых компонентов культуральной среды В. megaterium H и B. subtilis B-7025 и компонентов цитоплазмы B. megaterium H. Частота выявления антител к белковым компонентам куриных эмбрионов 4- и 10-суточной гестации, белковым компонентам клеточных стенок В. megaterium H и B. subtilis B-7025, а также белковым компонентам цитоплазмы B. subtilis B-7025 была низкой. Поэтому в дальнейших исследованиях эти белковые компоненты не использовали.
В результате проведенных исследований установлено, что частота выявления антител в СК мышей против собственных опухолевых антигенов совпадала (р>0,05) с частотой выявления антител к белковым компонентам ЭПК, культуральной среды В. megaterium H и B. subtilis B-7025, а также к компонентам цитоплазмы B. megaterium H и не зависела от гистогенеза опухоли (рис. 1).
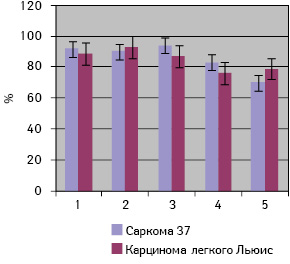
Таким образом, полученные экспериментальные результаты свидетельствуют о перспективности использования отобранных белковых компонентов в качестве тест-антигена для мониторинга опухолевого процесса в организме опухоленосителя.
Молекулярная масса отобранных антигенов для сконструированной тест-системы представлена на рис. 2.
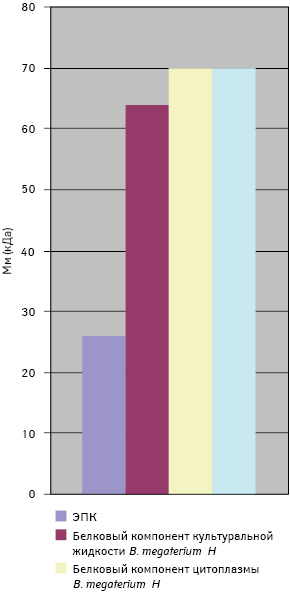
По данным исследований создана панель антигенов, состоящая из 4 компонентов: ЭПК 7 сут гестации (Мм 26 кДа); белкового компонента культуральной жидкости B. megaterium H (Мм 64 кДа); белкового компонента цитоплазмы микробной культуры B. megaterium H (Мм 70 кДа) и белкового компонента культуральной жидкости микробной культуры B. subtilis В-7025 (Мм 70 кДа), которые имеют перекрестно-реагирующие антигены с антителами СК животных с опухолями.
На втором этапе исследовали диагностическую чувствительность сконструированной тест-системы у больных КРР. Она включала соответственно: белковый компонент культуральной жидкости B. megaterium H — 92%; белковый компонент цитоплазмы B. megaterium H — 87%, белковый компонент культуральной жидкости B. subtilis В-7025 — 20,8%; и ЭПК — 32%, коммерческий РЭА — 28% (рис. 3).
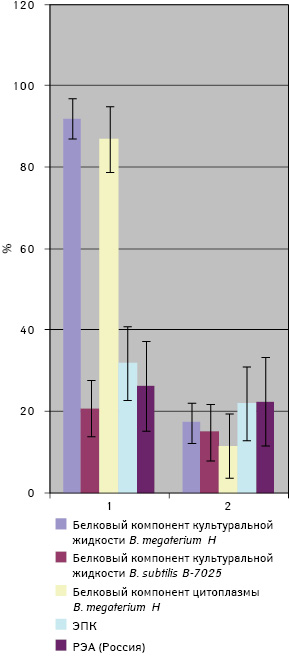
При исследовании чувствительности тест-системы у больных КРР в качестве контроля были использованы СК пациентов с аденоматозными полипами толстого кишечника. Важно отметить, что у пациентов с КРР чувствительность сконструированной тест-системы была выше по сравнению с больными, у которых диагностированы аденоматозные полипы кишечника только для белкового компонента культуральной жидкости B. megaterium H и белкового компонента цитоплазмы B. megaterium H (р<0,05). Диагностическая чувствительность остальных использованных антигенов (белковый компонент культуральной жидкости B. subtilis В-7025 и ЭПК) достоверно не отличалась между собой у больных КРР и пациентов с аденоматозными полипами кишечника (р>0,05). Поэтому в последующих исследованиях применяли тест-систему, сконструированную с использованием белкового компонента культуральной жидкости B. megaterium H и белкового компонента цитоплазмы B. megaterium H как наиболее информативную.
Анализ результатов использования сконструированной тест-системы у больных с диагнозом КРР через год после лечения показал, что при возникновении рецидива заболевания исследуемые показатели существенно возрастали (р<0,05) по сравнению с показателями у больных без клинических и инструментальных признаков рецидивирования (рис. 4).
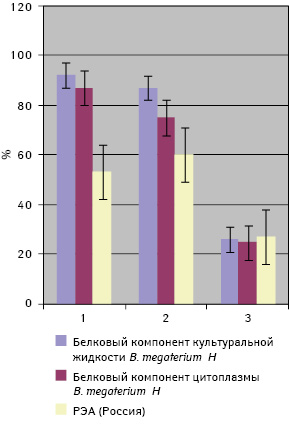
Полученные результаты свидетельствуют о возможности мониторинга течения заболевания и использования предложенной тест-системы для раннего выявления рецидивирования и метастазирования у больных КРР. Низкая информативность использования РЭА ни в коей мере не свидетельствует о нецелесообразности применения этого маркера при КРР. По-видимому, предложенная нами тест-система более чувствительна, чем тесты фирмы-производителя «Вектор-Бест» (Россия).
Реакция исследуемых СК 10 здоровых доноров на все используемые тест-антигены была оценена как негативная (уровень реакции <1,2), разница с соответствующими показателями больных КРР статистически значима (p<0,05), то есть диагностическая чувствительность разработанной тест-системы (возможность давать негативный результат в группе здоровых индивидуумов) составляла не менее 95%.
Таким образом, сконструированная нами тест-система на базе белкового компонента культуральной жидкости B. megaterium H и белкового компонента цитоплазмы B. megaterium H позволяет осуществлять мониторинг течения КРР у больных и может использоваться для своевременного проведения противорецидивного лечения.
Список использованной литературы
1. Шалимов С.А., Колесник Е.А., Гриневич Ю.А. (2005) Современные направления в лечении колоректального рака. Киев: ВИПОЛ, 111.
2. Гриневич Ю.А., Югринова Л.Г. (2013) Маркеры опухолевого роста. Киев: Здоров’я, 199.
3. Опухолевые маркеры в клинической практике: Пособие для врачей (2003). Под ред: В.Ф. Сухого. Днепропетровск: АРТ-ПРЕСС, 44.
4. Сергеева Н.С., Маршутина Н.В. (2011) Общие представления о серологических биомаркерах и их месте в онкологии. Практическая онкология, 12(4): 147–154.
5. Затула Д.Г, Семерников В.А. (1986) Иммунология перекрестно-реагирующих антигенов микроорганизмов и клеток бластом. Киев: Наук. думка, 1986. 224.
6. Діденко Г.В., Кузьменко О.П., Шпак Є.Г. та ін. (2012) Оптимізація методів виділення, електрофоретична характеристика та протипухлинна ефективність цитотоксичних метаболітів із фільтрату культуральної рідини B. subtilis В-7025. ДАНУ, (7): 185–190.
7. Isaenko E.Y. (2008) Ultrasound use for microbial cells decomposition. Annals of Mechnicov Institute, (1): 5–9.
8. Діденко Г.В. (2008) Розробка протипухлинних аутовакцин на основі білоквмісних метаболітів B. subtilis B-7025 та їх вплив на окремі реакції протипухлинного імунітету (експериментальні дослідження). Автореф. дис… канд. біол. наук. Київ: 19.
9. Laemmli U.K. (1970) Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature, 227: 680–5.
10. Greenberg C.S., Craddock P.R. (1982) Rapid single-step membrane protein assay. Clin. Chem., 28(7): 1725–1726.
11. Кэтти Д. (1991) Антитела. Методы. М: Мир: 230–6.
Адрес:
Кузьменко Александр Петрович
03022, Киев, ул. Васильковская, 45
Институт экспериментальной патологии,
онкологии и радиобиологии им. Р.Е. Кавецкого НАН Украины
E-mail: kuzmen.aleks@mail.ru














Leave a comment