Розробка, обґрунтування та оцінка ефективності протипухлинної вакцинотерапії на основі дендритних клітин у хворих зі злоякісними новоутвореннями
Храновская Н.Н., Крячок И.А., Ганул В.Л., Воробьева Л.И., Гриневич Ю.А. , Орел В.Е., Скачкова О.В., Ганул А.В., Цип Н.П., Свинцицкий В.С., Совенко В.М., Свергун Н.М., Горбач А.И.
Резюме. У статті наводяться результати клінічної апробації розроблених у Національному інституті раку протипухлинних вакцин на основі дендритних клітин (ДК) у хворих на рак легені та яєчника. Вивчення клінічної та імунологічної ефективності протипухлинної вакцини на основі ДК, навантажених лізатом пухлинних клітин, оброблених цитотоксичними лектинами B. subtilis B-7025, проведено в рамках II фази рандомізованих досліджень у хворих на рак яєчника III–IV стадії, а також протипухлинної вакцини на основі ДК, навантажених механоактивованими ліофілізованими пухлинними клітинами, — в рамках III фази рандомізованих досліджень у пацієнтів із недрібноклітинним раком легені (НДРЛ) ІІB–ІІІА стадії. Встановлено, що застосування ДК-вакцин у комплексному лікуванні хворих на НДРЛ і рак яєчника сприяє суттєвому поліпшенню результатів їх терапії. Зареєстровано підвищення 5-річної загальної виживаності пацієнтів із НДРЛ на 25% і раком яєчника на 35%. Включення ДК-вакцини в комплексне лікування хворих на НДРЛ і рак яєчника дозволяє відновити або підсилити протипухлинні імунні реакції організму. Для формування протипухлинної специфічної імунної відповіді потрібно не менше 4 етапів введення ДК-вакцини. Отримані результати розширюють перспективу застосування методу вакцинотерапії на основі ДК у пацієнтів з іншими нозологічними формами злоякісних новоутворень.
Резюме. В статье приводятся результаты клинической апробации разработанных в Национальном институте рака противоопухолевых вакцин на основе дендритных клеток (ДК) у больных раком легкого и раком яичника. Изучение клинической и иммунологической эффективности противоопухолевой вакцины на основе ДК, нагруженных лизатом опухолевых клеток, обработанных цитотоксическими лектинами B. subtilis B-7025, проведено в рамках II фазы рандомизированных исследований у больных раком яичника III-IV стадии, а также противоопухолевой вакцины на основе ДК, нагруженных механоактивированными лиофилизированными опухолевыми клетками, — в рамках III фазы рандомизированных исследований у пациентов с немелкоклеточным раком легкого (НМРЛ) ІІB-ІІІА стадии. Установлено, что применение ДК-вакцин в комплексном лечении больных НМРЛ и раком яичника способствует существенному улучшению результатов терапии. Зарегистрировано повышение 5-летней общей выживаемости пациентов с НМРЛ на 25% и раком яичника на 35%. Включение ДК-вакцины в комплексное лечение больных НМРЛ и раком яичника позволяет восстановить или усилить противоопухолевые иммунные реакции организма. Для формирования противоопухолевого специфического иммунного ответа требуется не менее 4 этапов введения ДК-вакцины. Полученные результаты расширяют перспективу применения метода вакцинотерапии на основе ДК у пациентов с другими нозологическими формами злокачественных новообразований.
 Современная противоопухолевая вакцинотерапия зарекомендовала себя как научно обоснованный и один из наиболее перспективных методов биотерапии в онкологии [1]. Наиболее полно возможности противоопухолевой вакцинотерапии исследованы при меланоме. К сожалению, следует отметить, что в ряде последних обзоров, обобщающих результаты крупных рандомизированных исследований, продемонстрирована довольно низкая эффективность противоопухолевой вакцинотерапии при меланоме — объективный ответ зарегистрирован лишь у 3,3% больных [2]. При этом высказывается гипотеза, что высокая иммуногенность этой опухоли и развитие эндогенной иммунной реакции на опухолеспецифические антигены, характеризуемой по наличию опухольинфильтрирующих лимфоцитов (TILs) и сенсибилизированных лимфоцитов в периферической крови, является скорее препятствием, чем способствующим фактором для достижения эффекта при проведении вакцинотерапии [3]. В настоящее время большие надежды в лечении меланомы возлагаются на препараты, направленные на блокирование CTLA-4/B7 и PD-1/PD-1L путей [4].
Современная противоопухолевая вакцинотерапия зарекомендовала себя как научно обоснованный и один из наиболее перспективных методов биотерапии в онкологии [1]. Наиболее полно возможности противоопухолевой вакцинотерапии исследованы при меланоме. К сожалению, следует отметить, что в ряде последних обзоров, обобщающих результаты крупных рандомизированных исследований, продемонстрирована довольно низкая эффективность противоопухолевой вакцинотерапии при меланоме — объективный ответ зарегистрирован лишь у 3,3% больных [2]. При этом высказывается гипотеза, что высокая иммуногенность этой опухоли и развитие эндогенной иммунной реакции на опухолеспецифические антигены, характеризуемой по наличию опухольинфильтрирующих лимфоцитов (TILs) и сенсибилизированных лимфоцитов в периферической крови, является скорее препятствием, чем способствующим фактором для достижения эффекта при проведении вакцинотерапии [3]. В настоящее время большие надежды в лечении меланомы возлагаются на препараты, направленные на блокирование CTLA-4/B7 и PD-1/PD-1L путей [4].
Считается, что последующие масштабные исследования эффективности противоопухолевых вакцин должны быть сосредоточены на менее иммуногенных опухолях с включением больных с минимальными клиническими признаками заболевания. При этом применение противоопухолевых вакцин представляется оптимальным в сочетании с основным лечением, направленным на уменьшение опухолевой массы хирургическим путем либо с помощью лучевой или химиотерапии, с целью элиминации остаточных опухолевых клеток и симптомов заболевания [5].
Большие надежды возлагаются на объединение антигенного опухолевого материала с профессиональными антигенпрезентирующими дендритными клетками (ДК). Уникальность функции этих клеток обосновывается способностью к интернализации, процессингу и презентации антигенов наивным Т-лимфоцитам в лимфоидной системе, инициации мощного специфического противоопухолевого иммунного ответа, опосредованного цитотоксическими Т-лимфоцитами. Использование ДК в составе противоопухолевой вакцины в качестве естественного адъюванта направлено на усиление иммуногенности опухолевых клеток, создание условий для эффективной презентации опухолевых антигенов, преодоление местной или системной иммуносупрессии путем индукции и поддержания иммунного ответа, направленного на элиминацию опухолевых клеток [6].
К настоящему времени в мире проведено более 114 клинических испытаний I–II фазы с использованием ДК в лечении пациентов с более 30 онкологическими нозологическими формами (меланома — 17,5%, рак предстательной железы — 15,8%, опухоли головного мозга — 13,0%, онкогематологические заболевания — 10,5%, рак яичника — 8%, рак грудной железы — 6%, рак почки — 6%, рак легкого — 6%, рак поджелудочной железы — 3,5%, саркомы мягких тканей — 3%, а также рак мочевого пузыря, печени, желудка и др. — всего 11,1%) [7]. Есть сообщения о довольно высокой частоте стабилизации или даже регрессии опухоли вследствие проведенной ДК-вакцинотерапии. Уже опубликованы положительные результаты исследования ІІІ фазы вакцинотерапии на основе ДК у больных с метастатическим раком предстательной железы. В этом исследовании использована вакцина Sipuleucel-T (также известная как APC 8015), состоящая из аутологичных ДК, полученных из лейкоконцентрата периферической крови больных и нагруженных отдельными пептидами. В 2010 г. FDA США было одобрено применение Sipuleucel-T для терапии больных гормонорефрактерным метастатическим раком предстательной железы [8, 9].
Таким образом, ДК-вакцинотерапию можно определить как завершение того начального периода, когда необходимо было доказать целесообразность ее применения в онкологии. Сейчас основным заданием является изучение возможности применения ДК-вакцин при низкоиммуногенных опухолях, создание эффективных конструкций ДК-вакцин и протоколов их применения для достижения максимальной клинической эффективности.
В Национальном институте рака МЗ Украины разработаны две оригинальные конструкции противоопухолевых вакцин на основе ДК, различающиеся способами нагрузки ДК опухолевым материалом:
- ДК, нагруженные лизатом опухолевых клеток (ЛОК), обработанных цитотоксическими лектинами B. subtilis B-7025 (метод получения ЛОК описан в работе Г.П. Потебни и соавторов, 2003 [10]);
- ДК, нагруженные механоактивированными лиофилизированными опухолевыми клетками (МА ЛФОК) (метод получения МА ЛФОК описан в исследованиях В.Э. Орел и соавторов [11, 12]).
Доклинические исследования разработанных противоопухолевых вакцин in vivo с использованием разных схем применения, в том числе в различных дозах, при разных путях введения в организм, в рамках одно- и многоразового введения в режиме вакцинотерапии, на разных моделях опухолевого роста продемонстрировали их значимую противоопухолевую и антиметастатическую активность при применении в монорежиме и существенное повышение лечебного эффекта вакцинации в комбинации с хирургическим удалением первичной опухоли [13].
В данной статье приводятся результаты клинической апробации разработанных противоопухолевых вакцин на основе ДК у больных раком легкого и раком яичника.
Объект и методы
Протоколы исследований и характеристика пациентов. Оценка эффективности противоопухолевой вакцины на основе ДК, нагруженных ЛОК, проведена у больных раком яичника III–IV стадии в рамках II фазы пилотного клинического исследования. Анализ эффективности противоопухолевой вакцины на основе ДК, нагруженных МА ЛФОК, проведен в рамках III фазы клинических испытаний «Рандомизированное двойное, проводимое в параллельных группах исследование эффективности дендритноклеточной аутовакцины при добавлении ее к стандартному хирургическому лечению у больных немелкоклеточным раком легкого ІІB–ІІІА стадии».
В рамках исследований реализованы такие цели:
- изучена эффективность включения противоопухолевой вакцины на основе ДК в комплексное лечение больных раком легкого и яичника в адъювантном режиме;
- установлены особенности развития клеточно-опосредованного иммунного ответа у больных раком легкого и яичника под влиянием противоопухолевой вакцины на основе ДК.
Все пациенты были извещены о проведении исследований и дали информированное согласие на их выполнение. Исследования проводили согласно этическим нормам, принятым законодательством Украины. Разрешение на их проведение выдано Центральной комиссией по вопросам этики МЗ Украины (протокол заседания от 05.11.2009 г. № 5.12-1201/КЕ) и Комиссией по вопросам этики Национального института рака (протокол заседания от 20.10.2006 г. № 43)
В первое исследование включена 81 пациентка с гистологически верифицированным диагнозом рака яичника. Их возраст составил в среднем 52,8±1,8 года. Распределение больных в зависимости от гистологической структуры опухолей показало, что в обеих группах преобладали серозные карциномы: в основной группе — 78%, в контрольной — 67,6% (табл. 1).
Таблица 1. Распределение больных раком яичника в группах в зависимости от гистологического строения опухоли
| Гистологическое строение эпителиальных злокачественных опухолей яичника | Основная группа | Контрольная группа | ||
| (n=41) | % | (n=40) | % | |
| Серозные | 32 | 78,0 | 27 | 67,5 |
| Муцинозные | 4 | 9,8 | 6 | 15,0 |
| Мезонефроидные | 2 | 4,9 | 3 | 7,5 |
| Недифференцированные | 2 | 4,9 | 3 | 7,5 |
| Эндометриоидные | 1 | 2,4 | 1 | 2,5 |
| Всего | 41 | 100,0 | 40 | 100,0 |
Лечение больных основной и контрольной групп предусматривало проведение циторедуктивной операции и 6 курсов адъювантной полихимиотерапии (ПХТ) по протоколу СР (цисплатин 100 мг/м + циклофосфамид 800 мг/м внутривенно).
Распределение больных в основной и контрольной группах по степени радикальности оперативних вмешательств приведено в табл. 2. Как свидетельствуют данные табл. 2, у большинства пациентов основной и контрольной групп проведены оптимальные и субоптимальные циторедуктивные операции — 75,6 и 80% соответственно. Лишь у 24,4% больных основной и 20% контрольной группы выполнены неоптимальные оперативные вмешательства.
Таблица 2. Распределение больных раком яичника в группах по степени радикальности оперативных вмешательств
| Вариант циторедуктивной операции | Основная группа | Контрольная группа | ||
| n | % | n | % | |
| Оптимальная циторедукция (остаточная опухоль отсутствует) | 12 | 29,3 | 10 | 25,0 |
| Субоптимальная циторедукция (остаточная опухоль 1–2 см в наибольшем измерении) | 19 | 46,3 | 22 | 55,0 |
| Неоптимальная циторедукция (остаточная опухоль >2 см в наибольшем измерении) | 10 | 24,4 | 8 | 20,0 |
| Всего | 41 | 100,0 | 40 | 100,0 |
Во второе исследование включены 100 больных немелкоклеточным раком легкого (НМРЛ) IIB–IIIА стадии. Распределение пациентов в зависимости от гистологической структуры опухолей показало, что в обеих группах практически поровну были представлены железистый и плоскоклеточный рак легкого (табл. 3).
Таблица 3. Распределение больных НМРЛ в группах в зависимости от гистологического строения опухоли
| Гистологическое строение опухолей легкого | Основная группа | Контрольная группа | ||
| (n=50) | % | (n=50) | % | |
| Железистый рак | 24 | 48 | 23 | 46 |
| Плоскоклеточный рак | 26 | 52 | 27 | 54 |
| Всего | 50 | 100,0 | 50 | 100,0 |
Таблица 4. Распределение больных НМРЛ в группах по степени радикальности оперативных вмешательств
| Вариант циторедуктивной операции | Основная группа | Контрольная группа | ||
| (n=50) | % | (n=50) | % | |
| Верхняя лобэктомия | 23 | 46 | 22 | 44 |
| Нижняя билобэктомия | 2 | 4 | 1 | 2 |
| Нижняя лобэктомия | 6 | 12 | 4 | 8 |
| Пневмонэктомия | 19 | 38 | 23 | 46 |
| Всего | 50 | 100,0 | 50 | 100,0 |
Больным НМРЛ проведено оперативное лечение в объеме лобэктомии или пневмонэктомии (табл. 4). 41% пациентов не позднее чем за 28 дней до начала иммунотерапии в неоадъювантном режиме получали ПХТ по схемам: винорелбин 30 мг/м в 1-й и 8-й дни, цисплатин 80 мг/м в 1-й день, этопозид 100 мг/мв 1; 2; 3-й дни; гемцитабин 1250 мг/м в 1-й и 8-й дни, цисплатин 80 мг/м в 1-й день; иринотекан 150 мг/мв1-й день, оксалиплатин 80 мг/м в1-й день.
Основная и контрольная группы больных в обоих исследованиях были репрезентативны по возрасту, гистологической структуре опухоли, стадии заболевания, типу оперативных вмешательств и схеме ПХТ.
Пациентам основных групп после окончания основного лечения проведена ДК-вакцинотерапия согласно схеме (рис. 1). Курс вакцинотерапии составлял 5 введений (этапов) ДК-вакцины.
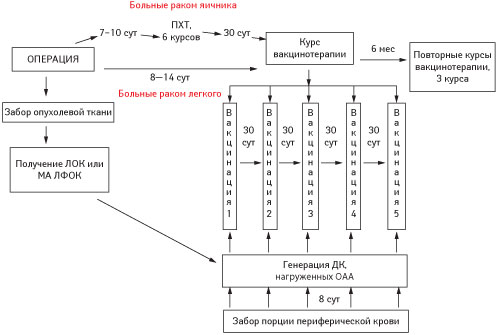
Рис. 1. Применение противоопухолевой вакцины на основе ДК у больных НМРЛ и раком яичника
Получение ДК-вакцины и характеристика ДК. Для каждого введения ДК генерировали из моноцитов периферической крови (50–100 мл) больных путем их инкубации в среде RPMI 1640 в течение 8 сут в присутствии гранулоцитарно-макрофагального колониестимулирующего фактора (ГМ-КСФ) или Г-КСФ, интерлейкина (ИЛ)-4, интерферона (ИФН)-α и липополисахарида при температуре 37 °С в атмосфере 5% СО2. На 6-е сутки инкубации к незрелым ДК добавляли ЛОК либо МА ЛФОК. До использования ЛОК и ЛФОК проверяли на стерильность и отсутствие жизнеспособных опухолевых клеток [14].
Контроль качества ДК включал оценку их фенотипических характеристик на конечном этапе изготовления ДК-вакцины непосредственно перед ее введением. Уровень одновременной экспрессии антигенов CD86 и HLA-DR на ДК, задействованных в презентации антигенов, составлял не менее 65%; антигена CD83, характеризующего степень зрелости ДК, — не менее 50%. Количество жизнеспособных клеток составляло не менее 95%, примесь лимфоцитов — не более 20%.
В среднем за одну инъекцию больным вводили 4,62±0,48•10 ДК, нагруженных модифицированным аутологичным опухолевым материалом.
Иммунологические исследования. В процессе вакцинотерапии, через 1 мес после каждого ее этапа, осуществляли мониторинг состояния клеточного иммунитета. Для оценки динамики развития антигенспецифического клеточного иммунного ответа у больных в ходе вакцинотерапии изучали активность лейкоцитов в реакции торможения миграции лейкоцитов (РТМЛ), способность Т-лимфоцитов секретировать ИЛ-4 и ИФН-γ, ИЛ-2, фактор некроза опухоли α (ФНО-α) в присутствии опухольассоциированных антигенов (ОАА). Для изучения влияния вакцинотерапии на функциональную активность клеток, принадлежащих неспецифическому звену иммунной системы, определяли цитотоксическую активность (ЦА) натуральных киллерных клеток (НКК) и количество CD16-лимфоцитов в периферической крови больных.
Для определения секреторной активности Т-лимфоцитов использовали метод двухпараметровой проточной цитометрии, с помощью которого одновременно устанавливали цитокиновый профиль и субпопуляционный состав лимфоцитов. После 7 сут инкубации лимфоцитов в присутствии 10 мкл МА ЛФОК добавляли форболмиристатацетат в концентрации 20 и 3 мкг/мл иономицина, инкубировали в течение 5 ч при 37 °С и 5% СО2, фиксировали 4% параформальдегидом и пермеабилизировали мембрану с помощью 0,1% раствора сапонина. Далее клетки метили с помощью моноклональных антител к поверхностному антигену СD3 и внутриклеточным ИЛ-2 и ИФН-γ и определяли количество цитокинпродуцирующих СD3-лимфоцитов. Результаты выражали в процентах.
Для проведения РТМЛ применяли цельную гепаринизированную периферическую кровь и пятиканальные капилляры, 10 мкл МА ЛФОК в использованной для «нагрузки» ДК концентрации, 10 мкл фитогемагглютинин (ФГА) в концентрации 5 мкг/мл. Загруженные капилляры центрифугировали в течение 5 мин при 1000 об./мин и инкубировали при 37 °С в течение 24 ч. Процент торможения миграции лейкоцитов оценивали по формуле:
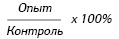
Учитывали повышение процента торможения миграции лейкоцитов в присутствии МА ЛФОК по сравнению с контрольными значениями (при наличии только питательной среды).
ЦА лимфоцитов по отношению к стандартным клеткам-мишеням К562 определяли с помощью метода проточной цитофлюориметрии. Устанавливали процент погибших клеток-мишеней при инкубации с лимфоцитами по отношению к количеству спонтанно погибших клеток-мишеней.
Все проточноцитометрические исследования выполнены на приборе FACS Calibur («Becton Dickinson», США) с использованием программы CellQuest-PRO для компьютеров Macintosh с целью анализа полученных данных.
Статистическая обработка результатов. Статистическую обработку данных проводили с использованием t-критерия Стьюдента для параметрических данных и критерия Манна — Уитни для непараметрических. Анализ выживаемости больных выполняли с использованием метода множительных оценок Каплана — Мейера, различие между группами определяли с помощью F-критерия Кокса.
Результаты исследований
Как показали результаты исследований, введение ДК-вакцины, как правило, не сопровождается развитием каких-либо существенных побочных или токсических реакций у больных. Не отмечено значимого ухудшения самочувствия пациентов и развития побочных явлений в виде аллергических или аутоиммунных расстройств, регионарной лимфаденопатии, связанных с введением вакцины. Из нежелательных эффектов зафиксировано лишь развитие гипертермической реакции с ознобом через 1–6 ч после инъекции в 10% случаев, которую устраняли с помощью жаропонижающих средств.
Применение противоопухолевой вакцины на основе ДК в комплексном лечении больных НМРЛ и раком яичника способствовало существенному повышению 3–5-летней общей и безрецидивной выживаемости пациентов, продлевало время до прогрессирования заболевания, приводило к увеличению медианы выживаемости (табл. 5, 6; рис. 2, 3).
Таблица 5. Эффективность применения противоопухолевой вакцины на основе ДК у больных НМРЛ IIB–IIIА стадии
| Группы больных | Общая выживаемость, % | ||||
| 1 год | 2 года | 3 года | 4 года | 5 лет | |
| Больные, получавшие ДК-вакцину и стандартное лечение | 96 | 89 | 69 | 44 | 39 |
| Больные, получавшие лишь стандартное лечение | 90 | 48 | 22 | 16 | 14 |
| Статистическая разница между группами (F-критерий Кокса) | p | p | p | p | p |
| Безрецидивная выживаемость, % | |||||
| 1 год | 2 года | 3 года | 4 года | 5 лет | |
| Больные, получавшие ДК-вакцину и стандартное лечение | 90 | 67 | 54 | 38 | 38 |
| Больные, получавшие лишь стандартное лечение | 76 | 24 | 18 | 18 | 12 |
| Статистическая разница между группами (F-критерий Кокса) | p | p | p | p | p |
Таблица 6. Эффективность применения противоопухолевой вакцины на основе ДК у больных раком яичника III–IV стадии
| Группы больных | Общая выживаемость, % | ||||
| 1 год | 2 года | 3 года | 4 года | 5 лет | |
| Больные, получавшие ДК-вакцину и стандартное лечение | 100 | 76 | 61 | 59 | 58 |
| Больные, получавшие лишь стандартное лечение | 77 | 61 | 34 | 28 | 23 |
| Статистическая разница между группами (F-критерий Кокса) | ? | p | p | p | p |
| Безрецидивная выживаемость, % | |||||
| 1 год | 2 года | 3 года | 4 года | 5 лет | |
| Больные, получавшие ДК-вакцину и стандартное лечение | 77 | 55,6 | 42 | 35 | 35 |
| Больные, получавшие лишь стандартное лечение | 65 | 43 | 19 | 10 | 5 |
| Статистическая разница между группами (F-критерий Кокса) | p | p | p | p | p |
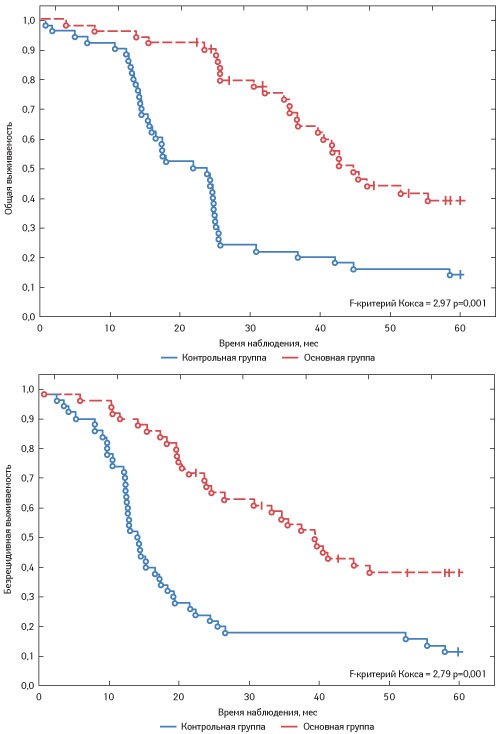
Рис. 2. Выживаемость больных НМРЛ IIB–IIIА стадии, получавших противоопухолевую вакцину на основе ДК
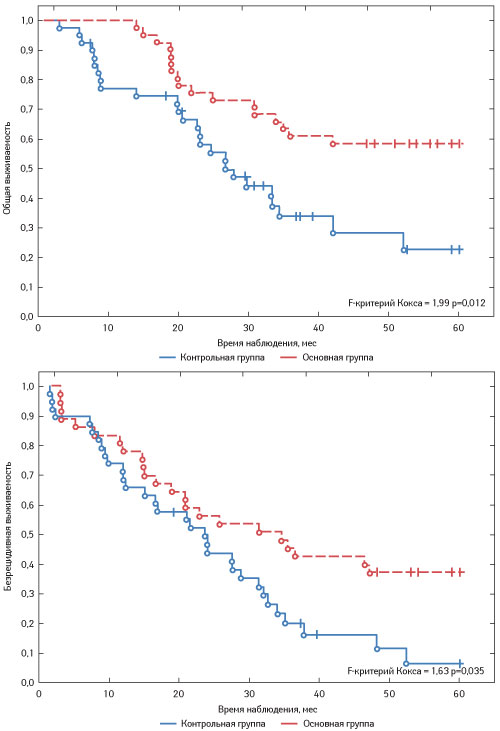
Рис. 3. Выживаемость больных раком яичника IIІ–IV стадии, получавших противоопухолевую вакцину на основе ДК
Так, 3-летняя общая выживаемость больных НМРЛ, получавших ДК-вакцину в составе комплексной терапии, повысилась на 47% по сравнению с таковой в группе пациентов, которым проводили только стандартное лечение (отношение шансов (ОШ) 0,22; 95% доверительный интервал (ДИ) 0,13–0,39), безрецидивной — на 36% (ОШ 0,31; 95% ДИ 0,19–0,52). У больных раком яичника включение ДК-вакцины способствовало повышению общей 3-летней выживаемости на 27% (ОШ 0,45; 95% ДИ 0,24–0,85), а безрецидивной — на 23% по сравнению с контролем (ОШ 0,59; 95 ДИ 0,34–1,04). У пациентов с НМРЛ увеличение 4-летней общей выживаемости составило 28% (ОШ 0,34; 95% ДИ 0,21–0,56), безрецидивной — 20% (ОШ 0,4; 95% ДИ 0,25–0,65), у больных раком яичника — 31% (ОШ 0,44; 95% ДИ 0,24–0,83) и 25% (ОШ 0,57; 95% ДИ 0,33–0,97) соответственно. В течение 5-летнего периода наблюдения применение ДК-вакцины приводит к повышению общей выживаемости больных НМРЛ на 25% (ОШ 0,47; 95% ДИ 0,9–0,74), безрецидивной — на 26% (ОШ 0,38; 95% ДИ 0,24–0,61), у пациентов с раком яичника — на 35% (ОШ 0,42; 95% ДИ 0,23–0,77) и 30% (ОШ 0,54; 95% ДИ 0,31–0,92) соответственно.
Продолжительность безрецидивного периода у больных НМРЛ, получавших ДК-вакцину, составила 40,7±3,72 мес по сравнению с 23,3±3,19 мес в контрольной группе (p
Оценка клинического эффекта ДК-вакцины, безусловно, должна сочетаться с лабораторным анализом уровня специфического противоопухолевого иммунного ответа. Поэтому мы исследовали способность лимфоцитов больных к секреции цитокинов и хемокинов после инкубации с антигенным материалом, используемым для изготовления ДК-вакцины. Такой подход позволяет количественно оценить содержание антигенспецифических Т-лимфоцитов и Тх-1/2-направленность развития иммунного ответа и степень их активации. Повышение секреторной активности лимфоцитов обусловлено их сенсибилизацией к ОАА под влиянием ДК-вакцинотерапии.
При анализе результатов иммунологического обследования установлено, что вакцинотерапия вызывала развитие иммунологического ответа у 75% пациентов в основном за счет вовлечения клеточно-опосредованного звена иммунной системы, без существенных изменений в состоянии гуморального звена.
Данные, характеризующие секреторную активность лимфоцитов после инкубации с ОАА, представлены на рис. 4 и 5. Из полученных результатов следует, что до начала проведения вакцинотерапии у больных как НМРЛ, так и раком яичника в ответ на ОАА происходит развитие иммунного ответа по Тх2-типу. После III этапа вакцинотерапии реализуется переключение типа иммунного ответа с Тх2- на Тх1-зависимый: увеличивается секреция ИФН-γ CD3-лимфоцитами, который является одним из главных провоспалительных цитокинов, активирующим цитотоксические Т-лимфоциты, а также моноциты, макрофаги и продукцию других провоспалительных цитокинов, и снижается синтез ИЛ-4. В то же время возрастает уровень секреции ИЛ-2 Т-лимфоцитами.
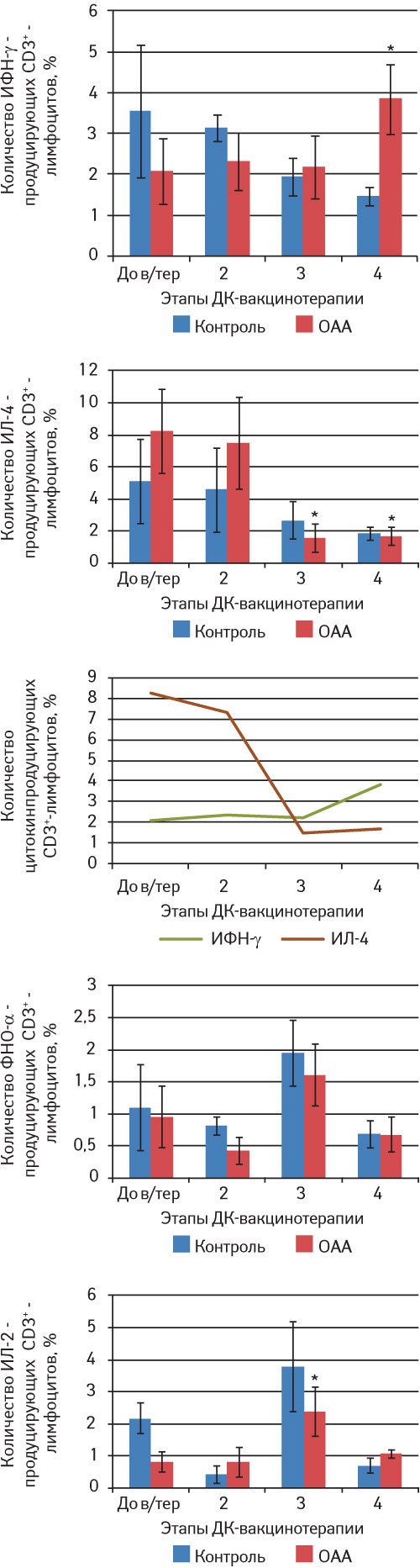
Рис. 4. Цитокин-секреторная активность CD3+-лимфоцитов периферической крови больных НМРЛ на этапах проведения вакцинотерапии на основе ДК.
До в/тер — до вакцинотерапии; *р
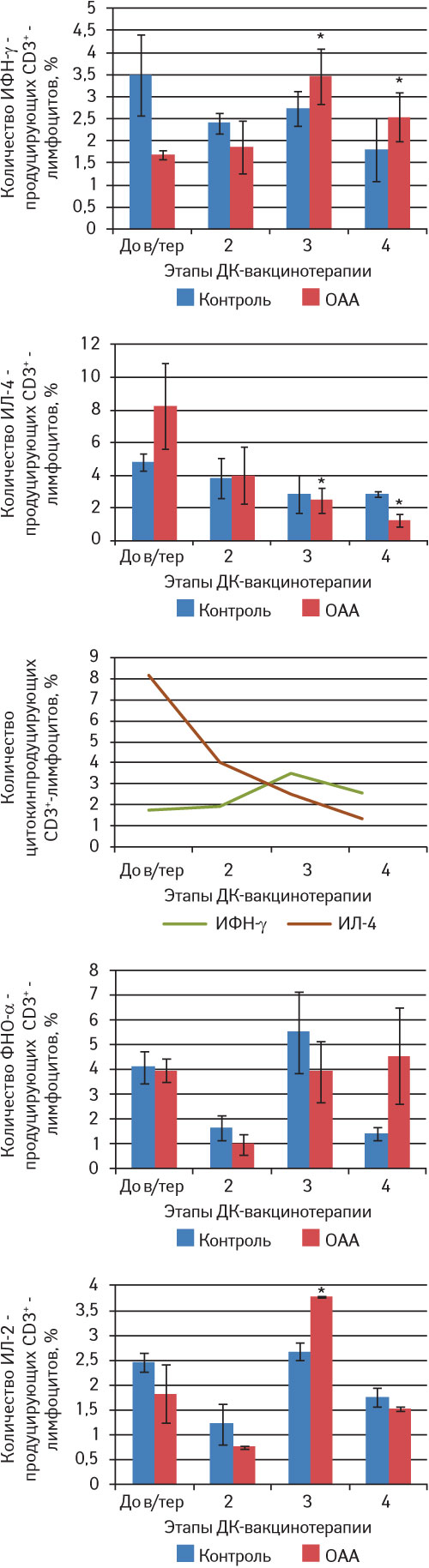
Рис. 5. Цитокин-секреторная активность CD3+-лимфоцитов периферической крови больных раком яичника на этапах проведения вакцинотерапии на основе ДК.
До в/тер — до вакцинотерапии; *р
Функциональное состояние Т-клеточного звена иммунной системы в процессе вакцинотерапии характеризуется и РТМЛ. Метод основывается на способности сенсибилизированных Т-лимфоцитов при инкубации с ОАА выделять цитокины (МИФ, ФНО-α, ИФН-γ) и хемокины, которые вызывают торможение миграции лейкоцитов. Считается, что увеличение процента торможения миграции лейкоцитов при взаимодействии с ОАА по отношению к проценту торможения миграции лейкоцитов в контроле свидетельствует о специфическом иммунном ответе под влиянием проведения ДК-вакцинотерапии. Данный метод in vitro отражает результаты реакции гиперчувствительности замедленного типа на ОАА in vivo.
Как показали результаты исследований, у больных НМРЛ реакция лейкоцитов периферической крови на ОАА появляется уже после проведения I этапа вакцинотерапии и остается практически на том же уровне непосредственно до ее окончания. У пациентов с раком яичника отмечена несколько иная ситуация: усиление реакции лейкоцитов на ОАА произошло лишь однократно — после проведения III этапа вакцинотерапии (рис. 6).
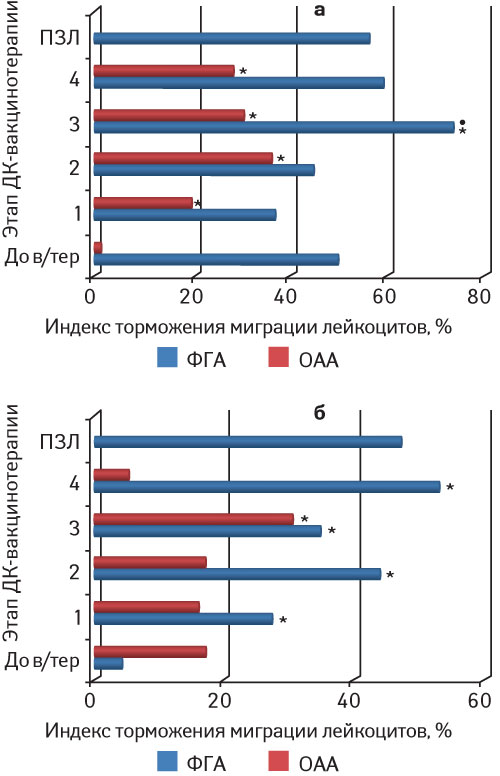
Рис. 6. Активность лейкоцитов периферической крови больных НМРЛ (а) и раком яичника (б) в РТМЛ на этапах проведения вакцинотерапии на основе ДК.
До в/тер — до вакцинотерапии, ПЗЛ — практически здоровые люди; *р
Особое значение в иммунном ответе на вакцинотерапию имеют НКК, которые способны удалять опухолевые клетки разных типов, особенно те, которые имеют сниженный уровень экспрессии молекул МНС (major histocompatibility complex — главный комплекс гистосовместимости) І и недоступные для действия Т-лимфоцитов.
Как показали полученные результаты, у больных НМРЛ до начала проведения вакцинотерапии ЦА НКК существенно снижена. Выполнение вакцинотерапии способствует повышению функциональной активности и увеличению количества этих клеток уже после I ее этапа. Наиболее существенные изменения в состоянии этого звена иммунитета отмечают после III и IV этапов вакцинотерапии. Однако у больных раком яичника до проведения вакцинотерапии мы не отметили существенных нарушений как количественных, так и функциональных показателей, характеризующих активность НКК. Некоторое повышение ЦА лимфоцитов было отмечено лишь после 4-го введения ДК-вакцины (рис. 7).
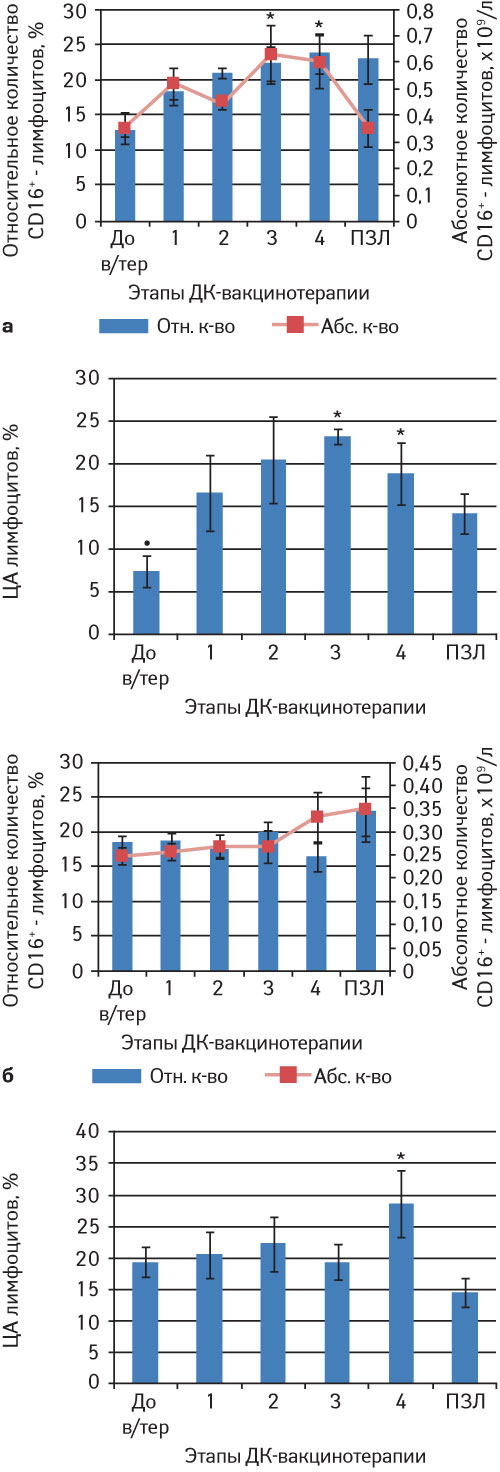
Рис. 7. Количество и ЦА НКК больных НМРЛ (а) и раком яичника (б) на этапах проведения вакцинотерапии на основе ДК.
До в/тер — до вакцинотерапии; ПЗЛ — практически здоровые люди; Отн. к-во — относительное количество; Абс. к-во — абсолютное количество; *р
Таким образом, наиболее выраженные изменения в состоянии клеточно-опосредованного иммунного ответа под действием терапии ДК-вакциной происходят лишь после III–IV этапа ее проведения.
Обсуждение результатов исследований
Недостаточная иммуногенность ОАА и повреждение механизма их презентации являются одними из основных причин, обусловливающих ускользание опухоли из-под иммунологического надзора и, как следствие, неблагоприятный исход онкологического заболевания [15]. Зачастую повреждение механизма презентации ОАА связывают с подавлением активности ДК — главных антигенпредставляющих клеток иммунной системы. Опухоль располагает для этого различными возможностями, воздействуя на ДК на стадии дифференцировки гемопоэтических предшественников, снижая их созревание, миграцию, функциональную активность и численность. Поэтому в вакцинотерапии рака весьма перспективным является путь индукции дифференцирования и нагрузки ДК антигенами из опухолей in vitro, поскольку с их помощью можно усилить именно начальные этапы иммунного ответа на «низкоиммуногенные» антигены, каковыми являются ОАА, восстановить нарушенные in vivo этапы их презентации иммунокомпетентным клеткам [16]. ДК являются чрезвычайно перспективной мишенью для терапевтических манипуляций иммунной системой, которая способна изменить соотношение «опухоль — иммунная система организма хозяина» в пользу хозяина и увеличить силу иммунного ответа, направленного на опухоль [17].
Разумеется, что данный метод предназначен для применения у больных онкологического профиля с адъювантной целью в случае так называемой резидуальной опухолевой болезни. При большой опухолевой массе эффективность вакцинотерапии a priori значительно ниже, что уже показано в ряде клинических исследований [7]. Согласно разработанной нами схеме, терапию противоопухолевой вакциной на основе ДК у пациентов с НМРЛ и раком яичника проводили в адъювантном режиме с целью предупреждения развития рецидивов и метастазов после окончания основного лечения и в случае сохранения достаточной иммунокомпетентности организма больных. На основе использования базовых критериев оценки эффективности терапии в онкологии продемонстрировано, что включение ДК-вакцины в комплексное лечение больных НМРЛ и раком яичника существенно повышает его эффективность, оцениваемую по их выживаемости. Зарегистрировано значительное повышение 3–5-летней общей и безрецидивной выживаемости больных, увеличение продолжительности безрецидивного периода и медианы безрецидивной выживаемости, снижение риска прогрессирования заболевания.
Поскольку механизм действия ДК-вакцины опосредован активацией либо формированием специфического противоопухолевого иммунного ответа, что, как правило, занимает от нескольких недель до нескольких месяцев, клинический эффект вакцинотерапии является отсроченным. В связи с этим актуальным становится поиск наиболее значимых «суррогатных» иммунологических маркеров для оценки прогноза ее эффективности [18].
Известно, что иммунологический ответ на ОАА, как и на любые антигены, состоит из комплекса процессов, в которых взаимодействуют эффекторные и регуляторные механизмы, тем или иным способом задействованные на разных этапах специфического и неспецифического клеточного иммунного ответа на ОАА. Поэтому для обеспечения максимальной эффективности регуляторные механизмы должны влиять на различные звенья иммунитета: как на неспецифическое, основой которого является функционирование НКК и макрофагов, так и специфическое звено, преимущественно Т-клеточное. Определение уровня развития антигенспецифического Т-клеточного иммунного ответа на ОАА считается базовым показателем в оценке и прогнозировании клинического ответа на проводимую активную специфическую иммунотерапию [19].
В нашем исследовании выраженная активация антигенспецифического клеточного иммунного ответа зарегистрирована у больных НМРЛ и раком яичника после проведения III–IV этапов ДК-вакцинотерапии. Об этом свидетельствует увеличение коэффициента соотношения ИФН-γ-продуцирующих CD3-лимфоцитов к ИЛ-4-продуцирующим после взаимодействия с ОАА. Данное соотношение определяет баланс между Tх1- и Tх2-типом иммунного ответа. Преобладание CD3ИФН-γ- над CD3ИЛ-4-лимфоцитами в количественном отношении свидетельствует об активации именно клеточного звена антигенспецифического иммунного ответа, который является ведущим в реализации специфической противоопухолевой активности.
Значительное повышение ЦА лимфоцитов у больных было отмечено также, как и в случае формирования антигенспецифических иммунных реакций, лишь после 3–4-го введения ДК-вакцины. На этом этапе вакцинотерапии ЦА НКК может усиливаться под действием цитокинов ИФН-γ, ИЛ-2 и др., которые выделяют активированные сенсибилизированные лимфоциты, образующиеся в процессе ее проведения. Таким образом, установлено, что ДК-вакцинотерапия у больных НМРЛ и раком яичника влияет не только на специфическое звено иммунитета, но и на популяцию НКК, обеспечивающих первую линию защиты от опухолевых клеток, формируя тем самым и общую противоопухолевую резистентность организма.
В общем, результаты иммунологических исследований свидетельствуют о том, что формирование противоопухолевого специфического иммунного ответа на аутологичные ОАА у больных НМРЛ и раком яичника требует 3–4 введений ДК-вакцины и занимает несколько месяцев. Исходя из этого, можно сделать вывод, что для достижения эффективности необходимо не менее 4 введений ДК-вакцины. Представленные иммунологические маркеры могут быть использованы в качестве дополнительного обоснования при назначении и выборе схемы проведения вакцинотерапии у пациентов со злокачественными новообразованиями.
Полученные результаты демонстрируют эффективность метода вакцинотерапии на основе ДК в лечении больных НМРЛ IIB–IIIА стадии и раком яичника III–IV стадии и расширяют перспективу его применения у пациентов с другими нозологическими формами злокачественных новообразований. Кроме того, такая противорецидивная терапия обладает известными преимуществами перед химиотерапией еще также в цене и переносимости.
Выводы
Применение противоопухолевой вакцины на основе ДК в комплексном лечении больных НМРЛ ІІB–ІІІА стадии и раком яичника ІІІ–IV стадии способствует существенному улучшению результатов их лечения. Зарегистрировано улучшение 5-летней общей выживаемости пациентов с НМРЛ на 25% и раком яичника на 35%.
Установлено, что противоопухолевая вакцина на основе ДК является эффективным модулятором состояния иммунной системы больных НМРЛ и раком яичника, который позволяет восстановить или усилить противоопухолевые иммунные реакции организма.
Для формирования противоопухолевого специфического иммунного ответа у пациентов с НМРЛ и раком яичника требуется не менее 4 этапов введений ДК-вакцины. Выявленные изменения в состоянии иммунной системы больных обосновывают целесообразность проведения комплексного иммуномониторинга.
Выражение признательности
Авторы выражают признательность доктору медицинских наук Г.П. Потебне за сотрудничество при разработке и исследовании эффективности противоопухолевой вакцины на основе ДК, нагруженных ЛОК, обработанных цитотоксическими лектинами B. subtilis B-7025.
Список использованной литературы
1. Потебня Г.С., Лисовенко Г.П. (2010) Биотерапия рака: достижения и перспективы. Онкология, 12 (3): 237–241.
2. Rosenberg S.A., Yang J.C., Restifo N.P. (2004) Cancer immunotherapy: moving beyond current vaccines. Nat. Med., 10: 909–915.
3. Schreiber T., Raez L., Rosenblatt J.D. (2010) Tumor immunogenicity and responsiveness to cancer vaccine therapy; The state of the art Semin Immunol, 22 (3): 105–112.
4. Ott P.A., Hodi F.S., Robert C. (2013) CTLA-4 and PD-1/PD-L1 blockade: new immunotherapeutic modalities with durable clinical benefit in melanoma patients. Clin. Cancer Res., 19 (19): 5300–9.
5. Moiseyenko V., Imyanitov E., Danilova A. et al. (2007) Cell technologies in immunotherapy of cancer. Adv. Exp. Med. Biol., 601: 387–93.
6. Palucka K., Ueno H., Fay J., Banchereau J. (2011) Dendritic cells and immunity against cancer. J. Intern. Med., 269 (1): 64–73.
7. Galluzzi L., Senovilla L., Vacchelli E. (2012) Dendritic cell-based interventions for cancer therapy. OncoImmunology, 1 (7): 1111–1134.
8. Higano C., Schellhammer P., Small E. et al. (2009) Integrated data from 2 randomized, double-blind, placebo-controlled, phase 3 trials of active cellular immunotherapy with sipuleucel T in advanced prostate cancer. Cancer, 115: 3670–3679.
9. Kantoff P.W., Higano C.S., Shore N.D. et al. (2010) Sipuleucel T immunotherapy for castration-resistant prostate cancer. N. Engl. J. Med, 363: 411–422.
10. Патент № 57869 (UA). Спосіб одержання протипухлинної аутовакцини / Потебня Г.П., Лисовенко Г.С., Черемшенко Н.Л. та ін. (Украина); Опубл. 15.07.2003, Бюл. №7.
11. Орел В.Э, Гриневич Ю.А., Дзятковская Н.Н. и др. (2008) Биоинженерная технология получения опухолеспецифического антигена на основе механохимически радиационно-гетерогенизированных опухолевых клеток. Специфічна імунотерапія в онкології / Под ред. Ю.А. Гриневича. Здоровье, Киев: 31–38.
12. Khranovska N., Orel V., Grinevich Yu. et al. (2012) Mechanical heterogenization of Lewis lung carcinoma cells can improve antimetastatic effect of dendritic cells. J. Mech. Med. Biol., 12(3): 1–22.
13. Храновская Н.Н.,Орел В.Э.,Гриневич Ю.А. и др. (2007) Влияние механохимически гетерогенизированных опухолевых клеток на антиметастатический эффект дендритных клеток при иммунизации животных с карциномой Льюис. Журнал АМН України, 3 (13): 553–566.
14. Храновська Н.М., Гріневич Ю. Я. (2006) Метод одержання аутологічної протипухлинної вакцини на основі дендритних клітин. Методичні рекомендації, Київ, 8 с.
15. Murphy J.F. (2010) Trends in cancer immunotherapy. Clin. Med. Insights. Oncol., 14: 67–80.
16. Моисеенко В.М., Балдуева И.А. (2011) Принципы создания и использования лечебных вакцин в онкологи. Рос. онкол. журн., 2: 49–53.
17. Tuyaerts S. (2011) Dendritic cell therapy for oncology roundtable conference. J. Immune Based Ther Vaccines, 9 (1): 10 p.; doi:10.1186/1476-8518-9-1.
18. Herzog R., Álvarez-Pasquin M., Díaz C. et al. (2013) Are healthcare workers’ intentions to vaccinate related to their knowledge, beliefs and attitudes? (a systematic review). GiBMC Public Health.11 p.; doi: 13 :154 171.
19. Hoos A., Britten C., Huber C., O’Donnell-Tormey J. (2011) A methodological framework to enhance the clinical success of cancer immunotherapy. Nature Biotechnology, 29: 867–870.














Leave a comment