ВИЧ-ассоциированные неходжкинские лимфомы
Карнабеда О.А.1, Гетьман Л.И.2, Антоняк С.Н. 2, Рослякова Т.В. 3, Шулига-Недайхлебова О.В. 3
- 1Національний медичний університет ім. О.О. Богомольца, Київ
- 2Інститут епідеміології та інфекційних хвороб ім. Л.В. Громашевського
- 3Медична клініка «Інновація»
Резюме. В статье представлены особенности клинической картины, диагностики и лечения ВИЧ-ассоциированных неходжкинских лимфом. Большинство ВИЧ-ассоциированных лимфоидных опухолей, согласно классификации ВОЗ 2008, являются диффузными В-крупноклеточными лимфомами. Для ВИЧ-ассоциированных лимфом характерен быстрый рост опухоли, и наиболее часто у этих пациентов определяют наличие В-симптомов. Поражение костного мозга диагностируют у 25–40% пациентов, желудочно-кишечного тракта — у 26%. Вовлечение в опухолевый процесс центральной нервной системы у ВИЧ-инфицированных отмечают у 12–57% пациентов. Пациенты с ВИЧ-ассоциированными лимфомами, у которых иммунная функция сохранена, имеют более низкий риск развития инфекционных осложнений, что позволяет назначить им оптимально эффективную химиотерапию в полном объеме.

В соответствии с новой классификации опухолей лимфоидной ткани (ВОЗ 2008) ВИЧ-ассоциированные лимфомы выделены в отдельную подгруппу «Лимфопролиферативные заболевания, ассоциированные с иммунодефицитом»[1, 50]. В результате изучения установлено, что вирус иммунодефицита человека (ВИЧ) значительно повышает риск развития хронических лимфопролиферативных заболеваний, таких как неходжкинские лимфомы (НХЛ) и лимфома Ходжкина. (ЛХ). Эпидемиологически доказано, что для ВИЧ-инфицированных пациентов характерно 60–200-кратное повышение заболеваемости НХЛ. Увеличение числа больных НХЛ среди ВИЧ-инфицированных составляет 5,6% в год, по сравнению с 0,015% в общей популяции. Риск НХЛ или первичной лимфомы центральной нервной системы (ЦНС) у ВИЧ-инфицированных лиц тесно связан с уровнем CD4. В одном из исследований установлено, что частота НХЛ повысилась с 15,6 до 253,8 на 10 тыс. человеко-лет, а первичная лимфома ЦНС— от 2 до 93,9 на 10 тыс. человеко-лет у пациентов с числом лимфоцитов CD4 >350 клеток/мкл по сравнению с пациентами с <50 клеток/мкл CD4 соответственно [5].
Кроме того, доказано, что у пациентов с меньшим количеством CD4 наиболее часто диагностируют первичную лимфому ЦНС и первичную лимфому экссудатов (ПЛЭ), в тоже время у ВИЧ-инфицированных пациентов с более высоким уровнем CD4 клеток выявляют ЛХ и лимфому Беркитта (ЛБ) [10, 32, 50, 55].
Большинство ВИЧ-ассоциированных лимфоидных опухолей, согласно онтогенезу клеток лимфоидной ткани, относятся к диффузной В-крупноклеточной лимфоме (ДВККЛ), которая включает в себя и первичную лимфому ЦНС. ЛБ у ВИЧ-ассоциированных пациентов составляет 30–40% [1]. Гораздо реже диагностируют ПЛЭ, плазмобластную лимфому и ЛХ. Другие подтипы лимфом, такие как фолликулярная лимфома и периферическая Т-клеточная лимфома, могут также развиваться у пациентов данной группы, но довольно редко [1, 55].
Патогенез ВИЧ-ассоциированных лимфом
Патогенез ВИЧ-ассоциированной лимфомы включает в себя сложное взаимодействие биологических факторов, таких как хроническая стимуляция антигеном, коинфекция онкогенных вирусов, генетические аномалии и нарушения регуляции цитокинов [22, 35, 39, 50].
Хроническая антигенная стимуляция, которая связана с ВИЧ-инфекцией, может привести вначале к увеличению количества поликлональных В-клеток и, вероятно, в дальнейшем способствовать появлению моноклональных [18, 55].
В последнее время отмечено увеличение количества циркулирующих свободных легких цепей иммуноглобулина у пациентов с повышенным риском развития ВИЧ-ассоциированной лимфомы, что может выступать маркером поликлональной В-клеточной активации [31]. Современные исследования с целью выявления свободных легких цепей иммуноглобулина могут быть полезны для определения наличия повышенного риска развития лимфомы у ВИЧ-инфицированных лиц [31].
Наиболее часто, приблизительно в 40% случаев ВИЧ-ассоциированных лимфом, выявляют онкогенный вирус Эпштейна — Барр (ВЭБ) [1, 3, 50]. Почти у всех больных первичной лимфомой ЦНС и ЛХ определяют ВЭБ. В большинстве случаев ВИЧ-ассоциированной ПЛЭ отмечают ассоциацию 2 онкогенных вирусов: ВЭБ и вируса герпеса 8-го типа (human herpesvirus — HHV-8), который присутствует практически у всех пациентов [8]. ВЭБ определяется у 30–50% ВИЧ-ассоциированной ЛБ и у 50% случаев плазмобластной лимфомы (табл. 1) [1, 3, 8]. ВЭБ-положительные ВИЧ-ассоциированные лимфомы часто экспрессируют латентный мембранный белок 1, который активирует пролиферацию клеток путем активации NF-kB пути и индуцирует гиперэкспрессию BCL2, тем самым блокирует апоптоз опухолевых B-клеток, способствуя их выживанию [17, 23, 46].
Таблица 1. Ассоциация онкогенных вирусов у пациентов с ВИЧ-лимфомами
| Гистологический вариант | ВЭБ+ | HHV-8 |
| ДВККЛ | ||
| Центробластная | 30% | 0 |
| Иммунобластная | 80–90% | 0 |
| Плазмобластная | >50% | 80% |
| ПЛЭ | 100% | 100 |
| ЛБ | 30–50% | 0 |
| Первичная лимфома ЦНС | 100% | 0 |
| ЛХ | 80–100% | 0 |
Повышение уровня цитокинов, таких как IL-6, IL-10, фактора некроза опухоли-β наряду с частыми аберрантными гипермутациями соматических генов иммуноглобулинов свидетельствуют о роли иммунной стимуляции в лимфоонкогенезе у ВИЧ-инфицированных пациентов [1].
Полиморфизм хемокиновых путей также влияет на риск развития ВИЧ-ассоциированных лимфом. Например, при ВИЧ-инфекции 3՛A-вариант фактора 1 стромальных производных клеток увеличивается вдвое, что в 4 раза повышает риск НХЛ у гетерозиготах и гомозиготах соответственно [43, 55].
Молекулярно-генетические особенности ВИЧ-ассоциированных лимфом
В результате исследований определен целый ряд генетических аномалий при ВИЧ-ассоциированных лимфомах. В работе A. Carbone (2003) доказано, что ЛБ связана с активацией MYC гена. Интересно, что около 20% ВИЧ-инфицированных, больных ДВККЛ, также имеют MYC-транслокацию [16, 27]. У пациентов с ВИЧ-ассоциированными лимфомами BCL6 мутация встречается в 20% случаев при центробластной ДВККЛ и у 60% — при ПЛЭ [24, 25].
G. Lenz и соавторы (2010) в результате исследований доказали, что молекулярный профиль ВИЧ-ассоциированных лимфом аналогичен ДВККЛ и ЛБ ВИЧ-отрицательных пациентов [33].
Гены, ассоциирующиеся с зародышевым центром В-клеток (germinal center B-cell like type — GCB) ДВККЛ, включали маркеры дифференциации зародышевого центра, такие как CD10 и BCL6, в то время как гены, связанные с активированным В-клеточным (activated B-cell like type — ABC) типом ДВККЛ, содержали IRF4/MUM1 [15].
В ряде исследований установлено, что экспрессия BCL2 гена была более чем в 4 раза выше при ABC ДВККЛ, чем при ДВККЛ с GCB [2]. Эти результаты свидетельствуют о том, что подтипы ДВККЛ GCB и ABC происходят из В-клеток на разных стадиях дифференциации. ДВККЛ с GCB возникает из зародышевого центра В-клеток, а ДВККЛ с ABC происходит от постзародышевого центра В-клеток на стадии плазматической дифференциации лимфоцита.
Генетический анализ показал, что патогенетические механизмы при ABC и GCB ДВККЛ различны. ДВККЛ с GCB исключительно связана с транслокаций t (14, 18) с вовлечением BCL2 гена и гена тяжелой цепи иммуноглобулинов, а также с амплификацией c-rel локуса на хромосоме 2р. Кроме того, данная лимфома имеет амплификацию онкогенного mir-17-92 microРНК кластера, делецию опухолевых супрессоров PTEN и частую аномалию BCL6 гена [34, 40].
При ABC ДВККЛ часто отмечают амплификацию онкогена SPIB, делецию локуса супрессора опухоли INK4a/ARF и трисомию 3, что приводит к экспрессии аномальных CARD11, BCL10 и A20, которые активируют IκB киназы и NF-кВ пути опухолевого лимфогенеза [17, 34, 35, 39].
В табл. 2 представлены гистогенетические и молекулярно-генетические особенности лимфом у ВИЧ-инфицированных пациентов в зависимости от гистологического происхождения опухоли.
Таблица 2. Особенности лимфом ассоциированных с ВИЧ-инфекцией
| Гистогенетическое происхождение | Гистология | Гистогенетические маркеры (%) | Молекулярно-генетические маркеры (%) | Клетки CD4 | ||||
|---|---|---|---|---|---|---|---|---|
| MUM1 | Syn-1 | BCL-2 | BCL-6 | P53 | c-MYC | |||
| Герминальный (зародышевый) центр | ЛБ | <15 | 0 | 0 | 100 | 60 | 100 | Может быть относительно хорошо сохранившееся количество |
| ДВККЛ с GCB | <30 | 0 | 0 | >75 | редко | 0–50 | Переменное количество | |
| Постгерминальный центр | ДВККЛ с ABC | 100 | >50 | 30 | 0 | 0 | 0–20 | Обычно малое |
| Первичная лимфома ЦНС | >50 | >60 | 90 | >50 | 0 | 0 | >50 мм3 | |
| ПЛЭ | 100 | >90 | 0 | 0 | 0 | 0 | Переменное количество | |
| Плазмобластная лимфома | 100 | 100 | 0 | 0 | Редко | 0 | Переменное количество | |
Примечания: KSHV — саркома Капоши, ассоциированная с вирусом герпеса; MUM1 — множественная миелома-1.
Диагностика ВИЧ-ассоциированных лимфом [55]
Наиболее важным диагностическим тестом является гистологическое и иммуногистохимическое изучение материала, полученного при эксцизионной биопсии.
В большинстве случаев гистологическая картина ВИЧ-положительных лимфом аналогична развивающимся у ВИЧ-отрицательных пациентов.
Гистологические особенности ВИЧ-ассоциированных лимфом [1, 55]
ВИЧ-ассоциированную ДВККЛ классифицируют на 2 гистологических варианта — центробластный и иммунобластный. Центробластный вариант составляет около 25% ВИЧ-ассоциированных лимфом и характеризуется диффузным ростом больших лимфоидных клеток с круглыми или овальными ядрами и выраженными ядрышками. Они часто экспрессируют маркеры зародышевого центра фолликула, такие как CD10 и BCL6, и, как правило, все опухолевые клетки являются CD20-положительными [9, 50]. Иммунобластный вариант ДВККЛ содержит более 90% иммунобластов и часто проявляет черты плазмоцитоидной дифференциации [14, 50, 53]. Данный вариант ДВККЛ составляет около 10% из всех ВИЧ-ассоциированных лимфом. Эта опухоль CD10-отрицательна, так как является лимфомой из постзародышевого центра фолликула лимфатического узла. Нередко при ДВККЛ иммунобластного типа отмечают положительную экспрессию на MUM1/IRF4 и CD138/syndecan-1 маркеры [9]. Данная опухоль часто имеет митозы с высокой Ki-67/MIB-1 экспрессией [36]. При иммунобластной лимфоме опухолевые клетки могут быть CD20-отрицательными из-за коэкспрессии ВЭБ.
Маркеры, связанные с активацией, такие как CD30, CD38, CD71, часто экспрессируются при иммунобластном варианте ДВККЛ [10, 50].
Опухолевая клетка при ПЭЛ является опухолью В-клеточного происхождения, но на опухолевых клетках отсутствует экспрессия В-клеточных антигенов, таких как CD20 и CD79a. CD45, CD30, CD38, CD138 обычно экспрессируются и связаны с KSHV/HHV-8 и ВЭБ [30].
При плазмобластной лимфоме, как правило, отмечают положительную экспрессию CD38, CD138 и MUM1/IRF4 антигенов и отрицательную CD20 и CD45 [53].
ВИЧ-ассоциированная ЛБ разделена на 3 отдельных подтипа: классический, плазмоцитоидный, нетипичный [50]. Классический тип ЛБ диагностируют примерно у 30% случаев всех ВИЧ-ассоциированных лимфом, морфологически он напоминает классическую ЛБ ВИЧ-отрицательных пациентов. Для ЛБ с плазмоцитоидной дифференциацией характерен средний размер клеток с обильной цитоплазмой, что значительно чаще отмечают в условиях выраженного иммунодефицита. В других случаях опухолевые клетки имеют высокий ядерный плеоморфизм с меньшим, но более заметным ядром, в прошлом данный тип ЛБ был назван нетипичной ЛБ. Все 3 типа имеют очень высокие показатели митотического индекса с экспрессией CD19, CD20, CD79a и CD10 и являются отрицательными для BCL2. Случаи ВЭБ-положительной ЛБ составляют от 30% — при классической ЛБ, а ЛБ, связанных с плазмоцитоидной дифференциацией, — 50–70% [51]. Классическая ЛХ у ВИЧ-инфицированных пациентов в основном представлена смешанно-клеточным вариантом, ВЭБ выявляют практически во всех случаях ЛХ [51]. Интересно, что в эру антиретровирусной (АРВ) терапии происходит значительное повышение заболеваемости нодулярным склерозом ЛХ из-за большей доли пациентов в высоким количеством CD4 клеток [6, 30].
Для диагностики ВИЧ-ассоциированных лимфом изучение экспрессии генов не используется. Но для установления происхождения ДВККЛ необходимо проведение иммуногистохимического исследования с использованием CD10, BCL6, и MUM1 [26]. Согласно последнему диагностическому и прогностическому алгоритму, необходимо изучение дополнительных маркеров GCET1 и FOXP1 [13]. Кроме того, по данным современной литературы, выявление MYC+ опухолевых клеток при ДВККЛ может быть применено для прогнозирования результатов терапии. Доказано, что MYC-положительные опухоли плохо отвечают на терапию с использованием R-CHOP режима [16, 26]. Таким образом, целесообразно выполнять цитогенетическое или FISH изучение опухоли для выявления MYC транслокаций с целью определения наиболее эффективного лечения.
Клинические особенности ВИЧ-ассоциированных НХЛ
Для ВИЧ-ассоциированных лимфом характерен быстрый рост опухоли. Наиболее часто у пациентов данной категории выявляют наличие В-симптомов (необъяснимая лихорадка, ночное повышенное потоотделение, необъяснимое уменьшение массы тела более 10% от нормальной). Поражение костного мозга диагностируют у 25–40% пациентов, желудочно-кишечного тракта — у 26%. Вовлечение в опухолевый процесс ЦНС у ВИЧ-инфицированных регистрируют у 12–57% больных [11, 53].
Комплекс лабораторно-инструментальных обследований для установления распространения опухолевого процесса и определения прогностической группы у пациентов с ВИЧ-ассоциированной лимфомой в основном не отличается от таковых у ВИЧ-отрицательных пациентов.
Диагностическая и прогностическая роль позитронно-эмиссионной томографии с фтордезоксиглюкозой (ПЭТ-ФДГ) доказана у пациентов с ВИЧ-отрицательными агрессивными лимфомами. В настоящее время роль ПЭТ-ФДГ в диагностике ВИЧ-ассоциированных лимфом изучена недостаточно. Предыдущий опыт применения ПЭТ-ФДГ у пациентов с ВИЧ-ассоциированными лимфомами ограничивается небольшим ретроспективным анализом и требует дальнейшего изучения. При проведении ПЭТ у больных с ВИЧ-ассоциированными лимфомами необходимо также проведение дифференциальной диагностики опухолевого поражения, узловой реактивной гиперплазии, липодистрофии и инфекции [19, 21].
Прогностические критерии при ВИЧ-ассоциированных лимфомах
Международный прогностический индекс (МПИ) является стандартным прогностическим критерием у ВИЧ-отрицательных пациентов с ДВККЛ. Однако использование МПИ у больных с ВИЧ-ассоциированными ДВККЛ — вопрос спорный. В ряде исследований продемонстрировано, что при применении МПИ у пациентов с ВИЧ-ассоциированными лимфомами прогнозировать выживаемость без прогрессирования и общую выживаемость невозможно [28, 45].
Прогностическое значение у ВИЧ-инфицированных пациентов имеет количество CD4-положительных лимфоцитов. Доказано, что пациенты с уровнем CD4 <100 клеток/мкл подвержены повышенному риску развития серьезных оппортунистических инфекций и летального исхода. Кроме того, как отмечалось ранее, у больных с тяжелой иммуносупрессией более часто диагностируют иммунобластный подтип ДВККЛ, большинство из которых являются ABC, они имеют плохие результаты по сравнению с пациентами с сохраненным иммунитетом, где подтип GCB более распространенный [21]. В последнее время опубликованы исследования, в результате которых не установлена связь между происхождением опухолевых клеток и исходом ВИЧ-ассоциированных ДВККЛ [12, 20, 47].
Поражение ЦНС, которое увеличилось при ВИЧ-ассоциированных агрессивных B-клеточных лимфомах, также имеет неблагоприятный прогноз [1].
Лечение при ВИЧ-ассоциированных НХЛ
Лечение при ВИЧ-ассоциированных лимфомах можно разделить на 2 этапа: до применения АРВ терапии и после широкого использования специфической комплексной АРВ терапии.
Результаты терапии ВИЧ-ассоциированных лимфом до эпохи АРВ терапии были плохими, медиана выживаемости пациентов в среднем составляла 5–6 мес и определялась в основном количеством CD4 клеток. Эти результаты связывали с развитием как гематологических, так и негематологических осложнений на фоне химиотерапии. В одном исследовании L.D. Kaplan и соавторы отметили, что высокие дозы циклофосфамида коррелируют с низкой выживаемостью пациентов [29]. В попытке улучшить результаты терапии и снизить риск развития инфекционных осложнений проведено многоцентровое рандомизированное исследование, в котором сравнивали результаты терапии в режиме mBACOD в стандартных дозах и при снижении дозы у 192 пациентов с ВИЧ-ассоциированными лимфомами [29].
Как видно из табл. 3, количество полных ответов, медиана выживаемости в группах сравнения статистически не отличались, но гематологическая токсичность в группе пациентов с применением низких доз в режиме mBACOD была статистически ниже. Авторы сделали вывод, что более низкие дозы химиопрепаратов предпочтительнее у больных с ВИЧ-ассоциированными лимфомами. Однако в исследование включены пациенты с малым количеством CD4-положительных лимфоцитов. В эпоху широкого применения АРВ терапии увеличилось количество больных с большим числом CD4 клеток, что в конечном счете позволяет повысить эффективность терапии и снизить инфекционный риск при использовании стандартных доз химиотерапии (см. табл. 3) [36].
Таблица 3. Результаты терапии ВИЧ-ассоциированных лимфом по данным клинических исследований
| Вид исследования (количество пациентов, n) | Вариант лимфомы | Схема терапии | Количество CD4 клеток/мм3 | Результаты терапии | ||||
| Полная ремиссия, % | Выживаемость без прогрессирования | Общая выживаемость | ||||||
| Kaplan L.D., 1997 [29] | Многоцентровое рандомизированное, фаза ІІІ (n=192) | Агрессивная НХЛ | m-BACOD + GM-CSF | 107 | 52 | 38 нед | 31 нед | |
| m-BACOD low + GM-CSF | 100 | 41 | 56 нед | 35 нед | ||||
| Ratner l., 2001[44] | фаза ІІ (n=65) | ДВККЛ, иммунобластная НХЛ | m-CHOP | 138 | 30 | Медиана ответа на терапию — 65 нед | ||
| CHOP | 122 | 48 | Медиана ответа на терапию не достигнута | |||||
| Sparano J. A., 2004 [48] | фаза ІІ (n=98) | ДВККЛ, ЛБ | didanosine | 90 | 47 | 1-годичная — 42%, 2-летняя — 35% | 6,8 мес | |
| CDE | 227 | 44 | 1-годичная — 40%, 2-летняя — 38% | 13,7 мес | ||||
| Mounier N., 2006 [37] | фаза ІІІ (n=485) | ДВККЛ | HIV(score 0) | ACVBP | 239 | 61 | 5-летняя — 35,54% | 5-летняя — 41,61% |
| CHOP | 239 | 51 | 5-летняя — 30,49% | 5-летняя — 38,57% | ||||
| HIV(score 1) | CHOP | 72 | 49 | 5-летняя — 16,35% | 5-летняя — 18,37% | |||
| CHOP low | 72 | 32 | 5-летняя — 10,29% | 5-летняя — 15,34% | ||||
| HIV (score 2–3) | CHOP low | 21 | 20 | 5-летняя — 0,16% | 5-летняя — 2,20% | |||
| VS | 21 | 5 | 5-летняя — 0% | 5-летняя — 0,8% | ||||
| Little R. F., 2003 [36]. | фаза ІІ (n=39) | ДВККЛ, ЛБ, ПЛЭ | EPOCH | 198 | 74 | 4,4-летняя — 73% | 4,4-летняя — 60% | |
| Kaplan L.D., 2005 [28] | фаза ІІІ (n=150) | ДВККЛ, ЛБ | R-CHOP | 130 | 49,5 | 45 нед | 139 нед | |
| CHOP | 147 | 41,2 | 38 нед | 110 нед | ||||
| Boue F., 2006 [7] | фаза ІІ(n=61) | ДВККЛ, ЛБ, иммунобластная, плазмобластная | R-CHOP | 172 | 35 | 2-летняя — 69% | 2-летняя — 75% | |
| Spina M., 2005 [49] | фаза ІІ(n=74) | ДВККЛ, ЛБ, анапластическая крупноклеточная лимфома, иммунобластная | CDE-R | 161 | 70 | 2-летняя — 59% | 2-летняя — 64% | |
| CDE | 227 | 45 | 2-летняя — 38% | 2-летняя — 45% | ||||
| Sparano J.A., 2010 [51] | фаза ІІ(n=101) | ДВККЛ, ЛБ | R-DAEPOCH | 181 | 73 | 1-годичная — 78%; 2-летняя — 66% | 2-летняя — 70% | |
| DAEPOCH→R | 194 | 55 | 1-годичная — 66%; 2-летняя — 63% | 2-летняя — 67% | ||||
| Dunleavy K., 2010 [21] | фаза ІІ (n=33) | ДВККЛ | SC-EPOCH-RR | 208 | 5-летняя — 84% | 5-летняя — 68% | ||
Примечания: m-BACOD — метотрексат, блеомицин, доксорубицин, циклофосфамид, винкристин, дексаметазон; GM-CSF-колонистимулирующий фактор; CDE — циклофосфамид, доксорубицин, этопозид; R — ритуксимаб; CHOP — циклофосфамид, винкристин, доксорубицин, преднизолон; VS — винкристин, преднизолон; ACVBP — доксорубицин, циклофосфамид, винкристин, блеомицин, преднизолон; EPOCH — этопозид, преднизолон, винкристин, доксорубицин, циклофосфамид; SC — короткий курс; DA— корригируемая доза.
Начало применения АРВ терапии около 15 лет назад оказало значительное влияние на исход лечения при ВИЧ-ассоциированных лимфомах с увеличением медианы выживаемости, что объясняется благотворным воздействием АРВ терапии на иммунную систему. Пациенты с ВИЧ-ассоциированными лимфомами, у которых иммунная функция сохранена, имеют более низкий риск развития инфекционных осложнений, что позволяет назначить им оптимально эффективную химиотерапию в полном объеме [10, 36]. В одном из исследований доказано, что у больных ВИЧ-ассоциированной лимфомой общая выживаемость и выживаемость без прогрессирования в значительной степени зависели от АРВ терапии, а не интенсивности доз цитостатической терапии [37].
В табл. 3 представлены результаты рандомизированных исследований различных режимов цитостатической терапии у пациентов с ВИЧ-ассоциированными лимфомами.
В табл. 4 приведены основные схемы для лечения при ВИЧ-ассоциированных лимфомах, эффективность которых представлена в табл. 3.
Таблица 4. Основные схемы цитостатической и поддерживающей терапии ВИЧ-ассоциированных лимфом
| Автор | Тип НХЛ | Название схемы | Препараты | Доза | День введения | Профилактика поражения ЦНС | Поддерживающая терапия |
|---|---|---|---|---|---|---|---|
| Sparano J.A., 2010 [47] | ДВККЛ, ЛБ, ПЛЭ, плазмобластная лимфома | R-EPOCH-21 | ритуксимаб | 375 мг/м2 | 1-й день, более 3 ч | Интратекально или цитарабин 50 мг или метотрексат 12 мг еженедельно 4 нед в течение 1 цикла | Филграстим 5 мг/кг на 6-й день после EPOCH Триметоприм/сульфаметоксол 160–800 мг 3 раза в неделю постоянно Флуконазол 100 мг ежедневно постоянно Ципрофлоксацин 500 мг 2 раза в сутки 8–15-й день после EPOCH |
| этопозид | 50 мг/м2 | 1–4-й день (96-часовая инфузия) | |||||
| доксорубицин | 10 мг/м2 | 1–4-й день (96-часовая инфузия) | |||||
| винкристин | 0,4 мг/м2 | 1–4-й день (96-часовая инфузия) | |||||
| преднизолон | 60 мг/м2 | 1–5-й день | |||||
| циклофосфамид | 1-й цикл: 187 мг/м2, если CD4 3, и 375, если CD4 >100 кл/м3 | 5-й день 60-минутная инфузия | |||||
| Dunleavy K., 2010 [21] | ДВККЛ, ЛБ, ПЛЭ, плазмабластная лимфома | SC-EPOCH-RR-21 | ритуксимаб | 375 мг/м2 | 1-й и 5-й дни, более 3 ч | Интратекально метотрексат 12 мг в 1-й и 5-й день 3–5 циклов | Филграстим 5 мг/кг 6–15-й день после EPOCH Профилактику Pneumocystis jiroveci pneumonia, если CD4 <100 кл/м3 |
| этопозид | 50 мг/м2 | 1–4-й день (96-часовая инфузия) | |||||
| доксорубицин | 10 мг/м2 | 1–4-й день (96-часовая инфузия) | |||||
| винкристин | 0,4 мг/м2 | 1–4-й день (96-часовая инфузия) | |||||
| преднизолон | 60 мг/м2 | 1–5-й день | |||||
| циклофосфамид | 750 мг/м2 | 5-й день 60-минутная инфузия | |||||
| Mounier N., 2006 [37] | ДВККЛ | ACVBP- 14 | доксорубицин | 75 мг/м2 | 1-й день | Интратекально метотрексат 12 мг перед каждым циклом (максимум 4 инъекции) | Филграстим 5 мг/кг на 6-й день после химиотерапии до количества нейтрофилов более 0,5х109/л Триметоприм/сульфаметоксол 160–800 мг 3 раза в неделю постоянно |
| циклофосфамид | 1200 мг/м2 | 1-й день | |||||
| винкристин | 2 мг/м2 | 1-й и 5-й дни | |||||
| блеомицин | 10 мг | 1-й и 5-й дни | |||||
| преднизолон | 60 мг/м2 | 1–5-й день | |||||
| CHOP-21 | доксорубицин | 50 мг/м2 | 1-й день | Интратекально метотрексат 12 мг перед каждым циклом (максимум 4 инъекции) | |||
| циклофосфамид | 750 мг/м2 | 1-й день | |||||
| винкристин | 1,4 мг/м2 | 1-й день | |||||
| преднизолон | 60 мг/м2 | 1–5-й день | |||||
| CHOP low-21 | доксорубицин | 25 мг/м2 | 1-й день | Интратекально метотрексат 12 мг перед каждым циклом (максимум 4 инъекции) | |||
| циклофосфамид | 400 мг/м2 | 1-й день | |||||
| винкристин | 1,4 мг/м2 | 1-й день | |||||
| преднизолон | 60 мг/м2 | 1–5-й день | |||||
| VS-14 | винкристин | 2 мг | 1-й день | Интратекально метотрексат 12 мг перед каждым циклом (максимум 4 инъекции) | |||
| преднизолон | 60 мг/м2 | 1–5-й день | |||||
| Spina M., 2005[49] | ДВККЛ, ЛБ, ПЛЭ, плазмабластная лимфома | CDE+/-R-28 | ритуксимаб | 375 мг/м2 | 1-й день, более 3 ч | Интратекально метотрексат 12 мг перед каждым циклом или цитарабин 50 мг в 1-й и 4-й день 1-го и 2-го цикла химиотерапии при ЛБ или поражении костного мозга | Филграстим 5 мг/кг на 6-й день после ХТ Триметоприм/сульфаметоксол 160–800 мг 3 раза в неделю постоянно Флуконазол 100 мг ежедневно постоянно |
| циклофосфамид | 185–200 мг/м2 | 1–4-й день (96-часовая инфузия) | |||||
| доксорубицин | 12,5 мг/м2 | 1–4-й день (96-часовая инфузия) | |||||
| этопозид | 60 мг/м2 | 1–4-й день (96-часовая инфузия) |
Учитывая риск развития инфекций во время и после завершения химиотерапии, особенно у пациентов с уровнем CD4 лимфоцитов <100 клеток/мм3, является важным проведение профилактических мер. Все пациенты с ВИЧ-ассоциированной лимфомой, независимо от числа лимфоцитов CD4 на момент установления диагноза и проведения химиотерапии, должны получать профилактику против Pneumocystis jiroveci pneumonia, желательно с триметопримом/сульфаметоксазолом (1 таблетка 2 раза в сутки 3 раза в неделю в течение терапии и до восстановления числа лимфоцитов CD4 >200 клеток/мм3). Пациенты с количеством лимфоцитов CD4 <50–100 клеток/мм3 также требуют назначения азитромицина 1200 мг/нед в качестве профилактики развития Mycobacterium avium. Назначение валацикловира для профилактики реактивации вируса простого герпеса показано только пациентам, у которых в анамнезе было клиническое проявление лабиального и аногенитального герпеса. Больные ВИЧ-ассоциированной лимфомой, у которых выявлена виремия гепатита В, требуют назначения противовирусной терапии. Однако монотерапия с применением, например, зидовудина, повысит вероятность специфической мутации ВИЧ, M184V, что может способствовать развитию резистентности к АРВ препаратам и повышать гематологическую токсичность химиотерапии. Пациенты с инфекциями слизистой оболочки, вызванными Candida, не должны получать азолы одновременно с химиотерапией.
Роль АРВ терапии в проведении химиотерапии у пациентов с ВИЧ-ассоциированной лимфомой
Мнения о риске и пользе от продолжения АРВ терапии во время химиотерапии агрессивных лимфом противоречивы. Многие исследователи справедливо обеспокоены тем, что неконтролируемая репликация ВИЧ во время химиотерапии приведет к ухудшению иммунной функции, а продолжение АРВ терапии в процессе химиотерапии и восстановление иммунитета могут предупредить развитие инфекционных осложнений, особенно у больных с малым количеством CD4. Тем не менее врачи должны быть готовы к потенциальным фармакокинетическим взаимодействиям между АРВ и химиотерапевтическими препаратами, особенно это касается первого поколения АРВ препаратов (зидовудин, ставудин, диданозин, ингибиторы протеазы).
Основываясь на результатах изучения взаимодействия АРВ препаратов первого поколения и цитостатических препаратов, ряд авторов рекомендуют приостановить АРВ терапию во время химиотерапии. Некоторые исследователи особенно обеспокоены их фармакокинетическим и фармакодинамическим взаимодействием, что может привести к снижению необходимой концентрации цитостатиков, увеличить токсичность химиотерапевтического лечения [52]. W.H. Wilson и соавторы, B.N. Phenix в своих работах показали, например, что некоторые классы АРВ препаратов первого поколения тормозят апоптоз лимфоидных клеток и способствуют повышению риска развития новых мутаций ВИЧ [41, 42].
В настоящее время широко применяют антиретровирусные препараты нового поколения, такие как тенофовир, эмтрицитабин, ралтегравир, которые хорошо переносятся, не кумулируют побочные эффекты химиотерапевтического лечения лимфом и не влияют на апоптоз лимфоцитов. Кроме того, в условиях острых оппортунистических инфекций 4-недельная задержка начала АРВ терапии связана с существенным повышением риска развития СПИДа или смерти [54]. У пациентов с ВИЧ-ассоциированной лимфомой обычно отмечают сопутствующие оппортунистические инфекции, и средняя 7-недельная задержка АРВ терапии во время химиотерапии может иметь негативные последствия в целом. Однако следует помнить, что пациентам с ВИЧ-ассоциированной лимфомой необходимо проведение 4–6 циклов химиотерапии, что может увеличить продолжительность перерыва в АРВ терапии и негативно отразиться на выживаемости пациентов в целом. M.H. Bateganya и W.O. Mwanda в результате своих исследований доказали явное преимущество выживаемости пациентов с ВИЧ-ассоциированной лимфомой при одновременном назначении АРВ терапии и химиотерапии [4, 38].
Клинический случай
Пациент А., 43 года, обратился с жалобами на общую слабость, боль в животе ноющего характера, изжогу, снижение массы тела на 20 кг в течение года.
Антитела к ВИЧ впервые выявлены 07.09.2012 г., когда больной был обследован по клиническим и эпидемиологическим показаниям (снижение массы тела, активный хронический гепатит С, потребитель инъекционных наркотиков в анамнезе).
Из анамнеза: болеет в течение последнего года; в июле 2011 г. диагностирована язвенная болезнь желудка; неоднократно проводилась противоязвенная терапия в амбулаторных и стационарных условиях, без улучшения. 4 раза выполнена фиброгастродуоденоскопия (ФГДС) с биопсией. При одном из исследований (февраль 2012 г.) выявлен кандидоз пищевода. Однако настороженности по поводу ВИЧ-инфекции, ранней диагностики рака желудка не отмечено.
При обследовании ФГДС от 31.08.2012 г.: в антральном отделе по всем стенкам опухолевидное образование, деформирующее желудок, ригидное, контактно кровоточащее, местами с налетом фибрина. Данные изменения распространяются на привратник и луковицу двенадцатиперстной кишки. Привратник как таковой не определяется, представляя собой бугристое образование.
Результаты патогистологического исследования № 4327-40 от 06.09.12 г.: в материале — фрагменты гнойно-воспалительной грануляционной ткани и некротического детрита. Картина позволяет достоверно судить только о наличии язвенного процесса. Рекомендован контроль после противоязвенной терапии, при возможности — повторная биопсия с получением сохранной ткани.
Пациент 13.09.2012 г. обращался в отделение СПИДа клиники Института эпидемиологии и инфекционных болезней им. Л.В. Громашевского.
При дообследовании: СД4 – 8,7%, что составляет 147 клеток/мкл; вирусная нагрузка ВИЧ — 1325 РНК копий/мл.
Принято решение о повторном исследовании гистологических препаратов, полученных при биопсии от 31.08.2012 г. в специализированной лаборатории.
Результат гистологического и иммуногистохимического исследования № 12CSD6049 от 02.10.2012 г.: в препаратах определяется гладкомышечная ткань (мышечная ткань желудка) с плотной инфильтрацией лимфоцитоподобными клетками крупного размера с небольшим количеством малых лимфоцитов. Ядро опухолевых клеток везикулярное, содержит 2–3 базофильных ядрышка. В опухоли много фигур митоза и апоптоза. Морфологическая картина наиболее соответствует крупноклеточной лимфоме. По данным иммуногистохимического анализа, опухолевые клетки положительны на CD20, отрицательны на CD3, CD30 и общие цитокератины. Также опухолевые клетки положительны на CD10, отрицательны на bcl6, MUM-1, что свидетельствует о их происхождении из герминативного центра. Заключение: ДВККЛ желудка, центробластный вариант, с фенотипом клеток герминативного (зародышевого) центра.
Дальнейшее лечение и наблюдение пациента осуществляют совместно с гематологом. Проводится дообследование.
Согласно проведенному ПЭТ/КТ: отмечены метаболически активные и структурные изменения нижней трети желудка, костно-деструктивных изменений не выявлено (рис. 1).
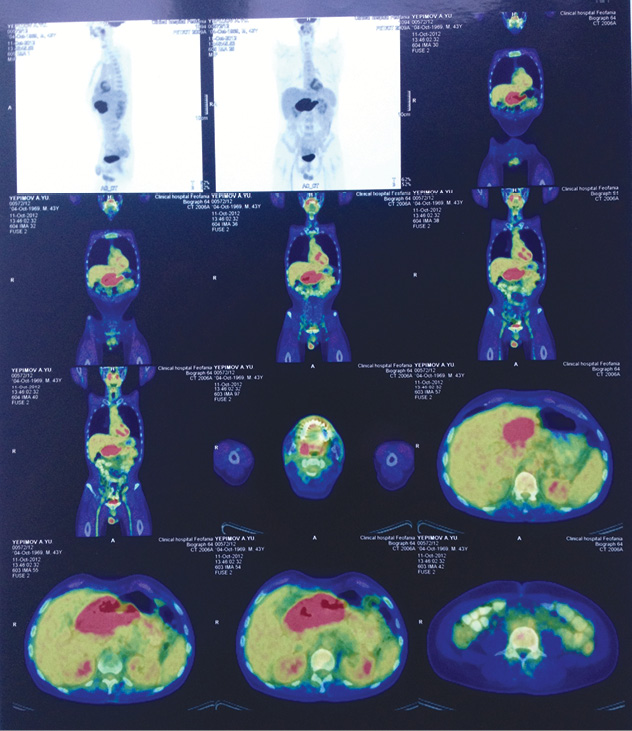
Данные анализа биохимии и периферической крови представлены в табл. 5, 6.
Таблица 5. Результаты анализа периферической крови пациента А.
| Эритроциты | Гемоглобин | MCV | MCHC | Тромбоциты | Лейкоциты | Лимфоциты, n | Нейтрофилы, n | Скорость оседания эритроцитов |
|---|---|---|---|---|---|---|---|---|
| 4,58х1012/л | 111 г/л | 77 | 31,2 | 125х109/л | 5.8х109/л | 1,4х109/л | 4.4х109/л | 110 мм/ч |
Таблица 6. Результаты биохимического анализа крови пациента А.
| Билирубин | АлАТ | АсАТ | Мочевина | Креатинин | Глюкоза | Альбумин |
|---|---|---|---|---|---|---|
| 10,4 мкмоль/л | 19 Ед/л | 30 Ед/л | 5,8 ммоль/л | 74 мкмоль/л | 5,5 ммоль/л | 34 г/л |
Проведено генотипирование на носительство аллеля HLA-B*5701.
На основании результатов исследования установлен диагноз:
ВИЧ-инфекция. Клиническая стадия IV. ВИЧ-ассоциированная неходжкинская ДВККЛ желудка IIE из зародышевого центра, T2N0M0. Кандидоз слизистой полости рта, пищевода. Хронический вирусный гепатит С, репликативная форма, РНК HCV+, генотип 3а, 1,2×106 копий.
До начала химиотерапии пациенту назначена АРВ терапия: ABC/3TC+LPV/rit (комбинация абакавир/ламивудин + комбинация лопинавир/ритонавир)
Проведен 1 курс полихимиотерапии R-CHOP-21 и два курса СНОР-21 в стандартных дозах на фоне симптоматической терапии. Ритуксимаб отменен, так как количество лимфоцитов CD4 после введения ритуксимаба уменьшилось до 90 кл/мкл, и развилась тяжелая нейтропения.
После каждого курса химиотерапии на 7-й день вводили филграстим в дозе 5 мг/кг до увеличения абсолютного количества нейтрофилов 1х109/л и более. Для профилактики Pneumocystis jiroveci pneumonia назначали триметоприм/сульфаметоксол 960 мг 3 раза в неделю постоянно. С целью профилактики бактериальных инфекций пациент принимал моксифлоксацин 400 мг 1 раз в сутки в течение 10 дней после каждого курса химиотерапии. Учитывая развитие кандидозного стоматита на фоне химиотерапии, пациенту назначали флуконазол 200–400 мг ежедневно постоянно, в среднем 10 дней.
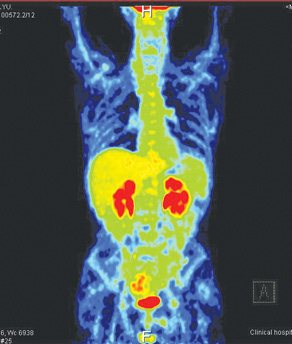
После завершения 3-го курса химиотерапии у пациента диагностирована полная ремиссия, подтвержденная результатами ПЭТ-КТ исследования 20.12.2012 г. (после 3 курсов химиотерапии). При сравнении с предыдущим ПЭТ-КТ от 11.10.2012 г. отмечено уменьшение толщины стенок желудка до 0,75 см по малой и большой кривизне. В нижней третьи желудка толщина стенок уменьшилась до 0,85 см. Повышения метаболической активности не выявлено. Заключение: В-клеточная лимфома желудка, состояние после 3 курсов полихимиотерапии. ПЭТ-КТ-картина полной метаболической регрессии и частично морфологической (рис. 2).
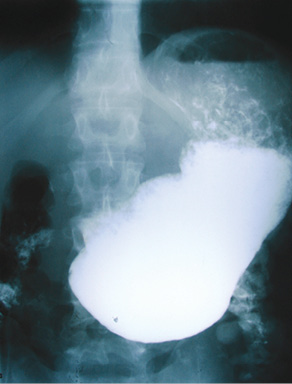
Однако у пациента появилась отрыжка тухлым яйцом, рвота непереваренной пищей, спастические боли в эпигастральной области после завершения химиотерапии. По данным рентгенологического исследования желудка (21.12.2012 г.) установлен декомпенсированный стеноз выходного отдела желудка. При проведении ФГДС (08.01.2013 г.) пищевод проходим, слизистая бледно-розовая, отечная, множественные линейные несливающиеся эрозии размером до 10 мм. Желудок плохо расправляется воздухом, натощак значительно увеличено количество мутной секреторной жидкости, слизи, желчи. Перистальтика сохранена. Складки сохранены, эластичны. Кардиальная складка II степени. Диффузная эритема слизистой на всем протяжении желудка. В антральном отделе яркая пятнистая эритема и мозаичный рисунок слизистой оболочки. Складки грубые, утолщенные, извитые, с неровной поверхностью. Привратник стенозирован, провести в двенадцатиперстную кишку аппарат диаметром 9 мм невозможно. Заключение: рефлюкс-эзофагит, стеноз выходного отдела желудка (рис. 3).
Учитывая рубцовую деформацию нижней трети желудка с декомпенсированным стенозом пилоруса, алиментарную кахексию и асцит, принято решение о целесообразности проведения хирургического паллиативного вмешательства. После адекватной предоперационной подготовки (коррекция водно-белково-электролитного обмена, установление питательного назоинтестинального зонда) выполнена операция в объеме наложения обходного переднего поперечно-ободочного гастроэнтероанастомоза с брауновским соустьем (по Вельферу — Шалимову), дренирование брюшной полости. Послеоперационный период протекал относительно удовлетворительно, без осложнений. Положительная динамика по эвакуации желудочного содержимого на фоне адекватной терапии сопровождения отмечена с 10-го дня, что позволило к парентеральному и энтеральному питанию добавить введение перорального дробного детского питательного докорма. Назогастральный декомпрессионный зонд вместе с узловыми кожными швами сняты на 14-й день послеоперационного периода. Пациент на 15-е сутки выписан из стационара.
Таким образом, к моменту установления диагноза ВИЧ-инфекции у многих пациентов может возникнуть лимфома. С целью исключения диагностической ошибки гистологический материал необходимо отправлять на исследование только в специализированную патогистологическую лабораторию. Особенности клинической картины и лечения ВИЧ-ассоциированных лимфом, а также высокий риск развития как инфекционных, так и неинфекционных осложнений на фоне химиотерапии, требуют дальнейшего изучения для улучшения прогноза заболевания в целом. Хотя у многих больных с иммунодефицитом возможна агрессивная полихимиотерапия, она сопровождается выраженными побочными эффектами и требует слаженного взаимодействия гематолога-онколога и специалиста по лечению ВИЧ-инфекции, нередко — вовлечения в лечебный процесс специалистов другого профиля.
Коллектив авторов выражает огромную благодарность доценту кафедры хирургии Национального медицинского университета им. А.А. Богомольца, кандидату медицинских наук А.В. Кравченку за проведенную операцию.
Список использованной литературы
1. Диагностическая онкогематология (2011)/ Под ред. Д.Ф. Глузмана. Киев: ДИА, 256 с.
2. Alizadeh A.A, Eisen M.B., Davis R.E. et al. ( 2000) Distinct types of diffuse large B-cell lymphoma identified by gene expression profiling. Nature, 403(6769): 503–511.
3. Ambinder R.F. ( 2001) Epstein-Barr virus associated lymphoproliferations in the AIDS setting. Eur. J. Cancer, 37(10): 1209–16.
4. Bateganya M.H., Stanaway J., Brentlinger P.E. et al. (2011) Predictors of Survival After a Diagnosis of Non-Hodgkin Lymphoma in a Resource-Limited Setting: A Retrospective Study on the Impact of HIV Infection and Its Treatment. J. of Acquired Immune Deficiency Syndromes, 56(4): 312–319.
5. Besson C., Goubar A., Gabarre J. et al. (2001) Changes in AIDS-related lymphoma since the era of highly active antiretroviral therapy. Blood, 98(8): 2339–44.
6. Biggar R.J., Jaffe E.S., Goedert J.J. et al. (2006) Hodgkin lymphoma and immunodeficiency in persons with HIV/AIDS. Blood, 108(12): 3786–91.
7. Boue F., Gabarre J., Gisselbrecht C. et al. (2006) Phase II trial of CHOP plus rituximab in patients with HIV-associated non-Hodgkin’s lymphoma. J. Clin. Oncol., 24(25): 4123–28.
8. Boulanger E.,Gerard L., Gabarre J. et al. (2005) Prognostic factors and outcome of human herpesvirus 8-associated primary effusion lymphoma in patients with AIDS. J. Clin. Oncol., 23(19): 4372–80.
9. Carbone A.(2003) Emerging pathways in the development of AIDS-related lymphomas. Lancet Oncol., 4(1): 22–29.
10. Carbone A., Gloghini A. (2005) AIDS-related lymphomas: from pathogenesis to pathology. Br. J. Haematol., 130(5): 662–670.
11. Castillo J.J., Winer E.S.,Stachurski D. et al. (2010) Clinical and pathological differences between human immunodeficiency virus-positive and human immunodeficiency virus-negative patients with plasmablastic lymphoma. Leuk. Lymphoma, 51(11): 2047–53.
12. Chadburn A., Chiu A., Lee J.Y. et al. (2009) Immunophenotypic analysis of AIDS-related diffuse large B-cell lymphoma and clinical implications in patients from AIDS Malignancies Consortium clinical trials 010 and 034. J. Clin. Oncol., 27(30): 5039–48.
13. Choi W.W., Weisenburger D.D., Greiner T.C. et al. (2009) A new immunostain algorithm classifies diffuse large B-cell lymphoma into molecular subtypes with high accuracy. Clin. Cancer. Res., 15(17): 5494–02.
14. Colomo L., Loong F., Rives S. et al. (2004) Diffuse large B-cell lymphomas with plasmablastic differentiation represent a heterogeneous group of disease entities. Am. J. Surg. Pathol., 28(6): 736–747.
15. Dalla-Favera R., Migliazza A., Chang C.C. et al. (1999) Molecular pathogenesis of B cell malignancy: the role of BCL-6. Curr. Top. Microbiol. Immunol., 246: 257–263.
16. Dave S.S., Fu K., Wright G.W. et al. (2006) Molecular diagnosis of Burkitt’s lymphoma. N. Engl. J. Med., 354(23): 2431–42.
17. Davis R.E., Brown K.D., Siebenlist U. et al. (2001) Constitutive nuclear factor kappaB activity is required for survival of activated B cell-like diffuse large B cell lymphoma cells. J. Exp. Med., 194(12): 1861–74.
18. Davis R.E., Ngo V.N., Lenz G. et al. (2010) Chronic active B-cell-receptor signalling in diffuse large B-cell lymphoma. Nature, 463(7277): 88–92.
19. Dunleavy K., Little R.F., Pittaluga S. et al. (2010) The role of tumor histogenesis, FDG-PET, and short-course EPOCH with dose-dense rituximab (SC-EPOCH-RR) in HIV-associated diffuse large B-cell lymphoma. Blood., 115(15): 3017–24.
20. Dunleavy K., Wilson W.H. (2010) Role of molecular subtype in predicting outcome of AIDS-related diffuse large B-cell lymphoma. J. Clin. Oncol., 8(16): e260–e262.
21. Dunleavy K., Mikhaeel G., Sehn L.H. et al. (2010) The value of positron emission tomography in prognosis and response assessment in non-Hodgkin lymphoma. Leuk. Lymphoma., 51 suppl 1: 28–33.
22. Fan W., Bubman D., Chadburn A. et al. (2005) Distinct subsets of primary effusion lymphoma can be identified based on their cellular gene expression profile and viral association. J. Virol., 79(2): 1244–51.
23. Gaidano G., Capello D., Carbone A. (2000) The molecular basis of acquired immunodeficiency syndrome-related lymphomagenesis. Semin. Oncol., 27(4): 431–441.
24. Gaidano G., Capello D., Cilia A.M. et al. (1999) Genetic characterization of HHV-8/KSHV-positive primary effusion lymphoma reveals frequent mutations of BCL6: implications for disease pathogenesis and histogenesis. Genes Chromosomes Cancer., 24(1): 16–23.
25. Gaidano G., Carbone A., Pastore C. et al. (1997) Frequent mutation of the 5’ noncoding region of the BCL-6 gene in acquired immunodeficiency syndrome-related non-Hodgkin’s lymphomas. Blood., 89(10): 3755–62.
26. Hans C.P., Weisenburger D.D., Greiner T.C. et al. (2004) Confirmation of the molecular classification of diffuse large B-cell lymphoma by immunohistochemistry using a tissue microarray. Blood, 103(1): 275–282.
27. Hummel M., Bentink S., Berger H. et al. (2006) A biologic definition of Burkitt’s lymphoma from transcriptional and genomic profiling. N. Engl. J. Med., 354(23): 2419–30.
28. Kaplan L.D., Lee J.Y., Ambinder R.F. et al. (2005) Rituximab does not improve clinical outcome in a randomized phase 3 trial of CHOP with or without rituximab in patients with HIV-associated non-Hodgkin lymphoma: AIDS-Malignancies Consortium Trial 010. Blood, 106(5): 1538–43.
29. Kaplan L.D., Straus D.J., Testa M.A. et al. (1997) Low-dose compared with standard-dose m-BACOD chemotherapy for non-Hodgkin’s lymphoma associated with human immunodeficiency virus infection: National Institute of Allergy and Infectious Diseases AIDS Clinical Trials Group. N. Engl. J. Med., 336(23): 1641–48.
30. Klein U., Gloghini A., Gaidano G. et al. (2003) Gene expression profile analysis of AIDS-related primary effusion lymphoma (PEL) suggests a plasmablastic derivation and identifies PEL-specific transcripts. Blood, 101(10): 4115–21.
31. Landgren O., Goedert J.J., Rabkin C.S. et al. (2010) Circulating serum free light chains as predictive markers of AIDS-related lymphoma. J. Clin. Oncol., 28(5): 773–779.
32. Little R.F., Wilson W.H. (2003) Update on the pathogenesis, diagnosis, and therapy of AIDS-related lymphoma. Curr .Infect. Dis. Rep., 5(2): 176–184.
33. Lenz G., Staudt L.M. (2010) Aggressive lymphomas. N. Engl. J. Med., 362(15): 1417–29.
34. Lenz G., Wright G.W., Emre N.C. et al. (2008) Molecular subtypes of diffuse large B-cell lymphoma arise by distinct genetic pathways. Proc. Natl. Acad. Sci. U S A., 105(36): 13520–25.
35. Lenz G., Davis R.E., Ngo V.N. et al. (2008) Oncogenic CARD11 mutations in human diffuse large B cell lymphoma. Science, 319(5870): 1676–79.
36. Little R.F., Pittaluga S., Grant N. et al.(2003) Highly effective treatment of acquired immunodeficiency syndrome-related lymphoma with dose-adjusted EPOCH: impact of antiretroviral therapy suspension and tumor biology. Blood, 101(12): 4653–59.
37. Mounier N.,Spina M., Gabarre J. et al. (2006) AIDS-related non-Hodgkin lymphoma: final analysis of 485 patients treated with risk-adapted intensive chemotherapy. Blood, 107(10): 3832–40.
38. Mwanda W. O., Orem J., Fu P. et al. (2009) Dose-Modified Oral Chemotherapy in the Treatment of AIDS-Related Non-Hodgkin’s Lymphoma in East Africa. J. Clin. Oncol., 27 (21): 3480–88;.
39. Ngo V.N., Davis R.E., Lamy L. et al. (2006) A loss-of-function RNA interference screen for molecular targets in cancer. Nature, 441(7089): 106–110.
40. Parekh S., Polo J.M., Shaknovich R. et al. (2007) BCL6 programs lymphoma cells for survival and differentiation through distinct biochemical mechanisms. Blood, 110(6): 2067–74.
41. Phenix B.N.,Cooper C.,Owen C. et al. (2002) Modulation of apoptosis by HIV protease inhibitors. Apoptosis ,7(4): 295–312.
42. Phenix B.N., Lum J.J., Nie Z. et al. (2001) Antiapoptotic mechanism of HIV protease inhibitors: preventing mitochondrial transmembrane potential loss. Blood, 98(4): 1078–85.
43. Rabkin C.S., Yang Q., Goedert J.J. et al. (1999) Chemokine and chemokine receptor gene variants and risk of non-Hodgkin’s lymphoma in human immunodeficiency virus-1-infected individuals. Blood, 93: 1838.
44. Ratner L., Lee J., Tang S. et al. (2001) Chemotherapy for human immunodeficiency virus-associated non-Hodgkin’s lymphoma in combination with highly active antiretroviral therapy. J. Clin. Oncol.,19(8): 2171–78.
45. Ribera J.M., Oriol A., Morgades M. et al. (2008) Safety and efficacy of cyclophosphamide, adriamycin, vincristine, prednisone and rituximab in patients with human immunodeficiency virus-associated diffuse large B-cell lymphoma: results of a phase II trial. Br. J. Haematol., 140(4): 411–419.
46. Rothe M., Sarma V., Dixit V.M. et al. (1995) TRAF2-mediated activation of NF-kappa B by TNF receptor 2 and CD40. Science., 269(5229): 1424–27.
47. Sparano J.A., Lee J.Y., Kaplan L.D. et al. (2010) Rituximab plus concurrent infusional EPOCH chemotherapy is highly effective in HIV-associated B-cell non-Hodgkin lymphoma. Blood, 115(15): 3008–16.
48. Sparano J.A., Lee S., Chen M.G. et al.(2004) Phase II trial of infusional cyclophosphamide, doxorubicin, and etoposide in patients with HIV-associated non-Hodgkin’s lymphoma: an Eastern Cooperative Oncology Group Trial (E1494). J. Clin. Oncol., 22(8): 1491–1500.
49. Spina M., Jaeger U., Sparano J.A. et al. (2005) Rituximab plus infusional cyclophosphamide, doxorubicin, and etoposide in HIV-associated non-Hodgkin lymphoma: pooled results from 3 phase 2 trials. Blood, 105(5): 1891–97.
50. Swerdlow S.H., Campo E., Harris N.L. et al. (2008) WHO Classification of Tumours of Haematopoietic and Lymphoid Tissues. Lyon, France: IARC.
51. Thompson L.D., Fisher S.I., Chu W.S. et al. (2004) HIV-associated Hodgkin lymphoma: a clinicopathologic and immunophenotypic study of 45 cases. Am. J. Clin. Pathol., 121(5): 727–738.
52. Tulpule A., Sherrod A., Dharmapala D. et al. (2002) Multidrug resistance (MDR-1) expression in AIDS-related lymphomas. Leuk. Res., 26(2): 121-127.
53. Vega F., Chang C.C., Medeiros L.J. et al. (2005) Plasmablastic lymphomas and plasmablastic plasma cell myelomas have nearly identical immunophenotypic profiles. Mod. Pathol., 18(6): 806–815.
54. Zolopa A.R., Andersen J., Komarow L. et al. (2009) Early Antiretroviral Therapy Reduces AIDS Progression/Death in Individuals with Acute Opportunistic Infections: A Multicenter Randomized Strategy Trial. PLoS. One, 4(5): e5575.
55. DeVita V.T., Lawrence T.S., Rosenberg S.A. (2012) Cancer: Principles & Practice of Oncology, 9e
ВІЛ-асоційовані неходжкінські лімфоми
1Національний медичний університет ім. О.О. Богомольця
2Інститут епідеміології та інфекційних хвороб ім. Л.В. Громашевського
3Медична клініка «Інновація»
Резюме. У статті представлені особливості клінічної картини, діагностики та лікування ВІЛ-асоційованих неходжкінських лімфом. Більшість ВІЛ-асоційованих лімфоїдних пухлин згідно з класифікацією ВООЗ 2008 є дифузними В-великоклітинними лімфомами. Для ВІЛ-асоційованих лімфом характерний швидкий ріст пухлини, часто у цих пацієнтів відзначають наявність В-симптомів. Ураження кісткового мозку діагностують у 25–40% пацієнтів, шлунково-кишкового тракту — у 26%. Залучення у пухлинний процес ЦНС у ВІЛ-інфікованих реєструють у 12–57% пацієнтів. Пацієнти з ВІЛ-асоційованими лімфомами, у яких імунна функція збережена, мають більш низький ризик розвитку інфекційних ускладнень, що дозволяє призначити їм оптимально ефективну хіміотерапію в повному обсязі.
Ключевые слова: ВІЛ-асоційована лімфома, лікування, діагностика.
HIV-associated non-Hodgkin lymphoma
1National Medical University named after O.O. Bogomolets
2Institute of Epidemiology and Infectious Disease named after L.V. Gromashevskogo
3«INNOVACIA» Cancer Center
Summary. In this article the clinical features, diagnosis, and treatment of HIV-associated non-Hodgkin’s lymphoma. Most HIV-associated lymphoid tumors, according to the WHO classification, 2008 are diffuse large cell lymphoma. For HIV-of associated lymphomas characterized by rapid growth of the tumor and the most common in these patients is determined by the presence of B-symptoms. Bone marrow is diagnosed in 25– 40% of patients, gastrointestinal tract in 26%. During the process of attraction in the CNS tumor in HIV-infected determined in 12–57% of patients. Patients with HIV-associated lymphomas, which immune function is preserved, have a lower risk of infection, so you can assign them to an optimally-effective chemotherapy in full.
Key words: HIV-associated lymphoma, treatment, diagnosis.














Leave a comment