Неоадъювантная интерферонотерапия в лечении больных с регионарными лимфогенными метастазами меланомы кожи
Коровин С.И., Фильчаков Ф.В., Кукушкина М.Н., Паливец А.Ю., Остафийчук В.В., Шумилина Е.С., Кукушкина С.Н.
Резюме. Вопрос эффективного лечения при лимфогенных метастазах меланомы кожи остается открытым. Единственным радикальным методом, способным задержать дальнейшее прогрессирование болезни на этом этапе, остается хирургический. Однако отдаленные результаты операций неудовлетворительны. В практической онкологии широко применяется доказанный способ улучшения исходов лимфодиссекций — адъювантная интерферонотерапия. Такое дополнение существенно меняет безрецидивную выживаемость и мало влияет на общую выживаемость. Указанные результаты мотивируют исследования, связанные с комбинацией режимов применения интерферона. В представленной работе оценена двухкомпонентная схема интерферонотерапии (неоадъювантная + адъювантная). В исследование включены больные с операбельными метастазами меланомы кожи в регионарных лимфатических узлах. До начала лечения пациенты рандомизированы в 2 группы: в первой (основной) получали индукционную терапию интерфероном α-2b предоперационно и после радикальной операции — курс поддерживающей терапии, во второй (контрольной) начинали лечение с удаления опухоли с последующей адъювантной двухкомпонентной терапией интерфероном α-2b (индукционная + поддерживающая). В процессе лечения в обеих группах исследована токсичность и показатели лейкограммы периферической крови. В результате изучения 2-летней общей и безрецидивной выживаемости не зарегистрировано преимуществ какой-либо из примененных схем.

Введение
Прогрессирование меланомы кожи начинается в основном с клинической манифестации лимфогенных метастазов. Появление гематогенных вторичных узлов без этапа поражения лимфатической системы — относительно редкое явление и составляет от 8 до 10% случаев [1]. В Украине каждый пятый пациент (19,5%), который впервые обратился к онкологу, и у которого установлен диагноз меланомы кожи, уже имеет клинические признаки поражения лимфатических узлов [2]. Среди пациентов с так называемой локализованной меланомой в 20% случаев выявляют микрометастазы в регионарных лимфатических узлах [3].
Результаты хирургического лечения больных с клиническими признаками лимфогенных метастазов меланомы кожи очень скромные. Так, по данным литературы, общая 5-летняя выживаемость пациентов после операции в зависимости от объема поражения лимфоузлов колеблется в диапазоне от 59 до 24% [4]. Естественно, что такая статистика мотивирует поиски методик, способных улучшить отдаленные результаты операций.
Сегодня единственным доказанным эффективным средством профилактики прогрессирования меланомы остается интерферон, опыт применения которого насчитывает более 30 лет. В 2010 г. проведен метаанализ рандомизированных исследований профилактической интерферонотерапии меланомы кожи по результатам лечения 8122 больных. Авторы пришли к заключению, что применение адъювантной терапии с помощью интерферона снижает риск прогрессирования заболевания (р<0,001) и улучшает общую выживаемость больных (р=0,002) [5]. Непрерывно продолжаются поиски оптимальных схем, доз и режимов применения интерферона у больных меланомой кожи. Одно из последних успешных исследований посвящено апробации пегилированного интерферона. Ретроспективным статистическим анализом установлено достоверное преимущество показателя безрецидивной выживаемости пациентов исследуемой группы. При медиане наблюдения 3,8 года разница показателей продолжительности жизни без прогрессирования в исследуемой группе в сравнении с группой наблюдения составила 18% (p=0,01). При более детальном анализе результатов протокола EORTC (European Organisation for Research and Treatment of Cancer) 18991 установлен еще один интересный факт. У больных с морфологическими признаками изъязвления меланомы пегинтерферон α-2b достоверно увеличивал показатели как общей, так и безрецидивной выживаемости [6]. В марте 2011 г. FDA (Food and Drug Administration) одобрена адъювантная терапия пегилированным интерфероном α-2b (протокол EORTC 18991) больных после хирургического лечения меланомы с метастазами в лимфатических узлах (III стадия).
Относительно интересной версией применения препарата у больных с метастазами меланомы в регионарных лимфатических узлах является двухэтапная схема — пред- и послеоперационная интерферонотерапия. Результаты такого рода исследования опубликованы в 2006 г. Авторы сообщают о позитивных результатах использования в таком алгоритме интерферона в высоких дозах [7]. В нашем исследование при лечении лимфогенных метастазов меланомы задействована схема неоадъювантной терапии интерфероном в средних дозах и низкодозная адъювантная интерферонотерапия.
Материалы и методы исследования
В исследование включен 41 больной с метастазами меланомы в регионарных лимфатических узлах. Критерии включения пациентов в исследование следующие: морфологическая верификация диагноза, наличие метастазов в лимфатических узлах, отсутствие метастатического поражения других органов и тканей, возможность проведения радикальной операции, удовлетворительное состояние больного (ECOG 0 или 1).
После обследования (компьютерная томография головного мозга, органов грудной и брюшной полости, ультразвуковое исследование лимфатических узлов с определением их количества и размеров) пациенты рандомизированы в основную и контрольную группы.
Больные основной группы (20 человек) начинали получать неоадъювантную терапию рекомбинантным α-2b-интерфероном. Препарат вводили подкожно в дозе 9 млн МЕ 1 раз в сутки на протяжении 22 дней (инициативная терапия). Через 3 нед оценивали результат терапии (контрольное ультразвуковое исследование регионарных лимфатических узлов) и начинался хирургический этап лечения, который состоял из регионарной лимфодиссекции и в случаях наличия меланомы — широкого иссечения первичной опухоли кожи.
После патогистологического подтверждения диагноза (6–9-е сутки после операции) предлагался третий, завершающий, этап лечения — адъювантная интерферонотерапия низкими дозами (3 млн МЕ подкожно 3 раза в неделю на протяжении 12 cialis generic мес).
Больные контрольной группы (21 пациент) начинали лечение с операции, а затем на 6–9-е сутки продолжали его в виде двухкомпонентной схемы профилактической интерферонотерапии: 9 млн МЕ рекомбинантного α-2b-интерферона 1 раз в сутки на протяжении 22 дней (инициативная терапия) с последующей поддерживающей терапией препаратом в низких дозах (3 млн МЕ интерферона подкожно 3 раза в неделю на протяжении 12 мес). Схема алгоритма лечения основной и контрольной групп представлена на рис. 1.
| Обследование(компьютерная томография головного мозга, органов грудной и брюшной полости, ультразвуковое исследование пораженного лимфатического коллектора) | ||||||
 |
||||||
| Основная группа, n=20 |  |
Рандомизация 1/1 |  |
Контрольная группа, n=21 | ||
 |
 |
|||||
| Рекомбинантный α-2b-интерферон подкожно по 9 млн МЕ/сут, 22 дня |  |
Операции | ||||
 |
 |
|||||
| Рекомбинантный α-2b-интерферон подкожно по 3 млн МЕ 3 раза в неделю, 12 мес | Рекомбинантный α-2b-интерферон подкожно по 9 млн МЕ/сут, 22 дня | |||||
 |
||||||
| Рекомбинантный α-2b-интерферон по 9 млн МЕ 3 раза в неделю, 12 мес | ||||||
В момент включения в исследование первичная опухоль была в наличии у 1 (5,0%) пациента основной группы (у остальных больных манифестация лимфогенных метастазов наступила в различные сроки после удаления меланомы). В контрольной группе первичная опухоль присутствовала у 2 (9,5%) больных.
В основной группе у 13 (65,0%) пациентов метастазы диагностированы в пахово-подвздошных и у 7 (35,0%) — в подмышечных областях. В контрольной группе, canadian pharmacy doxycycline соответственно, в 11 (52,4%) случаях отмечали поражение пахово-подвздошного и у 10 (47,6%) — подмышечного лимфоколлекторов.
В основную группу включено 20 больных в возрасте от 24 до 70 лет. Средний возраст пациентов — 49,6±2,01 года. Мужчины составили 35,0% группы (7 больных), женщины — 65,0% (13 пациенток).
В контрольную группу вошел 21 больной в возрасте от 24 до 69 лет, средний возраст составил 50,1±3,4 года. Большинство группы составили женщины — 57,1% (12 пациенток), доля мужчин была меньше — 42,9% (9 больных).
Оценены ближайшие и отдаленные результаты лечения больных. В основной группе исследовали влияние неоадъювантной терапии непосредственно на лимфогенные метастазы опухоли. http://viagrabuy-online24.com/ Отслежены изменения популяционного состава лимфоцитов периферической крови в процессе лечения больных обеих групп. Для сравнительного анализа изучены и сопоставлены показатели безрецидивной и общей выживаемости в основной и исследуемой группах.
Статистическая обработка полученных данных проведена с использованием программ Excel (MS Office 2003, XP) и STATІSTІCA 6,0 (StatSoft Inc., США). Показатели выживаемости оценивали по методу Каплана — Мейера. Различия оценивали как достоверные при р<0,05.
Результаты и их обсуждение
На протяжении 2010–2011 гг. в клинике Национального института рака проведено лечение 41 больного с метастазами меланомы кожи в лимфатические узлы.
В обеих группах у больных имели место типичные при интерферонотерапии побочные явления: гриппоподобный синдром (повышение температуры тела, озноб, головная боль, миалгия), местная эритематозная реакция и общая слабость. Наиболее частым осложнением была гипертермия, которая возникала через 2–3 ч после введения препарата и в большинстве случаев исчезала, или же температура тела снижалась до субфебрильных значений на протяжении первых 2 нед лечения. В основной группе гипертермия І степени имела место у 11 (55,5%) пациентов, II степени — у 9 (45,0%). В контрольной группе гипертермию І степени отмечали у 10 (47,6%) больных, II степени — у 10 (47,6%), III — у 1 (4,8%) пациента. Гипертермия ІІ–ІІІ степени требовала применения противовоспалительной терапии с использованием нестероидных противовоспалительных препаратов.
Динамика изменения лейкоцитов периферической крови в процессе лечения представлена в табл. 1 и 2.
Таблица 1. Изменения в лейкограмме периферической крови в процессе лечения у больных контрольной группы
| Форменные элементы | Единицы измерения | Этапы исследования | Практически здоровые доноры | ||||
|---|---|---|---|---|---|---|---|
| До лечения | После операции | После инициативного блока интерферонотерапии | 3 мес после операции | Окончание лечения | |||
| Лейкоциты | x109/л | 5,3 (3,6; 7,3) | 6,4 (3,7; 8,9) | 4,3 (1,6; 5,3)*, 2 | 4,2 (3,3; 5,3) | 5,2 (4,9; 7,0) | 5,4 (4,5; 7,0) |
| Палочкоядерные нейтрофилы | % | 1,5 (0; 4,5) | 2,0 (1,0; 4,5) | 2,0 (1,0; 6,5)1 | 2,5 (2,5; 3,0)* | 1,0 (0,5; 3,0) | 1,5 (0; 3,0) |
| x109/л | 0,07 (0; 0,29) | 0,11 (0,06; 0,40) | 0,09 (0; 0,34)1 | 0,11 (0,10; 0,13) | 0,06 (0,04; 0,15) | 0,08 (0; 0,16) | |
| Сегментоядерные нейтрофилы | % | 63,0 (44,5; 72,0) | 59,0 (52,0; 71,5) | 50,0 (33,0; 61,0) | 58,5 (49,0; 66,5) | 54,5 (48,0; 69,0) | 55,5 (42,5; 66,5) |
| x109/л | 2,96 (2,04; 5,15) | 3,91 (1,96; 5,70) | 2,15 (0,78; 3,15)*, 1, 2 | 2,49 (1,71; 3,18) | 2,83 (2,30; 4,90) | 3,11 (1,95; 4,50) | |
| Эозинофилы | % | 2,5 (0,5; 6,0) | 1,5 (1,0; 5,0) | 1,0 (0; 3,0)1 | 1,5 (0,5; 5,0) | 0,5 (1,0; 5,0) | 2,0 (0; 5,5) |
| x109/л | 0,14 (0,04; 0,36) | 0,10 (0,05; 0,28) | 0,04 (0; 0,14)1 | 0,08 (0,02; 0,18) | 0,04 (0,03; 0,24) | 0,12 (0; 0,29) | |
| Базофилы | % | 1,0 (0; 2,0) | 1,0 (0; 2,0) | 0 (0; 1,5) | 0,7 (0; 1,0) | 1,5 (0; 3,0) | 1,0 (0; 1,5) |
| x109/л | 0,06 (0; 0,11) | 0,05 (0; 0,14) | 0 (0; 0,06)1 | 0,03 (0; 0,05) | 0,08 (0; 0,15) | 0,05 (0; 0,10) | |
| Моноциты | % | 8,0 (5,0; 12,0) | 7,5 (4,5; 10,0) | 8,0 (4,0; 13,0) | 10,0 (6,5; 14,0) | 7,0 (6,0; 9,0) | 7,0 (4,5; 9,0) |
| x109/л | 0,45 (0,12; 0,77) | 0,40 (0,21; 0,67) | 0,38 (0,06; 0,66) | 0,42 (0,21; 0,69) | 0,42 (0,36; 0,44) | 0,33 (0,23; 0,54) | |
| Большие гранулярные лимфоциты | % | 2,8 (0,5; 6,0) | 3,0 (2,0; 5,0) | 4,0 (2,0; 15,0) | 4,5 (2,0; 7,0) | 4,0 (2,5; 7,0) | 4,0 (1,5; 11,0) |
| x109/л | 0,16 (0,03; 0,34)* | 0,18 (0,11; 0,32) | 0,15 (0,09; 0,71) | 0,19 (0,07; 0,34) | 0,20 (0,13; 0,54) | 0,24 (0,11; 0,50) | |
| Лимфоцити | % | 22,0 (15,0; 35,0)* | 22,0 (19,0; 34,0)* | 41,5 (21,0; 52,0) | 25,5 (21,5; 32,0) | 33,5 (24,0; 34,0) | 33,5 (21,5; 46,0) |
| x109/л | 1,32 (0,82; 1,70)* | 1,53 (0,92; 2,05) | 1,25 (0,75; 1,81)*, 2 | 1,06 (0,78; 1,57)* | 1,72 (1,66; 1,74) | 1,77 (1,17; 2,54) | |
Примечания: 1различия при сравнении с исходными данными статистически достоверны (р<0,05); 2различия при сравнении с показателем после операции статистически достоверны (р<0,05).
Таблица 2. Изменения в лейкограмме периферической крови в процессе лечения у больных основной группы
| Форменные элементы | Единицы измерения | Этапы исследования | Практически здоровые доноры | ||||
|---|---|---|---|---|---|---|---|
| До лечения | После неоадъювантной терапии | После операции | 3 мес после операции | Окончание лечения | |||
| Лейкоциты | x109/л | 5,1 (2,6; 6,5) | 4,1 (3,0; 5,2)* | 5,8 (3,6; 8,9)2 | 3,8 (2,8; 4,8)*, 3 | 4,1 (2,7; 7,7) | 5,4 (4,5; 7,0) |
| Палочкоядерные нейтрофилы | % | 3 (0; 8) | 3 (0; 7) | 1 (0; 5,5) | 5,5 (2; 10)*, 3 | 4 (1; 5)4 | 1,5 (0; 3,0) |
| x109/л | 0,15 (0; 0,39) | 0,12 (0; 0,36) | 0,07 (0; 0,32) | 0,18 (0,08; 0,48)* | 0,12 (0,05; 0,21) | 0,08 (0; 0,16) | |
| Сегментоядерные нейтрофилы | % | 59,5 (51,5; 72,5) | 52 (37; 64)1 | 63 (55; 68)*, 2 | 47 (44; 57)3 | 63 (51,5; 83)2, 4 | 55,5 (42,5; 66,5) |
| x109/л | 3,34 (1,42; 4,48) | 1,73 (1,25; order viagra online 2,96)*, 1 | 3,70 (2,21; 5,87)2 | 1,75 (1,32; 2,64)*, 3 | 2,58 (1,73; 3,98)2 | 3,11 (1,95; 4,50) | |
| Эозинофилы | % | 2 (1; 3,5) | 1 (0; 1,5)*, 1 | 1 (0; 5,5) | 2 (0; 4,5) | 3 (0; 8) | 2 (0; 5,5) |
| x109/л | 0,06 (0,05; 0,27) | 0,03 (0; 0,10)*, 1 | 0,10 (0; 0,32)2 | 0,07 (0; 0,20) | 0,12 (0; 0,31) | 0,12 (0; 0,29) | |
| Базофилы | % | 0,5 (0; 2) | 0 (0; 0,5)*, 1 | 0 (0; 1,5) | 0 (0; 1) | 1 (0; 3) | 1 (0; 1,5) |
| x109/л | 0,03 (0; 0,08) | 0 (0; 0,04)*, 1 | 0 (0; 0,06)* | 0 (0; 0,04)* | 0,05 (0; 0,08) | 0,05 (0; 0,10) | |
| Моноциты | % | 7 (4,5; 12) | 8 (6,5; 14)* | 7,5 (3; 13) | 10 (8; 14)*, 3 | 6,5 (2; 13) | 7 (4,5; 9,0) |
| x109/л | 0,33 (0,23; 0,49) | 0,35 (0,24; 0,64) | 0,50 (0,15; 0,82) | 0,44 (0,22; 0,50) | 0,34 (0,08; 0,50) | 0,33 (0,23; 0,54) | |
| Большие гранулярные лимфоциты | % | 2,5 (0,5; 5) | 4 (1; 11) | 3,5 (1,2; 5,5) | 5 (3; 7) | 2 (1; 5) | 4 (1,5; 11) |
| x109/л | 0,12 (0,03; 0,23)* | 0,18 (0,03; 0,38) | 0,17 (0,05; 0,40) | 0,22 (0,11; 0,25) | 0,08 (0,03; 0,38) | 0,24 (0,11; 0,50) | |
| Лимфоцити | % | 23,5 (17,5; 32)* | 35 (26; 53)1 | 26,7 (17,5; 33,5)*, 2 | 34 (21; 38) | 22 (7; 35,5)*, 2, 4 | 33,5 (21,5; 46) |
| x109/л | 1,33 (0,61; 2,21)* | 1,48 (0,68; 2,11) | 1,41 (0,76; 2,28) | 1,22 (0,92; 1,39)* | 0,73 (0,34; 2,73)* | 1,77 (1,17; 2,54) | |
Примечания: 1различия при сравнении с исходными данными статистически достоверны (р<0,05); 2различия при сравнении с постнеоадъювантным этапом статистически достоверны (р<0,05); 3различия при сравнении с послеоперационным этапом статистически достоверны (р<0,05); 4различия при сравнении с послеоперационным этапом статистически достоверны (р<0,05); *различия при сравнении с показателем у практически здоровых людей статистически достоверны (р<0,05).
При изучении исходных показателей больных контрольной и основной групп выявлено статистически значимое уменьшение общего количества циркулирующих лимфоцитов в сравнении со здоровыми донорами. Абсолютное количество других видов лейкоцитов было в пределах физиологической нормы. Как результат, в лейкоцитарной формуле пациентов изменено соотношение форменных элементов: достоверно уменьшена доля лимфоцитов и несколько увеличено соотношение нейтрофилов.
У больных контрольной группы на 8–10-е сутки после операции generic celebrex отмечали увеличение общего количества лимфоцитов периферической крови до уровня показателей здоровых доноров, абсолютное количество других форм лейкоцитов существенно не менялось.
После индукционного курса интерферонотерапии, проведенного у пациентов контрольной группы в адъювантном режиме, количество лейкоцитов в периферической крови существенно уменьшается за счет сегментоядерных нейтрофилов и лимфоцитов (р<0,05) по сравнению с послеоперационным показателем.
Применение у больных контрольной группы поддерживающего курса интерферонотерапии в течение 3 мес способствует восстановлению в периферической крови общего количества лейкоцитов, в частности нейтрофильных гранулоцитов, до уровня практически здоровых доноров. Однако сохранялась лимфоцитопения, наблюдался сдвиг лейкоцитарной формулы влево за счет увеличения количества палочкоядерных нейтрофилов.
После окончания лечения интерфероном у больных контрольной группы все исследуемые гематологические показатели находились в пределах физиологических значений.
При исследовании влияния интерферона на гематологические показатели у больных основной группы установлено следующее.
После индукционного курса интерферонотерапии, проведенного в неоадъювантном режиме, количество лейкоцитов в периферической крови значительно уменьшалось по сравнению с показателем у здоровых доноров. Абсолютное количество гранулоцитов становилось меньше начальных показателей, зато количество лимфоцитов несколько увеличивалось. Как следствие, в лейкоцитарной формуле происходили изменения соотношения различных форм лейкоцитов: существенно снижался процент нейтрофилов и увеличивалось содержание лимфоцитов в сравнении с исходными показателями.
Необходимо отметить, что подобные изменения в лейкограмме после индукционной терапии происходили и в контрольной группе.
На 8–10-е сутки после операции у больных основной группы количество лейкоцитов и их форм в периферической крови восстанавливалось. На этом этапе особенно чувствительными оказались сегментоядерные нейтрофилы, абсолютное количество которых значительно возрастало, что может быть обусловлено особенностями послеоперационного периода.
У больных основной группы на фоне проведения в послеоперационный период поддерживающего курса интерферонотерапии (3 мес) развивалась лейкоцитопения в результате уменьшения количества сегментоядерных нейтрофилов и лимфоцитов. В это же время фиксировали смещение лейкоцитарной формулы влево за счет увеличения количества палочкоядерных нейтрофилов, как и у пациентов контрольной группы на этом же этапе наблюдения. У пациентов основной группы, в отличие от контрольной, происходило существенное повышение относительного содержания моноцитов на фоне интерферонотерапии.
Установлено, что после окончания поддерживающей интерферонотерапии у больных основной группы сохранялась лимфоцитопения, а другие гематологические показатели оставались в пределах физиологических значений.
Таким образом, мы можем сделать следующий вывод. Использованные схемы лечения переносятся больными вполне удовлетворительно, не приводят к существенным осложнениями, не усугубляют течение заболевания.
При оценке клинических результатов в первую очередь следует отметить факт частичной регрессии пораженных лимфатических узлов у больных основной группы на фоне неоадъювантной интерферонотерапии. Мы наблюдали это у 2 (10%) пациентов.
На протяжении периода наблюдения (2 года) в основной группе у 5 (25%) больных отмечено прогрессирование заболевания; из них 3 (15%) пациента умерли. В контрольной группе прогрессирование имело место у 7 di mana beli viagra (33,3%) больных, из которых 3 (14,3%) умерли.
Кривые общей и безрецидивной выживаемости представлены на рис. 2 и 3.
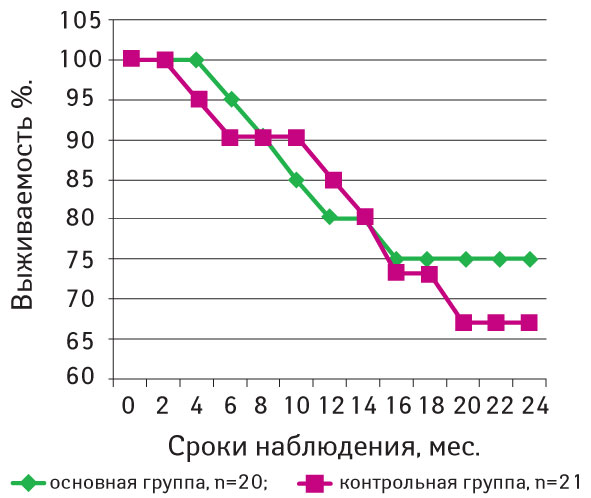

Итак, у больных основной группы 2-летняя безрецидивная выживаемость составила 75,0±9,2%, а в контрольной группе — 67,1±10,2% (p>0,05).
2-летняя общая выживаемость в основной группе равна 85,1±7,9%, а в контрольной этот показатель составил 85,7±7,6%.
Выводы
1. Примененная схема неоадъювантной интерферонотерапии удовлетворительно переносилась больными и не сопровождалась выраженными токсическими проявлениями.
2. Использованные режимы предоперационной интерферонотерапии способны вызывать частичную регрессию метастазов меланомы в регионарных лимфатических узлах.
3. Разработанная методика неоадъювантной терапии привела к статистически недостоверной тенденции улучшения послеоперационной 2-летней безрецидивной выживаемости больных с метастазами меланомы кожи в регионарных лимфатических узлах (исследование — 75,0±9,2%, контроль — 67,1±10,2%) и не повлияла на общую 2-летнюю выживаемость (исследование — 85,7±7,6%, контроль — 85,1±7,9%).
Список использованной литературы
1. Craig L., Slingluff J., Dodge R.K. et al. (1993) The annual risk of melanoma progression. Cancer, 70(7): 1917–1927.
2. Коровин С.И., Гулак Л.О., Федоренко З.П. и др. (2010) Проблема меланомы кожи в Украине. Онкология (спец. вып.), 12(1): 46–52.
3. Morton D.L., Cochran A.N. (2004) The case for lymphatic mapping and sentinel lymphadenectomy in the management of primary melanoma. Brit. J. Dermatology, 151: 308–319.
4. Balch C.By., Gershenwald J.E., Soong S.-J.aw et al. (2009) Final version of 2009 AJCC stading melanoma and classification. J. Clin. Oncol., 27(36): 6192–6206.
5. Mocellin S., Pasquali S., Rossi C.R. et al. (2010) Interferon alpha adjuvant therapy in patients with high risk melanoma: a systematic review and metaanalysis. J. Natl. Cancer Inst., 102(7): 493–501.
6. Eggermont A.M., Suciu S., Santinami M. et al. (2008) Adjuvant therapy with pegylated interferon alfa-2b versus observation alone in resected stage III melanoma: final results of EORTC 18991, a randomized phase III trial. Lancet, 372: 117–126.
7. Moschos S.J., Edington H.D., Land S.R. et al. (2006) Neoadjuvant Treatment of Regional Stage IIIB Melanoma With High-Dose Interferon Alfa-2b Induces Objective Tumor Regression in Association With Modulation of Tumor Infiltrating Host Cellular Immune Responses. J. Clin. Oncology, 24(19): 3164–71.
Неоад’ювантна інтерферонотерпія в лікуванні хворих із регіонарними лімфогенними метастазами меланоми шкіри
Резюме. Питання ефективного лікування при лімфогенних метастазах меланоми шкіри залишається відкритим. Єдиним радикальним методом, здатним затримати подальше прогресування захворювання на цьому етапі, є хірургічний. Однак віддалені результати операцій незадовільні. У практичній онкології широко застосовується доведений спосіб покращення наслідків лімфадисекцій — ад’ювантна інтерферонотерапія. Таке доповнення суттєво змінює безрецидивну виживаність і мало впливає на загальну виживаність. Вказані результати мотивують дослідження, пов’язані з комбінацією режимів застосування інтерферону. У представленій роботі оцінено двокомпонентну схему інтерферонотерапії (неоад’ювантна + ад’ювантна). У дослідження включено хворих з операбельними метастазами меланоми шкіри в регіонарних лімфатичних вузлах. На початку лікування пацієнтів рандомізовано на 2 групи: у першій (основній) отримували індукційну терапію інтерфероном α-2b перед оперативним втручанням, а після lipitor радикальної операції — курс підтримуючої терапії, у другій (контрольній) починали лікування з видалення пухлини з наступною ад’ювантною двокомпонентною терапією інтерфероном α-2b (індукційна + підтримувальна). У процесі лікування в обох групах досліджували токсичність і показники лейкограми периферичної крові. При вивченні показників 2-річної загальної та безрецидивної виживаності не зареєстровано переваг жодної із застосованих схем.
Ключові слова: меланома шкіри, інтерферон.
Neoadjuvant interferon in the treatment of patients with melanoma regional lymph node metastasis
Summary. The question about effective treatment of melanoma lymph node metastasis remains opened. The surgery is a single radical method that can delay further progression of the disease at this stage. However, the long-term results surgical operations are unsatisfactory. In practical oncology adjuvant interferon is widely used to improve outcomes of regional lymph node dissections. This addition significantly influences on disease-free survival and has a little impact on overall survival. These results motivate conducting researches on the application of combined regimes of interferon therapy. In the present study two-component scheme of interferon therapy (neoadjuvant and adjuvant) is evaluated. The patients with resectable metastatic melanoma in regional lymph nodes were included in this study. Prior to treatment patients were randomized into two groups: the first of them (study group) obtained induction course of interferon α-2b therapy before operation and maintenance course after surgery; the second (control group) began treatment with regional lymph node dissection with following adjuvant interferon α-2b therapy (induction and maintenance course). The toxicity and parameters of peripheral blood leukograms were studied during the treatment in both groups. The benefit in 2-year overall and disease-free survival was not registered in the any of the application schemes.
Key words: skin melanoma, interferon.














Leave a comment