Прогнозування безпосередніх результатів гастректомій при раку шлунка
Бондарь Г.В.1, Думанский Ю.В. 2, Лях Ю.Е. 1, Гурьянов В.Г. 1, Бондарь А.В.2, Псарас Г.Г. 3, Заика А.Н. 1
- 1Донецький національний медичний університет ім. М. Горького, Донецьк
- 2Донецький обласний протипухлинний центр, Донецьк
- 3КЛПЗ «Міський міжрайонний онкологічний диспансер м. Маріуполя»
Резюме. Вивчено прогностичні фактори безпосередніх результатів гастректомій, виконаних у 1435 хворих на рак шлунка в Донецькому обласному протипухлинному центрі за 20-річний період. Доведено, що ризик виникнення інтраопераційних ускладнень після гастректомій з приводу раку шлунка підвищується зі збільшенням кількості резектованих органів та/або анатомічних структур; ризик післяопераційних ускладнень — за наявності у хворого супутніх захворювань; ризик смерті — за наявності у хворого ускладнень пухлинного процесу, супутніх захворювань, при локалізації пухлини в тілі, кардіальному відділі шлунка або тотальному його ураженні.
Резюме. Изучены прогностические факторы непосредственных результатов гастрэктомий, выполненных у 1435 больных раком желудка в Донецком областном противоопухолевом центре за 20-летний период. Доказано, что риск возникновения интраоперационных осложнений после гастрэктомий по поводу рака желудка повышается с увеличением количества резецированных органов и/или анатомических структур; риск послеоперационных осложнений — при наличии у больного сопутствующих заболеваний; риск летального исхода — при наличии у больного осложнений опухолевого процесса, сопутствующих заболеваний, при локализации опухоли в теле, кардиальном отделе желудка или тотальном его поражении.

История вопроса
Заболеваемость раком желудка (РЖ) в Украине за 10-летний период (с 2002 по 2011 г.) снизилась с 29,1 до 23,0, в том числе среди мужчин с 37,9 до 29,9, а у женщин — с 21,4 до 17,2 на 100 тыс. населения. Смертность за тот же отрезок времени уменьшилась с 23,5 до 18,1, в том числе среди мужчин с 31,0 до 24,2, а у женщин — с 17,0 до 12,9 на 100 тыс. населения [5, 6]. До настоящего времени основным методом лечения этих пациентов является хирургический [9–12]. Наиболее распространенным видом оперативных вмешательств, применяемых для лечения пациентов с РЖ, является гастрэктомия (ГЭ). Несмотря на существенное улучшение непосредственных результатов хирургического лечения РЖ, выполнение ГЭ нередко сопровождается развитием тяжелых интра- и послеоперационных осложнений, а в ряде случаев приводит к летальному исходу. В этой связи прогнозирование непосредственных результатов ГЭ при РЖ является важным фактором, позволяющим улучшить результаты лечения этой категории пациентов [10, 12].
Цель исследования — определить основные прогностические факторы непосредственных результатов ГЭ у больных РЖ.
Материалы и методы
Материалом для исследования послужили данные о 1435 больных, у которых выполнена ГЭ в Донецком областном противоопухолевом центре. Из них мужчин было 954 (66,48±1,25%), женщин — 481 (33,52±1,25%). Средний возраст составил 58,6 года. Сопутствующие заболевания имели место у 319 (22,23±1,1%) пациентов, при этом наиболее часто отмечали патологию сердечно-сосудистой системы — у 143 (9,97±0,79%). В гистологическом строении опухоли превалировала аденокарцинома — в 861 (60,0±1,29%) случае. Распространенность опухолевого процесса соответствовала I стадии — у 56 (3,9±0,51%) больных, II–III — у 953 (66,41±1,25%) пациентов. В 426 (29,69±1,21%) наблюдениях болезнь диагностирована в IV стадии. У 220 (15,33±0,95%) больных до операции имелись различные осложнения опухолевого процесса.
Для прогнозирования результатов исследования использованы методы математического моделирования [1, 2, 4]. Для установления связей между прогнозируемым признаком и набором входных признаков применены методы построения математических моделей — методы нейросетевого моделирования и построения логистических регрессионных моделей [1, 2]. При построении моделей для оптимизации порога принятия решения использован метод построения кривых операционных характеристик [8]. В работе поставлены задачи выделения минимального набора входных признаков, которые позволят достаточно точно прогнозировать результат, а также оценки степени влияния на результат каждого из выделенных факторных признаков. При выделении набора наиболее значимых признаков использовали метод генетического алгоритма (ГА) отбора наиболее значимых переменных, что связано с большим количеством (n>83) анализируемых входных признаков в исходных моделях [2]. ГА на порядки превосходит по быстроте метод случайного поиска и не уступает по скорости методам пошагового отбрасывания (включения) переменных, являясь более эффективным [2].
Для оценки качества прогнозирования модели использовали стандартные критерии: чувствительность, специфичность, показатель отношения правдоподобия (+LR, –LR) [2, 3, 7]. Для обобщения полученных результатов на генеральную совокупность для них рассчитывали также 95% доверительный интервал (ДИ) [3, 7]. Под чувствительностью математической модели понимали долю правильно спрогнозированных моделью случаев, под специфичностью — долю правильно спрогнозированных не случаев [3]. Отношение правдоподобия — отношение вероятности того, что данный результат диагностического теста будет ожидаться у пациента с патологией по сравнению с вероятностью, что тот же самый результат будет ожидаться у пациента без патологии, — показывает, во сколько раз выше (+LR)/ниже (–LR) вероятность получить данный результат теста у больных, чем у здоровых [3].
Для проверки адекватности моделей использовали метод случайного (с вовлечением генератора случайных чисел) разбиения анализируемых данных на три множества: обучающее (1235 больных), контрольное (50 больных) и подтверждающее (150 пациентов) [3]. Обучающее множество использовали для построения модели, контрольное — предотвращения переобучения модели, тестовое — только для подтверждения заявленной чувствительности и специфичности модели на новых данных [2, 8]. Для оценки адекватности модели использовали также метод анализа кривых операционных характеристик ROC (Receiver Operating Characteristic curve analysis), при этом рассчитывали площадь под ROC-кривой AUC (Area under the ROC curve) и ее 95% ДИ [2, 4, 7]. Модель считали адекватной при статистически значимом отличии величины AUC от 0,5. При проведении анализа ROC-кривой выбирали оптимальное значение порога принятия/отвержения [2].
Для оценки степени и направленности влияния признаков на результат применяли метод построения логистических регрессионных моделей, в рамках которых рассчитывали отношение шансов (ОШ) риска отрицательного исхода для каждого факторного признака и соответствующий 95% ДИ [1, 4, 7]. Под ОШ понимали отношение отрицательной оценки состояния у пациентов, подверженных или не подверженных влиянию фактора [3]. При увеличении значения факторного признака риск «случая» повышается, если ОШ >1, и риск «случая» снижается, если ОШ
В качестве факторных признаков анализировали 83 показателя: пол больного, локализация и форма роста опухоли, ее гистологическая структура, наличие и характер осложнений опухолевого процесса до операции, распространенность опухолевого процесса (категории T, N и M), наличие и характер сопутствующих заболеваний, технические особенности выполнения операции, объем и характер хирургического вмешательства, число резецированных органов и/или анатомических структур, наличие послеоперационных осложнений, группа и резус-принадлежность крови больного и др.
Результаты и их обсуждение
Из 1435 больных, у которых выполнена ГЭ, интраоперационные осложнения отмечены у 245 (17,1±1,0%). Наиболее частыми из них были ятрогенное повреждение селезенки — у 220 (87,3%) больных, реже отмечены вскрытие просвета кишки — у 7 (2,8%) пациентов, нарушение кровоснабжения сегмента поперечной ободочной кишки и ятрогенное повреждение диафрагмы — в 5 (1,9%) и 3 (1,2%) наблюдений соответственно.
Создана модель прогнозирования риска возникновения интраоперационных осложнений. При проведении анализа в качестве результирующего признака Y1 принимали риск возникновения осложнения во время проведения операции, при этом в случае возникновения интраоперационных осложнений результирующая переменная имеет значение Y1=1 (интраоперационные осложнения отмечали в 245 случаях), а при отсутствии таковых — Y1=0. При этом на первом этапе проведения анализа была построена нейросетевая модель прогнозирования, которая в качестве факторных включала все 83 показателя. После выбора (с использованием ROC-кривой) оптимального порога принятия/отвержения модели ее прогностические характеристики на обучающем множестве были следующими: чувствительность составляла 83,3% (95% ДИ 77,9–88,0%), специфичность — 82,9% (95% ДИ 80,6–85,2%). На подтверждающем множестве чувствительность модели составила 85,2% (95%ДИ 68,8–96,2%), специфичность — 75,6% (95% ДИ 67,6–82,8%). Таким образом, ошибка обучения и ошибка обобщения модели статистически значимо не отличаются (p>0,05), что свидетельствует об адекватности модели.
Для выявления минимального набора факторных признаков, связанных с риском возникновения интраоперационных осложнений, использован ГА отбора факторных признаков. В результате проведения отбора выделено 3 признака: технические особенности выполнения операции (X59), объем операции (X60), количество резецированных органов и/или анатомических структур (X61).На выделенном наборе 3 признаков построена линейная модель прогнозирования. На обучающем множестве чувствительность модели составила 85,6% (95% ДИ 80,6–90,1%), специфичность — 75,4% (95% ДИ 72,8–78,0%). На подтверждающем множестве чувствительность — 85,2% (95% ДИ 68,8–96,2%), специфичность — 56,1% (95% ДИ 47,2–64,8%). Для оценки адекватности 3-факторной модели использован метод построения и анализа кривых операционных характеристик (ROC-кривая модели приведена на рис. 1).
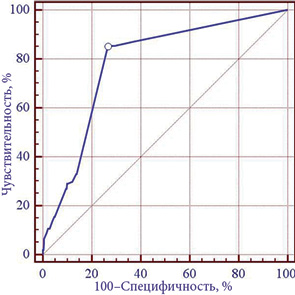
Площадь под ROC-кривой 3-факторной модели AUC=0,78±0,01 статистически значимо (p<0,001) отличается от 0,5 — модель адекватна. Оптимальный порог принятия/отвержения для модели определяли путем оптимизации показателя Yoden index (J):
J = max (sensitivity + specificity − 1) (1).
При выборе оптимального порога чувствительность 3-факторной модели прогнозирования риска возникновения интраоперационных осложнений (для всех 1435 случаев) оказалась равной 84,9% (95% ДИ 79,8–89,1%), специфичность — 73,5% (95% ДИ 70,9–76,0%). Отношение правдоподобия для модели прогнозирования: +LR=3,2 (95% ДИ 2,9–3,6), –LR=0,21 (95% ДИ 0,20–0,30).
Для оценки степени влияния 3 выделенных факторных признаков на риск возникновения интраоперационных осложнений построена логистическая модель регрессии. Из проведенного в рамках построенной логистической модели анализа следует, что риск возникновения интраоперационных осложнений повышается (p<0,001) c увеличением числа резецированных органов и/или анатомических структур (ОШ=3,2; 95% ДИ 2,7–3,9). Это объясняется тем, что число резецированных органов и/или анатомических структур увеличивается у больных с распространенными опухолями, при выполнении операции с выраженным спаечным процессом. Дополнительная мобилизация соседних органов при распространенном опухолевом процессе повышает риск развития интраоперационных осложнений, например, нарушение кровоснабжения в сегменте поперечной ободочной кишки. Выраженный спаечный процесс в левом фланке значительно повышает риск ятрогенного повреждения селезенки, особенно у пациентов с короткой желудочно-селезеночной связкой.
Послеоперационные осложнения имели место в 159 (11,1±0,8%) случаях. Наиболее частыми послеоперационными осложнениями были тромбоэмболия легочной артерии (24; 9,6%), абсцессы (25; 10,0%) и перитонит (22; 8,8%). Для анализа риска возникновения послеоперационных осложнений использован метод построения математических моделей. При проведении анализа в качестве результирующего признака Y3 прогнозировали риск возникновения осложнения после проведения операции, при этом в случае развития послеоперационных осложнений (отмечены в 159 случаях) результирующая переменная принимает значение Y3=1, при условии отсутствия таковых результирующая переменная Y3=0. В качестве факторных признаков анализировали 83 показателя.
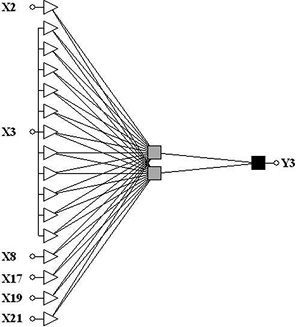
На первом этапе проведения анализа построена нейросетевая модель прогнозирования, которая включала все 83 показателя. Для выявления минимального набора факторных признаков, связанных с риском возникновения послеоперационных осложнений, использован ГА отбора. В результате выделено 6 признаков: пол (X2), локализация опухоли (X3), наличие осложнений опухолевого процесса до операции (X8), наличие сопутствующих заболеваний (X17), ишемическая болезнь сердца (X19), общий атеросклероз, атеросклеротический кардиосклероз, аортокоронарокардиосклероз, постинфарктный кардиосклероз (X21).
На выделенном наборе 6 признаков была построена нелинейная нейросетевая модель прогнозирования. На рис. 2 приведена архитектура полученной нейросетевой модели. На обучающем множестве чувствительность модели составила 60,1% (95% ДИ 51,8–68,2%), специфичность — 64,4% (95% ДИ 61,6–67,3%). На подтверждающем множестве чувствительность — 61,5% (95% ДИ 31,9–87,1%), специфичность — 59,9% (95% ДИ 51,5–68,0%).
При сравнении прогностических характеристик модели, полученных на обучающем и тестовом множествах, не выявлено статистически значимого различия показателей чувствительности (p=0,84) и специфичности (p=0,34), что является свидетельством отсутствия «подгонки» коэффициентов и возможности использования модели на новых данных. При этом следует отметить, что сокращение числа входных признаков не изменило статистически значимо чувствительности и специфичности 6-факторной нейросетевой (MLP) модели по сравнению с моделью, построенной на всех 83 факторных признаках (p>0,05), что подтверждает высокую значимость отобранных показателей. Для оценки адекватности 6-факторной модели использован метод построения и анализа кривых операционных характеристик (ROC-кривая модели приведена на рис. 3).
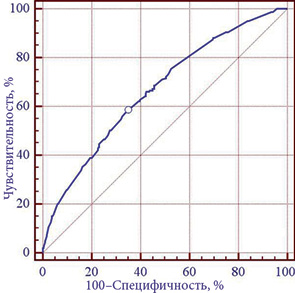
Площадь под ROC-кривой полученной модели AUC=0,67±0,02, статистически значимо (p<0,001) отличается от 0,5 — модель адекватна.
При выборе оптимального порога чувствительность 6-факторной модели прогнозирования риска возникновения послеоперационных осложнений (для всех 1435 случаев) оказалась равной 58,5% (95% ДИ 50,4–66,2%), специфичность — 65,3% (95% ДИ 62,6–67,9%). Отношение правдоподобия для модели прогнозирования: +LR=1,7 (95% ДИ 1,4–2,0), –LR=0,6 (95% ДИ 0,5–0,8). Для оценки степени влияния 6 выделенных факторных признаков на риск возникновения послеоперационных осложнений построена логистическая модель регрессии. Из проведенного в рамках построенной логистической модели анализа следует, что риск возникновения послеоперационных осложнений повышается (p<0,001) при наличии у больного сопутствующих заболеваний (ОШ=1,8; 95% ДИ 1,3–2,6).
Это объясняется тем, что в 52,4% случаев пациенты были в возрасте старше 60 лет с выраженной сопутствующей патологией, преимущественно сердечно-сосудистой системы.
Послеоперационная летальность составила 4,5±0,6% (65 пациентов). Для проведения анализа риска летального исхода также использовали метод построения математических моделей. При проведении анализа в качестве результирующего признака Y2 прогнозировали риск летального исхода после проведения операции, при этом в случае летального исхода результирующая переменная принимает значение Y2=1 (летальный исход произошел в 65 случаях), в случае отсутствия послеоперационных осложнений результирующая переменная Y2=0. В качестве факторных признаков анализировали 84 показателя.
На первом этапе проведения анализа построена нейросетевая модель прогнозирования, которая включала все 84 показателя. Для выявления минимального набора факторных признаков, связанных с риском летального исхода, использован ГА отбора факторных признаков. В результате выделен 1 признак: наличие послеоперационных осложнений. В связи с этим для анализа риска летального исхода была построена логистическая модель регрессии на тех же 6 факторных признаках, что и для модели прогнозирования риска возникновения послеоперационных осложнений.
Из проведенного в рамках построенной логистической модели анализа следует, что риск летального исхода после проведения операции повышается (p=0,029) при наличии у больного осложнений опухолевого процесса до операции (ОШ=2,2; 95% ДИ 1,1–3,6). Риск летального исхода после проведения операции возрастает (p=0,003) также при наличии у больного сопутствующих заболеваний (ОШ=2,2; 95% ДИ 1,3–3,7). Также установлено, что риск летального исхода после проведения операции выше (p=0,019) при локализации опухоли в теле и кардиальном отделе желудка, а также при тотальном поражении (ОШ=2,2; 95% ДИ 1,1–4,1) по сравнению с локализацией опухоли в антральном отделе и при субтотальном поражении. Повышение риска летального исхода в связи с наличием у больного до операции осложнений опухолевого процесса объясняется тяжестью последних.
В нашем исследовании у 3,28±0,47% больных до операции развилось кровотечение, что существенно ухудшило состояние пациентов и, естественно, не могло не сказаться на результате хирургического вмешательства. Кроме того, у 9,27±0,77% пациентов имелся стеноз различной степени выраженности, который приводит к развитию тяжелых электролитных нарушений и, как следствие, — нарушению функций целого ряда органов и систем, что также повышало риск летального исхода, как и наличие тяжелых соматических заболеваний. Многие послеоперационные осложнения явились результатом декомпенсации имевшихся до операции тяжелых сопутствующих заболеваний, прежде всего сердечно-сосудистой системы. Локализация опухоли в теле и кардиальном отделе желудка, равно как и тотальное его поражение, существенно повышала травматичность хирургического вмешательства и, соответственно, риск летального исхода. Хирургические вмешательства при опухолях желудка более низкой локализации (за исключением опухолей, распространяющихся на двенадцатиперстную кишку) технически менее сложные и менее травматичные, чем операции у больных с проксимально расположенными опухолями или тотальным поражением желудка.
Выводы
1. Выделены 3 факторных признака, определяющих в основном риск возникновения интраоперационных осложнений: технические особенности выполнения операции, объем операции, количество резецированных органов и/или анатомических структур, — чувствительность модели составила 84,9% (95% ДИ 79,8–89,1%), специфичность — 73,5% (95% ДИ 70,9– 76,0%). Отношение правдоподобия для модели: +LR=3,2 (95% ДИ 2,9–3,6), –LR=0,21 (95% ДИ 0,20–0,30).
2. Установлено, что риск возникновения интраоперационных осложнений повышается (p
3. Выделены 6 факторных признаков, определяющих в основном риск возникновения послеоперационных осложнений: пол, локализация опухоли, наличие осложнений до операции, наличие сопутствующих заболеваний, характер сопутствующих заболеваний (ишемическая болезнь сердца, общий атеросклероз, атеросклеротический кардиосклероз, аортокоронарокардисклероз, постинфарктный кардиосклероз), — чувствительность модели составила 58,5% (95% ДИ 50,4–66,2%), специфичность — 65,3% (95% ДИ 62,6–67,9%). Отношение правдоподобия для модели прогнозирования: +LR=1,7 (95% ДИ 1,4–2,0), –LR=0,6 (95% ДИ 0,5–0,8).
4. Установлено, что риск возникновения послеоперационных осложнений повышается (p
5. Установлено, что риск летального исхода после проведения операции повышается (p=0,029) при наличии у больного осложнений опухолевого процесса (ОШ=2,2; 95% ДИ 1,1–3,6) и также возрастает (p=0,003) при наличии сопутствующих заболеваний (ОШ=2,2; 95% ДИ 1,3–3,7). Также доказано, что риск летального исхода после проведения операции выше (p=0,019) при локализации опухоли в теле, кардиальном отделе или при тотальном поражении желудка (ОШ=2,2; 95% ДИ 1,1–4,1) по отношению к локализации в антральном отделе и субтотальном поражении желудка.
Список использованной литературы
1. Гланц С. (1999) Медико-биологическая статистика. Практика, Москва, 459 с.
2. Казаков В.Н., Лях Ю.Е., Кутько И.И. (2001) Теоретические и практические аспекты автоматизированной информационной системы «Депрессии». Серия «Очерки биологической и медицинской информатики». Из-во ДонГМУ, Донецк, 160 с.
3. Лях Ю.Е., Гурьянов В.Г., Хоменко В.Н., Панченко О.А. (2006) Основы компьютерной биостатистики. Анализ информации в биологии, медицине и фармации статистическим пакетом MedStat. Папакица Е.К., Донецк, 214 с.
4. Петри А. К., Сэбин К. (2003) Наглядная статистика в медицине (Пер. с англ.). Гэотар-Мед, Москва, 144 с.
5. Рак в Україні в 2002–2003 р. Захворюваність, смертність, показники діяльності онкологічної служби (2012) Бюл. Нац. канцер-реєстру України, Київ, 5: 105 с.
6. Рак в Україні в 2010–2011 р. Захворюваність, смертність, показники діяльності онкологічної служби (2012) Бюл. Нац. канцер-реєстру України, Київ, 13: 111 с.
7. Altman D.G., Machin D., Bryant T.N. (2003) Statistics with confidence. Confidence intervals and statistical guidelines. BMJ Books, Bristol, 240 p.
8. Metz C.E., Kronman H.B. (1980) Statistical significance tests for binormal ROC curves. J. Math. Psychol., 22: 218–243.
9. Pisanu A. Montisci A., Piu S., Uccheddu A. (2007) Curative surgery for gastric cancer in the elderly: treatment decisions, surgical morbidity, mortality, prognosis and quality of life. Tumori., 93(5): 478–484.
10. Schauer M., Peiper M., Theisen J., Knoefel W. (2011) Prognostic factors in patients with diffuse type gastric cancer (linitis plastica) after operative treatment. Eur. J. Med. Res., 16(1): 29–33.
11. Tokunaga M., Tanizawa Y., Bando E. et al. (2013) Poor survival rate in patients with postoperative intra-abdominal infectious complications following curative gastrectomy for gastric cancer. Ann. Surg. Oncol., 20(5): 1575–83.
12. Qiu M.Z., Wang Z.Q., Luo H.Y. et al. (2011) Prognostic analysis in node-negative gastric cancer patients in China. Tumour Biol., 32(3): 489–492.














Leave a comment