Результати хірургічного лікування мультицентричного раннього раку шлунка
Давыдов М.И., Туркин И.Н., Давыдов М.М., Левицкий А.В.
Резюме. Частота мультицентричного раннього раку шлунка становить за даними літератури від 2 до 16%. Доопераційна діагностика цієї патології складна. Дискутабельним є питання й про раціональний обсяг хірургічного втручання при мультицентричному ранньому раку. У Російському онкологічному науковому центрі ім. М.М. Блохіна РАМН (Москва) у 1990–2008 рр. прооперовано 394 пацієнти з раннім раком шлунка. Діагноз установлено на підставі морфологічного дослідження біоптатів і операційного матеріалу. Усі хворі одержали лише хірургічне лікування. Ступінь радикальності операцій згідно з критеріями UICC відповідав R0. Прогностична роль і морфологічні особливості мультицентричного раннього раку шлунка (n=23) порівняні з аналогічними характеристиками моноцентричного раннього раку (n=371). Для оцінки критерію «виживаність» використовувався моментний метод побудови таблиць доживання.
Резюме. Частота мультицентричного раннего рака желудка составляет по данным литературы от 2 до 16%. Дооперационная диагностика этой патологии сложна. Дискутабельным является вопрос и о рациональном объеме хирургического вмешательства при мультицентричном раннем раке. В Российском онкологическом научном центре им. Н.Н. Блохина РАМН (Москва) в 1990–2008 гг. оперировано 394 пациента с ранним раком желудка. Диагноз установлен на основании морфологического исследования биоптатов и операционного материала. Все больные получили только хирургическое лечение. Степень радикальности операций, согласно критериям UICC, соответствовала R0. Прогностическая роль и морфологические особенности мультицентричного раннего рака желудка (n=23) сравнены с аналогичными характеристиками моноцентричного раннего рака (n=371). Для оценки критерия «выживаемость» использовался моментный метод построения таблиц дожития.

Частота мультицентричного раннего рака желудка составляет по данным литературы от 2 до 16%. Дооперационная диагностика этой патологии сложна, что обусловлено небольшими размерами очагов: при диаметре до 5 мм ошибка распознавания мультицентричного роста составляет по данным H. Isozaki и соавторов (1996) [9] 84%, при диаметре до 9 мм — 37%. В исследовании F. Borie и соавторов (2003) [5] только у 1 из 32 больных диагноз мультицентричного раннего рака установлен до операции.
Мнения относительно прогностического значения мультицентричного роста раннего рака желудка противоречивы. В исследовании И.Ю. Долгова (1992) [1] мультицентричность расценена как фактор, ухудшающий прогноз: 5-летняя выживаемость после хирургического лечения составила всего 62,6% против 82,7% при моноцентричном характере роста раннего рака. Напротив, Y. Seto и соавторы (1996) [18], K. Takeshita и соавторы (1997) [20], F. Borie и соавторы (2003) [5] считают, что мультицентричность опухоли не оказывает существенного влияния на отдаленные результаты лечения.
Дискутабельным является вопрос и о рациональном объеме хирургического вмешательства при мультицентричном раннем раке. Одни авторы рекомендуют выполнять только гастрэктомию [4, 16, 17], другие считают адекватной в большинстве случаев резекцию желудка [5–8, 12, 13], третьи считают возможным выполнять в ряде случаев эндоскопическую резекцию слизистой оболочки [20].
объект и методы исследования
В Российском онкологическом научном центре им. Н.Н. Блохина РАМН (Москва) в период с 1990 по 2008 г. было оперировано 394 больных ранним раком желудка. Диагноз у всех был установлен на основании морфологического исследования биоптатов и операционного материала. Мультицентричный рак диагностирован у 23 (5,8%) пациентов. Согласно критериям мультицентричности, предложенным C.G. Moertel и соавторами в 1957 г. [14], новообразования (рис. 1, 2) были разделены участком непораженной слизистой оболочки и не являлись отсевом из другого опухолевого очага.
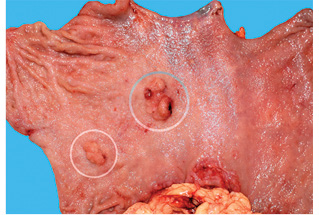
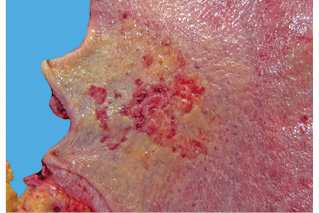
У 19 (82,6%) больных из 23 опухолевые очаги располагались в одном анатомическом отделе желудка, у 3 (13%) — в двух, и у 1 (4,3%) больного — в трех анатомических отделах. У 17 (73,9%) пациентов выявлено 2 опухолевых очага, у 2 (8,7%) — 3, у 3 (13%) — 4 и у 1 (4,3%) больного — 6 опухолевых очагов. Всего у 23 пациентов с мультицентричным ранним раком желудка определено 58 опухолевых очагов.
Все больные получили только хирургическое лечение. Степень радикальности операций, согласно критериям UICC, соответствовала R0 [19].
Субтотальная дистальная резекция желудка выполнена 8 (34,8%) больным: у 5 объем лимфодиссекции соответствовал D1, у 3 — D2. У 6 больных опухолевые очаги локализовались в нижней трети желудка, у 1 — в средней трети, у 1 — в нижней и средней трети.
Гастрэктомия выполнена у 13 (56,5%) больных: у 9 объем лимфодиссекции соответствовал D1, у 4 — D2. У 9 пациентов опухолевые очаги локализовались в средней трети желудка, у 1 — в нижней трети, у 1 — в верхней трети, у 1 — в средней и верхней трети, у 1 больного — во всех трех анатомических отделах желудка.
Субтотальная проксимальная резекция с лимфодиссекцией D2 выполнена 1 больному с локализацией двух опухолевых очагов в верхней трети желудка (4,3%).
Одному из 23 пациентов с наличием 2 опухолевых очагов по большой кривизне тела желудка была выполнена клиновидная резекция (4,3%).
Прогностическая роль и морфологические особенности мультицентричного раннего рака желудка (n=23) сравнены с аналогичными характеристиками моноцентричного раннего рака (n=371).
Статистический анализ проводили с помощью программы «Statistica 6 for Windows». Достоверность различий качественных показателей определялась по непараметрическому критерию χ², либо при значении ожидаемых чисел <5 — по двухстороннему варианту точного критерия Фишера. Достоверность различий количественных показателей в двух группах оценивалась по критерию Стьюдента.
Для оценки критерия «выживаемость» использовался моментный метод построения таблиц дожития (Kaplan E.L. и Meier P., 1958). Для сравнения кривых кумулятивной выживаемости, рассчитанных по методу Kaplan —Meier, использовался log-rank тест. Уровень достоверности, необходимый для утвердительного ответа, составлял ≥95% (p<0,05).
Результаты и их обсуждение
В табл. 1 и 2 представлены локализация опухоли, а также демографические и морфологические факторы у больных моно- и мультицентричным ранним раком.
| Локализация опухоли | Рак | Р | |||
|---|---|---|---|---|---|
| моноцентричный(n=371) | мультицентричный (n=23) | ||||
| n | % | n | % | ||
| Нижняя треть | 181 | 48,8 | 7 | 30,4 | 0,13 |
| Нижняя и средняя треть | – | – | 1 | 4,3 | – |
| Средняя треть | 142 | 38,3 | 10 | 43,5 | 0,78 |
| Средняя и верхняя треть | – | – | 2 | 8,7 | – |
| Верхняя треть | 48 | 12,9 | 2 | 8,7 | 0,79 |
| Поражение трех отделов | – | – | 1 | 4,3 | – |
| Факторы | Рак, n (%) | Р | |
|---|---|---|---|
| моноцентричный (n=371) | мультицентричный(n=23, число очагов 58) | ||
| Возраст, лет | 57,2±11,5 | 60,4±8,18 | 0,19 |
|
Глубина инвазии M SM |
186 (50,1) 185(49,9) |
37 (63,8) 21 (36,2) |
0,07 |
|
Степень дифференцировки Высокая Умеренная Низкая |
91 (24,5) 59 (15,9) 221 (59,6) |
23 (39,7) 11 (19) 24 (41,4) |
0,02 0,69 0,01 |
| Размер опухоли (см) | 2,7±1,5 | 2,1±1,5 | <0,01 |
Локализация опухолевых очагов при мультицентричном раннем раке чаще соответствовала средней трети желудка — (43,5%), затем нижней трети — 30,4%. При моноцентричном раке отмечено наиболее частое поражение нижней (48,8%) и средней (38,3%) трети.
Согласно гипотезе Y. Seto и соавторов (1996) [18], источником мультицентричного роста являются очаги кишечной метаплазии, трансформирующиеся, как правило, в высокодифференцированную аденокарциному. Этим, по их мнению, обусловливается достоверно более высокая частота мультицентричного раннего рака желудка у больных пожилого и старческого возраста: средний возраст больных в исследовании авторов составил 61,3±11,5 года при мультицентричном против 55,7±11,6 года (p<0,01) при моноцентричном раке [18]. Между тем, достоверная зависимость частоты мультифокального роста от возраста больных в нашем исследовании не прослеживается.
Глубина инвазии при мультицентричном раке чаще соответствовала слизистому слою, чем при моноцентричном: 63,8 и 50,1% соответственно (p=0,07, различия недостоверны).
Однофакторный анализ морфологических характеристик продемонстрировал достоверные различия между моноцентричным и мультицентричным ранним раком желудка только по двум факторам: размерам опухолевых очагов и степени дифференцировки. Размеры очагов при мультицентричном характере роста оказались достоверно меньше, чем при моноцентричном раке: 2,1±1,5 см против 2,7±1,5 см соответственно (p<0,01). При мультицентричном раке достоверно чаще отмечалась аденокарцинома высокой степени дифференцировки (р=0,02) и достоверно реже — низкодифференцированные опухоли (р=0,01).
D1-лимфодиссекция выполнена у 14 больных (60,9%), D2 — у 8 (34,8%). У 1 (4,3%) больного, перенесшего клиновидную резекцию желудка, объем лимфодиссекции оценен как D0 .
В проведенном нами анализе закономерностей лимфогенного метастазирования раннего рака желудка (n=394) мультицентричный рост не оказался в числе значимых факторов риска: частота лимфогенного метастазирования мультицентричного раннего рака составила 13% (3 из 23 наблюдений), моноцентричного — 12,1% (45 из 371 наблюдений). Различия статистически недостоверны (p=0,84).
Во всех трех наблюдениях мультицентричного рака с наличием лимфогенных метастазов наибольшая глубина инвазии соответствовала подслизистому слою. Во всех случаях также опухоль была представлена двумя очагами (у 2 пациентов они локализовались в средней трети желудка и у 1 — в верхней и средней трети). У 1 больного отмечено поражение только лимфоузлов малого сальника (группа № 3), у двух других – малого и большого сальников (группы № 3 и 4sb). Среднее количество пораженных лимфоузлов составило 2,3±1,2 при мультицентричном и 2,2±1,6 при моноцентричном раннем раке (p=0,91, различия недостоверны).
Значимые факторы риска и соответствующая им частота лимфогенного метастазирования, представленные в табл. 3, характерны как для моноцентричного, так и для мультицентричного раннего рака.
| Ранговое место фактора | Коэффициент информативности | Частота лимфогенного метастазирования, % | Р | |
|---|---|---|---|---|
| 1 | Лимфатическая инвазия | 0,1726 | 47,2 | <0,001 |
| 2 | Субмукозная инвазия | 0,0499 | 18,7 | <0,001 |
| 3 | Размер опухоли >4,0 см | 0,0432 | 31 | 0,021 |
| 4 | Венозная инвазия | 0,0429 | 44,1 | <0,001 |
| 5 | Переход опухоли на пищевод | 0,0244 | 38,5 | 0,007 |
| 6 |
Макроскопический тип 0 I 0 III |
0,0241 |
21,2 16,9 |
0,041 |
| 7 | Низкая степень дифференцировки | 0,0055 | 15,1 | 0,007 |
Размеры опухоли, ее макроскопический тип и переход на пищевод определялись при эндоскопическом исследовании. Эндосонография позволяла уточнить глубину инвазии опухоли. Лимфатическая и венозная инвазия определялись после операции. Следует отметить, что идентификация лимфатической и венозной инвазии возможна и до операции — после эндоскопической резекции пораженной слизистой оболочки.
Отдаленные результаты
Период наблюдения больных после операции составил от 4 до 200 мес. Результаты представлены в табл. 4.
| Критерий | Показатель |
|---|---|
|
Живы без признаков Умерли От прогрессирования От неопухолевых заболеваниий От другой опухоли |
18 (78,3) 5 (21,7) 1 (4,3) 3 (13,0) 1 (4,3) |
Умерли 5 из 23 пациентов, общая летальность составила, таким образом, 21,7%. Структура летальности при мультицентричном раннем раке отражает закономерности, характерные для раннего рака желудка в целом: бόльшая часть больных умирают от причин, не связанных с прогрессированием. Прогрессирование опухоли было отмечено только у одного больного после клиновидной резекции желудка. Приводим клиническое описание данного наблюдения.
Больная С., возраст 66 лет. При обследовании выявлен экзофитный рак тела желудка (малигнизированный полип) в области большой кривизны. Пациентка оперирована 20.04.1994 г. в объеме клиновидной резекции желудка. При морфологическом исследовании операционного препарата выявлен мультицентричный рост опухоли: первая опухоль представлена низкодифференцированной аденокарциномой кишечного типа с наличием лимфатической и венозной инвазии, прораставшей подслизистый слой (уровень SM2 согласно классификации Японской ассоциации по изучению рака желудка 1998 г.). Размеры опухоли 3,5х2,5 см, макроскопический тип 0I. Вторая опухоль представлена низкодифференцированной аденокарциномой с инвазией слизистого слоя, макроскопическим типом 0II С, размерами 0,7х0,5 см, и располагалась на расстоянии 1 см от первой. Проксимальный и дистальный хирургические отступы от краев опухоли соответствовали 2,0 см. Края резекции при гистологическом исследовании интактные. Через 3,5 мес отмечено бурное прогрессирование: интралюминарный рецидив в зоне резекции и метастазы в регионарных лимфоузлах в сочетании с метастазами в печени. Рекомендована химиотерапия. Смерть больной от прогрессирования 29.06.1995 г. Продолжительность жизни с момента диагностики рецидива составила 10,9 мес, общая продолжительность жизни с момента операции — 14,3 мес.
Очевидно, что выбранный объем хирургического вмешательства в данном случае был неадекватным.
При мультицентричном раннем раке желудка первично-множественные злокачественные опухоли зарегистрированы нами в 1 (4,3%) наблюдении: вторая опухоль была представлена метахронным раком тела матки, диагностированным через 30 мес после D1-гастрэктомии по поводу мультицентричного раннего рака с локализацией двух опухолевых очагов в средней и верхней трети желудка. Больная была оперирована в объеме экстирпации матки с придатками. Через 47,8 мес после гастрэктомии и 18 мес после экстирпации матки наступил летальный исход от прогрессирования рака тела матки.
От неопухолевой патологии умерли 3 пациента, которым ранее была выполнена гастрэктомия. Продолжительность их жизни составила 4; 46 и 57 мес.
Таким образом, общая 5- и 10-летняя выживаемость больных мультицентричным ранним раком желудка составила 84,9 и 76,4% и достоверно не отличалась от аналогичных показателей выживаемости при моноцентричном раннем раке — 85,6 и 72,6% соответственно (p=0,71). Кривые выживаемости представлены на рис. 3.

Практически идентичные показатели выживаемости указывают на отсутствие прогностической значимости мультицентрического характера роста для раннего рака желудка.
Стратегия хирургического лечения больных мультицентричным ранним раком желудка продолжает оставаться предметом дискуссий. Одним из аспектов проблемы является выбор оптимального объема резекции желудка. Всегда ли необходима гастрэктомия? Ряд отечественных и зарубежных авторов при диагностированном до операции мультицентричном раннем раке рекомендуют выполнять гастрэктомию, независимо от анатомической локализации опухолевых очагов [2–4, 11, 16, 17]. Существует и другая точка зрения: при концентрации всех опухолевых очагов в нижней или верхней трети желудка субтотальная дистальная или проксимальная резекция являются онкологически адекватными вмешательствами [5–8, 13]. Например, в исследовании F. Borie и соавторов (2004) [6] 5-летняя выживаемость больных, оперированных в объеме субтотальной резекции желудка по поводу моно- и мультицентричного рака, достоверно не отличалась: 92% против 90% соответственно (p=0,8), а частота интралюминарных рецидивов составила 3% при моноцентричном раке и 5% — при мультицентричном (p=0,6). Возможность парциальной резекции при мультицентричном раннем раке желудка подтверждает также вывод T. Kosaka и соавторов (1990) [12] о том, что очаги мультицентричного опухолевого роста более чем в 80% локализуются в одном анатомическом отделе желудка. В нашем исследовании очаги мультицентричного роста были сосредоточены в одном из отделов желудка у 19 (82,6%) больных из 23.
Все больные (n=8), перенесшие субтотальную дистальную резекцию желудка по поводу мультицентричного рака, живы в сроки от 41 до 200 мес. У 6 из них опухолевые очаги локализовались в нижней трети желудка, у 1 — в средней трети, у 1 — в нижней и средней трети желудка.
Проксимальная резекция выполнена у 1 больного с локализацией 2 опухолевых очагов в верхней трети желудка. Пациент продолжает наблюдаться без признаков прогрессирования (период наблюдения — 48 мес).
После гастрэктомии (n=12, из анализа исключен 1 пациент с первично-множественными злокачественными опухолями) 5- и 10-летняя выживаемость составила 81,8 и 65,5% соответственно. В этой группе 3 пациента умерли в сроки 4; 46 и 57 мес от неопухолевых причин. Остальные 9 больных наблюдаются в сроки от 47 до 120 мес. У 8 пациентов опухолевые очаги локализовались только в средней трети желудка, у 1 — только в нижней трети, у 1 — только в верхней трети, у 1 — в средней и верхней трети, у 1 — во всех трех отделах.
Таким образом, гастрэктомия является операцией выбора при мультицентричном раннем раке с локализацией опухолевых очагов в средней трети, а также при поражении более чем одного анатомического отдела желудка. Дистальная субтотальная резекция может выполняться при мультицентричном раке с поражением только нижней трети желудка, подтвержденным скрупулезным эндоскопическим исследованием, включающем эндосонографию, современные методики окрашивания слизистой оболочки и отсутствии тяжелой дисплазии в биоптатах слизистой оболочки других анатомических отделов желудка.
Сделать выводы о целесообразности проксимальной субтотальной резекции при мультицентричном раннем раке проксимального отдела желудка нам не позволяет малое число наблюдений.
При анализе продолжительности жизни и частоты прогрессирования опухоли в зависимости от объема лимфодиссекции среди всех больных ранним раком желудка, независимо от числа очагов, отмечены следующие закономерности (рис. 4).
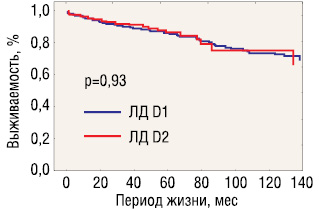
Показатели общей выживаемости не зависели от объема лимфодиссекции: 5- и 10-летняя выживаемость составила соответственно 86,5 и 75,3% после D2-лимфодиссекции против 85,9 и 73,5% после D1 (p=0,93 log-rank test). Однако общая частота прогрессирования опухоли в группе больных, перенесших D2-диссекцию, оказалась достоверно ниже, чем в группе D1: 1,3% против 6,7% (p<0,05). Различия в частоте локорегионарных рецидивов также оказались статистически значимыми: 0% после D2- и 4,3% после D1-диссекции (p<0,05).
На рис. 5 и 6 представлена выживаемость, стратифицированная по критерию pN0/pN+, которые выявили некоторые преимущества D2-лимфодиссекции только при наличии регионарных лимфогенных метастазов при раннем раке желудка.
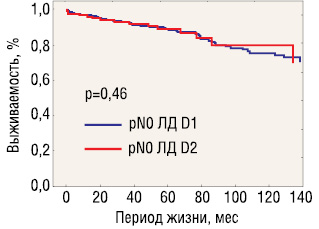
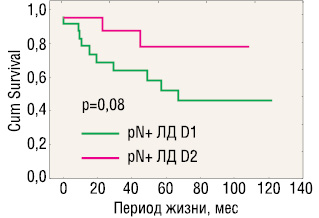
У больных без лимфогенных метастазов (pN0) 5- и 10-летняя общая выживаемость составила 89,8 и 76,7% в группе D1 и соответственно 87,5 и 75,8% — в группе D2 (p=0,46 log-rank test) (см. рис. 4). Частота прогрессирования и локорегионарных рецидивов составила 2,7 и 2,1% после лимфодиссекции D1 и 0% после D2 (различия недостоверны).
Продолжительность жизни в группе больных с наличием лимфогенных метастазов (pN+) после D2-лимфодиссекции оказалась несколько выше, чем после D1: 5-летняя выживаемость составила соответственно 78,1 и 51,6%, а 10-летняя — 78,1 и 45,9% (p=0,08, log-rank test, различия недостоверны). В то же время частота прогрессирования после D2-диссекции составила 9,5%, после D1 — 39,1% (p<0,05), а частота локорегионарных рецидивов — 0 и 26% соответственно (p<0,05). Различия оказались статистически достоверными.
У больных с подслизистой инвазией опухоли и наличием лимфогенных метастазов 5-летняя продолжительность жизни после D2-диссекции составила 73,6%, после D1 — 35,9% (различия достоверны: p=0,03 log-rank test). Частота прогрессирования в этой же подгруппе больных после D2-лимфодиссекции составила 11,1%, после D1 — 43,8% (p<0,05), а частота локорегионарных рецидивов — 0 и 25% соответственно (p<0,05).
Выводы
1. Мультицентричный рост раннего рака желудка не сопровождается повышением частоты лимфогенного метастазирования и не ухудшает результаты хирургического лечения в сравнении с аналогичными показателями при моноцентричном раннем раке желудка.
2. Гастрэктомия является операцией выбора при мультицентричном раннем раке с локализацией опухолевых очагов в средней трети, а также при поражении более чем одного анатомического отдела желудка. Дистальная субтотальная резекция может выполняться при мультицентричном раке с поражением только нижней трети желудка.
3. Выполнение D2-лимфодиссекции у больных ранним раком желудка при наличии факторов риска лимфогенного метастазирования позволяет достоверно снизить частоту рецидивов и улучшить результаты хирургического лечения этой группы больных.
Литература
- 1. Долгов И.Ю. (1992) Ранний рак желудка (диагностика, лечение, прогноз): Автореф. дис. … канд. мед. наук. Москва, 25 с.
- 2. Черноусов А.Ф., Поликарпов С.А., Годжелло Э.А. (2002) Ранний рак и предопухолевые заболевания желудка. ИздАт, Москва, 253 с.
- 3. Черноусов А.Ф., Черноусов Ф.А., Селиванова И.М. (2004) Радикальное хирургическое лечение раннего рака желудка. Хирургия. Журнал им. Н.И. Пирогова., 7: 4–8.
- 4. Чернявский А.А., Шарандов Е.А. (2001) Ранний рак (in situ) желудка и его хирурги-ческое лечение. Анналы хирургии, 6: 59–64.
- 5. Borie F., Plaisant N., Millat B. et al. (2003) Treatment and prognosis of early multiple gastric cancer. Eur. J. Surg. Oncol., 29(6): 511–514.
- 6. Borie F., Plaisant N., Millat B. et al.; for the French Association for Surgical Research (2004) Apropriate Gastric Resection with Lymph Node Dissection for Early gastric Cancer. Ann. Surg. Oncol., 11(5): 512–517.
- 7. Bozzetti F., Marubini E., Bonfanti G. et al. (1997) Total Verlus Subtotal Gastrectomy: surgical morbidity and mortality rates in a Multicenter Italian Randomized Trial. The Italian Gastrointestinal Tumor Study Group. Ann. Surg., 5: 613–620.
- 8. Endo M., Habu H. (1990) Clinical studies of early gastric cancer. Hepatogastroenterology, 37: 408–410.
- 9. Isozaki H., Okajima K., Hu X. et al. (1996) Multiple early gastric carcinomas. Clinicopathologic feautures and histogenesis. Cancer, 78(10): 2078–2086.
- 10. JGCA — Japanese Classification of Gastric Carcinoma (1998) 2nd English Ed. Gastric Cancer, 1: 10–24.
- 11. Kitamura K., Yamaguchi T., Okamoto K. et al. (1995) Total gastrectomy for early gastric cancer. J. Surg. Oncol., 60(2): 83–88.
- 12. Kosaka T., Miwa K., Yonemura Y. et al. (1990) A clinicopathologic study on multiple gastric cancers with special reference to distal gastrectomy. Cancer, 65: 2602–2605.
- 13. Lawrence M., Shiu M.H. (1991) Early gastric cancer. Twenty-eight year experience. Ann. Surg., 213: 327–334.
- 14. Moertel C.G., Bargen J.A., Soule E.H. (1957) Multiple gastric cancers: review of the literature and study of 42 cases. Gastroenterology, 32: 1095.
- 15. Ohta H., Noguchi Y., Takagi K. et al. (1987) Early gastric carcinoma with special reference to Macroscopic classification. Cancer, 60: 1099–1106.
- 16. Oliveira F.J., Ferrao H., Furtado E. et al. (1998) Early gastric cancer: Report of 58 cases. Gastric Cancer, 1: 51–56.
- 17. Piso P., Werner U., Benten D. et al. (2001) Early gastriccancer-excellent prognosis after curative resection in 87 patients irrespective of submucosal infiltration, lymph node metastases or tumor size. Langenbeck’s Arch. Surg., 386: 26–30.
- 18. Seto Y., Nagawa H., Muto T. (1996) Treatment of Multiple Early Gastric Cancer. Jpn. J. Clin. Oncol., 26: 134–138.
- 19. Sobin L.Y., Wittekind Ch. (Еds.) (2002) UICC. TNM Classification of malignant tumors. 6th ed. Wiley-Liss, New-York.
- 20. Takeshita K., Tani M., Honda T. et al. (1997) Treatment of Primary Multiple Early Gastric Cancer: From the Viewpoint of Clinicopathologic Features. World J. Surg., 21: 832–836.














Leave a comment