Перспективи використання біологічних маркерів чутливості клітин раку шлунка до хіміотерапії
Щепотін І.Б.1, Колеснік О.О.1, Лукашенко А.В.1, Розумій Д.О.1, Бурлака А.А.2, Жуков Ю.О.1
У роботі узагальнено дані зарубіжних авторів та власних досліджень про перспективи використання біологічних маркерів для визначення чутливості клітин пухлин раку шлунка до хіміотерапії. Приведено аналіз ефективності застосування при прогнозуванні перебігу захворювання у хворих на рак шлунка дигідропіримідин-дегідрогенази та її ізоформ, білків ЕRCC1, р53, VEGF, VEGFR, HIF-1α, bcl-2. Зроблена оцінка застосування неоад’ювантного режиму хіміотерапії у комбінованому лікуванні хворих на рак шлунка згідно з міжнародними стандартами. Також наведено результати власних досліджень щодо застосування неоад’ювантної поліхіміотерапії (ECF) в умовах подальшого оперативного лікування. Виявлено кореляційні зв’язки між рівнем експресії у цих хворих молекулярних маркерів р53, VEGF, bcl-2 та чутливістю клітин пухлин шлунка до хіміотерапії. Проведений аналіз свідчить про актуальність і практичну значимість використання новітніх молекулярних технологій для вдосконалення алгоритмів лікування хворих на рак шлунка.
Вступ
Рак шлунка — одна з найбільших проблем охорони здоров’я. За деякими оцінками рак шлунка займає 4-те місце серед найпоширеніших онкологічних захворювань у світі [11]. Загальна кількість випадків захворювання на рак шлунка в Україні за 2007–2008 рр. становила 12 380, а за 2008–2009 рр. — 12 065. У розвинутих країнах рак шлунка в основному діагностують на пізніх стадіях захворювання, за винятком Японії, де скринінгові програми охоплюють основні групи ризику. В інших країнах, зокрема в Україні, ця проблема залишається актуальною і на сьогодні. Екологічні фактори ризику розвитку раку шлунка включають інфікування Helicobacter рilory, тютюнопаління, вживання великої кількості солі та інші дієтичні чинники. Крім того, пацієнти з обтяженим сімейним анамнезом захворюваності на рак шлунка мають високий ступінь ризику захворювання на цю патологію.
Неод’ювантна поліхіміотерапія при раку шлунка
Сьогодні неоад’ювантна поліхіміотерапія (ПХТ) вважається перспективним напрямком у лікуванні раку шлунка. Так, дослідницька група The British Medical Research Council провела аналіз ІІІ фази дослідження MAGIC trail неоад’ювантної хіміотерапії при раку шлунка [6]. У цій роботі 503 пацієнти були рандомізовані на дві групи: хворі 1-ї групи отримували неоад’ювантну ПХТ (епірубіцин, цисплатин, флуороурацил — схема ECF) та хірургічне лікування, а у 2-й групі призначали тільки хірургічне лікування. За локалізацією пухлин у кожній групі хворі були розподілені таким чином: 74% — рак шлунка, 14% — рак дистальних відділів стравоходу, а у 11% — гастроезофагеальний рак. За ступенем інфільтрації стінки органа згідно з класифікацією TNM, частота рТ1-рТ2 у групі хворих, які отримували неоад’ювантну ПХТ, становила 51,7%, у групі хірургічного лікування — 36,8%. Показники 5-річної виживаності серед хворих, які отримували неоад’ювантну ПХТ, становили 36% та 23% були у групі самостійного хірургічного лікування. Отже, неоад’ювантна ПХТ в режимі ECF значно покращила виживаність без прогресування та загальну виживаність у пацієнтів із раком шлунка та дистальними відділами стравоходу. Автори визначили неоад’ювантну ПХТ як варіант вибору стратегії лікування резектабельних форм раку шлунка у стандартах лікування (NCCN).
Молекулярні маркери прогнозу при раку шлунка
Загальний досвід лікування раку шлунка свідчить, що гістопатологічна відповідь на цитотоксичну терапію є базовим маркером виживаності та успішності лікування. Однак, незважаючи на тривалу історію досліджень, сьогодні залишається гострою проблемою вибір адекватних біомаркерів, використання яких забезпечило б індивідуальне прогнозування регресії/прогресування пухлини у відповідь на цитотоксичну терапію. Використання рутинних клінічних параметрів, таких як стадія процесу за TNM, локалізація пухлини, стать хворого та гістологічний тип росту, не дає бажаної відповіді клініцисту. Додатковою складністю в цій проблемі є використання протоколів, які визначають стратегію лікування на основі локалізації пухлини, та не беруть до уваги біологічні особливості пухлини й організму в цілому. Молекулярно-біологічні дослідження клітин пухлини вказують на те, що злоякісний фенотип є сумою всіх генетичних те епігенетичних змін, які забезпечують селективну здатність виживати злоякісним клонам клітин. А повна відповідь на цитотоксичну терапію, вірогідно, також диктується фенотипом пухлини та сигнальними шляхами, які беруть участь у відповіді пухлини на лікування. Оптимальні маркери прогнозу ефективності хіміотерапії мають бути надійними, доступними, легкими у визначенні та характеризувати системну відповідь організму на ріст пухлини. Цитотоксичність системних хіміотерапевтичних агентів та променевої терапії виникає переважно завдяки їх здатності індукувати пошкодження мембран, органел та ДНК у клітинах пухлин.
Визначення дигідропіримідин-дегідрогенази (DPD)
У ряді досліджень проводився аналіз метаболітів флуороурацилу як потенційних факторів прогнозу. Відомо, що дигідропіримідин-дегідрогеназа є ключовим ферментом у метаболізмі флуороурацилу. DPD перетворює флуороурацил у дигідрофлуоурацил (DHFU), який проявляє протипухлинну активність. Зниження активності тимідинфосфорилази (ТР), тимідин-кінази (ТК) чи фосфорибозилтрансферази (OPRT) асоціюється зі зниженням метаболічної активації та, відповідно, із виникненням локальної резистентності до флуороурацилу. Зростання активності ферментів, які берують участь у метаболізмі флуороурацилу (ТР, ТК, OPRT) підвищує рівень метаболітів флуороурацилу, що веде до зростання ефективності хіміотерапії.
Експресія білка ERCC1
Важливим маркером прогнозу ефективності платиновмісної хіміотерапії у хворих на рак шлунка є активність ERCC1. Репарація пошкоджених нуклеотидів ферментами репарації (NER) є первинним механізмом, який видаляє адукти платина-ДНК із ДНК клітин пухлини. Рівні активності білка ERCC1, який є важливою частиною сигнальних шляхів NER, можуть слугувати у ролі маркера активності репарації при раку шлунка [13].
Імуногістохімічний аналіз експресії білка ERCC1 у пухлинах 64 пацієнтів із поширеним раком шлунка, яких лікували флуороурацилом/оксаліплатином, показав, що у пацієнтів із низьким рівнем експресії білка ERCC1 був кращий терапевтичний ефект і медіана загальної виживаності [13]. У подібному дослідженні хворих на рак стравоходу отримано закономірності, які свідчать, що негативна експресія білка ERCC1 та TS у клітинах пухлин корелює із позитивним терапевтичним ефектом. Проведення мультиваріантного аналізу показало, що білок ERCC1 є незалежним прогностичним фактором патологічної відповіді пухлин на хіміотерапію. Крім того, пацієнти із негативною експресією білка ERCC1 у тканині пухлини мали кращу загальну та безрецидивну виживаність [12]. Є дані, отримані авторами [7], які досліджували експресію білка ERCC1 імуногістохімічним методом у хворих на рак шлунка та гастроезофагеальний рак. Проведено рандомізацію двох груп хворих, де 142 пацієнти 1-ї групи не отримували неоад’ювантної хіміотерапії, а 103 хворих 2-ї групи отримували неоад’ювантну платиновмісну хіміотерапію. У пацієнтів визначали експресію білка ERCC1-XPF, FANCD2, APE1 та р53. В учасників дослідження, у яких застосовували неоад’ювантну хіміотерапію, сприятливий прогноз (ступінь гістопатологічної відповіді пухлини (TRG 1, 2 чи 3) асоціювався із кращою виживаністю (р=0,038). Експресія в ядрі клітин пухлин ERCC1 корелювала з поганою гістопатологічною відповіддю пухлини (TRG 4 чи 5) до неоад’ювантної хіміотерапії (р=0,006) та асоціювалася з низькою захворюванняспецифічною (р=0,02) та загальною (р=0,04) виживаністю. Таким чином, експресія ядерного білка ERCC1 є перспективним прогностичним маркером у хворих на гастроезофагеальний рак, які отримують неоад’ювантну ПХТ.
Експресія білка ТР53
ТР53 (р53) є критичним транскрипційним фактором, який бере участь у ключових функціях клітини, таких як регуляція клітинного циклу, апоптоз та репарація ДНК. ТР53 часто піддається мутаціям при розвитку раку. Мутований білок р53 резистентний до деградації, а тому пухлинна експресія його у клітинах пухлин розглядається як маркер-замінник мутацій р53 і, відповідно, може корелювати з резистентністю пухлини. При раку шлунка негативна експресія р53 корелює з хорошим терапевтичним ефектом, що підтверджено чотирма опублікованими дослідженнями [2, 4, 14, 15]. В іншому дослідженні за участю 25 хворих на метастатичний рак шлунка, які отримували високодозову хіміотерапію та аутологічну трансплантацію кісткового мозку, надекспресія р53 та присутність мутацій р53 у 5–9 екзонах тканини біоптату до проведеного лікування мали сильні асоціативні зв’язки з хорошою загальною виживаністю. Експресія р53 та статус мутації були єдиними параметрами, які асоціювалися з об’єктивною регресією пухлини та гістологічною відповіддю на лікування [1].
Клітинна гіпоксія та ангіогенез
Як відомо, пошкодження мітохондрій та формування клітинної гіпоксії в пухлині є потужним індуктором ангіогенезу. Гіпоксичне мікрооточення у клітинах пухлин формує відбір клітин, здатних уникати апоптоз та виживати в умовах порушення метаболізму кисню в мітохондріях. Сигнальний шлях, опосередкований гіпоксія-індукованим транскрипційним фактором-1 (HIF-1) є критичним для неоангіогенезу в пухлині [9]. Гіпоксія індукує експресію генів, які регулюють різні критичні біологічні процеси формування пухлини, такі як проліферація, апоптоз, міграція та ангіогенез. Зокрема, гіпоксія активує експресію фактора росту ендотелію судин (VEGF), який є критичним про-ангіогенним фактором. Крім того, за умов гіпоксії відбувається індукція експресії рецепторів ендотеліального фактора росту (VEGFR1) на клітинах ендотелію, а також багато інших ангіогенних факторів, протеаз та атрактантів макрофагів, які можуть впливати на неоангіогенез [9].
У нещодавно проведеному дослідженні за участю хворих на рак шлунка (як із негативною експресією VEGF, так і з позитивною) виявили подібні показники відповіді на лікування до пацієнтів. Однак медіана виживаності була значно вищою серед хворих, які характеризувалися негативною експресією VEGF. Це свідчить на користь прогностичної значимості VEGF як маркера відповіді до ПХТ при раку шлунка [3]. Імуногістохімічний аналіз VEGF у біоптатах пухлини до лікування у 52 хворих на рак стравоходу, в яких застосовували хіміопроменеву терапію, показав, що надекспресія VEGF у клітинах пухлин може асоціюватись із поганим прогнозом [16]. В одній із робіт показано, що низька експресія VEGF асоціюється із високою чутливістю пухлини до ПХТ. Ці автори також визначали рівень експресії МІВ-1 (рівень активності проліферації) та СD34 (щільність капілярів) і показали, що пухлини, в яких співвідношення VEGF/MIB-1 становило 1:6 та менше, до проведення хіміопроменевої терапії мали кращий прогноз позитивного терапевтичного ефекту [10].
Об’єкт і методи дослідження
У 2008–2010 рр. на базі науково-дослідного відділення пухлин органів черевної порожнини та заочеревинного простору Національного інституту раку проведено дослідження, присвячене пошуку корелятивних зв’язків між експресією маркерів bcl-2, p-53, VEGF та чутливістю до неоад’ювантної ПХТ першої лінії ECF з метою персоналізації терапевтичних стратегій.
Результати та їх обговорення
Дослідження проведено на біопсійному матеріалі аденокарцином шлунка 46 хворих на рак шлунка ІІ–IV стадії (T2N1M0–T4N2M1). У всіх пацієнтів після стандартних методів обстеження та гістологічного підтвердження діагнозу, проводилось імуногістохімічне дослідження біопсійного матеріалу на наявність експресії маркерів bcl-2, p-53, VEGF.
Далі проводили два курси неоад’ювантної ПХТ відповідно до національних стандартів — за схемою ECF (епірубіцин 40 мг/м поверхні тіла в 1-й день, цисплатин 40 мг/м — у 2-й день, флуороурацил — 425 мг/м 1–4 дні) з подальшим оперативним лікуванням через 21 добу після останнього курсу ПХТ. Після оперативного лікування проводилося гістологічне дослідження видаленого препарату та показників окисного пошкодження ДНК з визначенням частки залишкової життєздатної пухлинної тканини. Залежно від рівнів активності досліджуваних маркерів пацієнти розподілились на 3 групи (таблиця, рис. 1).
| Група чутливості хворих на рак шлунка |
Bcl-2 | P53 | VEGF |
|---|---|---|---|
| Група ВисЧ* | – | – | + |
| Група НЧ* | – | – | – |
| Група ВідЧ* | + | + | – |
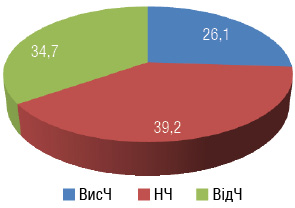
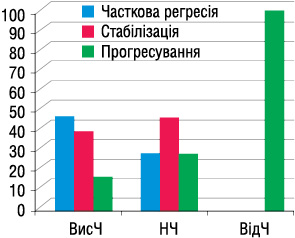
Терапевтичний ефект ПХТ оцінювали за даними ендоскопічного та рентгенологічного методів згідно з критеріями RECIST. Безпосередні результати проведеної ПХТ наведено на рис. 2.
Отримані безпосередні результати лікування свідчать про середню чутливість та високу специфічність вибраних імуногістохімічних маркерів. Комбіноване застосування маркерів (р53, VEGF, bcl-2) значно підвищило точність визначення груп чутливості до хіміотерапії, що свідчить про ефективність розробленої методики персоналізації ПХТ. На даному етапі дослідження отримані задовільні безпосередні результати лікування, необхідна оцінка впливу методики на 5-річну виживаність хворих.
Висновки
Рак шлунка залишається однією з найбільших проблем охорони здоров’я. Доказова база оптимальної стратегії лікування цих пацієнтів наразі вдосконалюється. Доведено, що перспективним напрямком є використання неоад’ювантної ПХТ з подальшим оперативним лікуванням. Основними завданням, які покладаються на проведення неоад’ювантної ПХТ, полягають у підвищенні резектабельності, зменшенні розмірів пухлини, профілактиці розвитку метастатичної хвороби на ранніх стадіях. Варіації відповіді пухлин раку шлунка на цитотоксичну терапію — у межах 40–60%. Дослідження біології раку зробили можливим ідентифікувати критичні сигнальні шляхи, які беруть участь у каскаді цитотоксичних ефектів терапевтичних агентів.
Зразки тканин, які отримують шляхом біопсії, є надійним матеріалом для генетичних, епігенетичних та протеомних досліджень відповіді пухлини на ПХТ. Роль біомаркерів у прогнозуванні ефективності терапії таргетними препаратами широко досліджується при раку шлунка та прямої кишки. Аналіз даних дає підстави вважати, що прогностичні біомаркери можуть бути критично важливими для відбору пацієнтів, чутливих до терапевтичних агентів.
Постгеномна ера в дослідженні раку відкрила нові перспективи в онкології, це дозволить дослідити протеом клітин пухлин і тим самим персоналізувати клінічну онкологію [5, 8]. Новітні молекулярні технології забезпечать практикуючих лікарів можливістю оцінювати біологічні процеси та потенційні прогностичні маркери, які допоможуть у плануванні стратегії лікування онкологічних хворих [17].
Література
2. Bataille F., Rummele P., Dietmaier W. et al. (2003)Alterations in p53 predict response to preoperative high dose chemotherapy in patients with gastric cancer. Mol. Pathol., 56: 286–292.
3. Boku N., Chin K., Hosokawa K. et al. (1998) Biological markers as a predictor for response and prognosis of unresectable gastric cancer patients treated with 5-fluorouracil and cis-platinum. Clin. Cancer. Res., 4: 1469–1474.
4. Boku N., Ohtsu A., Nagashima F. et al. (2007) Relationship between expression of vascular endothelial growth factor in tumor tissue from gastric cancers and chemotherapy effects: comparison between S-1 alone and the combination of S-1 plus CDDP. Jpn. J. Clin. Oncol., 37: 509–514.
5. Cascinu S., Graziano F., Del Ferro E. et al. (1998)Expression of p53 protein and resistance to preoperative chemotherapy in locally advanced gastric carcinoma. Cancer, 83: 1917–1922.
6. Chin L., Gray J.W. (2008) Translating insights from the cancer genome into clinical practice. Nature, 452: 553–563.
7. Cunningham D., Allum W.H., Stenning S.P. et al. (2006) Perioperative chemotherapy versus surgery alone for resectable gastroesophageal cancer. N. Engl. J. Med., 355: 11–20.
8. Fareed K.R., Kaye P., Soomro I.N. et al. (2009) Biomarkers of response to therapy in oesophago-gastric cancer. Gut., 58: 127–143.
9. Hanash S.M., Pitteri S.J., Faca V.M. (2008) Mining the plasma proteome for cancer biomarkers. Nature, 452: 571–579.
10. Harris A.L. (2002) Hypoxia — a key regulatory factor in tumour growth. Nature Rev. Cancer, 2: 38–47.
11. Imdahl A., Bognar G., Schulte-Monting J. et al. (2002) Predictive factors for response to neoadjuvant therapy in patients with oesophageal cancer. Eur. J. Cardiothorac. Surg., 21: 657–663.
12. Kamangar F., Dores G.M., Anderson W.F. (2006) Patterns of cancer incidence, mortality, and prevalence across five continents: defining priorities to reduce cancer disparities in different geographic regions of the world. J. Clin. Oncol., 24: 2137–2150.
13. Kim M.K., Cho K.J., Kwon G.Y. et al. (2008) ERCC1 predicting chemoradiation resistance and poor outcome in oesophageal cancer. Eur. J. Cancer, 44: 54–60.
14. Kwon H.C., Roh M.S., Oh S.Y. et al. (2007) Prognostic value of expression of ERCC1, thymidylate synthase, and glutathione S-transferase P1 for 5-fluorouracil/oxaliplatin chemotherapy in advanced gastric cancer. Ann. Oncol., 18(3): 504–509.
15. Nagashima F., Boku N., Ohtsu A. et al. (2005) Biological markers as a predictor for response and prognosis of unresectable gastric cancer patients treated with irinotecan and cisplatin. Jpn. J. Clin. Oncol., 35: 714–719.
16. Nakata B., Chung K.H., Ogawa M. et al. (1998) p53 protein overexpression as a predictor of the response to chemotherapy in gastric cancer. Surg. Today, 28: 595–598.
17. Shimada H., Hoshino T., Okazumi S. et al. (2002) Expression of angiogenic factors predicts response to chemoradiotherapy and prognosis of oesophageal squamous cell carcinoma. Br. J. Cancer, 86: 552–557.
18. Weissleder R., Pittet M.J. (2008) Imaging in the era of molecular oncology. Nature, 452: 580–589.
Перспективы применения биологических маркеров чувствительности клеток рака желудка к химиотерапии
Национальный институт рака, Киев
Национальный медицинский университет им. А.А. Богомольца,Киев
Резюме. В работе обобщены данные зарубежных авторов и собственных исследований о перспективах использования биологических маркеров с целью изучения чувствительности клеток опухоли рака желудка к химиотерапии. Проведен анализ эффективности применения при прогнозировании течения заболевания у больных раком желудка дигидропиримидин-дегидрогеназы и ее изоформ, белка ERCC1, p53, VEGF, VEGFR, HIF-1, bcl-2. Выполнена оценка использования неоадъювантного режима химиотерапии в комбинированном лечении больных раком желудка согласно международным стандартам. Также представлены результаты собственных исследований по применению неоадъювантной полихимиотерапии (ECF) в условиях дальнейшего оперативного лечения. Найдены корреляционные связи между уровнем экспрессии у этих больных молекулярных маркеров р53, VEGF, bcl-2 и чувствительности клеток опухоли желудка к химиотерапии. Проведенный анализ свидетельствует об актуальности и практической значимости использования современных молекулярных технологий с целью усовершенствования алгоритмов лечения больных раком желудка.
рак желудка, неоадъювантная полихимиотерапия, маркеры чувствительности.














Leave a comment