Выбор метода устранения обтурационной толстокишечной непроходимости
Калинин А.Е. 1, Калинин Е.В. 2
- 1Луганский областной клинический онкологический диспансер, Украина
- 2Луганский государственный медицинский университет
Резюме. Выбор способа устранения толстокишечной непроходимости (ТКН) является сложной задачей, иногда следует отдать предпочтение малоинвазивным методикам, а в ряде случаев выбрать радикальное оперативное вмешательство. В статье представлен опыт отечественных и зарубежных хирургов в устранении ТКН, проанализирована возможность формирования первичного анастомоза на высоте ТКН, оценена эффективность стентирования и реканализации просвета.
 Введение
Введение
По частоте встречаемости колоректальный рак занимает 4-е место среди онкологических заболеваний. Ежегодно в мире регистрируют около 800 тыс. новых случаев рака и около 440 тыс. смертей от этой болезни. Среди непосредственных причин летальности важное место занимает толстокишечная непроходимость (ТКН), которую диагностируют в 68–70% случаев [1, 2]. Хирургическое лечение больных с таким диагнозом носит дифференцированный характер и зависит от биологического возраста пациента, тяжести общего состояния, стадии опухолевого процесса и запущенности кишечной непроходимости [3].
Методы устранения кишечной непроходимости
При ТКН, вызванной опухолью правой половины ободочной кишки, принято выполнять правостороннюю гемиколэктомию с формированием первичного анастомоза. При раке левой половины толстого кишечника с проявлениями ТКН перечень оперативных вмешательств предполагает 2 варианта подходов: 1) без формирования анастомоза (двуствольная колостомия и обструктивная резекция) и 2) с формированием первичного анастомоза (резекция кишки с выведением превентивной колостомы или илеостомы; брюшно-анальная резекция прямой кишки с низведением (при раке прямой кишки); субтотальная колэктомия или колэктомия; интраоперационный лаваж или мануальная декомпрессия кишечника с первичным восстановлением непрерывности кишечника). Мнения хирургов при выборе объема и метода оперативного вмешательства у этой категории больных очень часто расходятся и являются предметом многочисленных дискуссий.
Многие исследователи, учитывая тяжесть общего состояния пациентов и угрозу возникновения серьезных осложнений после радикальных и первично-восстановительных операций, считают целесообразным выполнение 2- или 3-этапных операций. Лечение, как правило, начинают с формирования двуствольной колостомы. Спустя 2 мес после ликвидации непроходимости проводят резекцию кишки с опухолью с наложением анастомоза (2-й этап), а на 3-м этапе — закрытие колостомы [4–7]. Следует отметить, что при сравнении двух вышеописанных подходов разницы в частоте осложнений, смертности, рецидивов и опухольспецифичной выживаемости не установлено [8, 9].
Большинство хирургов отдают предпочтение выполнению обструктивных резекций (операция Гартмана), главным преимуществом которых является удаление источника непроходимости [10–12]. Так, 5-летняя выживаемость в группе больных, перенесших операции Гартмана на фоне ТКН, составила 38%, что оказалось несколько ниже, чем в группе пациентов, которым были выполнены ургентные первично-восстановительные операции (41–45%) [13].
Также следует учесть, что в любом случае формирование колостомы само по себе является травмирующим вмешательством, значительно ухудшающим качество жизни больных, а повторная операция, направленная на восстановление непрерывности кишечника, в 40–72% случаев становится практически невозможной [14, 15]. В связи с этим ряд авторов считают целесообразным при тяжелом общем состоянии пациентов, во время экстренного хирургического вмешательства, проводить одномоментное радикальное удаление опухоли с формированием У-образного анастомоза. Преимущества такой операции заключаются в следующем: во-первых, удаление новобразования и устранение кишечной непроходимости производят в один этап, во-вторых, одномоментно восстанавливается непрерывность толстой кишки; в-третьих, наложенная колостома обеспечивает профилактику несостоятельности швов анастомоза и, в-четвертых, закрытие стомы осуществляется путем внебрюшинного доступа [16]. Однако вероятность несостоятельности анастомоза все же сохраняется.
В ряде исследований, посвященных ТКН, авторы предлагают расширить объем оперативных подходов до субтотальных или тотальных колэктомий [17–19]. Основными аргументами, по их мнению, являются: улучшение качества жизни и социально-трудовой реабилитации при отсутствии колостомы, уменьшение числа осложнений и летальных случаев, а также сокращение длительности лечения по сравнению с многоэтапными операциями. Однако, по данным J.A. Torralba, летальность после колэктомии составляет не менее 9–14%, а частота послеоперационных осложнений достигает 25,5% [20, 21, 29]. Кроме этого, в 31,2% случаев отмечали развитие диареи, которая, в свою очередь (в 6,2% случаев), приводила к стойкой инвалидизации [22].
H.A. Dudley и соавторы указывают на возможность интраоперационного лаважа кишечника с первичным наложением анастомоза [22]. Процедуру осуществляют следующим образом: через илеостому, аппендикостому или назоинтестинальный тубаж вводят солевой раствор, а через трубку в дистальном отделе ободочной кишки осуществляют отток кишечного содержимого. В результате кишечник очищается от каловых масс, что создает благоприятные условия для заживления анастомоза [23–27].
Однако целый ряд авторов указывают на различную частоту послеоперационных осложнений. Так J.F. Lim, использовав вышеописанную методику у 24 пациентов, не отметил ни одного случая несостоятельности [28], а в исследованиях, проводимых Scotia, показано, что среди 44 больных, подвергшихся интраоперационному лаважу, у 2 (5%) диагностирован дефект швов анастомоза [29–31], у других исследователей этот показатель оказался выше и составил 16% [21]. Большинство хирургов все же отмечают высокую частоту несостоятельности, достигающую показателя 30,7%, а также значительный процент послеоперационных осложнений — 53,8% [32, 33].
Альтернативой вышеописанной методике может служить проведение мануальной декомпрессии кишечника. Данная процедура заключается в «сдаивании» кишечного содержимого с последующим формированием анастомоза [34].
M.H. Kam провел детальный скрининг публикаций, посвященных сравнению двух вышеописанных методик [33]. Автор показал, что у пациентов (n=110), у которых выполнено удаление опухоли с последующим интраоперационным лаважом кишечника и восстановлением непрерывности кишечной трубки, частота несостоятельности швов анастомоза составила 7% (n=8), а у пациентов (n=255), которым вместо интраоперационного лаважа применяли метод мануальной декомпрессии, — 1% (n=3). При этом 30-дневная летальность среди больных двух групп не различалась [35].
Малоинвазивные методы устранения кишечной непроходимости
На современном этапе развития хирургии, когда накоплен огромный опыт лечения ТКН и имеется большой прогресс в изучении и понимании ее патогенеза, все больше хирургов как в Украине, так и за рубежом признают необходимость проведения на высоте ТКН декомпрессии толстой кишки с использованием малоинвазивных технологий, среди которых следует выделить стентирование и эндоскопическую реканализацию просвета кишечника [21, 36, 37].
Стентирование
Скрининг публикаций, посвященных стентированию, показал, что для устранения ТКН левых отделов толстого кишечника большинство авторов используют непокрытые саморасширяющиеся стенты длинной 40–100 мм и шириной 20–22 мм (рис. 1–7), а процедуру проводят под контролем рентгеноскопии без предварительной дилатации просвета. Спустя 5–20 дней (максимум в течение 4 нед) после установки стента выполняются плановые оперативные вмешательства [38–42]. В приведенном ниже обзоре публикаций даны оценка эффективности этого методического подхода для устранения ТКН, частота возможных осложнений, данные по 30-дневной летальности, информация о количестве выполненных одноэтапных оперативных вмешательств, а также сведения о ближайшей и отдаленной выживаемости.

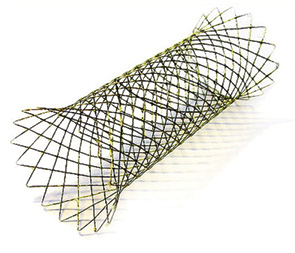





Во многоцентровое рандомизированное исследование, проведенное в Нидерландах (ISRCTN46462267), включены 98 больных с опухолью левых отделов толстого кишечника (от селезеночного угла до верхнеампулярного отдела прямой кишки) и явлениями острой кишечной непроходимости. У 47 из них были установлены стенты и в дальнейшем выполнена плановая операция, а 51 — проводилось ургентное оперативное вмешательство. При анализе результатов лечения не выявлено различий ни в частоте осложнений, ни в смертности между двумя группами пациентов, отмечено также, что количество стомированных больных значительно меньше в группе стентирования (23:38). В ходе лечения диагностированы следующие осложнения: абсцесс брюшной полости — 3 случая в группе стентирования и 4 — в группе с неотложными операциями; перфорация опухоли, соответственно 6:0; несостоятельность швов анастомоза 5:1; пневмония 3:1 и раневая инфекция 1:3 соответственно. В результате проведенного исследования установлено, что стентирование может служить альтернативой ургентной операции, однако не имеет ярко выраженных преимуществ перед последней [43].
Так, A.L. Knight и соавторы провели сравнительный анализ двух групп пациентов, в которых у больных первой группы (n=15) в предоперационный период установлены саморасширяющиеся стенты, а пациентам второй (n=88) выполнены плановые операции. Продемонстрировано, что 30-дневная летальность в группе стентирования составила 6,7%, а в группе планово оперированных больных — 5,7%, при этом 5-летняя выживаемость в группах составила 60 и 58% соответственно, что, по мнению авторов, указывает на то, что стентирование не ухудшает прогноз заболевания [44].
Однако I.A. Pirlet и соавторы в своих исследованиях указывают на высокую частоту случаев неудачной установки стента, а именно — 53,3%, и перфорации опухоли — 6,7% [45]. A. Mainar в своей публикации приводит данные о 72 пациентах, у которых на предоперационном этапе установлены непокрытые стенты [46]. Автор отмечает, что процедура стентирования в 90% случаях проведена успешно, тем не менее послеоперационные осложнения, такие как кровотечения, возникшие при доставке стента (n=5), выраженный болевой синдром (n=2), перитонит, связанный с перфорацией опухоли (n=1), или бессимптомная перфорация, выявленная при плановом оперативном вмешательстве (n=2), отмечены у 10 пациентов (14%). Первичный анастомоз был наложен 65 больным, то есть в 90,3% случаев.
F. Camunez изучал вопрос об эффективности процедуры стентирования у 80 больных с опухолью нисходящей ободочной, сигмовидной кишки и ректосигмоидного отдела толстого кишечника [47]. Автором отмечены успешноcть процедуры и устранение кишечной непроходимости у 87,5 и 84% больных соответственно. Перфорация опухоли во время доставки проводника протекала бессимптомно и была выявлена у 2 (2,5%) пациентов, процедура стентирования была продолжена, а затем — выполнена плановая операция. У 2 (2,5%) больных диагностирована перфорация с развитием перитонита. Общая летальность, по данным автора, составила 0,8%. После проведения дообследования 33 пациентам было предложено радикальное оперативное вмешательство, у 24 из них произведена левосторонняя гемиколэктомия, у 8 — выполнена низкая передняя резекция, а у 1 больного — колостомия в связи с выявленным во время операции канцероматозом.
M. Alcántara и соавторы провели рандомизированное исследование для оценки эффективности устранения кишечной непроходимости методом стентирования и оперативным способом на примере 28 пациентов с левосторонней локализацией опухоли толстого кишечника и кишечной непроходимостью. У больных основной группы (n=15) были установлены стенты на высоте непроходимости и проведено последующее одноэтапное оперативное вмешательство. У пациентов контрольной группы (n=13) — интраоперационно выполнен лаваж толстого кишечника и наложен первичный анастомоз. Частота осложнений составила 13,3 и 53,8% соответственно. В основной группе несостоятельности швов не выявлено, в то же время в контрольной такое осложнение диагностировано в 30,7% случаев. Отдаленную выживаемость оценивали в течение 37,6 мес, различий в двух группах не отмечено [41].
Определенный интерес представляют результаты исследования H.I. Cheung и соавторов, полученные авторами при изучении двух групп больных, у которых (n=48) опухоль располагалась от селезеночного угла до ректосигмоидного отдела толстой кишки и отмечались явления ТКН [48]. 24 пациентам основной группы установлены стенты и выполнено радикальное лапароскопическое оперативное вмешательство, а 24 больным контрольной произведена открытая ургентная операция. Авторы отмечают, что частота несостоятельности швов анастомоза, случаев раневой инфекции, кровопотери и болевого синдрома в первой группе больных была значительно ниже. При этом одноэтапные операции без выведения превентивной стомы выполнены у 16 пациентов основной группы (66,7%) и 9 (37,5%) больных контрольной, кроме этого, у 6 (25%) больных сформирован анастомоз и наложена превентивная стома.
Y. Saida и соавторы изучали ближайшие и отдаленные последствия лечения 44 пациентов с установленными на высоте кишечной непроходимости стентами, у 40 из которых выполнены ургентные операции (n=40) [49–51]. Авторами отмечено, что частота осложнений была значительно ниже в группе стентирования, так, например, хирургическая инфекция зафиксирована в 2 и 14% случаев, соответственно, несостоятельность анастомоза — 3 и 11% и 3-летняя выживаемость — 48 и 50% соответственно. При этом 5-летняя выживаемость в первой группе составила 40%, а среди пациентов второй группы — 44%.
Все результаты вышерассмотренных исследований представлены в итоговой таблице.
Таблица Стентирование в устранении обтурационной кишечной непроходимости
| Авторы | Сравниваемые операции | В 1-й группе установлены стенты; 2-й выполнена операция | Локализация опухоли | Успешность установки стента, % | Эффективность | Летальность |
| M. Alcántara(рандомизированное исследование) | Стентирование и открытая операция (лаваж кишечника и первичный анастомоз) | 15:13 | Левая половина толстого кишечника | – | Значительное уменьшение количества осложнений в группе стентирования (13,3%:53,8%), несостоятельности швов анастомоза (0:30,7%) | Летальность в обеих группах одинаковая |
| H.Y. Cheung(рандомизированное исследование) | Стентирование с последующей лапароскопической операцией и открытая ургентная операция | 24:24 | От селезеночного угла до ректосигмоидного отдела | 83 | Частота одноэтапных операций — 66,7% (n=16), постоянная колостома выведена в 33,3% (n=8), превентивная – 0%. В контрольной группе: первично-восстановительные операции выполнены в 37% (n=9), колостома выведена 62,5% (n=15), включая превентивную стому 25% (n=6). Частота осложнений значительно ниже в группе стентирования | – |
| A.L. Knight(ретроспективная оценка выживаемости) | Стентирование и открытая плановая операция | 15:88 | Левая половина толстого кишечника | – | – | 30-дневная и 5-летняя выживаемость одинаковая |
| J.E. van Hooft и соавторы (рандомизированное многоцентровое исследование) | Стентирование и открытая ургентная операция | 47:51 | Нисходящая ободочная, сигмовидная кишка, ректосигмоидный отдел, верхнеампулярный отдел прямой кишки | 70,2 | В группе стентирования количество стомированных больных было значительно ниже, однако повысилась частота осложнений, связанных со стомой | Летальность не изменилась, однако исследование прекращено в связи с высокой частотой 30-дневной смертности |
| A. Mainar и соавторы (мультицентровое исследование) |
Стентирование и открытая ургентная операция | 72 | Нисходящая ободочная, сигмовидная кишка, ректосигмиодный отдел | 90 | 14% осложнений: 1,4% перфорация и перитонит, 2,8% бессимптомная перфорация, первичный анастомоз наложен у 90,3% больных | – |
| Pirlet и соавторы (рандомизированное многоцентровое исследование) | Стентирование и открытая ургентная операция | 30:30 | От селезеночного угла до ректосигмоидного отдела | 53,3 | – | Исследование прекращено в связи с высокой частотой неудачной установки стентов |
| F. Camunez и соавторы (ретроспективная оценка эффективности стентирования) | Стентирование | 80 | Нисходящая сигмовидная, ректосигмоидный отдел | 87,5 | Частота осложнений: 2,5% — бессимптомная перфорация с развитием перитонита, летальность — 1,25%. После дообследования 30 больным предложено радикальное оперативное вмешательсво. У 29 пациентов выполнена операция без выведения колостомы | – |
| Y. Saida | Стентирование и открытая ургентная операция | 44:40 | – | 88 | Частота осложнений была значительно ниже в группе стентирования: раневая инфекция — 2% против 14%; несостоятельность — 3% против 11% | 3-летняя и 5-летняя выживаемость одинаковая |
Эндоскопическая реканализация просвета кишечника
Ряд авторов в своих работах указывают на возможность проведения эндоскопической реканализации обтурирующих опухолей методами лазерной и электрокоагуляции, а также фотодеструкции (рис. 8, 9) [41].

Однако Ю.В. Синева и соавторы считают, что проведение такого рода лечебных процедур у больных с непроходимостью является весьма сложной задачей. Стенозирование опухолью просвета до 0,2–0,3 см препятствует проведению зонда для декомпрессии выше места обтурации, а форсированное проведение этих манипуляций без четкого представления о протяженности опухолевого поражения кишки авторы считают нецелесообразным ввиду опасных осложнений [10].
А.М. Беляев и соавторы описывают следующий метод реканализации просвета прямой кишки с использованием электрода, крючка для лапароскопических операций, щипцов для горячей биопсии и петли для полипэктомии. С помощью этого инструментария опухолевый канал расширяют до 1 см, при этом успешность процедуры отмечена в 21 случае из 32 [52]. У 90,5% больных выполнены первично-восстановительные операции, при этом несостоятельности анастомоза не выявлено. Послеоперационной летальности не было.
А.В. Шелехов и соавторы предложили проводить эндоскопическую реканализацию просвета методом монополярной диатермокоагуляции, формируя канал с помощью цапки на всем протяжении стенозированного участка. Дальнейшее восстановление просвета сочетали с применением лазерной фотодеструкции, чередуя сеансы реканализации с 48-часовой паузой. Автор указывает на возможность реканализации с использованием колоноскопа и установкой временного стента в виде интубационной трубки № 10 диаметром 13,6 мм («Portex», Великобритания). Данный подход позволил уменьшить количество обструктивных резекций с 72,5 до 22,8%, при этом 5-летняя выживаемость больных со II стадией заболевания в основной группе составила 71,7%, а в контрольной — 50,2% [53].
Для тех случаев, когда отсутствует возможность визуального контроля за просветом кишки, нами разработана следующая методика: под контролем рентгеноскопии за опухоль заводят J-образный проводник 7–9Fr и выполняют бужирование с последующей реканализацией просвета. Процедура дополняется энтеро- и колоносорбцией высокоемкими сорбентами (полиметилсилоксан или карболайн).
Данная методика позволяет: 1) быстро устранить симптоматику кишечной недостаточности; 2) осуществить в предоперационный период полноценную химиолучевую терапию; 3) облегчить проведение первично-восстановительной операции и течение послеоперационного периода; 4) добиться явного улучшения качества жизни больных без ухудшения прогноза основного заболевания (в группе исследования первично-восстановительные операции выполнены у 74,6% больных, оперативное вмешательство с выведением превентивной колостомы и формированием первичного анастомоза — у 14,8%); 5) применение энтеро- и колоносорбции высокоемкими сорбентами на ряду с декомпрессией кишечника дает возможность начать химиолучевую терапию уже с 5–6-х суток после устранения обтурации просвета, а также значительно снизить частоту осложнений химиолучевого лечения [54].
Выводы
- При выполнении радикальной операции на высоте ТКН необходимо отдавать предпочтение первично-восстановительным вмешательствам, однако следует учесть, что частота послеоперационных осложнений будет выше в сравнении с плановыми операциями.
- Стентирование и эндоскопическая реканализация просвета кишечника являются эффективными методами устранения ТКН, позволяющими увеличить количество первично-восстановительных вмешательств без ухудшения прогноза основного заболевания.
Список использованной литературы
1. Барсуков Ю., Ковалевский Е. (2006) Диагностика и лечение колоректального рака. Врач, 13: 64–65.
2. Информация по заболеваемости колоректальным раком в мире: [Электронный ресурс] Международная организации по исследованию рака. URL:http://globocan.iarc.fr/factsheet.asp#BOTH.(Дата обращения: 03.09.2012).
3. Tekkis P.P., Kinsman R., Thompson M.R., Stamatakis J.D. (1998) The Association of Coloproctology of Great Britain and Ireland study of large bowel obstruction caused by colorectal cancer. Ann. Surg., 204: 76–81.
4. Севастьянов С.И., Кашников В.Н., Рибаков Е.Г., Чернишов С.В. (2005) Показания и выбор вида превентивной стомы при плановых хирургических вмешательствах по поводу рака прямой кишки. Колопроктология, 3(13): 33–38.
5. Федоров В.Д. (1987) Рак прямой кишки. Медицина, Москва, 318 с.
6. Федоров В.Д., Воробьев Г.И., Ривкин В.Л. (1994) В кн..: В.Д.Федорова (ред.) Клиническая оперативная колопроткология: Руководство для врачей. ГНЦ колопроткологии, Москва: 35–38.
7. Чернышов С.В. (2005) Выбор вида превентивной стомы как метода отключения дистальных отделов толстой кишки при хирургических вмешательствах по поводу рака прямой кишки в плановом порядке. В кн..: Современные методы диагностики и лечения заболеваний в клинике и эксперименте. Материалы науч. конф. молодых ученых, 13–14 октября 2005 г., Москва: 164–168.
8. De Salvo G.L., Gava C., Lise M., Pucciarelli S. (2004) Curative surgery for obstruction from primary left colorectal carcinoma: Primary or staged resection? Cochrane Database Syst. Rev., 2: CD002101.
9. Fielding L.P., Stewart-Brown S., Blesovsky L. (1979) Large bowel obstruction caused by cancer: a prospective study. BMJ, 2: 517–519.
10. Алиев С.А. (1998) Альтернативные подходы к хирургическому лечению осложненных форм рака ободочной кишки. Хирургия. Журнал им. Н.И. Пирогова, 8: 58–67.
11. Алиев С.А. (1998) Пути улучшения результатов хирургического лечения непроходимости ободочной кишки опухолевого генеза. Вестн. хирургии, 6(157): 34–39.
12. Kronborg O. (1995) Acute obstruction from tumour in the left colon without spread. A randomised trial of emergency colostomy versus resection. Int. J. Colorectal. Dis., 10: 1–5.
13. Villar J.M., Martinez A.P., Villegas M.T. et al. (2005) Surgical options for malignant left-sided colonic obstruction. Surg. Today, 35: 275–281.
14. Амелин В.М.,Кутин А.А., Гарунов А.Н. (1998) Хирургическая тактика при обтурационной толстокишечной непроходимости. Рос. мед. журн., 6(42): 34–36.
15. Воробей А.В., Зайцев В.Ф., Жидков С.А, Беляев Н.Ф. (2005) Колоректальный рак. Минск, 98 с.
16. Малахов Ю.П., Брюсов ИГ. (2003) Возможности У-образного анастомоза при хирургическом лечении толстокишечной непроходимости опухолевого генеза. Материалы Всерос. науч.-практ. конф., 2003 г., Пермь: 62–64.
17. Пахомова Г.А. (2000) В кн.: О.И.Головко (ред.) Субтотальная колэктомия в лечение обтурационной непроходимости ободочной кишки. Проблемы колопроктологии: сб. науч. трудов. Видар, Москва: 376–380.
18. Information about Guidelines of National Comprehensive Cancer Network: [Electronic resource] National Comprehensive Cancer Network. URL: http://www.nccn.org/professionals/physician_gls/f_
guidelines.asp#rectal. (Date of use: 15.03.2013).
19. The Scotia Study Group Single-stage treatment for malignant left-sided colonic obstruction: a prospective randomized clinical trial comparing subtotal colectomy with segmental resetion following intraoperative irrigation. (1995) Dr. J. Surg., 82: 1622–27.
20. Omejc M., Stor Z., Jelenc F., Repse S. (1998) Outcome after emergency subtotal/total colectomy compared to elective resection in patients with left-sided colorectal carcinoma. Int. Surg., 3(83): 241–244.
21. Torralba J.A., Robles R., Parrilla P. et al. (1998) Subtotal colectomy vs. intraoperative colonic irrigation in the management of obstructed left colon carcinoma. Dis. Colon. Rect., 1(41): 18–32.
22. Алекперов С.Ф., Пугаев А.В., Ачкасов Е.Е. и др. (2010) Современные тенденции в хирургическом лечении обтурационной толстокишечной непроходимости опухолевого генеза. Рос. онкол. журн., 1: 54–56.
23. Dudley H.A., Radcliffe A.G., McGeehan D. (1980) Intraoperative irrigation of the colon to permit primary anastomosis. Br. J. Surg., 67: 80–81.
24. Horiuchi A., Nakayama Y., Kajiyama M. et al. (2012) Endoscopic decompression of benign large bowel obstruction using a transanal drainage tube. Colorectal Dis., 14(5): 623–627.
25. Gainant A. (2012) Emergency management of acute colonic cancer obstruction. J. Visc. Surg., 149(1): 3–10.
26. Pan C.Q., Zhou W.M., Yu B.X. et al. (2010) Application of intraoperative colon irrigation in primary resection and anastomosis of left colorectal cancer with intestinal obstruction. Nan Fang Yi Ke Da Xue Xue Bao, 30(3): 605–607.
27. Sule A.Z., Ajibade A. (2011) Adult large bowel obstruction: a review of clinical experience. Ann. Afr. Med., 10(1): 45–50.
28. Lim J.F., Tang C.L., Seow-Choen F., Heah S.M. (2005) Prospective, randomized trial comparing intraoperative colonic irrigation with manual decompression only for obstructed left-sided colorectal cancer. Dis. Colon. Rectum, 48: 205–209.
29. Lau P.W.K., Lo C.Y., Law W.L. (1995) The role of one-stage surgery in acute left-sided colonic obstruction. Am. J. Surg., 169: 406–409.
30. Sasaki K., Kazama S., Sunami E. et al. (2012) One-stage segmental colectomy and primary anastomosis after intraoperative colonic irrigation and total colonoscopy for patients with obstruction due to left-sided colorectal cancer. Dis. Colon. Rectum., 55(1): 72–78.
31. Ortiz H., Biondo S., Ciga M.A. еt al. (2009) Comparative study to determine the need for intraoperative colonic irrigation for primary anastomosis in left-sided colonic emergencies. Colorectal Dis, 11(6): 648–652.
32. Лузин В.В. (2001) Сборник работ по применению препарата «Энтеросгель» в медицине. Часть 2. Абдоминальная хирургия, Онкология, 71 с.
33. Топузов Э.Г., Шишкина Г.А., Кокая А.А. (2000). В кн.: А.В. Шаброва, Э.Г. Топузова, Ю.В. Плотникова (ред.). Применение интраоперационного толстокишечного сорбционного диализа при раке толстой кишки, осложненном толстокишечной непроходимостью. Преемственность в решении актуальных вопросов хирургии: сб. науч. тр., посвященный 100-летию проф. П.Н. Напалкова. СПбГМА им. И.И. Мечникова, СПб: 112–113.
34. Ansaloni L., Andersson R.E., Bazzoli F. et al (2010) Guidelenines in the management of obstructing cancer of the left colon: consensus conference of the world society of emergency surgery (WSES) and peritoneum and surgery (PnS) society. World J Emerg Surg., 28: 5–29.
35. Kam M.H., Tang C.L., Chan E. et al. (2009) Systematic review of intraoperative colonic irrigation vs. Manual decompression in obstructed left-sided colorectal emergencies. Int. J. Colorectal. Dis., 24: 1031–37.Watt A.M., Faragher I.G., Griffin T.T. et al. (2007) Self-expanding metallic stents for relieving malignant colorectal obstruction: a systematic review. Ann. Surg., 246: 24–30.
36. Watt A.M., Faragher I.G., Griffin T.T. et al. (2007) Self-expanding metallic stents for relieving malignant colorectal obstruction: a systematic review. Ann. Surg., 246: 24–30.
37. Tung K.L., Cheung H.Y., Ng L.W. et al. (2013) Endo-laparoscopic approach versus conventional open surgery in the treatment of obstructing left-sided colon cancer: Long-term follow-up of a randomized trial. Asian J. Endosc. Surg., 6(2): 78–81.
38. Selinger C.P., Ramesh J., Martin D.F. (2011) Long-term success of colonic stent insertion is influenced by indication but not by length of stent or site of obstruction. Int. J. Colorectal. Dis., 26(2): 215–218.
39. Gross K.N., Francescatti A.B., Brand M.I., Saclarides T.J. (2012) Surgery after colonic stenting. Am. Surg., 78(6): 722–727.
40. Branche J., Attar A., Vernier-Massouille G. et al. (2012) Extractible self-expandable metal stent in the treatment of Crohn’s disease anastomotic strictures. Endoscopy, 44 (Suppl. 2): 325–326.
41. Alcántara M., Serra-Aracil X., Falcó J. et al. (2011) Prospective, controlled, randomized study of intraoperative colonic lavage versus stent placement in obstructive left-sided colonic cancer. World J. Surg., 35: 1904–10.
42. Tan C.J., Dasari B.V., Gardiner K. (2012) Systematic review and meta-analysis of randomized clinical trials of self-expanding metallic stents as a bridge to surgery versus emergency surgery for malignant left-sided large bowel obstruction. British J. Surg., 99(4): 469–476.
43. van Hooft J.E., Bemelman W.A., Oldenburg B. et al. (2011) Colonic stenting versus emergency surgery for acute left-sided malignant colonic obstruction: a multicentre randomised trial. Lancet Oncol., 12: 344–352.
44. Knight A.L., Trompetas V., Saunders M.P., Anderson H.J. (2012) Does stenting of left-sided colorectal cancer as a «bridge to surgery» adversely affect oncological outcomes? A comparison with non-obstructing elective left-sided colonic resections. Int J. Colorectal. Dis., 27(11): 1509–14.
45. Pirlet I.A., Slim K., Kwiatkowski F. et al. (2011) Emergency preoperative stenting versus surgery for acute left-sided malignant colonic obstruction: a multicentre randomized controlled trial. Surg. Endosc., 25: 1814–21.
46. Mainar A., De Gregorio Ariza M.A., Tejero E. et al. (1999) Acute colorectal obstruction: treatment with self-expandable metallic stents before scheduled surgery — results of a multicenter study. Radiology, 210(1): 65–69.
47. Camúñez F., Echenagusia A., Simó G. et al. (2000) Malignant Colorectal Obstruction Treated by Means of Self-expanding Metallic Stents: Effectiveness before Surgery and in Palliation. Radiology, 216: 492–497.
48. Cheung H.Y., Chung C.C., Tsang W.W. et al. (2009) Endolaparoscopic approach vs conventional open surgery in the treatment of obstructing left-sided colon cancer: a randomized controlled trial. Arch. Surg., 144: 1127–32.
49. Saida Y., Sumiyama Y., Nagao J., Takase M. (1996) Stent endoprosthesis for obstructing colorectal cancers. Dis. Colon. Rectum, 39: 552–555.
50. Bonfante P., D’Ambra L., Berti S. et al. (2012) Managing acute colorectal obstruction by «bridge stenting» to laparoscopic surgery: Our experience. World J. Gastrointest. Surg., 4(12): 289–295.
51. Kulu Y., Ulrich A., Bruckner T. et al. (2013) Validation of the international study group of rectal cancer definition and severity grading of anastomotic leackage. Surgery, 6(153): 753–761.
52. Беляев A.M., Захаренко A.A., Дворецкий С.Ю. (2011) Тактика лечения больных раком левого фланга ободочной кишки, осложненного непроходимостью. Клиническая медицина. Хирургия. Онкология, 12: 610–619.
53. Расулов Р.И., Дворниченко В.В, Шелехов А.В. (2008) Лечение осложненного рака прямой кишки. Наука, Новосибирск, 153 с.
54. Антипова С.В., Калинин А.Е., Кононов В.Н. и др. (2010) Эндоскопическая реканализация просвета прямой кишки, осложненного кишечной непроходимость. Український медичний альманах, 15(13): 22–24.
Вибір методу усунення товстокишкової непрохідності
Резюме. Вибір способу усунення товстокишкової непрохідності (ТКН) є складним завданням, іноді слід віддати перевагу малоінвазивним методиками, а в ряді випадків вибрати радикальне оперативне втручання. У статті представлено досвід вітчизняних і зарубіжних хірургів в усуненні ТКН, проаналізовано можливість формування первинного анастомозу на висоті ТКН, оцінено ефективність стентування і реканалізації просвіту.
Ключевые слова: обтураційна товстокишкова непрохідність, стентування, реканалізація, колоректальний рак, інтраопераційний лаваж, декомпресія кишечнику.
Method selection of the treatment of large bowel obstruction
Summary. Method selection of the treatment of large bowel obstruction (LBO) is a difficult problem, sometimes should be preferred a minimally invasive techniques, and in some cases should be chosen radical surgery. We have studied the experience of domestic and foreign surgeons in treating of LBO, analyzed the possibility to forming primary anastomosis to patients with LBO, evaluated the efficacy of stenting and recanalization of the lumen.
Key words: large bowel obstruction, stent, recanalization of lumen, colorectal cancer, intraoperative irrigation, intestinal decompression.














Leave a comment