Гіперпластичні процеси ендометрія у хворих зі злоякісними пухлинами яєчника
Ткаля Ю.Г., Воробьева Л.И., Свинцицкий В.С., Цип Н.П., Турчак А.В., Неспрядько С.В., Гончарук И.В., Самохвалова А.А.
Резюме. У статті продемонстровано результати аналізу частоти гіперпластичних процесів ендометрія у хворих зі злоякісними пухлинами яєчника різного гістогенезу всіх вікових періодів. Оцінено морфологічну структуру супутніх гіперпластичних процесів ендометрія у пацієнтів із раком яєчника. Вивчено виживаність хворих на рак яєчника із супутньою комплексною неатиповою гіперплазією ендометрія залежно від віку жінок.
Резюме. В статье продемонстрированы результаты анализа частоты гиперпластических процессов эндометрия у больных со злокачественными опухолями яичника разного гистогенеза всех возрастных периодов. Оценена морфологическая структура сопутствующих гиперпластических процессов эндометрия у пациенток с раком яичника. Изучена выживаемость больных раком яичника с сопутствующей комплексной неатипической гиперплазией эндометрия в зависимости от возраста женщин.
 ВВЕДЕНИЕ
ВВЕДЕНИЕ
Неудачи ранней диагностики и высокая смертность больных со злокачественными опухолями яичника (ЗОЯ) связаны с отсутствием научно обоснованного представления о концепции этиопатогенеза. Однако к настоящему времени накоплено значительное количество экспериментальных, эпидемиологических и клинических фактов, которые демонстрируют, что ведущая роль в общей гипотезе патогенеза ЗОЯ принадлежит взаимодействию сложных механизмов эндокринно-обменных и молекулярно-генетических нарушений [1–8].
Особенностью ЗОЯ различного морфологического строения является их нередкое сочетание с патологией эндометрия: по данным литературы, у каждой 2-й пациентки диагностируют ту или иную внутриматочную патологию. Изменения эндометрия, с одной стороны, могут быть вторичным процессом, с другой — результатом влияния общих факторов риска и звеньев патогенеза [9–12].
Факторы риска ЗОЯ включают раннее менархе (до 11 лет); позднюю менопаузу (после 55 лет); отсутствие родов; бесплодие с сохраненной овуляцией; эндокринное бесплодие, сопровождающееся гиперандрогенией; длительный прием препаратов, стимулирующих овуляцию; хроническое воспаление придатков матки [6, 8, 13, 14]. По результатам многих исследований, риск возникновения рака яичника (РЯ) связан также с ожирением, особенно у женщин в раннем репродуктивном периоде и перименопаузе, при этом течение заболевания у пациенток с высоким индексом массы тела имеет более агрессивный характер [15–17].
Аналогичные факторы риска, согласно эстрогенной концепции патогенеза патологических процессов матки, установлены для различных пролиферативных состояний эндометрия. К ним также относят отсутствие родов; позднюю менопаузу; эндокринное бесплодие с частыми ановуляторными циклами; ожирение, при котором отмечается усиленный синтез внегонадных эстрогенов, инсулинорезистентность/гиперинсулинемия; поликистоз/склерокистоз яичников, для которых характерно избыточное образование андростендиона. Все вышеперечисленные факторы лежат в основе развития I патогенетического варианта различных гиперпластических процессов эндометрия (ГПЭ), включая эндометриоидную карциному, частота которых составляет 70% [9, 18].
Как видно из вышеприведенного, в патогенезе опухолей яичника и эндометрия лежат общие факторы, среди которых кардинальная роль отводится гормональным. Их значение было представлено еще в «овуляторной» гипотезе M.F. Fathalla (1971), постулирующей, что риск развития РЯ находится в прямой зависимости от числа овуляторных циклов на протяжении жизни женщины [19]. В многочисленных эпидемиологических исследованиях отмечено, что беременность снижает риск возникновения РЯ, а большое количество беременностей, закончившихся родами, обладает мощным протективным действием [20]. И наоборот, бесплодие повышает риск развития РЯ, а препараты, стимулирующие овуляцию в течение >12 менструальных циклов, увеличивают этот риск в 2–3 раза [21, 22]. В то же время применение комбинированных оральных контрацептивов снижает риск возникновения РЯ [23]. В рандомизированном исследовании, проводившемся под эгидой ВОЗ, относительный риск развития РЯ у женщин, когда-либо принимавших оральные контрацептивы, составил 0,75% [4, 7]. Отмечено, что риск развития РЯ у пациенток с мутацией в генах BRCA1/2 снижается на 14% при приеме оральных контрацептивов и на 38% — у женщин, длительно принимавших указанные препараты [24].
На сегодня доказана взаимосвязь между особенностями метаболизма эстрогенов, а также неклассических фенолстероидов, образующихся путем конверсии андрогенов, и риском возникновения гормонозависимых опухолей, в частности рака грудной железы (РГЖ) и рака эндометрия (РЭ) [18].
К факторам прогноза клинического течения ЗОЯ относят стадию опухолевого процесса, гистологическую структуру опухоли, степень ее дифференцировки, объем остаточных опухолей при циторедуктивных операциях [1, 25, 26]. Роль гормональных факторов в клиническом течении ЗОЯ остается недостаточно исследованной.
Цель исследования — изучить частоту сопутствующих ГПЭ у больных со ЗОЯ и определить их клиническое значение.
Объект и методы исследования
Материалом исследования служили результаты ретроспективного анализа историй болезни 303 больных со ЗОЯ I–IV стадии, которые находились на стационарном лечении в отделении онкогинекологии Национального института рака в период 2001–2009 гг. Всем больным проведено лечение по радикальной программе: хирургическое, комбинированное и комплексное (согласно стандартам диагностики и лечения онкологических больных, утвержденным Приказами МЗ Украины от 27.07.1998 г. № 226 и от 17.09.2007 г. № 554). Комбинированное лечение заключалось в проведении циторедуктивной операции с последующей химиотерапией в адъювантном режиме или в комбинации с неоадъювантной химиотерапией. Комплексное лечение включало оперативное вмешательство, химиотерапию и лучевое лечение.
Анализ результатов исследования проводили в зависимости от возрастных периодов женщин. Согласно классификации ВОЗ (1980) выделили репродуктивный период (≤45 лет), перименопаузу (46–55 лет), раннюю постменопаузу (56–60 лет) и позднюю постменопаузу (≥61 год). Особое внимание обращали на особенности менструальной и репродуктивной функции больных. Клинический диагноз верифицировали с помощью морфологического исследования операционного материала пациенток согласно гистологической классификации опухолей яичника ВОЗ (2002), стадию опухолевого процесса оценивали по международной классификации FIGO (2009). Сопутствующие ГПЭ характеризовали, используя международную гистологическую классификацию ГПЭ ВОЗ (1994). Клиническое течение заболевания, частоту рецидивов анализировали для каждого возрастного периода больных.
Статистическую обработку результатов исследования проводили методами параметрической статистики, включая t-критерий Стьюдента, корреляционный анализ с помощью парных корреляций Пирсона. Показатели выживаемости больных оценивали по методу Каплана — Мейера, для парных сравнений применяли log-rank критерий. Статистически достоверными считали данные при р<0,05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Анализ историй болезни показал, что возраст больных со ЗОЯ разного генеза колебался от 16 до 82 лет, составляя в среднем 51,3±0,8 года. Отмечено 3 возрастных пика заболевания в интервале 40–69 лет, при этом наибольшее количество пациенток было в возрасте 50–59 лет (рис. 1). При распределении больных по возрастным группам установлено, что их количество в репродуктивном, перименопаузальном и позднем постменопаузальном периодах было одинаковым (27,1–29,7%) и только в ранней постменопаузе — в 2 раза меньшим (14,8%) (табл. 1). Общее число пациенток постменопаузального периода было наибольшим и составило 41,9%, что согласуется с данными литературы [4, 7].
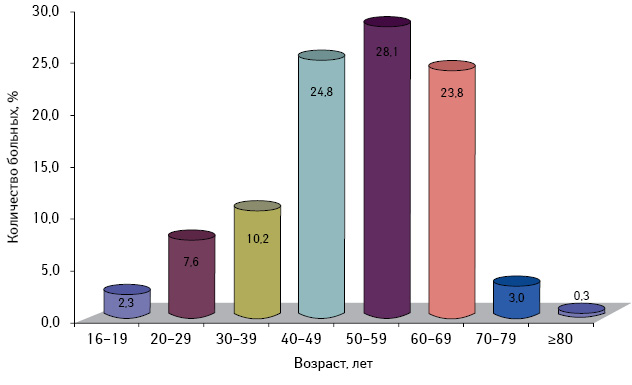
Таблица 1. Распределение больных со ЗОЯ по возрастным периодам
| Возрастной период, лет | Количество больных |
Средний возраст, колебания, лет |
|
| n | % | ||
| Репродуктивный (16–45) | 90 | 29,7 | 34,4±0,9/16–45 |
| Перименопауза (46–55) | 86 | 28,4 | 50,5±0,3/46–55 |
| Постменопауза (≥56) | 127 | 41,9 | 62,5±0,3/56–82 |
|
45 | 14,8 | 57,9±0,2/56–60 |
|
82 | 27,1 | 67,0±0,4/61–82 |
| Всего | 303 | 100,0 | 51,3±0,8/16–82 |
По данным морфологического исследования операционного материала выявлены сопутствующие ГПЭ у 178 из 303 больных, что послужило основанием для разделения всех пациенток со ЗОЯ на 2 группы: группа I — 178 (58,7%) женщин с сопутствующими ГПЭ, группа II — 125 (41,3%) больных без ГПЭ. Клиническая характеристика больных и гистологическая форма ЗОЯ представлены в табл. 2, согласно данным которой в I группе отмечена тенденция к увеличению количества больных в репродуктивном, перименопаузальном периодах, тогда как во II группе — относительного количества пациенток в постменопаузе (особенно в позднем постменопаузальном периоде).
Таблица 2. Клиническая характеристика больных со ЗОЯ I–IV стадии с сопутствующими ГПЭ (I группа) и без них (II группа)
| Показатель | Группа I | Группа II | ||
| n | % | n | % | |
| Количество больных (n=303) | 178 | 100,0 | 125 | 100,0 |
| Репродуктивный период | 63 | 35,4 | 27 | 21,6 |
| Перименопауза | 54 | 30,3 | 32 | 25,6 |
| Постменопауза | 61 | 34,3 | 66 | 52,8 |
|
16 | 9,0 | 29 | 23,2 |
|
45 | 25,3 | 37 | 29,6 |
| Менструальный статус (M±m/колебания) | ||||
| Возраст наступления менархе, лет | 13,6±0,1/11–19 | 13,8±0,1/11–20 | ||
| Менструальный цикл, дней | 27,9±0,1/18–36 | 28,1±0,1/20–30 | ||
| Длительность менструаций, дней | 5,1±0,1/2–14 | 4,8±0,08/3–7 | ||
| Репродуктивный потенциал на 1 больную (M±m/колебания) | ||||
| Роды | 1,4±0,07/0–5 | 1,6±0,1/0–6 | ||
| Аборт | 1,5±0,15/0–10 | 1,6±0,2/0–8 | ||
| Выкидыш | 0 | 0,1±0,1/0–4 | ||
| Гистологический диагноз | ||||
| РЯ (n=268) | 152 | 85,4 | 116 | 92,8 |
|
136 | 76,4 | 96 | 76,8 |
|
11 | 6,2 | 14 | 11,2 |
|
3 | 1,7 | 3 | 2,4 |
|
0 | 0,0 | 3 | 2,4 |
|
2 | 1,1 | 0 | 0,0 |
| Злокачественные опухоли стромы полового тяжа (ОСПТ) (n=27) | 20 | 11,2 | 7 | 5,6 |
|
13 | 7,3 | 6 | 4,8 |
|
6 | 3,3 | 0 | 0,0 |
|
1 | 0,6 | 1 | 0,8 |
| Герминогенные ЗОЯ (n=8) | 6 | 3,4 | 2 | 1,6 |
| Стадия заболевания | ||||
|
35 | 19,7 | 10 | 8,0 |
|
14 | 7,9 | 7 | 5,6 |
|
122 | 68,5 | 100 | 80,0 |
|
7 | 3,9 | 8 | 6,4 |
| Рецидивы (n=177/100%) | ||||
| Репродуктивный период | 14 | 7,9 | 25 | 14,1 |
| Перименопауза | 27 | 15,3 | 34 | 19,2 |
| Постменопауза | 32 | 18,1 | 45 | 25,4 |
|
11 | 6,2 | 17 | 9,6 |
|
21 | 11,9 | 28 | 15,8 |
| Всего (n=177) | 73 | 41,3 | 104 | 58,7 |
Данные по менструальному статусу больных были сопоставимыми и соответствовали физиологическим нормам, репродуктивный потенциал был низким в обеих группах, что не противоречит «овуляторной» гипотезе M.F. Fathalla [19].
Анализ распространения ЗОЯ показал, что в обеих группах преобладали пациентки с III стадией заболевания, соответственно 68,5 и 80,0%. Ранние стадии опухолевого процесса отмечены в 2 раза чаще у больных I группы.
Наиболее часто выявляли опухоли эпителиального генеза — 268 (88,4%), из них 152 (85,4%) — у больных I группы и 116 (92,8%) — у пациенток II группы. Среди них преобладал серозный рак — 76,4 и 76,8% соответственно (см. табл. 2).
Опухоли неэпителиального генеза (ОСПТ и герминогенные) в 2 раза чаще регистрировали у больных I группы (14,6%), чем у пациенток II группы (7,2%). Этот факт объясняется тем, что такие опухоли обладают высокой гормональной активностью и проявляются симптомами гиперэстрогении и/или гиперандрогении в виде различных ГПЭ и повышенного риска развития РГЖ [4, 9, 27]. ОСПТ фиксировали во все возрастные периоды с пиком заболеваемости в постменопаузе, герминогенные опухоли диагностированы у девочек и женщин молодого возраста.
Интерес представили результаты анализа частоты рецидивов у больных со ЗОЯ разного генеза — 177 (58,4%) случаев. В обеих группах пациенток наибольшее количество рецидивов отмечено в перименопаузальном (15,3 и 19,2% соответственно) и постменопаузальном периодах (18,1 и 25,4% соответственно), особенно в поздней постменопаузе (11,9 и 15,8% соответственно). Частота рецидивов в репродуктивный период была наименьшей: в I группе — 7,9%, во II группе — 14,1%. Эти данные позволяют заключить, что в перименопаузальный и постменопаузальный периоды ЗОЯ имеют более агрессивное и неблагоприятное клиническое течение (см. табл. 2).
По результатам морфологического исследования операционного материала 303 больных со ЗОЯ у 178 (58,7%) выявлены различные гиперпластические процессы матки. Эту группу составили 154 (50,8%) больные с ГПЭ, 10 (3,3%) — с РЭ и 14 (4,6%) пациенток, которые ранее были прооперированы по поводу миомы матки (как известно, эта доброкачественная опухоль в 90% случаев сочетается с различными ГПЭ) [12]. Сопутствующие гиперпластические процессы матки у больных со ЗОЯ диагностированы во все возрастные периоды с одинаковой частотой: в репродуктивном — 35,4%, перименопаузальном и постменопаузальном — 30,3 и 34,3% соответственно (рис. 2). Эти данные указывают на определенное значение общих патогенетических механизмов развития гиперпластических процессов матки и ЗОЯ независимо от возраста женщин.
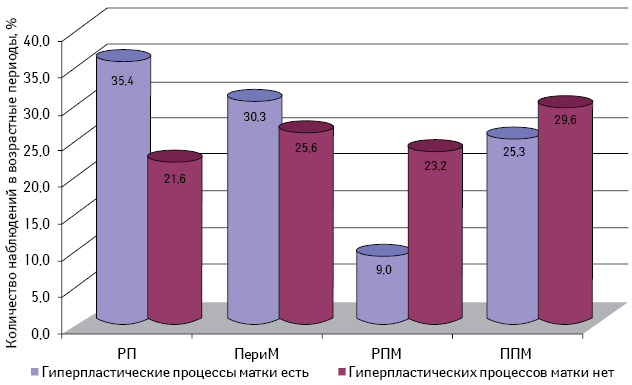
Примечания: РП — репродуктивный период; ПериМ — перименопауза; РПМ — ранняя постменопауза; ППМ — поздняя постменопауза
При анализе морфологической структуры ГПЭ у больных со ЗОЯ (n=154) отмечено (табл. 3), что комплексная неатипическая гиперплазия эндометрия (КНАГЭ), которая, по данным литературы и клинических наблюдений, является результатом хронической абсолютной или относительной гиперэстрогенемии и/или гиперэстрогении, диагностирована у 65,0% больных. Именно с этим фактором в лечении данных видов ГПЭ с успехом применяется гормональная терапия [28, 29]. На втором месте по частоте отмечена простая неатипическая гиперплазия эндометрия (17,5%), которая является результатом кратковременной гиперэстрогении.
Таблица 3. Характеристика ГПЭ у больных со ЗОЯ разного гистогенеза (n=154)
| ГПЭ | Количество больных | |
| n | % | |
| Простая неатипическая гиперплазия | 27 | 17,5 |
| Комплексная неатипическая гиперплазия | 100 | 65,0 |
| Простая атипическая гиперплазия | 1 | 0,7 |
| Комплексная атипическая гиперплазия | 4 | 2,6 |
| Полипы железисто-кистозные, железисто-фиброзные | 19 | 12,3 |
| Полипы атипические | 3 | 1,9 |
| Всего | 154 | 100,0 |
Железисто-кистозные, железисто-фиброзные и атипические полипы, которые выявлены у 22 (14,2%) больных, являются результатом хронического продуктивного воспаления эндометрия, в ходе которого противовоспалительные цитокины и факторы роста (EGFR, IGF-I, фактор некроза опухоли α), являясь паракринными медиаторами, опосредуют влияние эстрогенов на рецепторы клеток эндометрия, усиливая при этом дисбаланс между пролиферацией и апоптозом [29–31].
У 5,2% больных I группы диагностированы атипическая гиперплазия и атипические полипы эндометрия, которые, по данным литературы, в 30–50% случаев, независимо от возраста женщин, являются результатом микросателлитной нестабильности, приводящей к прогрессии в эндометриоидную карциному. Такие изменения эндометрия в основном не являются гормонозависимыми [29, 32].
Следует отметить, что у 10 (5,6%) больных I группы установлен РЯ и синхронный РЭ, что может свидетельствовать о сходстве их патогенеза как гормонозависимых опухолей. Средний возраст пациенток составил 54,7±0,9 года, показатели менархе, менструального цикла и длительности менструаций соответствовали физиологическим нормам, средний показатель родов — 1,7, абортов — 1,1. Средний возраст пациенток с физиологической менопаузой составил 49,6±1,2 года, хирургической — 44,8±1,4 года. РЯ имел гистологическое строение серозного рака, РЭ — аденокарциномы эндометрия разной степени дифференцировки. У 6 больных РЭ развился на фоне КНАГЭ, у 1 — в полипе эндометрия, у 5 — диагностирована лейомиома матки, что также свидетельствует о наличии общих гормональных нарушений у пациенток с РЯ и РЭ.
Кроме того, у 7 (2,3%) из 303 больных выявлен метахронный РЯ и РГЖ, средний возраст составил 53,9±1,1 года. Менструальный статус пациенток был без особенностей. Средний показатель родов — 1,4, абортов — 1,3. Средний возраст физиологической менопаузы — 52,7±1,3 года, хирургической — 43,3±2,3 года. У этих больных диагностирован серозный РЯ (G3). Морфологическая структура РГЖ была вариабельной: у 3 — инфильтративный дольчатый рак, у 2 — инфильтративный протоковый рак, 2 — скиррозный рак (G3). Представленные результаты также указывают на общие факторы риска и патогенетические механизмы развития РЯ и РГЖ.
Распределение больных в зависимости от гистогенеза ЗОЯ и морфологической структуры сопутствующих ГПЭ представлено в табл. 4. Из данных табл. 4 следует, что среди больных со ЗОЯ с сопутствующими ГПЭ преобладали пациентки с КНАГЭ (100/65,0%), что было отмечено нами выше; из них превалировали больные с серозным РЯ (81/52,6%) и с ОСПТ (12/7,9%). При этом среди пациенток с серозным РЯ сопутствующая КНАГЭ отмечена в 69,2% случаев (рис. 3–6), а среди больных с ОСПТ — в 66,7%. Кроме того, КНАГЭ диагностирована у всех пациенток с недифференцированным РЯ (3/100%) и у 37,5% больных муцинозным РЯ. Простая КНАГЭ отмечена почти у всех больных со ЗОЯ: 12,0% — с серозным РЯ; 37,5% — с муцинозным РЯ; 50,0% — с эндометриоидным РЯ; 22,2% — с ОСПТ; 83,3% — с герминогенными ЗОЯ. Эти данные также могут свидетельствовать о наличии общих гормональных нарушений при неатипических гиперплазиях эндометрия и ЗОЯ независимо от гистологического генеза последних.
Таблица 4. Распределение больных в зависимости от гистогенеза ЗОЯ и морфологической структуры сопутствующих ГПЭ (n=154)
|
Гистологическая структура ЗОЯ (n=154) |
Морфологическая структура сопутствующих ГПЭ (n=154) | |||||||||||
| ПНАГЭ | КНАГЭ | ПАГЭ | КАГЭ | ПЖК и ПЖФ | ПА | |||||||
| n | % | n | % | n | % | n | % | n | % | n | % | |
| Серозный рак (n=117) | 14 | 9,1 | 81 | 52,6 | 1 | 0,7 | 4 | 2,6 | 14 | 12,3 | 3 | 1,9 |
| Муцинозный рак (n=8) | 3 | 1,9 | 3 | 1,9 | 0 | 0,0 | 0 | 0,0 | 2 | 1,1 | 0 | 0,0 |
| Недифференцированный рак (n=3) | 0 | 0,0 | 3 | 1,9 | 0 | 0,0 | 0 | 0,0 | 0 | 0,0 | 0 | 0,0 |
| Эндометриоидный рак (n=2) | 1 | 0,7 | 0 | 0,0 | 0 | 0,0 | 0 | 0,0 | 1 | 0,6 | 0 | 0,0 |
| ОСПТ (n=18) | 4 | 2,6 | 12 | 7,9 | 0 | 0,0 | 0 | 0,0 | 2 | 1,1 | 0 | 0,0 |
| Герминогенные ЗОЯ (n=6) | 5 | 3,2 | 1 | 0,7 | 0 | 0,0 | 0 | 0,0 | 0 | 0,0 | 0 | 0,0 |
| Всего (n=154) | 27 | 17,5 | 100 | 65,0 | 1 | 0,7 | 4 | 2,6 | 19 | 12,3 | 3 | 1,9 |
| Серозный рак(n=117/100%) | 14 | 12,0 | 81 | 69,2 | 1 | 0,9 | 4 | 3,4 | 14 | 12,0 | 3 | 2,5 |
| Муцинозный рак (n=8/100%) | 3 | 37,5 | 3 | 37,5 | 0 | 0,0 | 0 | 0,0 | 2 | 25,0 | 0 | 0,0 |
| Недифференцированный рак (n=3/100%) | 0 | 0,0 | 3 | 100 | 0 | 0,0 | 0 | 0,0 | 0 | 0,0 | 0 | 0,0 |
| Эндометриоидный рак (n=2/100%) | 1 | 50,0 | 0 | 0,0 | 0 | 0,0 | 0 | 0,0 | 1 | 50,0 | 0 | 0,0 |
| ОСПТ (n=18/100%) | 4 | 22,2 | 12 | 66,7 | 0 | 0,0 | 0 | 0,0 | 2 | 11,1 | 0 | 0,0 |
| Герминогенные ЗОЯ (n=6/100%) | 5 | 83,3 | 1 | 16,7 | 0 | 0,0 | 0 | 0,0 | 0 | 0,0 | 0 | 0,0 |
| Всего (n=154/100%) | 27 | 17,5 | 100 | 65,0 | 1 | 0,7 | 4 | 2,6 | 19 | 12,3 | 3 | 1,9 |
ПНАГЭ — простая неатипическая гиперплазия эндометрия; КНАГЭ — комплексная неатипическая гиперплазия эндометрия; ПАГЭ — простая атипическая гиперплазия эндометрия; КАГЭ — комплексная атипическая гиперплазия эндометрия; ПЖК и ПЖФ — полипы железисто-кистозные и железисто-фиброзные; ПА — полипы атипические.

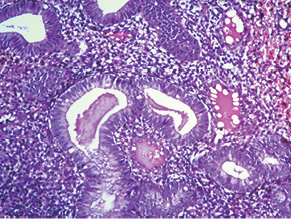
Учитывая тот факт, что только КНАГЭ является отражением хронической гиперэстрогении в организме больных, дальнейший анализ проведен для пациенток со ЗОЯ с сопутствующей КНАГЭ. Распределение этих больных в зависимости от возрастного периода представлено в табл. 5, из которой следует, что количество пациенток с сопутствующей КНАГЭ в репродуктивном, перименопаузальном и постменопаузальном периодах было сопоставимым — 33,0; 36,0 и 31,0% соответственно. Представленные данные также подтверждают общие факторы риска и патогенетические механизмы развития ЗОЯ и КНАГЭ независимо от возрастного периода женщин.
Таблица 5. Распределение больных со ЗОЯ с сопутствующей КНАГЭ в зависимости от возрастного периода (n=100)
| Возрастной период больных со ЗОЯ | Количество больных с КНАГЭ | |
| n | % | |
| Репродуктивный | 33 | 33,0 |
| Перименопаузальный | 36 | 36,0 |
| Постменопаузальный | 31 | 31,0 |
| Всего | 100 | 100,0 |
Далее мы оценили и сравнили общую выживаемость пациенток с наличием КНАГЭ (I группа) и отсутствием ГПЭ (II группа) независимо от генеза опухолей (рис. 7). Как свидетельствуют данные рис. 7, выживаемость больных со ЗОЯ оказалась достоверно выше у женщин с КНАГЭ (р<0,05). Медиана общей выживаемости пациенток, у которых диагностирована КНАГЭ, составила 63,0±3,1 мес, тогда как при отсутствии изменений в эндометрии она была достоверно ниже — 32,0±4,8 мес (р<0,05).
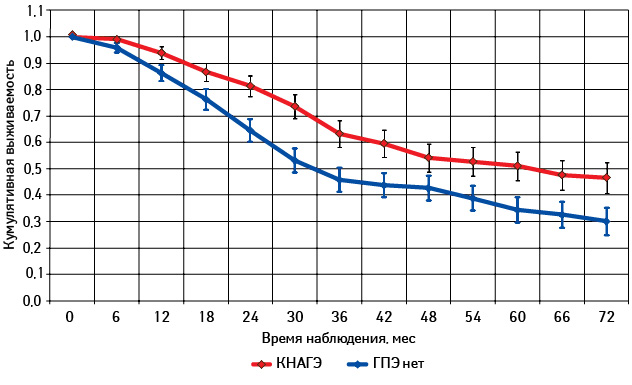
Поскольку среди больных со ЗОЯ наиболее многочисленную группу составили пациентки с РЯ (n=268), мы сочли целесообразным последующий анализ проводить для больных с КНАГЭ (n=87) и без морфологических изменений эндометрия при эпителиальных ЗОЯ (n=116).
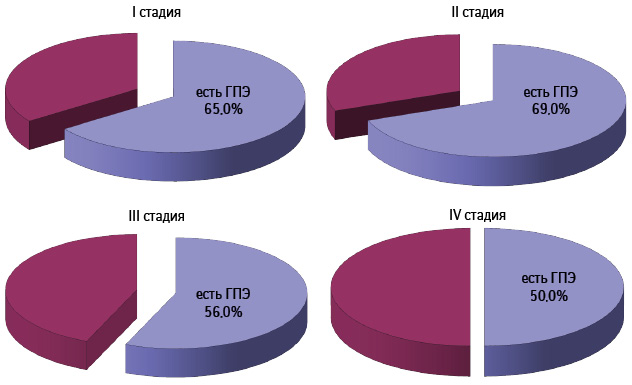
Распределение больных РЯ в зависимости от стадии опухолевого процесса и наличия/отсутствия ГПЭ представлено на рис. 8. Как свидетельствуют данные, наибольшее количество больных с ГПЭ выявлено при I и II стадии (65,0 и 69,0% соответственно) по сравнению с таковыми при III и IV стадии заболевания (56,0 и 50,0% соответственно), однако различия между показателями были статистически недостоверными (р>0,05).
Анализируя общую и безрецидивную выживаемость больных РЯ в зависимости от наличия или отсутствия КНАГЭ установлено, что оба показателя достоверно выше в группе пациенток с КНАГЭ (р=0,021 и р=0,024 соответственно). Так, 3- и 5-летняя общая выживаемость больных с КНАГЭ составила 63,2±4,2 и 51,2±3,8%, тогда как у пациенток без ГПЭ — 45,8±4,7 и 33,5±3,1% соответственно. Подобная тенденция отмечена и при оценке 3- и 5-летней безрецидивной выживаемости сравниваемых групп (54,2±4,3 и 35,2±3,4% против 49,7±4,7 и 27,5±3,1%). Кривые выживаемости по Каплану — Мейеру представлены на рис. 9, 10.
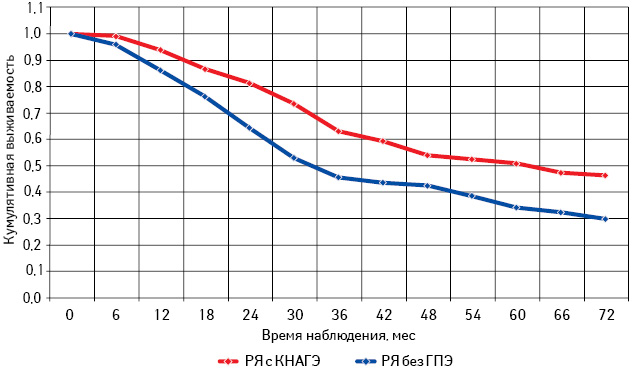
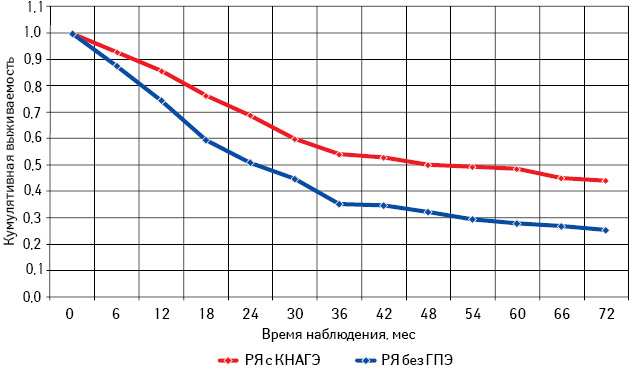
Проведен анализ общей и безрецидивной выживаемости больных РЯ с КНАГЭ и без ГПЭ в зависимости от возрастного периода (табл. 6; рис. 11–16).
Таблица 6. Общая и безрецидивная выживаемость больных РЯ с КНАГЭ и без ГПЭ в зависимости от возрастного периода
| Возрастной период | Общая выживаемость, % | Медиана безрецидивной выживаемости, мес | ||||
| РЯ с КНАГЭ | РЯ без ГПЭ | РЯ с КНАГЭ | РЯ без ГПЭ | |||
| 3-летняя | 5-летняя | 3-летняя | 5-летняя | |||
| Репродуктивный | 74,5±4,6 | 49,0±4,9 | 64,5±5,1 | 45,0±3,7 | 62,5*±4,8 | 33,0*±3,1 |
| Перименопаузальный | 53,5*±4,2 | 39,0*±3,7 | 39,8*±3,4 | 18,5*±3,2 | 30,0*±4,6 | 15,8*±2,9 |
| Постменопаузальный | 65,0*±5,7 | 50,0*±4,2 | 41,0*±3,8 | 30,5*±3,6 | 50,0*±3,5 | 27,0*±3,2 |
р<0,05 — различия показателей выживаемости больных.
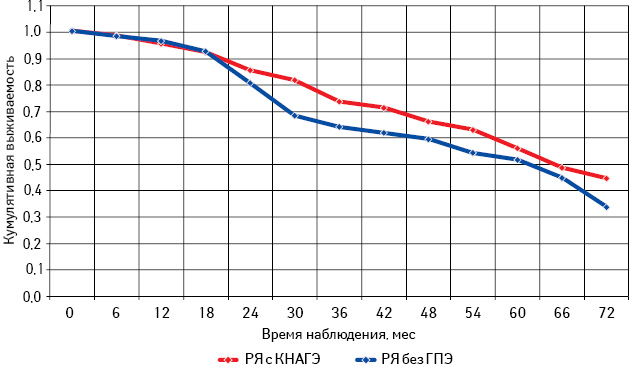
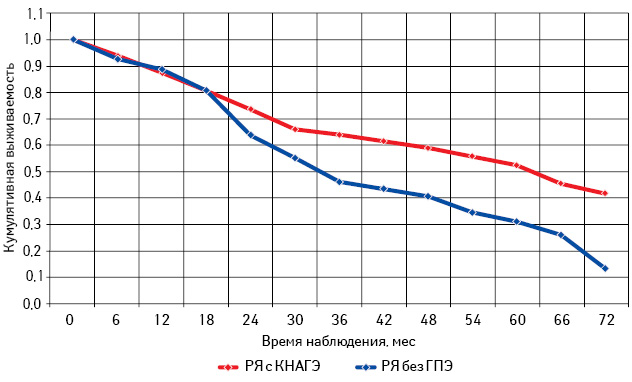
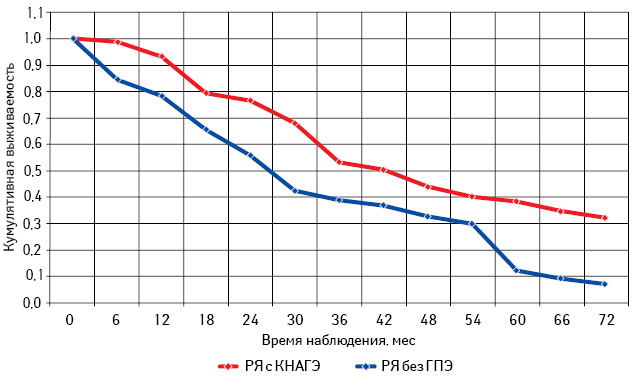
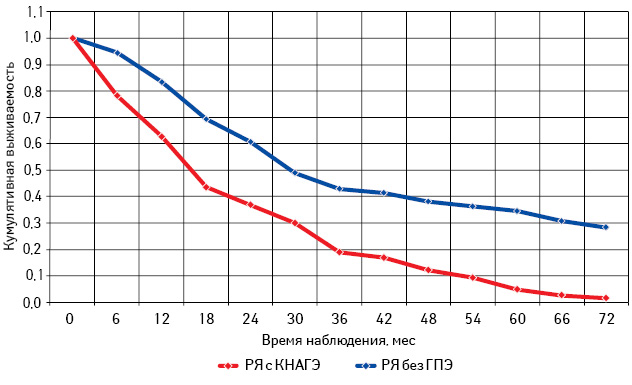
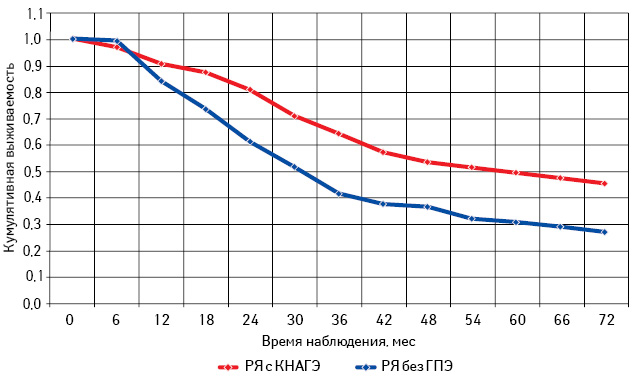
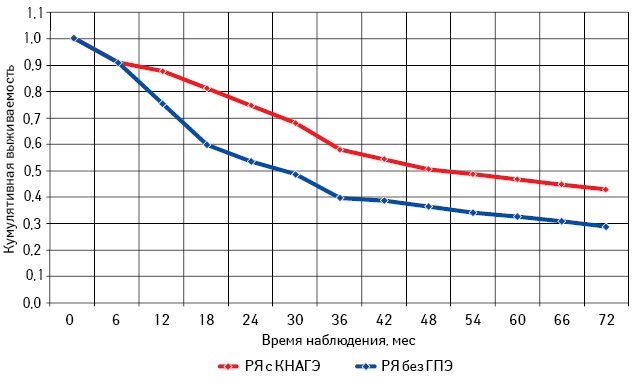
Самая низкая общая и безрецидивная выживаемость зарегистрирована у больных РЯ перименопаузального периода, особенно при отсутствии морфологических изменений эндометрия (см. рис. 13, 14; табл. 6). При этом наибольшее количество рецидивов у пациенток с КНАГЭ также отмечено в этом возрасте, что свидетельствует об агрессивном течении заболевания у больных РЯ перименопаузального возраста (рис. 17). Представленные данные позволяют предположить наличие определенной связи физиологического гормонального дисбаланса у женщин в период перименопаузы с клиническим течением заболевания.
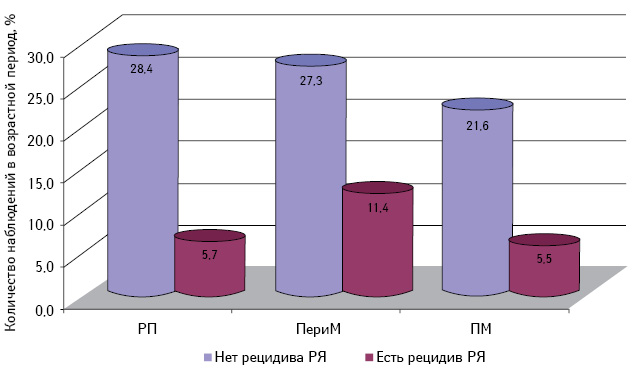
Примечания: РП — репродуктивный период; ПериМ — перименопауза; ПМ — постменопауза
Из данных табл. 6 следует, что, независимо от возрастного периода пациенток, 3- и 5-летняя выживаемость больных с КНАГЭ выше, чем у пациенток без ГПЭ. Однако в подгруппе больных репродуктивного периода различия показателей 3- и 5-летней выживаемости оказались статистически недостоверными (с КНАГЭ — 74,5 (49,0%) и без ГПЭ — 64,5 (45,0%); р=0,52). При этом результаты 3- и 5-летней общей выживаемости больных РЯ с КНАГЭ перименопаузального и постменопаузального периодов были достоверно выше, чем у пациенток без ГПЭ (р<0,05 для всех вариантов сравнения). Следует отметить, что медиана безрецидивной выживаемости у больных РЯ с КНАГЭ репродуктивного, перименопаузального и постменопаузального возраста была достоверно выше, чем у пациенток без ГПЭ (62,6; 30,0 и 50,0 мес против 33,0; 15,8 и 27,0 мес соответственно; р<0,05).
Таким образом, сопутствующая КНАГЭ имеет клиническое значение у больных РЯ преимущественно перименопаузального и постменопаузального возраста и может рассматриваться как предиктивный фактор более благоприятного течения опухолевого процесса.
Полученные результаты подтверждают наличие общих факторов риска и гормональных механизмов патогенеза опухолевых процессов яичника и ГПЭ. Последние, в свою очередь, могут быть фактором риска развития ЗОЯ.
Полученные нами результаты, с одной стороны, согласуются с данными литературы о том, что у больных РЯ и с опухолями других гормонозависимых органов (РГЖ, РЭ) репродуктивного периода отмечены менее агрессивное течение заболевания и более высокие показатели выживаемости [4, 7]. Злокачественные опухоли гормонозависимых органов у пациенток этого возрастного периода и перименопаузы связывают с I типом гормонального канцерогенеза, при котором происходит усиленная пролиферация клеток под воздействием классических эстрогенов и/или андрогенов на фоне случайной мутации или воздействия какого-либо канцерогенного агента. В постменопаузе РЯ имеет агрессивное течение и неблагоприятный прогноз, поскольку ведущая роль принадлежит действию периферических менопаузальных неклассических эстрогенов (фенолстероиды (16-α ОНЕ), катехолэстрогены (4-гидроксиэстрадиол и 4-гидроксиэстрон) и их дериваты из класса хинонов и семихинонов), преимущественно внегонадного синтеза. При наличии возрастных эндокринно-обменных изменений у женщин, проявляющихся ожирением, инсулинорезистентностью и гиперинсулинемией, образование неклассических эстрогенов и действие их на специфические рецепторы различных тканей усиливаются. С вышеизложенными процессами связывают переход промоторного типа гормонального канцерогенеза в генотоксический, что приводит к развитию менее гормонозависимой опухоли, которая характеризуется неблагоприятным течением в гормонозависимых органах (РГЖ, РЭ, РЯ) [33–36]. С другой стороны, результаты нашего исследования противоречат данным литературы, поскольку установлено, что наиболее агрессивное течение и неблагоприятный прогноз отмечали у больных РЯ перименопаузального возраста, тогда как пациентки постменопаузального периода заняли промежуточное место по частоте возникновения рецидивов, а также показателям безрецидивной и общей выживаемости.
Представленные результаты продемонстрировали, что гормональные изменения в организме, проявляющиеся ГПЭ, у больных РЯ могут быть важным прогностическим фактором течения заболевания. При этом эндокринные факторы, являясь весомым элементом патогенеза заболеваний яичников и тела матки, представляют собой лишь часть общего механизма сложных взаимодействий молекулярно-генетических, иммунных, а также гормонально-рецепторных изменений в органах-мишенях, что диктует проведение дальнейших исследований в этом направлении, включая изучение механизмов взаимодействия стероидных гормонов с рецепторами опухолевых клеток.
ВЫВОДЫ
1. Сопутствующие ГПЭ отмечены у 60,0% пациенток со ЗОЯ, из них — у 85,4% больных РЯ; а также у 74,1% пациенток с ОСПТ. КНАГЭ, которая является результатом хронических дисгормональных нарушений, выявлена у 65,0% пациенток со ЗОЯ, 69,2% больных серозным РЯ и 66,7% пациенток с ОСПТ.
2. ГПЭ наблюдались во всех возрастных периодах больных со ЗОЯ и РЯ с одинаковой частотой в репродуктивном, перименопаузальном и постменопаузальном возрасте. Полученные результаты могут подтверждать наличие общих факторов риска и гормонального патогенеза опухолевых процессов яичника и ГПЭ. Последние могут быть фактором риска развития ЗОЯ.
3. У больных РЯ с КНАГЭ отмечена более высокая общая и безрецидивная выживаемость в перименопаузальном и постменопаузальном возрасте по сравнению с пациентками соответствующих возрастных периодов без ГПЭ, что позволяет рассматривать сопутствующую КНАГЭ у больных РЯ этого возраста как предиктивный фактор более благоприятного течения опухолевого процесса.
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ
1. Воробьева Л.И. (2012) Практическая онкогинекология. Киев, 228 с.
2. Воробьева Л.И., Свинцицкий В.С., Ткаля Ю.Г. (2013) Гормональный канцерогенез и обоснование применения гормональной терапии в лечении больных раком яичника. Клин. онкол., 1(9): 56–64.
3. Осинский С.П., Ваупель П. (2009) Микрофизиология опухолей. Наукова думка, Киев, 256 с.
4. Disaia P.J., Creasman W.T. (2012) Clinical Oncologic Gynecology (пер. с англ. под ред. Новиковой Е.Г.). РидЭлсивер, Москва, 346 c.
5. Capen C.C. (2004) Mechanisms of hormone-mediated carcinogenesis of the ovary. Toxicol. Pathol., 32: 1–5.
6. Landen J.C.N., Birrer M.J., Sood A.K. (2008) Early stages of the pathogenesis of ovarian cancer. J. Clin. Oncol., 26(6): 149–160.
7. Урманчеева А.Ф., Кутушева Г.Ф., Ульрих Е.А. (2012) Опухоли яичника (клиника, диагностика и лечение). Н-Л, СПб., 68 с.
8. Горбунова В.А. (2011) Диагностика и лечение рака яичников. МИА, Москва, 248 с.
9. Бохман Я. В. (2002) Руководство по онкогинекологии. Фолиант, СПб., 542 с.
10. Савельева Г.М., Бреусенко В.Г., Голова Ю.А. (2002) Период постменопаузы: климактерические расстройства, изменения в матке и яичниках. Врач, 8: 3–6.
11. Сметник В.П., Тумилович В.Г. (2003) Неоперативная гинекология: руководство для врачей. МИА, Москва, 592 с.
12. Вихляева Е.М. (2002) Руководство по эндокринной гинекологии. МИА, Москва, 768 с.
13. Чехун В.Ф. (2009) Воспаление и рак. Онкология, 11(4): 244–245.
14. Altinoz M.A., Korkmaz R. (2004) NF-kappaB, macrophage migration inhibitory factor and cyclooxygenase-inhibitions as likely mechanisms behind the acetaminophen- and NSAID-prevention of the ovarian cancer. Neoplasma, 51(4): 239–247.
15. Olsen C.M., Green A.C., Whiterman D.C. et al. (2007) Obesity and the risk of epithelial ovarian cancer. Eur. J. Cancer, 43(4): 690–709.
16. Olsen C.M., Nagle C.M., Whiterman D.C. et al. (2013) Obesity and risk of ovarian cancer subtypes. Endocr. Relat. Cancer; 20(2): 251–262.
17. Schouten L.J., Rivera C., Hunter D.J. et al. (2008) Height, body mass index, and ovarian cancer: a pooled analysis of 12 cohort studies. Cancer Epidemiol. Biomarkers Prev., 17(4): 902–912.
18. Урманчеева А.Ф., Тюляндин С.А., Моисеенко В.М. (2008) Практическая онкогинекология: избранные лекции. Центр ТОММ, СПб., 400 с.
19. Fathalla M.F. (1971) Incessant ovulation: a factor in ovarian neoplasia? Lancet, 2: 163.
20. Riman T., Dickman P. W., Nilsson S. et al. (2002) Risk factors for invasive epithelial ovarian cancer: results from a Swedish case-control study. Am. J. Epidemiol, 156: 363–373.
21. Ji Q., Liu P. I., Chen P. K. et al. (2004) Follicle stimulating hormone-induced growth promotion and gene expression profiles on ovarian surface epithelial cells. Int. J. Cancer, 112: 803–814.
22. Tashiro H., Katabuchi H., Begum M. et al. (2003) Roles of luteinizing hormone/chorionic gonadotropin receptor in anchorage-dependent and -independent growth in human ovarian surface epithelial cell lines. Cancer Sci., 94: 953–959.
23. Fleming J. S., Beaugie C. R., Haviv I. et al. (2006) Incessant ovulation, inflammation and epithelial ovarian carcinogenesis: revisiting old hypotheses. Mol. Cell. Endocrinol., 247: 4–21.
24. Whittemore A.S., Balise R.R., Pharoah P.D. et al. (2004) Oral contraceptive use and ovarian cancer risk among carriers of BRCA1 or BRCA2 mutations. Br. J. Cancer, 91(11): 1911–1915.
25. Винокуров В.Л. (2004) Рак яичников: закономерности метастазирования и выбор адекватного лечения больных. Фолиант, СПб., 336 с.
26. Свінціцький В.С., Воробйова Л.І. (2010) Злоякісні пухлини яєчника: оптимізація комплексного лікування. Онкология, 12(1): 93–97.
27. Бохман Я.В. (2007) Лекции по онкогинекологии. МИА, Москва, 304 c.
28. Дубоссарская З.М., Дубоссарская Ю.А. (2009) Гиперплазия эндометрия (клиническая лекция). Жіночий лікар, 5: 22–27.
29. Запорожан В.Н., Татарчук Т.Ф., Дубинина В.Г., Косей Н.К. (2012) Современная диагностика и лечение гиперпластических процессов эндометрия. Репродукт. эндокринол., 1(3): 5–13.
30. Калугина Л.В., Татарчук Т.Ф. (2013) Полипы эндометрия. Нужна ли противорецидивная терапия? Репродукт. эндокринол., 2(10): 69–75.
31. Татарчук Т.Ф., Задорожная Т.Д., Коренная Е.Е. (2004) Морфофункциональные особенности гиперпластических процессов эндометрия на фоне хронического эндометрита. Здоровье женщины, 4(26): 59–62.
32. Щербина Н.А., Карташова М.А. (2012) Применение гормонотерапии при атипической гиперплазии эндометрия у больных, имеющих микросателлитную нестабильность и метилирование гена ESR. Междунар. мед. журн., 18(4): 82–86.
33. Берштейн Л.М. (2001) Возраст, факторы внешней среды и гормональный канцерогенез. Вопр. онкологии, 47(2): 148–154.
34. Берштейн Л.М. (2010) Колчан и стрелы — проканцерогенная роль маммарного жира. Природа, 12: 13–19.
35. Берштейн Л.М. (2007) Гормональные и прогенотоксические аспекты BRСA1-ассоциированного канцерогенеза. Вопр. онкологии, 53(6): 642–652.
36. Дильман В.М. (1987) Четыре модели медицины. Медицина, Ленинград, 288 с.
Адрес:
Ткаля Юлия Георгиевна
03022, Киев, ул. Ломоносова, 33/43
Национальный институт рака
E-mail: j.tkalya@gmail.com














Leave a comment