Імуногістохімічна діагностика нейроендокринних пухлин шлунково-кишкового тракту (огляд літератури та власні дослідження)
Кривешко А.С.1, Курик О.Г.2, Яковенко В.О.3, Баздирєв В.В.4
- 1Національний медичний університет ім. О.О. Богомольця МОЗ України, Київ
- 2Державна наукова установа «Науково-практичний центр профілактичної та клінічної медицини» Державного управління справами, Київ
- 3Медичний центр «Універсальна клініка «Оберіг», Київ
- 4Медична (онкологічна) клініка «Інновація», Київська обл., Вишгородський район, с. Лютіж
Резюме. Нейроендокринні пухлини (НЕП) травного тракту становлять актуальну проблему. У діагностиці НЕП вирішальне значення має морфологічне дослідження, яке в подальшому відіграє важливу роль у виборі лікувальної тактики. Морфологічна діагностика НЕП базується на класифікації Всесвітньої організації охорони здоров’я і критеріях оцінки прогнозу НЕП. Основним в морфологічній діагностиці НЕП є імуногістохімічне (ІГХ) дослідження з використанням маркерів, що дозволяють встановити нейроендокринну природу пухлини, і маркерів, що визначають потенціал злоякісності пухлини. Для верифікації НЕП доцільно використовувати поєднання таких імунних маркерів, як хромогранін А, синаптофізин, CD56, а для визначення потенціалу злоякісності — Кі-67, р53 і AMACR. На сьогодні, з урахуванням данних ІГХ дослідження, НЕП класифікують на: 1) високодиференційовані пухлини з низьким ступенем злоякісності — НЕП G1; 2) високодиференційовані пухлини з проміжним ступенем злоякісності — НЕП G2; 3) низькодиференційовані пухлини з високим ступенем злоякісності — нейроендокринні карциноми. ІГХ дослідження дає можливість визначити локалізацію первинної НЕП у випадках, коли першими діагностують метастази. Для цього використовуються ІГХ маркери: СDX2 — маркер кишкової локалізації; PDX, ISL1, PAX8 — маркери походження з підшлункової залози. Для визначення метастатичного потенціалу використовують маркер CD44. Наведено три випадки морфологічної діагностики НЕП апендикса, підшлункової залози і прямої кишки з власної практики.

Нейроендокринні пухлини (НЕП) травного тракту на сьогодні є актуальною проблемою, що зумовлено як зростанням захворюваності, так і труднощами діагностики [1, 2, 6]. НЕП — це новоутворення з клітин дифузної нейроендокринної системи (APUD-системи), які у більшості локалізуються в шлунково-кишковому тракті (ШКТ) (до 85%), разом з тим серед усіх пухлин ШКТ вони становлять до 8% [22]. Згідно з даними американських дослідників за 2012 р., відсоток ураження НЕП різних відділів ШКТ у пацієнтів негроїдної раси становив: шлунка — 5,7%, тонкої кишки — 21,0%, апендикса — 2,0%, товстої кишки — 7,9%, прямої кишки — 27,0%. У пацієнтів європеоїдної раси відзначали менший відсоток ураження основних локалізацій (крім апендикса): шлунка — 5,7%, тонкої кишки — 17,7%, апендикса 3,2%, товстої кишки — 7,4%, прямої кишки — 12,3% [27]. НЕП — потенційно злоякісні пухлини, які мають здатність до глибокого інфільтративного росту, разом із тим характеризуються повільним прогресуванням.
Останнім часом у високорозвинених країнах значно зросла частота виявлення НЕП серед населення. Це можна пояснити насамперед використанням сучасних методів діагностики, а також поширенням інформації про можливість виникнення цих пухлин серед лікарів, які становлять первинну ланку діагностики. На жаль, ситуація в Україні дещо інакша — значна частина НЕП залишається нерозпізнаною через малопомітну симптоматику, недостатню інформованість і настороженість лікарів, а також малу можливість використання специфічних методів діагностики для верифікації НЕП. Одним із перспективних методів ранньої діагностики і лікування НЕП шлунка і кишечнику є відеогастродуоденоскопія і відеоколоноскопія з біопсією, морфологічним підтвердженням діагнозу і подальшою ендоскопічною резекцією або підслизовою дисекцією новоутворення [4, 14, 15].
Морфологічна діагностика НЕП базується на класифікації Всесвітньої організації охорони здоров’я, а також на критеріях оцінки прогнозу НЕП. Крім того, враховують пропозиції Європейської спільноти з вивчення НЕП (European Neuro-Endocrine Tumor Society — ENETS), що розробила додаткову класифікацію TNM з визначення злоякісності НЕП ШКТ та підшлункової залози [9, 26].
Система визначення ступеня злоякісності (Grade) полягає у встановленні кількості мітозів, відповідно, G1, G2, G3 — кількість мітозів <2, 2–20 та >20, а також ґрунтується на оцінці рівня проліферативної активності пухлинних клітин — індекс Кі-67 — <2, <20 і >20. Кількість мітозів підраховують у 10 полях зору з найвищою мітотичною активністю, результатом є середня кількість мітозів. Індекс проліферативної активності Кі-67 (клон МІВ-1) встановлюють шляхом визначення частоти забарвлених ядер у 2000 пухлинних клітин у ділянках з найвищою проліферативною активністю. У 2010 р. Grade була затверджена Американським об’єднаним комітетом з онкології (American Joint Committee on Cancer — AJCC) [17]. Визначення індексу Кі-67 вважають обов’язковим при вивченні біопсій метастазів і маленьких зразків тканин, коли немає можливості точного обчислення кількості мітозів. Індекс Кі-67 є не лише показником злоякісного потенціалу пухлини, який корелює з виживанням, але й важливим критерієм у алгоритмі лікування хворих на НЕП ШКТ [13].
Імуногістохімічні (ІГХ) методи на сьогодні є обов’язковою частиною гістологічних досліджень, оскільки лише вони забезпечують специфічну візуалізацію локалізації певного антигену. Імунофенотипові ознаки малігнізації з’являються значно раніше, ніж загальноприйняті гістологічні, що може бути використане для більш достовірного виявлення пухлинного росту та прогнозування рецидиву [16, 30].
IГХ маркери, які використовують для діагностики НЕП, поділяють переважно на дві групи — маркери для верифікації пухлин і для визначення потенціалу злоякісності.
Перша група маркерів, які застосовують для верифікації НЕП, — це антитіла до загальних нейроендокринних маркерів, а саме синаптофізин, хромогранін А, нейронспецифічна енолаза, бомбезин та ін. [6].
Хроморганін А (СgA) — загальний нейроендокринний маркер, найбільш відомий білок сім’ї гранінів, кислих секреторних глікопротеїнів, які містяться разом із пептидними гормонами в гранулах ендокринних та нейроендокринних клітин. Визначення рівня CgA використовується як для первинної діагностики, так і в ролі індикатора зміни активності пухлини для прогнозу перебігу захворювання [5, 22].
Синаптофізин (Syn) — маркер дрібних везикул із нейротрансмітерами, це трансмембранний глікопротеїн (р38), який присутній в нейроендокринних клітинах. Його роль полягає в формуванні синаптичних везикул, а також вивільненні нейротрансмітера [3, 5, 24].
Нейронспецифічна енолаза (NSE) — маркер цитоплазматичних протеїнів. Визначається у великій кількості в нейронах та нейроендокринних клітинах, а також у пухлинних клітинах, які утворилися внаслідок мутації цих клітин [6, 25].
Провідним фактором як в механізмі злоякісної трансформації клітин, так і в біологічній поведінці вже в утвореній пухлині є проліферативна активність. Основним маркером проліферації є антиген Кі-67, який є негістоновим білком та експресується майже у всіх фазах клітинного циклу, тому відображає розмір проліферативного пулу. Для визначення проліферативного індексу використовують клон МІВ-1. Визначають відсоток мічених клітин пухлини в ділянках з найбільшою ядерною експресією. За результатами ІГХ досліджень отримують забарвлення ядер у коричневий колір, з більш інтенсивним забарвленням ядерець, а також чітке фарбування мітотичних фігур [13].
Збільшення розмірів пухлини супроводжується зниженням експресії адгезивних молекул. Це підтверджує концепцію про вплив зниження експресії адгезивних молекул на пухлинне прогресування та метастазування. НЕП характеризуються підвищеною експресією CD56 (молекула нейроадгезії, яка бере участь у міжклітинних взаємодіях).
Одним із найважливіших молекулярних маркерів є фосфопротеїн р53 — продукт гена-супресора ТР53, який локалізується на короткому плечі 17-ї хромосоми. р53 виконує три основні функції: регуляцію клітинного циклу, індукцію апоптозу, стабілізацію геному. Порушення діяльності клітинного циклу пов’язане з порушенням діяльності р53 і, як наслідок, призводить до розвитку неоплазії [6].
Нещодавно вчені провели дослідження та визначили залежність ступеня експресії AMACR від стадії розвитку НЕП. AMACR — цитоплазматичний ензим, який відіграє основну роль у бета-окисненні розгалужених ланцюгів жирних кислот [8]. Встановлено кореляцію між рівнем експресії AMACR, Кі-67 і р53 та потенціалом злоякісності пухлини: НЕП G1, НЕП G2 та нейроендокринною карциномою (НЕК) (табл. 1).
Таблиця 1. Експресія Кі-67, р53 та AMACR при різному ступені злоякісності пухлини
| Пухлина | Ki-67, % | p53, % | AMACR, % |
| НЕП G1 | 1,7 | 0,0 | 0,0 |
| НЕП G2 | 7,2 | 0,0 | 66,7 |
| НЕК | 67,1 | 66,7 | 90,2 |
Тому для встановлення відмінностей НЕК від НЕП можна застосовувати р53 та Кі-67, а AMACR дає можливість диференціювати не лише НЕК від НЕП, але й НЕП G1 від НЕП G2.
Беручи до уваги дані ENETS [17, 26], маємо чітку класифікацію НЕП, яка базується на методах ІГХ дослідження (табл. 2).
Таблиця 2. Класифікація НЕП
|
Ступінь злоякісності |
МІ | Кі-67 | Діагноз |
| G1 | <2 | <2 | НЕП G1 |
| G2 | 2–20 | 3–20 | НЕП G2 |
| G3 | >20 | >20 | НЕП |
Тут і далі: МІ — мітотичний індекс.
Отже, на основі цих даних можемо чітко встановити відмінності в класифікації:
- НЕП G1 — високодиференційовані пухлини з низьким ступенем злоякісності, високою експресією хромограніну А, синаптофізину, МІ <2 та проліферативною активністю (Ki-67) <20, високою експресією CD56, низькою експресією BCL-2 та р53, AMACR не експресує;
- НЕП G2 — високодиференційовані пухлини із переміжним ступенем злоякісності, високою експресією хромограніну А, синаптофізину, МІ 2–20 та проліферативною активністю 2–20, помірною експресією CD56, помірною експресією BCL-2 та р53, експресією AMACR >60%;
- НЕК — низькодиференційовані злоякісні пухлини з високим ступенем злоякісності, слабкою експресією хромограніну А, але з експресією синаптофізину на рівні >70%, МІ >20 та проліферативною активністю >20, низькою експресією CD56, високою експресією BCL-2 та р53. Основними відмінностями є висока експресія AMACR — 90%, а також інвазія судин та нервових стовбурів, наявність некрозів, виражений ядерний поліморфізм, великі розміри пухлини, віддалене метастазування.
НЕП можуть бути вперше діагностовані при виявленні метастазів у печінці, лімфатичних вузлах або інших органах. Тому НЕП становлять складне клінічне завдання для лікаря, оскільки лікування значною мірою залежить від виявлення первинного вогнища ураження. Останнім часом значно розширився набір специфічних маркерів, які використовуються для визначення можливих шляхів метастазування від «німих» пухлин. Наводимо низку органоспецифічних маркерів, які в основному вказують на локалізацію найбільш розповсюджених НЕП:
- СDX2 — маркер, який свідчить про первинне кишкове походження НЕП [10, 20, 21, 28];
- PDX1 — свідчить про походження з підшлункової залози [12];
- ISL1 — маркер походження з підшлункової залози [18, 31], а також виявлений при ректальних НЕП [11, 19];
- TTF1 — маркер легеневої локалізації, негативний при походженні зі ШКТ та підшлункової залози [28, 29];
- PAX8 — маркер підшлункового походження [23], але він проявляє низьку специфічність, оскільки також експресується при НЕП шлунка, дванадцятипалої кишки, апендикулярного відростка та прямої кишки [7, 23].
Визначення критеріїв метастатичного потенціалу неможливе без використання ІГХ дослідження. Доведено ефективність ІГХ експресії CD44, який є інтегральним клітинним глікопротеїном, що відіграє важливу роль у міжклітинній взаємодії, клітинній адгезії та міграції. Також проводили дослідження для виявлення кореляції між експресією CD44 та E-кадгерином. Доведено, що втрата CD44, але не E-кадгеринів може бути корисним показником метастатичного потенціалу карциноїдних пухлин [32–34].
На базі Медичного центру «Універсальна клініка «Оберіг» за 2009–2015 рр. діагностовано 15 НЕП ШКТ різної локалізації: шлунок, дванадцятипала кишка, здухвинна кишка, апендикс, ободова, пряма кишка, підшлункова залоза. В усіх випадках було проведене ІГХ дослідження. Наводимо результати власних морфологічних досліджень окремих НЕП.
Клінічні випадки
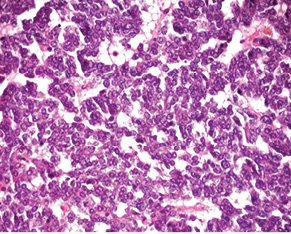
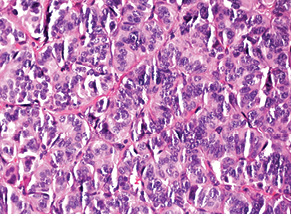
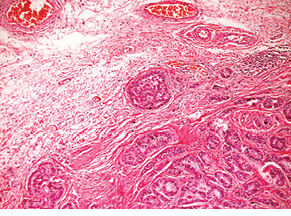
Випадок НЕП апендикса у пацієнтки віком 53 років. Пухлина була видалена лапароскопічно. Після гістологічного дослідження встановлено, що просвіт апендикса повністю заповнений пухлиною, що інфільтрує м’язовий шар. Пухлина побудована з папілярних, солідних і трабекулярних структур, утворених клітинами з невеликою кількістю еозинофільної цитоплазми, ядра пухлинних клітин містять дрібногранулярний хроматин, мітози не виявляються (рис. 1).
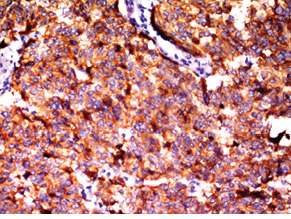
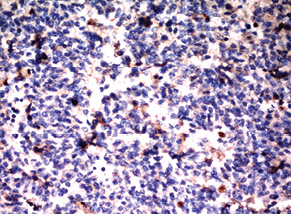
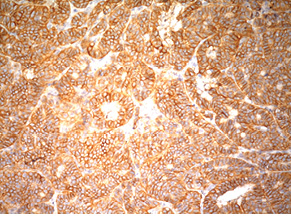
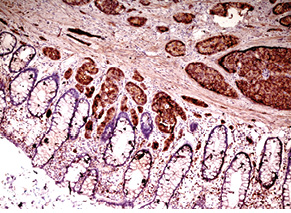
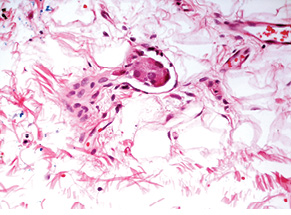
Для підтвердження діагнозу та встановлення ступеня злоякісності пухлини виконано ІГХ дослідження, за результатами якого пухлинні клітини позитивні на загальні цитокератини у вигляді точок у цитоплазмі або перинуклеарного кільця, усі клітини пухлини різко позитивні на CD56, хромогранін А, синаптофізин (рис. 2), що свідчить про нейроендокринне диференціювання пухлини. При забарвленні на проліферативні маркери позитивними на Кі-67 виявилося <2% клітин пухлини (рис. 3). Така проліферативна активність характерна для НЕП G1 (типового карциноїду).
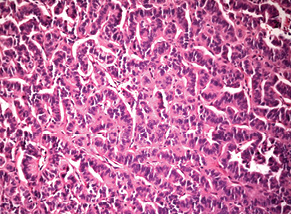
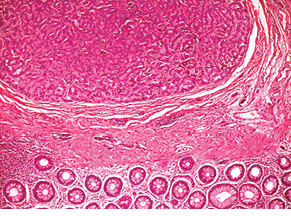
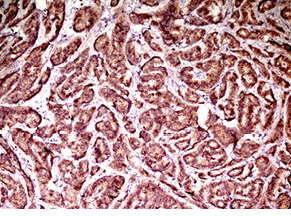
Випадок НЕП підшлункової залози у пацієнтки віком 43 років. Пухлина 1,5 см в діаметрі видалена лапароскопічно. Гістологічно побудована переважно у вигляді трабекулярних структур; ядра пухлинних клітин містять дрібногранулярний хроматин типу «солі з перцем»; МІ виявився <2. При ІГХ дослідженні всі клітини пухлини різко позитивні на хромогранін А і синаптофізин; позитивними на Кі-67 виявилося до 20% клітин (рис. 4–6).
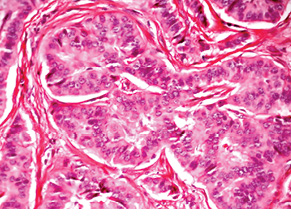
Наступний випадок НЕП прямої кишки у пацієнтки віком 51 року також розцінено як високого ступеня злоякісності. Пухлина була видалена ендоскопічно шляхом підслизової дисекції. Після гістологічного дослідження встановлено, що в підслизовому шарі визначається утворення, сформоване залозистими та трабекулярними структурами пухлинних клітин (рис. 7). Клітини пухлини зі світлою цитоплазмою (рис. 8). Ядра містять глибчастий гіперхромний хроматин. Фігури мітозу не визначаються. Відмічаються дрібні вогнища інвазії в слизовій оболонці та підслизовій основі (рис. 9, 10); вогнищевий карциноматоз кровоносних судин у підслизовому шарі (рис. 11). За будовою пухлина найбільше відповідає високодиференційованій НЕП. Для підтвердження діагнозу виконане ІГХ дослідження. За результатами ІГХ реакцій клітини пухлини позитивні на CD56 (див. рис. 10), синаптофізин (рис. 12), реакція на хромогранін А гетерогенна позитивна, також відсутні клітини, позитивні на маркер проліферації Кі-67.
У цьому випадку за критерієм оцінки мітотичної активності пухлина належить до високодиференційованих. Однак наявні пухлинні мікроемболи у кровоносних судинах, що свідчить про приналежність пухлини до високого ступеня злоякісності.
Висновки
1. Діагностика НЕП базується на використанні ІГХ методів, які дозволяють підтвердити біологічну природу пухлини, оцінити ступінь її злоякісності, що впливає на подальшу тактику лікування та прогноз хвороби. Найбільш інформативним є використання таких маркерів, як хромогранін А, синаптофізин, CD56, Кі-67, p53 та AMACR.
2. ІГX дослідження допомагає визначити локалізацію первинної НЕП у випадках, коли першими виявляють метастази. Для цього застосовують ІГХ маркери: СDX2 — кишкова локалізація; PDX, ISL1, PAX8 — походження з підшлункової залози.
3. Для визначення метастатичного потенціалу використовують маркер CD44.
Перспективою подальших досліджень вважаємо пошук і обґрунтування доцільності застосування нових схем ІГХ маркерів для верифікації пухлин, визначення критеріїв злоякісності та метастатичного потенціалу.
Список використаної літератури
1. Грабовий А.Н. (2011) Основы морфологической диагностики нейроэндокринных опухолей. Клин. онкол, 1: 102–104.
2. Гуревич Л.Е. (2011) Морфологическая диагностика нейроэндокринных новообразований желудочно-кишечного тракта. Практ. рекомендации, М.: 30 с.
3. Kumar G.L., Rudbeck L. (2011) Иммуногистохимические методы: Руководство. М., 224 с.
4. Курик О.Г., Яковенко В.О., Баздирєв В.В. та ін. (2014) Нейрoендокринні пухлини (карциноїди) шлунка і кишечника — рання діагностика і мініінвазивні ендоскопічні втручання. Морфологія, 8(1): 58–64.
5. Caplinn М., Kvols L. (2010) Нейроэндокринные опухоли: Руководство для врачей. М.: Практическая медицина, 224 с.
6. Петров С.В., Райхлин Н.Т. (2012) Руководство по иммуногистохимической диагностике опухолей человека. Изд. 4-е издание, доп.и перераб. Казань, 624с.
7. Agaimy A., Erlenbach-Winsch K., Konukiewitz B. et al. (2013) ISL 1 expression is not restricted to pancreatic well-differentiated neuroendocrine neoplasms, but is also commonly found in well and poorly differentiated neuroendocrine neoplasms of extrapancreatic origin. Mod. Pathol., 26: 995–1003.
8. Annenkov A., Nishikura K., Domori K., Ajioka Y. (2012) Alpha-methylacyl-coenzyme A racemase expression in neuroendocrine neoplasms of the stomach. Virchows Arch., 461: 169–175.
9. Bosman F.T., Carneiro F., Theise N.D. (2010) Nomenclature and classification of neuroendocrine neoplasms of digestive system. WHO Classification of Tumours of the Digestive System, 4 Ed. IARC, Lyon: 13–14.
10. Erickson L.A., Papouchado B., Dimashkieh H. et al.(2004) Cdx2 as a marker for neuroendocrine tumors of unknown primary sites. Endocr. Pathol.,15: 247–252.
11. Graham R.P., Shrestha B., Caron B.L. et al. (2013) Islet-1 is a sensitive but not entirely specific marker for pancreatic neuroendocrine neoplasms and their metastases. Am. J. Surg. Pathol., 37: 399–405.
12. Hermann G., Konukiewitz B., Schmitt A. et al. (2011) Hormonally defined pancreatic and duodenal neuroendocrine tumors differ in their transcription factor signatures: Expression of ISL 1, PDX1, NGN3, and CDX2. Virchows Arch., 459: 147–154.
13. Jamali M., Chetty R. (2008) Predicting prognosis in gastroenteropancreatic neuroendocrine tumors: an overview and the value of Ki-67 immunostaining. Endocr. Pathol., 19: 282–288.
14. Kim G.U., Kim K.J., Hong S.M. et al. (2013) Clinical outcomes of rectal neuroendocrine tumors ≤10 mm following endoscopic Resection. Endoscopy, 45(12): 1018–1023.
15. Kim S.H., Park C.H., Ki H.S. et al. (2013) Endoscopic treatment of duodenal neuroendocrine tumors. Clin. Endosc., 46(6): 656–661.
16. Klimstra D.S., Modlin I.R., Andrew N.V. et al. (2010) Pathology reporting of neuroendocrine tumors: application of the Delphic consensus process to the development of a minimum pathology data set. Am. J. Surg. Pathol., 34: 300–313.
17. Kloppel G., Rindi G., Perren A. et al. (2010) The ENETS and AJCC/UICC TNM classifications of the neuroendocrine tumors of the gastrointestinal tract and the pancreas a statement. Virchows Arch., 456: 595–597.
18. Koo J., Mertens R.B., Mirocha J.M. et al. (2012) Value of Islet 1 and PAX8 in identifying metastatic neuroendocrine tumors of pancreatic origin. Mod. Pathol., 25: 893–901.
19. Koo J., Zhou X., Moschiano E. et al. (2013) The immunohistochemical expression of Islet 1 and PAX8 by rectal neuroendocrine tumors should be taken into account in the differential diagnosis of metastatic neuroendocrine tumors of unknown primary origin. Endocr. Pathol., 24: 184–190.
20. La Rosa S., Rigoli E., Uccella S. et al. (2004) CDX2 as a marker of intestinal EC-cells and related well-differentiated endocrine tumors. Virchows Arch., 445: 248–254.
21. La Rosa S., Chiaravalli A.M., Placidi C. et al. (2010) TT F1 expression in normal lung neuroendocrine cells and related tumors. Immunohistochemical study comparing two different monoclonal antibodies. Virchows Arch., 457: 497–507.
22. Li T.-T., Qiu F., Qian Z.R. et al. (2014) Classification, clinicopathologic features and treatment of gastric neuroendocrine tumors. World J. Gastroenterol., 20 (1): 118–125.
23. Long K.B., Srivastava A., Hirsch M.S. et al. (2010) PAX8 expression in well-differentiated pancreatic endocrine tumors: Correlation with clinicopathologic features and comparison with gastrointestinal and pulmonary carcinoid tumors. Am. J. Surg. Pathol., 34: 723–729.
24. Modlin I.M., Oberg K., Chung D.C. et al. (2008) Gastroenteropancreatic neuroendorine tumors. Lancet Oncol., 9: 61–72.
25. Oberg K.E. (2010) Gastrointestinal neuroendocrine tumors. Ann. Oncol., 21(7): 73–80.
26. O’Toole D., Grossman A., Gross D. et al. (2009) ENETS Consensus Guidelines for the Standards of Carein Neuroendocrine Tumors: biochemical markers. Neuroendocrinol., 90: 194–202.
27. Ramage J.K., Ahmed A., Ardill J. et al. (2012) Guidelines for the management of gastroenteropancreatic neuroendocrine (including carcinoid) tumours (NETs). Gut., 61: 6–32.
28. Saqi A., Alexis D., Remotti F. et al. (2005) Usefulness of CDX2 and TTF-1 in differentiating gastrointestinal from pulmonary carcinoids. Am. J. Clin. Pathol., 123(3): 394–404.
29. Sangoi A.R., Ohgami R.S., Pai R.K. et al. (2011) PAX8 expression reliably distinguishes pancreatic well differentiated neuroendocrine tumors from ileal and pulmonary well-differentiated neuroendocrine tumors and pancreatic acinar cell carcinoma. Mod. Pathol., 24: 412–424.
30. Scherubl H., Jensen R.T., Cadiot G. et al. (2011) Management of early gastrointestinal neuroendocrine neoplasms. World J. Gastrointest. Endosc., 3(7): 133–139.
31. Schmitt A.M., Riniker F., Anlauf M. et al. (2008) Islet 1 (Isl1) expression is a reliable marker for pancreatic endocrine tumors and their metastases. Am. J. Surg. Pathol., 32: 420–425.
32. Sun X., Gong Y., Talamonti M.S. et al. (2002) Expression of cell adhesion molecules, CD44s and E-cadherin, and microvessel density in carcinoid tumors (XS, YG, MSR) and surgery (MST). Mod. Pathol., 15: 1333–1338.
33. Williams K., Motiani K., Giridhar P.V., Kasper S. (2013) CD44 integrates signaling in normal stem cell, cancer stem cell and (pre)metastatic niches. Exp. Biol. Med. (Maywood), 238: 324–338.
34. Zöller M. (2011) CD44: can a cancer-initiating cell profit from an abundantly expressed molecule? Nat. Rev. Cancer, 11: 254–267.
Иммуногистохимическая диагностика нейроэндокринных опухолей желудочно-кишечного тракта (обзор литературы и собственные исследования)
Национальный медицинский университет им. А.А. Богомольца, Киев
Государственное научное учреждение «Научно-практический центр профилактической и клинической медицины» Государственного управления делами, Киев
Медицинский центр «Универсальная клиника «Обериг», Киев
Медицинская (онкологическая) клиника «Инновация», Киев
Резюме. Нейроэндокринные опухоли (НЭП) пищеварительного тракта являются актуальной проблемой. В диагностике НЭП решающее значение имеет морфологическое исследование, что в дальнейшем играет важную роль в выборе лечебной тактики. Морфологическая диагностика НЭП базируется на классификации Всемирной организации здравоохранения и на критериях оценки прогноза НЭП. Основным в морфологической диагностике НЭП является иммуногистохимическое (ИГХ) исследование с использованием маркеров, позволяющих установить нейроэндокринную природу опухоли, и маркеров, определяющих потенциал злокачественности опухоли. Для верификации НЭП целесообразно использовать сочетание таких иммунных маркеров, как хромогранин А, синаптофизин, CD56, а для определения потенциала злокачественности — Кі-67, p53 и AMACR. На сегодня, с учетом данных ИГХ исследования, НЭП классифицируют на: 1) высокодифференцированные опухоли с низкой степенью злокачественности — НЭП G1; 2) высокодифференцированные опухоли с промежуточной степенью злокачественности — НЭП G2; 3) низкодифференцированные опухоли с высокой степеню злокачественности — нейроэндокринные карциномы. ИГХ исследование дает возможность определить локализацию первичной НЭП в случаях, когда первыми диагностируют метастазы. Для этого используют ИГХ маркеры: СDX2 — маркер кишечной локализации; PDX, ISL1, PAX8 — маркеры происхождения из поджелудочной железы. Для определения метастатического потенциала используют маркер CD44. Приведено три случая морфологической диагностики НЭП аппендикса, поджелудочной железы и прямой кишки из собственной практики.
нейроэндокринные опухоли, желудочно-кишечный тракт, диагностика, иммуногистохимические маркеры.
Адреса:
Олена Георгіївна Курик
01014, Київ, вул. Верхня, 5
Тел.: (044) 254-68-01
E-mail: O_Kurik@ukr.net














Leave a comment