Імунореактивність у хворих на меланому шкіри: зв’язок з морфологічними ознаками виразкування первинної пухлини та віддаленими результатами комбінованого лікування
Кукушкіна С.М., Фільчаков Ф.В., Коровін С.І., Грабовий О.М., Кукушкіна М.М., Весельская В.Н.
Резюме. Метою роботи було вивчення стану імунної системи у хворих на первинно-локалізовану меланому шкіри (ПЛМ) залежно від наявності виразкування первинної пухлини у взаємозв’язку з віддаленими результатами комбінованого лікування. Досліджено популяційний склад лімфоцитів (Лф) периферичної крові (ПК) у 47 хворих на ПЛМ ІВ–ІІС стадії до лікування. Імуногістохімічне дослідження первинної пухлини проведено у 12 пацієнтів. Період спостереження становив 3 роки. Встановлено, що незалежно від результатів лікування в ПК хворих з виразкуванням зростає відсоток CD16+-Лф та знижується відносний вміст CD3+-Лф (співвідношення CD4/CD8 збережено). За відсутності виразкування: у пацієнтів із рецидивом ці показники реєструють в межах норми, проте формується тенденція до зростання відносної кількості Т-Лф; у хворих без рецидиву збільшується відсоток CD8+-Лф, суттєво знижується індекс CD4/CD8. У пацієнтів із ПЛМ без та з виразкуванням первинної пухлини зі сприятливим перебігом захворювання відзначають високий рівень двічі позитивних Т-Лф у циркуляції. Вміст регуляторних Т-клітин в крові хворих на ПЛМ не залежить від перебігу онкологічного процесу та наявності виразкування пухлини. Висока щільність накопичення в пухлині CD8+- та CD45RO+-Лф пов’язана з кращими результатами лікування, при цьому найвищі показники інфільтрації пухлини CD45RO+-клітинами відмічають у хворих без рецидиву за наявності виразкування. Подальші дослідження стану імунної системи у пацієнтів із ПЛМ без та з виразкуванням пухлини дозволять удосконалити тактику протипухлинного лікування цієї категорії хворих та нададуть можливість прогнозувати ефективність такої терапії.

ВСТУП
Одним із шляхів підвищення ефективності лікування хворих зі злоякісними новоутвореннями, в тому числі меланомою шкіри (МШ), є персоналізація терапії з урахуванням прогностичних факторів [1–4].
На сьогодні лише декілька прогностичних факторів, зокрема критерії стадіювання захворювання, широко застосовуються в клінічній практиці при МШ [1, 5–7]. До таких критеріїв у хворих на первинно-локалізовану МШ (ПЛМ) відносять поверхневе виразкування первинної пухлини [1]. Згідно з даними Американського об’єднаного комітету раку, при однаковій категорії T (класифікація за системою TNM) виживаність пацієнтів із виразкуванням первинної МШ є нижчою, ніж у хворих без виразкування, і дуже близькою до цього показника при МШ без виразкування вищої категорії T. Наприклад, 5-річна виживаність пацієнтів без виразкування МШ при Т3а становить 79%, а хворих з виразкуванням при T2b — 82%, в обох випадках стадія захворювання — ІІА [8]. Також показано, що виразкування МШ корелює з наявністю мікрометастазів у сторожових лімфатичних вузлах [9] та розглядається як фактор ризику розвитку метастазів у головному мозку [10].
Вперше дані про несприятливе прогностичне значення виразкування меланоми опубліковано A.C. Allen та S. Spitz у 1953 р. [11–13]. Протягом багатьох років наявність виразкування первинної пухлини пов’язували з підвищеним ризиком розвитку рецидиву та смертності хворих на МШ [13–16], і майже півстоліття потому було показано, що ця патогістологічна характеристика меланоми асоціюється з кращою клінічною відповіддю на інтерферонотерапію у цієї категорії хворих, тобто є сприятливим предиктивним фактором. Такі висновки зроблено на основі аналізу результатів двох великих клінічних контрольованих рандомізованих випробувань (EORTC 18952 та 18991) застосування α-2b-інтерферону в ад’ювантному режимі у 2644 хворих на МШ ІІ–ІІІ стадії, які продемонстрували, що за умов відсутності макрометастазів у регіонарних лімфатичних вузлах інтерферонотерапія вірогідно підвищує як безрецидивну, так і загальну виживаність хворих із морфологічними ознаками виразкування первинної пухлини [14, 17, 18].
Отже, виразкування первинної пухлини має важливе значення щодо перебігу захворювання у пацієнтів із МШ. Проте з чим саме пов’язане прогностичне значення виразкування МШ, досі залишається нез’ясованим.
Метою нашого дослідження було вивчити стан імунної системи у хворих на ПЛМ залежно від наявності виразкування первинної пухлини у взаємозв’язку з віддаленими результатами комбінованого лікування.
ОБ’ЄКТ і МЕТОДИ ДОСЛІДЖЕННЯ
У дослідження залучено 47 хворих (27 жінок та 20 чоловіків) на МШ ІВ–ІІС стадії віком 26–74 років (середній вік — 54,3 року).
Критерії включення в дослідження: письмова згода пацієнта на участь у дослідженні; чоловіки та жінки; вік хворих від 18 до 75 років; гістологічне підтвердження діагнозу; локалізація первинної пухлини на шкірі кінцівок або тулуба; стан хворого за шкалою ECOG 0–1 бал.
Критерії виключення із дослідження: клінічні ознаки ураження регіонарних лімфатичних вузлів; наявність транзитних метастазів; наявність віддалених метастазів; серйозна супутня патологія; наявність іншого онкологічного захворювання в анамнезі; для хворих жіночої статі — вагітність або лактація.
До початку лікування виконували стандартне обстеження, яке включало рентгенографію органів грудної порожнини, ультразвукове обстеження органів черевної порожнини та регіонарних лімфатичних вузлів.
Пацієнти отримували комбіноване лікування: широке висічення первинної пухлини та ад’ювантну інтреферонотерапію (27 осіб одержували рекомбінантний α-2b-інтерферон по 3 млн МО 3 рази на тиждень протягом 12 міс; 20 осіб спочатку отримували рекомбінантний γ-інтерферон по 500 тис. МО у 1, 3, 5, 7 та 9-й день з подальшим курсом α-2b-інтерферону, як описано вище).
Період спостереження за хворими — 3 роки.
Усім пацієнтам до лікування проводили імунологічне дослідження периферичної крові (ПК), 12 хворим виконано імуногістохімічне дослідження первинної пухлини.
Як контрольну групу обстежено 60 практично здорових людей (ПЗЛ).
Імунофенотипічні характеристики лімфоцитів (Лф) ПК визначали методом проточної цитофлуориметрії з використанням моноклональних антитіл до антигенів CD3, CD19, CD4, CD8, CD16, мічених FITC («Сорбент», Росія), CD5-PE («Beckman Coulter», США), CD3-PC5/CD4-RD1/CD8-FITC («Beckman Coulter», США). Субпопуляції В-Лф (В1- та В2-клітин) визначали серед CD19+-клітин лімфоцитарного гейту за наявністю або відсутністю експресії CD5 (відповідно CD19+CD5+ та CD19+CD5–); двічі позитивні (ДП) Т-Лф визначали серед CD3+-клітин лімфоцитарного гейту за одночасною експресією CD4 та CD8 (CD3+CD4+CD8+); регуляторні Т-клітини (Трег) визначали серед CD4+-Лф за наявністю високої експресії CD25 у поєднанні з низькою або негативною експресією CD127 (CD4+CD25highCD127low-neg). Результати підраховували на проточному цитофлуориметрі FACScan («Becton Dickinson», США) з використанням програми «Cell Quest».
Імуногістохімічне дослідження первинної пухлини проводили на матеріалі, отриманому при хірургічному лікуванні хворих. Операційний матеріал фіксували в забуференному 10% розчині формаліну (pH 7,4) й ущільнювали в парапласт із застосуванням гістіопроцесора Histos-5 («Milestone», Італія). Із парафінових блоків виготовляли гістологічні зрізи товщиною 5 мкм за допомогою мікротома Microm НМ325 («Thermo Scientific», Німеччина). Для загальної оцінки новоутворень зрізи фарбували гематоксиліном та еозином. Імуногістохімічні реакції проводили з використанням антитіл до антигенів людини: поліклональних CD3, моноклональних CD8 (сlone C8/144B), CD20 (сlone L26), CD45RO (сlone UCHL1) («Dako», Данія), CD45RA (сlone ALB11) («Beckman Coulter», США) — відповідно до рекомендацій виробника. Для візуалізації продуктів імуногістохімічної реакції застосовували систему детекції EnVisionTM FLEX («Dako», Данія) з використанням як хромогену 3-аміно-9-етилкарбазолу («DBS», США). Зрізи дофарбовували гематоксиліном Gill. Як позитивний контроль використовували тканинні зразки з певною позитивною реактивністю, а для негативного контролю проводили процедуру без застосування первинних антитіл. Отримані препарати вивчали і фотографували за допомогою мікроскопа Nikon Eclipse 80i з камерою DS-5SMc/L2 («Nikon», Японія). Оцінку вмісту мічених клітин у препаратах проводили напівкількісним способом, відображуючи результати в умовних одиницях (ум. од.) від 0 до 3: «0» — відсутність, «1» — поодинокі клітини, «2» — 10–30 клітин, «3» — >30 клітин у полі зору.
Статистичну обробку результатів проводили з використанням програм Excel (MS Office 2003, XP) та Statіstіca 6.0 (StatSoft Inc., США). Для визначення вірогідності розбіжностей (р) між показниками застосовували t-критерій Стьюдента та критерій Манна — Уїтні. Вибір параметричних чи непараметричних критеріїв аналізу базувався на визначенні характеру розподілу даних за критерієм Шапіро — Уїлка. Розбіжності оцінювали як вірогідні при р<0,05. Результати дослідження в таблицях та тексті представлено у вигляді медіани, 10-го та 90-го процентилів; на рисунках — у вигляді індивідуальних даних та медіани.
РЕЗУЛЬТАТИ ТА ЇХ ОБГОВОРЕННЯ
При вивченні віддалених результатів комбінованого лікування хворих встановлено, що за 3-річний період спостереження у 12 із 47 пацієнтів виникли метастази в регіонарних лімфатичних вузлах або/та у віддалених органах. Таким чином, всі хворі були розподілені на дві групи: з рецидивом (n=12) та безрецидивним перебігом захворювання (n=35).
Як видно з наведених в табл. 1 даних, загальний вміст Лф в ПК пацієнтів із ПЛМ не залежить від результатів комбінованого лікування і реєструється в межах нормальних значень. Разом з тим в пулі циркулюючих Лф відмічають зменшення абсолютної кількості В-клітин, яка за умов безрецидивного перебігу захворювання є вірогідно меншою за показник у ПЗЛ і зумовлена дефіцитом переважно В2-Лф.
Таблиця 1. Популяційний склад Лф ПК у хворих на ПЛМ залежно від перебігу захворювання
| Імунологічні показники | Одиниці вимірювання | Хворі на ПЛМ | ПЗЛ | |
| Без рецидиву захворювання | З рецидивом захворювання | |||
| Лф | ×10/л | 1,54 (1,08; 2,24) | 1,68 (0,95; 2,78) | 1,77 (1,17; 2,54) |
| CD3 | % | 71,0 (60,0; 81,0) | 70,0 (56,0; 81,0) | 72,0 (63,0; 79,0) |
| ×10/л | 1,06 (0,66; 1,60) | 1,10 (0,69; 1,94) | 1,29 (0,82; 1,93) | |
| CD4 | % | 44,0 (36,0; 53,0) | 45,5 (36,0; 57,0) | 42,5 (35,0; 48,0) |
| ×10/л | 0,67 (0,40; 0,99) | 0,75 (0,44; 1,25) | 0,71 (0,53; 1,06) | |
| CD8 | % | 29,0 (17,0 37,0) | 25,5 (20,0; 30,0) | 26,0 (18,0; 35,0) |
| ×10/л | 0,44 (0,20; 0,82) | 0,47 (0,26; 0,69) | 0,45 (0,24; 0,75) | |
| CD4/CD8 | ум. од. | 1,41 (1,00; 2,75) | 1,86 (1,20; 2,11) | 1,78 (1,03; 2,93) |
| CD4CD25CD127 | % | 3,0 (1,9; 4,1) | 3,3 (2,1; 4,8) | 2,8 (1,9; 3,7) |
| ×10/л | 0,05 (0,02; 0,08) | 0,07 (0,02; 0,10) | 0,05 (0,03; 0,09) | |
| CD3CD4CD8 | % | 2,5 (1,4; 4,2)• | 1,7 (1,3; 2,3) | 1,4 (1,1; 1,8) |
| ×10/л | 0,04 (0,02; 0,05)• | 0,02 (0,02; 0,04) | 0,02 (0,02; 0,03) | |
| CD16 | % | 22,0 (10,0; 34,0) | 24,5 (14,0; 40,0) | 20,0 (14,0; 32,0) |
| ×10/л | 0,34 (0,14; 0,58) | 0,40 (0,26; 0,66) | 0,34 (0,24; 0,55) | |
| CD19 | % | 6,1 (3,9; 8,6)• | 6,3 (3,2; 8,8) | 6,9 (4,1; 10,1) |
| ×10/л | 0,09 (0,05; 0,18)• | 0,11 (0,05; 0,20) | 0,13 (0,08; 0,20) | |
| CD195 | % | 2,2 (1,2; 4,1) | 2,6 (0,5; 4,8) | 2,8 (1,7; 4,2) |
| ×10/л | 0,04 (0,01; 0,07) | 0,04 (0,01; 0,10) | 0,05 (0,03; 0,08) | |
| CD195 | % | 3,6 (2,3; 5,1) | 3,1 (2,0; 6,0) | 4,3 (2,2; 6,6) |
| ×10/л | 0,06 (0,03; 0,09)• | 0,05 (0,03; 0,18) | 0,07 (0,04; 0,13) | |
| CD195/CD195 | ум. од. | 0,62 (0,30; 1,35) | 0,56 (0,25; 1,85) | 0,66 (0,19; 1,04) |
•Розбіжність при порівнянні з показником у ПЗЛ статистично вірогідна (р<0,05).
Відносний вміст Т-клітин в обох групах хворих визначається в межах нормальних значень, проте у пацієнтів без рецидиву, на відміну від хворих з прогресуванням пухлинного процесу, спостерігається тенденція до зниження індексу співвідношення субпопуляцій Т-хелперів і цитотоксичних Т-Лф (ЦТЛ). Рівень Трег реєструють, незалежно від особливостей перебігу захворювання, на рівні дещо вищому, ніж у ПЗЛ. Відносний вміст ДП Т-Лф є високим в групі осіб із безрецидивним перебігом захворювання, в той час як в групі пацієнтів із рецидивом визначається в межах нормальних значень. Важливо зазначити, що загальна кількість ДП Т-Лф у ПК хворих із кращою клінічною відповіддю на комбіноване лікування є вищою не лише за таку у ПЗЛ, але й має тенденцію до зростання щодо відповідного показника у пацієнтів, менш чутливих до аналогічної терапії. У хворих обох досліджуваних груп формується тенденція до збільшення частки природних кілерних клітин (ПКК) серед циркулюючих Лф, зменшується відносна кількість В-клітин, яка у пацієнтів із безрецидивним перебігом захворювання є вірогідно меншою порівняно з ПЗЛ.
Таким чином, хворі на ПЛМ із різною клінічною відповіддю на комбіноване лікування суттєво не відрізняються між собою за популяційним складом циркулюючих Лф. Проте у пацієнтів із безрецидивним перебігом захворювання до початку лікування реєструють високий вміст ДП Т-Лф порівняно з ПЗЛ і більш виражений дефіцит В-Лф, зокрема В2-клітин, у ПК.
Дослідження популяційного складу та функціональної активності Лф ПК у хворих на ПЛМ продемонструвало наявність низки відмінностей між імунологічними показниками у пацієнтів без та із виразкуванням первинної пухлини [19]. У зв’язку з цим ми проаналізували отримані дані з урахуванням особливостей перебігу захворювання та залежно від наявності виразкування МШ (серед хворих без прогресування пухлинного процесу виразкування первинної пухлини верифіковано у 13 із 35 осіб, серед пацієнтів з рецидивом — у 8 з 12).
Як свідчать наведені у табл. 2 дані, у пацієнтів без пролонгації захворювання за умов відсутності виразкування МШ популяційний склад Лф ПК характеризується нормальним вмістом Т-клітин, зокрема Т-хелперів, та суттєвим зростанням відносної кількості ЦТЛ щодо цього показника у ПЗЛ. Визначається низький (при порівнянні з нормальним) рівень імунорегуляторного індексу (CD4/CD8). При цьому формується тенденція до зростання імунорегуляторного індексу щодо показника у хворих з виразкуванням. Кількість (відносна та абсолютна) ДП Т-Лф суттєво перевищує відповідні показники у ПЗЛ. Вміст ПКК відповідає нормальним значенням. Загальна кількість В-Лф у ПК у таких хворих є вірогідно нижчою, ніж у ПЗЛ, що зумовлено розвитком дефіциту В2-клітин у циркуляції. Водночас на тлі збереженого в межах нормальних значень відсотка В1-клітин формується тенденція до зменшення частки В2-клітин.
Таблиця 2. Популяційний склад Лф ПК у хворих на ПЛМ залежно від наявності виразкування первинної пухлини та перебігу захворювання
|
Імунологічні показники |
Одиниці вимірювання | Хворі на ПЛМ | ПЗЛ | |||
| Без рецидиву захворювання | З рецидивом захворювання | |||||
| Без виразкування первинної пухлини | З виразкуванням первинної пухлини | Без виразкування первинної пухлини | З виразкуванням первинної пухлини | |||
| Лф | ×10/л | 1,51 (1,25; 2,35) | 1,54 (1,08; 2,17) | 1,41 (0,82; 3,08) | 1,68 (1,49; 2,78) | 1,77 (1,17; 2,54) |
| CD3 | % | 72,5 (64,0; 82,0) | 70,0 (51,0; 73,0)•* | 79,0 (69,0; 85,0) | 69,5 (45,0; 81,0) | 72,0 (63,0; 79,0) |
| ×10/л | 1,06 (0,84; 1,78) | 1,06 (0,53; 1,46) | 1,18 (0,56; 2,37) | 1,10 (0,69; 1,94) | 1,29 (0,82; 1,93) | |
| CD4 | % | 44,0 (36,0; 54,0) | 44,0 (38,0; 52,0) | 55,5 (36,0; 61,0) | 45,0 (29,0; 57,0) | 42,5 (35,0; 48,0) |
| ×10/л | 0,69 (0,48; 0,98) | 0,64 (0,28; 0,99) | 0,81 (0,29; 1,70) | 0,75 (0,44; 1,25) | 0,71 (0,53; 1,06) | |
| CD8 | % | 31,5 (24,0; 37,0)• | 20,0 (17,0; 35,0)* | 27,5 (20,0; 35,0) | 25,0 (17,0; 30,0) | 26,0 (18,0; 35,0) |
| ×10/л | 0,47 (0,31; 0,84) | 0,33 (0,18; 0,57)* | 0,41 (0,19; 0,83) | 0,47 (0,26; 0,69) | 0,45 (0,24; 0,75) | |
| CD4/CD8 | ум. од. | 1,34 (1,00; 2,17)• | 2,11 (1,08; 2,76) | 2,02 (1,03; 3,05) | 1,84 (1,20; 2,11) | 1,78 (1,03; 2,93) |
| CD3CD4CD8 | % | 2,5 (1,4; 3,2)• | 2,7 (1,9; 2,9)• | 1,3 | 2,0 (1,4; 2,3) | 1,4 (1,1; 1,8) |
| ×10/л | 0,04 (0,02; 0,05)• | 0,04 (0,03; 0,05)• | 0,02 | 0,03 (0,02; 0,04) | 0,02 (0,02; 0,03) | |
| CD16 | % | 19,0 (9,0; 31,0) | 27,0 (20,0; 41,0)•* | 16,0 (10,0; 40,0) | 28,5 (14,0; 43,0) | 20,0 (14,0; 32,0) |
| ×10/л | 0,28 (0,14; 0,54) | 0,42 (0,22; 0,58) | 0,30 (0,10; 0,52) | 0,42 (0,28; 43,0) | 0,34 (0,24; 0,55) | |
| CD19 | % | 6,2 (3,9; 8,6) | 5,2 (4,0; 8,4) | 5,9 (2,5; 8,9) | 7,0 (3,2; 8,8) | 6,9 (4,1; 10,1) |
| ×10/л | 0,09 (0,06; 0,18)• | 0,08 (0,03; 0,14)• | 0,06 (0,05; 0,27) | 0,12 (0,06; 0,22) | 0,13 (0,08; 0,20) | |
| CD195 | % | 2,45 (1,45; 4,45) | 1,90 (1,00; 3,90) | 2,60 (0,50; 3,20) | 2,8 (1,20; 4,8) | 2,8 (1,7; 4,2) |
| ×10/л | 0,04 (0,02; 0,10) | 0,03 (0,01; 0,05)• | 0,02 (0,01; 0,10) | 0,04 (0,02; 0,08) | 0,05 (0,03; 0,08) | |
| CD195 | % | 3,25 (2,20; 5,25) | 3,8 (3,1; 5,0) | 3,1 (2,0; 5,7) | 3,1 (2,0; 6,0) | 4,3 (2,2; 6,6) |
| ×10/л | 0,05 (0,04; 0,10)• | 0,06 (0,02; 0,09) | 0,04 (0,03; 0,18) | 0,06 (0,04; 0,09) | 0,07 (0,04; 0,13) | |
| CD195/CD195 | ум. од. | 0,68 (0,45; 1,82) | 0,52 (0,28; 0,87)* | 0,56 (0,25; 0,84) | 0,56 (0,43; 1,85) | 0,66 (0,19; 1,04) |
•Розбіжність при порівнянні з показником у ПЗЛ статистично вірогідна (р<0,05).
*Розбіжність при порівнянні з показником у хворих без рецидиву, у яких відсутнє виразкування первинної пухлини, статистично вірогідна (р<0,05).
Індивідуальні дані (n=1).
На відміну від вищезазначеного, за наявності виразкування МШ у пацієнтів без пролонгації захворювання реєструється зниження відсотка Т-Лф при порівнянні з показником як у ПЗЛ, так і у хворих без виразкування. Відзначено тенденцію до зниження відносної кількості ЦТЛ, проте суттєвих відмінностей порівняно з ПЗЛ не виявлено. Натомість, реєструються вірогідні відмінності між групами хворих без та із виразкуванням МШ за відносною та абсолютною кількістю ЦТЛ. Характер змін вмісту ДП Т-Лф ПК у пацієнтів із виразкуванням пухлини відповідає аналогічному показнику у хворих без виразкування. Разом з тим при виразкуванні МШ відбувається збільшення відносного вмісту ПКК, відсоток яких є суттєво вищим за відповідний показник як у ПЗЛ, так і у хворих без виразкування. Вміст В-Лф ПК у таких пацієнтів, як і у хворих без виразкування МШ, є низьким, що пов’язано зі зменшенням кількості В1-клітин.
Зазначимо, що у пацієнтів обох досліджуваних груп зміни співвідношення субпопуляцій В-Лф (В1/В2) мають діаметрально протилежний характер: за наявності виразкування спостерігається тенденція до зростання цього показника, за його відсутності — до зменшення. Хоча обидві групи хворих за цим показником суттєво не відрізняються від групи ПЗЛ, проте вірогідно різняться при порівнянні між собою.
Аналіз популяційного складу Лф ПК у хворих із прогресуванням пухлинного процесу показав таке: за відсутності виразкування МШ спостерігається тенденція до підвищення відносного вмісту Т-Лф, зокрема Т-хелперів, а відносна кількість ПКК та В-Лф (як В1-, так і В2-клітин) суттєво не відрізняється від нормальних значень.
За наявності виразкування первинної пухлини у хворих із пролонгацією пухлинного процесу відносна кількість Т-Лф та їх субпопуляцій (Т-хелперів і ЦТЛ) реєструється в межах нормальних значень, відсоток ПКК дещо збільшується. При цьому абсолютна кількість ПКК має тенденцію до зростання як щодо відповідного показника у ПЗЛ, так і у хворих без виразкування. Вміст В-клітин у пулі циркулюючих Лф та індекс В1/В2 відповідають таким у ПЗЛ і у хворих без виразкування. Проте, якщо у пацієнтів без виразкування МШ відмічають тенденцію до зниження загального вмісту В-Лф, то у хворих із виразкуванням зазначений показник реєструють у межах нормальних значень. Серед хворих, у яких упродовж 3 років спостереження виявлено метастази, рівень у крові ДП Т-Лф досліджено лише у 4 осіб (у групі без виразкування — 1 особа, з виразкуванням — 3), що не дозволило нам охарактеризувати групи пацієнтів із рецидивом захворювання за цим показником.
Як видно з наведених в табл. 3 даних, у хворих на ПЛМ абсолютний вміст Трег у ПК та їх частка в пулі циркулюючих Лф не залежить від віддалених результатів лікування, аналіз яких проводили з урахуванням наявності виразкування первинної пухлини. Оцінка співвідношення кількості Трег та ЦТЛ (Трег/CD8) або ПКК (Трег/CD16) показала, що у пацієнтів без виразкування МШ значення цих індексів не відрізняються від нормальних, але спостерігається тенденція до збільшення співвідношення Трег/CD16. Навпаки, у хворих із виразкуванням пухлини, незалежно від ефективності лікування, відбувається суттєве підвищення індексу Трег/CD8 порівняно із ПЗЛ та хворими без пролонгації онкологічного процесу з відсутністю виразкування. Індекс Трег/CD16 у хворих із виразкуванням реєструють у межах нормальних значень.
Таблиця 3. Вміст Трег у ПК у хворих на ПЛМ залежно від наявності виразкування первинної пухлини та перебігу захворювання
| Імунологічні показники | Одиницівимірювання | Хворі на ПЛМ | ПЗЛ | |||
| Без рецидиву захворювання | З рецидивом захворювання | |||||
| Без виразкування первинної пухлини | З виразкуванням первинної пухлини | Без виразкування первинної пухлини | З виразкуванням первинної пухлини | |||
| Трег | % | 3,0 (1,9; 4,5) | 3,1 (2,7; 3,7) | 3,3 (2,1; 4,3) | 3,1 (2,5; 4,8) | 2,8 (1,9; 3,7) |
| ×10/л | 0,05 (0,03; 0,09) | 0,05 (0,02; 0,06) | 0,08 (0,02; 0,10) | 0,06 (0,04; 0,09) | 0,05 (0,03; 0,09) | |
| Трег/CD8 | ум. од. | 0,10 (0,08; 0,14) | 0,14 (0,12; 0,18)•* | 0,12 (0,06; 0,15) | 0,15 (0,11; 0,19)•* | 0,11 (0,06; 0,17) |
| Трег/CD16 | ум. од. | 0,17 (0,13; 0,25) | 0,10 (0,09; 0,17) | 0,19 (0,05; 0,31) | 0,12 (0,10; 0,14) | 0,14 (0,06; 0,23) |
•Розбіжність при порівнянні з показником у ПЗЛ статистично вірогідна (р<0,05).
*Розбіжність при порівнянні з показником у хворих без рецидиву, у яких відсутнє виразкування первинної пухлини, статистично вірогідна (р<0,05).
Таким чином, у популяційному складі Лф ПК у пацієнтів із ПЛМ із безрецидивним перебігом захворювання до початку комбінованого лікування визначається тенденція до зменшення співвідношення Т-хелперів та ЦТЛ, що характерно переважно для хворих без виразкування пухлини. При цьому, за умов відсутності виразкування, фіксують значне зростання відсотка ЦТЛ, проте суттєвого збільшення загальної кількості цих Лф у ПК не виявлено. Початковий рівень відносного вмісту ПКК у ПК хворих із безрецидивним перебігом патологічного процесу відповідає нормальним значенням. Разом з тим його вміст різний при розподіленні на групи з урахуванням наявності виразкування пухлини. Так, у пацієнтів з виразкуванням частка ПКК у пулі циркулюючих Лф є високою і суттєво перевищує рівень як у ПЗЛ, так і у хворих без виразкування. Дефіцит В-Лф у пацієнтів без пролонгації захворювання за умов відсутності виразкування МШ спричинений зменшенням кількості В2-клітин, а у разі його наявності — зменшенням кількості В1-клітин, що зумовлює різний індекс співвідношення цих субпопуляцій.
У хворих із прогресуванням пухлинного процесу початкова відносна кількість Т-Лф реєструється у межах нормальних значень і характеризується збільшенням за відсутності виразкування пухлини. При цьому, якщо за умов кращої клінічної відповіді на лікування у хворих без виразкування пухлини зростає відсоток ЦТЛ, то при низькій ефективності такої терапії відмічають тенденцію до підвищення відсотка Т-хелперів. Однак суттєвих відмінностей імунорегуляторного індексу залежно від наявності виразкування МШ хворих із рецидивом не виявлено. Характер змін вмісту ПКК залежно від патогістологічних особливостей пухлини збігається з показником у пацієнтів без пролонгації захворювання, а відсутність вірогідних розбіжностей у такому разі можна пояснити невеликою кількістю спостережень у групі хворих без рецидиву. Загальний вміст В-Лф у ПК пацієнтів із пролонгацією пухлинного процесу відмічається на рівні нормальних значень, разом з тим за умов відсутності виразкування спостерігається тенденція до його зниження. Зазначимо, що за наявності виразкування пухлини початковий рівень абсолютної кількості В-Лф у ПК хворих із ефективним лікуванням є меншим, ніж у пацієнтів із низькою ефективністю комбінованого лікування (р=0,080). На відміну від осіб без пролонгації захворювання, у пацієнтів з рецидивом співвідношення В1- та В2-Лф не залежить від наявності виразкування пухлини.
Початковий вміст Трег в ПК, а також співвідношення Трег та клітин-ефекторів (ЦТЛ або ПКК) у хворих на ПЛМ не пов’язаний з ефективністю комбінованого лікування. Ці показники мають різний характер змін за наявності та відсутності виразкування МШ: у пацієнтів із виразкуванням підвищується індекс Трег/CD8, а у хворих без виразкування — індекс Трег/CD16.
Вміст ДП Т-Лф в ПК хворих зі сприятливим перебігом захворювання визначається на підвищеному рівні, при цьому збільшення цього показника спостерігається як за наявності, так і відсутності виразкування пухлини.
Отже, у пацієнтів без виразкування МШ, незалежно від результатів комбінованого лікування, початковий рівень ПКК та Т-Лф відповідає нормальному, проте в осіб з кращою клінічною відповіддю на терапію реєструється велика частка ЦТЛ, високий абсолютний і відносний вміст ДП Т-Лф та низький індекс CD4/CD8. У хворих із виразкуванням МШ відмічають зниження відносної кількості Т-Лф та зростання відносної кількості ПКК (у пацієнтів без рецидиву — суттєве, з рецидивом — на рівні тенденції), проте лише в осіб із безрецидивним перебігом захворювання визначається високий вміст ДП Т-Лф. Популяція В-Лф характеризується однаковим співвідношенням В1- та В2-клітин у всіх хворих з рецидивом, в той час як при безрецидивному перебігу захворювання відмічено суттєву різницю між пацієнтами без та із виразкуванням пухлини.
Особливості лімфоїдної інфільтрації залежно від морфологічних ознак поверхневого виразкування первинної пухлини наведено на рис. 1.
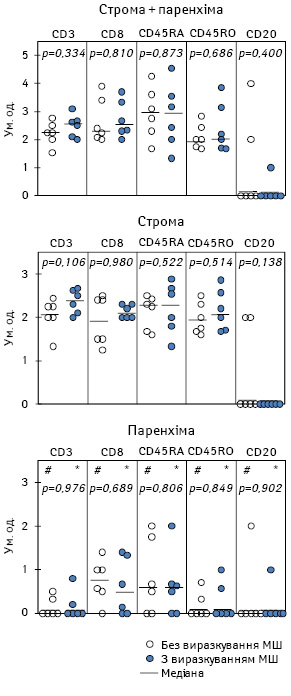
Як видно, щільність Т- та В-клітин, а також наївних Лф (CD45RA+) і клітин імунологічної пам’яті (CD45RО+) у пухлинній тканині у хворих без поверхневого виразкування (n=6) відповідає такій у пацієнтів із виразкуванням (n=6). При цьому популяційний склад Лф, які інфільтрують окремо строму або паренхіму, не залежить від досліджуваного патогістологічного параметра пухлини. В обох випадках кількість клітин, що експресують CD3-, CD8-, CD45RA- та CD45RO-антигени, в стромі первинної МШ є вірогідно більшою, ніж у паренхімі.
Дослідження лімфоїдної інфільтрації пухлини залежно від особливостей перебігу захворювання за 3-річний період спостереження (рис. 2) показало, що у пацієнтів із безрецидивним перебігом (n=7) суттєво зростає щільність Т-Лф, зокрема ЦТЛ, та відмічається тенденція до збільшення кількості клітин імунологічної пам’яті при порівнянні з хворими з рецидивом патологічного процесу (n=5). Слід зауважити, що згідно з раніше отриманими даними [20] ми не виявили вірогідних відмінностей між інтенсивністю лімфоїдної інфільтрації первинної пухлини (строми та паренхіми разом узятих) залежно від 1-річних результатів комбінованого лікування у цих хворих. Разом з тим детальний аналіз показав, що у хворих із безрецидивним перебігом пухлинного процесу в паренхімі МШ була суттєво підвищена щільність накопичення CD8+-клітин. З іншого боку, у пацієнтів без прогресування захворювання строма пухлини більш виражено інфільтрована Лф, які експресують CD45RА- і CD45RO-антигени.
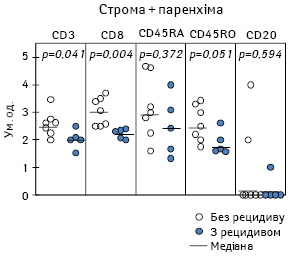
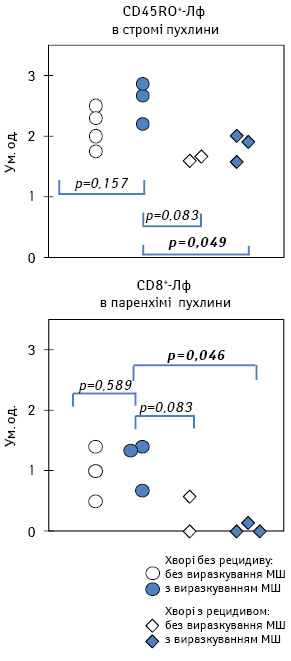
Як видно з рис. 3, висока щільність клітин імунологічної пам’яті в стромі МШ у хворих зі сприятливим перебігом захворювання більшою мірою зумовлена зростанням цього показника у пацієнтів з верифікованим виразкуванням пухлини. У свою чергу, високий рівень накопичення ЦТЛ у паренхімі МШ у таких пацієнтів відзначається за умови як відсутності, так і наявності досліджуваного патогістологічного параметра.
За наявності поверхневого виразкування МШ пацієнти з різним перебігом захворювання упродовж 3 років спостереження мають певні особливості лімфоїдної інфільтрації пухлини (рис. 4). Так, у хворих з кращою клінічною відповіддю на лікування (n=3), на відміну від пацієнтів із прогресуванням пухлинного процесу (n=3), МШ більш виражено інфільтрована Т-Лф, зокрема ЦТЛ.
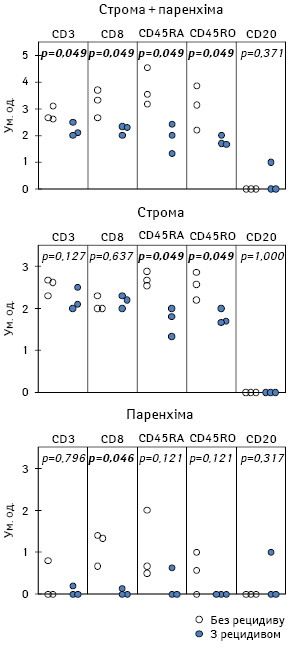
У хворих із виразкуванням МШ, незалежно від результатів лікування, Лф, які інфільтрують первинну пухлину, однаковою мірою представлені як наївними клітинами, так і клітинами імунологічної пам’яті. Проте щільність Лф з таким фенотипом у тканині пухлини є значно вищою у пацієнтів зі сприятливим перебігом захворювання.
Отже, дослідження лімфоцитарної інфільтрації пухлинної тканини показало, що збільшення частки ЦТЛ та/або ефекторних Т-клітин пам’яті серед Лф імунного запалення у хворих на ПЛМ пов’язано зі сприятливим перебігом онкологічного процесу. Найбільшу щільність клітин імунологічної пам’яті в тканині МШ відзначають у хворих з кращою клінічною відповіддю на комбіноване лікування за умов наявності виразкування первинної пухлини.
На нашу думку, комплексне (ПК, первинна пухлина) лабораторне дослідження імунореактивності організму є важливим для визначення індивідуальних особливостей перебігу захворювання та прогнозування відповіді на лікування у хворих на ПЛМ.
ВИСНОВКИ
1. У пацієнтів із ПЛМ ІВ–ІІС стадії із 3-річним безрецидивним перебігом захворювання, на відміну від хворих з прогресуванням пухлинного процесу, до початку лікування реєструють більш виражений дефіцит В-Лф в ПК та високий вміст ДП Т-Лф.
2. У хворих на ПЛМ з безрецидивним перебігом патологічного процесу відсутність виразкування первинної пухлини асоціюється зі збільшенням відносної кількості ЦТЛ та низьким індексом CD4/CD8, а наявність виразкування — зі зниженням відносної кількості Т-Лф та зростанням відносного вмісту ПКК.
3. Відсутність виразкування первинної пухлини у хворих на ПЛМ з прогресуванням пухлинного процесу асоціюється зі збільшенням відносної кількості Т-Лф при збереженому індексі CD4/CD8, наявність виразкування — зі зниженням відносної кількості Т-Лф та зростанням відносного вмісту ПКК.
4. Збільшення частки ЦТЛ та/або ефекторних Т-клітин пам’яті серед Лф імунного запалення в первинній пухлині у пацієнтів із ПЛМ асоціюється зі сприятливим перебігом захворювання. Найбільшу щільність клітин імунологічної пам’яті в пухлинній тканині відмічають за наявності виразкування у хворих на ПЛМ з кращою клінічною відповіддю на комбіноване лікування.
СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ
1. Чехун В.Ф. (2012) От системной биологии рака до методологии персонализированного лечения. Онкология, 14(2): 84–88.
2. Gogas H., Eggermont A.M., Hauschild A. et al. (2009) Biomarkers in melanoma. Ann. Oncol., 20(suppl. 6): vi8–vi13.
3. Mahoney K.M., Atkins M.B. (2014) Prognostic and predictive markers for the new immunotherapies. Oncology (Williston Park), 28(suppl. 3): 39–48.
4. Weinstein D., Leininger J., Hamby C., Safai B. (2014) Diagnostic and prognostic biomarkers in melanoma. J. Clin. Aesthet. Dermatol., 7(6): 13–24.
5. Karagiannis P., Fittall M., Karagiannis S.N. (2015) Evaluating biomarkers in melanoma. Front. Oncol., 4: 383.
6. Redman J.M., Gibney G.T., Atkins M.B. (2016) Advances in immunotherapy for melanoma. BMC Medicine, 14: 20.
7. Xu M.J., Dorsey J.F., Amaravadi R. et al. (2016) Circulating tumor cells, DNA, and mRNA: potential for clinical utility in patients with melanoma. Oncologist, 21(1): 84–94.
8. Balch C.M., Gershenwald J.E., Soong S. et al. (2009) Final version of 2009 AJCC melanoma staging and classification. J. Clin. Oncol., 27(36): 6199–6206.
9. Grande S.H., Reinke K., Shaikh L. et al. (2006) Prognostic significance of extent of ulceration in primary cutaneous melanoma. Am. J. Surg. Pathol., 30(11): 1396–1400.
10. Qian M., Ma M.W., Fleming N.H. et al. (2013) Clinicopathological characteristics at primary melanoma diagnosis as risk factors for brain metastasis. Melanoma Res., 23(6): 461–467.
11. Allen A.C., Spitz S. (1953) Malignant melanoma. А clinicopathological analysis of the criteria for diagnosis and prognosis. Cancer, 6(1): 1–45.
12. Moll E.H., Fu Y., Qian Y. et al. (2015) Immune biomarkers are more accurate in prediction of survival in ulcerated than in non-ulcerated primary melanomas. Cancer Immunol. Immunother., 64(9): 1193–1203.
13. Balch C.M., Wilkerson J.A., Murad T.M. et al. (1980) The prognostic significance of ulceration of cutaneous melanoma. Cancer, 45(12): 3012–3017.
14. Eggermont A.M., Spatz A., Hauschild V., Robert C. (2012) Is ulceration in cutaneous melanoma just a prognostic and predictive factor or is ulcerated melanoma a distinct biologic entity? Curr. Opin. Oncol., 24(2): 137–140.
15. Spatz A., Stock N., Batist G., van Kempen L.C. (2010) The biology of melanoma prognostic factors. Discov. Med., 10(50): 87–93.
16. Callender G.G., McMasters K.M. (2011) What does ulceration of a melanoma mean for prognosis? Adv. Surg., 45: 225–236.
17. Eggermont A.M., Suciu S., Rutkowski P. et al. (2016) Long term follow up of the EORTC 18952 trial of adjuvant therapy in resected stage IIB–III cutaneous melanoma patients comparing intermediate doses of interferon-alpha-2b (IFN) with observation: ulceration of primary is key determinant for IFN-sensitivity. Eur. J. Cancer, 55: 111–121.
18. Eggermont A.M., Suciu S., Testori A. et al. (2012) Ulceration and stage are predictive of interferon efficacy in melanoma: results of the phase III adjuvant trials EORTC 18952 and EORTC 18991. Eur. J. Cancer, 48(2): 218–225.
19. Фильчаков Ф.В., Кукушкина С.Н., Шумилина Е.С. и др. (2013) Иммунологический профиль больных меланомой кожи в зависимости от наличия изъязвления первичной опухоли и статуса «сторожевых» лимфатических узлов. Клин. онкол., 3: 61–67.
20. Фильчаков Ф.В., Грабовой А.Н., Лён А.Д. и др. (2014) Локальный иммунный ответ у больных меланомой кожи: связь с эффективностью интерферонотерапии. Клин. онкол., 4(16): 12–16.
Иммунореактивность у больных меланомой кожи: связь с морфологическими признаками изъязвления первичной опухоли и отдаленными результатами комбинированного лечения
Национальный институт рака, Киев
Резюме. Целью работы было изучение состояния иммунной системы у больных первично-локализованной меланомой кожи (ПЛМ) в зависимости от наличия изъязвления первичной опухоли во взаимосвязи с отдаленными результатами комбинированного лечения. Исследован популяционный состав лимфоцитов (Лф) периферической крови (ПК) у 47 пациентов с ПЛМ ІВ–ІІС стадии до лечения. Иммуногистохимическое исследование первичной опухоли проведено у 12 больных. Период наблюдения составил 3 года. Установлено, что независимо от результатов лечения в ПК пациентов с изъязвлением возрастает процент CD16+-Лф и снижается относительное содержание CD3+-Лф (соотношение CD4/CD8 сохранено). При отсутствии изъязвления у больных с рецидивом эти показатели регистрируются в пределах нормы, однако формируется тенденция к повышению относительного количества Т-Лф; у больных без рецидива увеличивается процент CD8+-Лф, существенно снижается индекс CD4/CD8. У больных ПЛМ без и с изъязвлением первичной опухоли с благоприятным течением заболевания отмечают высокий уровень дважды позитивных Т-Лф в циркуляции. Содержание регуляторных Т-клеток в крови пациентов с ПЛМ не зависит от течения заболевания и наличия изъязвления опухоли. Высокая плотность накопления в опухоли CD8+- и CD45RO+-Лф связана с лучшими результатами лечения, при этом самые высокие показатели инфильтрации опухоли CD45RO+-клетками фиксируют у больных без рецидива при наличии изъязвления. Дальнейшие исследования состояния иммунной системы у пациентов с ПЛМ без и с изъязвлением опухоли позволят усовершенствовать тактику противоопухолевого лечения этой категории больных и предоставят возможность прогнозировать эффективность такой терапии.
иммунная система, меланома кожи, изъязвление первичной опухоли, комбинированное лечение, интерферонотерапия.
Адреса:
Кукушкіна Світлана Миколаївна
03022, Київ, вул. Ломоносова, 33/43
Національний інститут раку
Тел.: (044) 259-01-84
E-mail: labklimmun@i.ua














Leave a comment