Дефіцит природних кілерів і/або природних кілерних Т-лімфоцитів як причина злоякісних новоутворень у людей (огляд літератури)
- 1Институт экспериментальной и клинической медицины Национального медицинского университета имени А.А. Богомольца
- 2Івано-Франківський національний медичний університет
Резюме. Дефіцити природних кілерів і природних кілерних Т-лімфоцитів — одні з найпоширеніших у людській популяції первинних імунодефіцитних хвороб, які проявляються у вигляді рецидивних інфекцій, викликаних умовно патогенними і опортуністичними внутрішньоклітинними мікроорганізмами, а також аутоімунних, алергічних, імунозапальних та онкологічних ускладнень. Злоякісні новоутворення є характерним проявом таких імунодефіцитів, зважаючи на важливу роль кілерних клітин у забезпеченні протипухлинного імунітету. У статті проведено аналіз наукових публікацій з проблеми онкологічних проявів дефіцитів природних кілерів і природних кілерних Т-лімфоцитів у людей. У лікуванні цих імунодефіцитних хвороб застосовують препарати інтерферонів різних класів, рекомбінантного інтерлейкіну-2 та тимозину-альфа1. Імунотропний препарат альфа-/бета-дефензинів нещодавно продемонстрував ефективність в усуненні дефіциту природних кілерів і природних кілерних Т-лімфоцитів у дітей та дорослих у кількох невеликих контрольованих клінічних дослідженнях і є перспективним засобом базисної імунотерапії таких імунодефіцитів.
Одержано 10.01.2018
Прийнято до друку 27.02.2018
Вступ
Як відомо, у пацієнтів з первинними імунодефіцитами реєструється підвищена частота злоякісних новоутворень порівняно із загальною популяцією. Сьогодні онкологічний синдром вважається важливою, а часом невід’ємною складовою клінічного фенотипу багатьох первинних імунодефіцитів людини, однак питома вага пухлин у структурі проявів широко варіює при різних хворобах імунної системи залежно від вагомості ураженого імунного чинника в протипухлинному імунітеті. Прикладами первинних імунодефіцитів, при яких часто розвиваються онкологічні ускладнення, є вибіркові дефіцити природних кілерів і природних кілерних Т-лімфоцитів. Ґрунтовний огляд з дефіциту природних кілерів у людей опублікований нами раніше (Мальцев Д.В., Недопако Я.Я. (2013) Дефіцит природних кілерів: гетерогенність, клініка, діагностика, лікування, клінічні приклади. Український медичний часопис, 2(94): 129–142), а в даній роботі ми сконцентруємо увагу саме на онкологічних проявах зазначених клітинних імунодефіцитів.
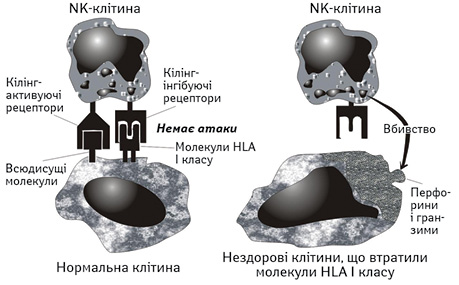
Біологічна роль природних кілерів та природних кілерних Т-лімфоцитів. Завдяки досягненням фундаментальної імунології стало очевидним, що такі міноритарні субпопуляції лімфоцитів, як природні кілери (natural killers — NK) з фенотипом СD3СD16СD56 та природні кілерні Т-лімфоцити (natural killer T-lymphocytes — NKT) з фенотипом СD3СD16СD56, є першою ланкою клітинного протипухлинного імунітету людини. Природні кілери належать до системи природженого імунітету, тоді як природні кілерні Т-лімфоцити займають проміжне місце між природженим і адаптивним імунітетом людського організму. Природні кілери розпізнають пухлини на підставі дисбалансу сигналів, які находять до клітини через кілінг-активуючі та кілінг-інгібуючі рецептори, здійснюючи шаблонне розпізнавання мішені, характерне для природженого імунітету в цілому. Втрата експресії молекул HLA I класу, до якої вдаються пухлинні клітини для уникнення цитотоксичної відповіді з боку СD8 Т-лімфоцитів, призводить до посилення сигналів через кілінг-активуючі рецептори і подальшої цитолітичної реакції з боку природного кілера щодо клітини-мішені [12]. Остання полягає у полімеризації білка перфорину в цитолемі пухлинної клітини і введенні через сформовані патологічні пори гранзимів, які запускають каскад апоптозу (рисунок). Якщо ж запрограмована загибель пухлинної клітини з певних причин не відбулася, то остання гине шляхом некрозу за механізмом осмотичного лізису. Природні кілерні Т-лімфоцити використовують аналогічний ефекторний механізм, однак розпізнають мішені за допомогою так званих інваріантних антиген-розпізнавальних рецепторів, які взаємодіють з деякими, наприклад гліколіпідними, антигенами пухлини, представленими у складі некласичних молекул гістосумісності, у тому числі молекули CD1. Цей механізм ідентифікації нагадує специфічне розпізнавання мішеней, яке здійснюється клітинами адаптивного імунітету, однак з вузьким репертуаром антигенів, що відповідає шаблонному стилю розпізнавання, типовому для системи природженого захисту.
Етіологія первинного дефіциту NK- і/або NKT-клітин. Дефіцит природних кілерів є генетично гетерогенним синдромом. Фенотип ізольованого дефіциту NK-клітин описаний при мутаціях в гені Fcγ RIIIA [14], у зоні центромери 8-ї хромосоми в локусі 8p11.23-q11.21 [17], гені імуноглобуліноподібного транскрипту 6-го типу у локусі 19q13 [30], гені STXBP2 [35] та гені МСМ4 [25].
Показана генетична гетерогенність первинного ізольованого дефіциту NKT-клітин. Так, мутації у локусі Nkt1 на 1-й хромосомі асоційовані з парціальним дефіцитом NKT-клітин при системному червоному вовчаку, Nkt2 на 2-й хромосомі — при цукровому діабеті 1-го типу, а на 18-й хромосомі — з тотальним дефіцитом цих клітин [29].
Нещодавно в контрольованому клінічному дослідженні встановлено, що генетичний дефіцит ферментів циклу фолієвої кислоти може бути однією з найчастіших причин вибіркового дефіциту NK- і/або NKT-клітин у людей [3].
Зв’язок первинного дефіциту NK- і/або NKT-клітин з онкологічними ускладненнями. Первинний дефіцит природних кілерів належить до малих імунодефіцитних хвороб, яким властиві велика поширеність в популяції, дебют в будь-якому віці, тривалі періоди безсимптомного перебігу, варіабельність клінічної картини протягом життя та гетерогенність симптомів навіть у межах однієї родини. Сімейний дефіцит природних кілерів вперше описаний J.K. Portaro та співавторами (1978) як спадковий дефіцит К-клітин у здорових осіб [46]. У подальшому з’ясували, що з цим імунодефіцитом можуть бути пов’язані клінічні симптоми, часом — навіть загрозливі життю. Прояви хвороби безпосередньо визначаються функціональним призначенням природних кілерів в організмі людини. Ці клітини чинять противірусний та протипухлинний ефекти завдяки участі в реакціях спонтанної і антитілозалежної клітинно-опосередкованої цитотоксичності, а також здійснюють імунорегуляторні впливи шляхом продукції цитокінів, зокрема інтерферонів (ІФН). Тож у клінічній картині переважають часті, тривалі, атипові, аномально тяжкі або хронічні вірусні інфекції, здебільшого викликані агентами з опортуністичними властивостями, а також аутоімунні, алергічні ускладнення та злоякісні пухлини, переважно лімфопроліферативного походження.
Онкологічні ускладнення у хворих зі дефіцитом природних кілерів можна пояснити втратою безпосереднього імунного нагляду за мутантними клітинами, а також реактивацією деяких лімфотропних вірусів з онкогенними властивостями, зокрема вірусу Епштейна — Барр (EBV), герпесвірусу людини 8-го типу та/або папіломавірусів. Останній механізм визначає переважання лімфопроліферативних пухлин і раку шийки матки у клінічній картині хвороби. Зокрема, EBV у таких хворих може бути причиною лімфопроліферативних синдромів [17], пухлини із гладких м’язів у наднирковій залозі [52], хронічного мононуклеозу [5], синдрому хронічної втоми [11], фатального інфекційного мононуклеозу [19], гемофагоцитарного лімфогістіоцитозу [37, 47, 50]. Якщо говорити про асоціацію з папіломавірусною інфекцією, то Z.K. Ballas та співавтори (1990) описали пацієнтку з кількісним дефіцитом природних кілерів та експансією клітин з фенотипом CD3CD4CD8NKH1[6]. У неї відзначалися рецидивні кондиломи, вульварна і цервікальна карцинома in situ, пульмональні інфільтрати і стан гіперкоагуляції, зумовлені папіломавірусною інфекцією. Ця пацієнтка померла у віці 30 років, а її сестра — в дитинстві від лейкозу [6]. Окрім класичних проявів у вигляді шкірних папілом [10], кондилом, дисплазії та раку шийки матки, у таких хворих папіломавіруси можуть уражати дихальну систему, зокрема бути причиною гранулематозу легень і рецидивного папіломатозу гортані [8, 9].
H.W. Ziegler та співавтори (1981) вперше повідомили про асоціацію ізольованого дефіциту природних кілерів і злоякісних пухлин. У їхньому дослідженні вивчено імунний статус 10 хворих із хронічним лімфолейкозом порівняно з таким у контрольній групі. Встановлено, що у 9 із 10 пацієнтів не визначалася активність природних кілерів, незважаючи на підвищену кількість цих клітин у крові. При вимірюванні функціональної активності у літичних одиницях в 1 мл крові виявилося, що цитотоксичний потенціал NK-клітин був принаймні в 7 разів нижчим, ніж у контролі. Лікування за допомогою фібробластного ІФН та індуктора інтерфероногенезу 1:С було ефективним у 2 хворих з ранніми проявами неоплазії, однак не сприяло покращенню у інших 3 пацієнтів із задавненою хворобою [61].
Згодом L.P. Ruco та співавтори (1983) описали глибокий дефіцит природних кілерів у всіх 10 обстежених пацієнтів із волосатоклітинною лейкемією у невеликому контрольованому дослідженні. Автори також показали ефективність препаратів альфа-ІФН у таких випадках [49]. Пізніше група дослідників на чолі з B.R. Smith (1985) повідомили ще про 4 хворих з волосатоклітинним лейкозом, у яких відзначався глибокий функціональний дефіцит природних кілерів [55]. Y. Fujimiya та співавтори (1987) виявили кількісний і функціональний дефіцит природних кілерів у пацієнтів із хронічним мієлолейкозом і запропонували новий метод лікування — клонування і ампліфікацію NK-клітин [21]. Раніше таку асоціацію описали H.W. Ziegler-Heitbrock з колегами (1985) [62]. C.M. Yang та співавтори (2002) повідомили про тайванську дівчинку з дефіцитом природних кілерів, у якої з трирічного віку відзначався атопічний дерматит і рецидивний лабіальний герпес, а у шість років розвинулася лімфома Ходжкіна [60]. Крім того, про причинову роль дефіциту природних кілерів повідомляли при гемофагоцитарному лімфогістіоцитозі [27, 25], метастатичній меланомі [26], лімфомі Ходжкіна [35], хронічному лімфолейкозі [43], недиференційованому гострому лейкозі [18] та лейкемії з великих гранулярних лімфоцитів (NK-клітин) [23].
У пацієнтів з дефіцитом NKT-лімфоцитів, на відміну від осіб з дефіцитом NK-клітин, частіше реєструють такі онкологічні ускладнення, як рак голови і шиї, множинна мієлома, аденокарцинома грудної залози і гепатоцелюлярна карцинома. J.W. Molling та співавтори (2007) показали, що аномально мала кількість NKT-клітин є предиктором виникнення та прогресування і несприятливого клінічного прогнозу при сквамозно-клітинних карциномах голови і шиї. Період катамнестичного лонгітудинального спостереження становив 31 міс. При малій, середній і великій кількості NKT-клітин відзначали вірогідні відмінності з боку загальної витривалості (39; 75 і 92% відповідно), специфічної для хвороби витривалості пацієнтів (31; 74 і 92% відповідно) і локорегіонарного рівня (31; 74 і 92% відповідно) [39].
Персистуючий дефіцит NKT-клітин був причиною рецидиву лейкемії після пересадки алогенного кісткового мозку, як це продемонстрували P. Dellabona зі співавторами в 2011 р. [15]. Раніше науковці під керівництвом M.V. Dhodapkar (2003) ідентифікували якісний дефіцит NKT-клітин у пацієнтів із множинною мієломою. Автори показали, що саме ця імунна дисфункція призводила до швидкої трансформації передпухлинної гаммапатії і непрогресуючої мієломи в прогресуючу форму злоякісної пухлини [16]. T. Crough та колеги (2004) діагностували глибокий дефіцит NKT-клітин у пацієнтів із мієломою і раком грудної залози у спеціально спланованому дослідженні [13]. Така імунна дисфункція може траплятися в осіб з гепатоцелюлярною карциномою, що розвинулася на тлі хронічного вірусного гепатиту [40].
Класифікація. J. Orange (2006) запропонував виділяти три різновиди синдрому дефіциту природних кілерів, зокрема — абсолютний (absolute natural killer deficiency — ANKD), класичний (classical natural killer deficiency — CNKD) і функціональний дефіцит природних кілерів (functional natural killer deficiency — FNKD) (таблиця) [42].
| Форма | Функція NK | Кількість NKT | Кількість NK |
| ANKD | Знижена | Знижена | Знижена |
| CNKD | Знижена | Не знижена | Знижена |
| FNKD | Знижена | Не знижена | Не знижена |
Дефіцит природних кілерів офіційно включено в авторитетну світову базу даних On-line Mendelian Inheritance in Man (entry 609981). Міжнародні експерти запропонували робочий варіант критеріїв діагностики цього імунодефіциту (http://bioinf.uta.fi/xml/idr/ff/FF135.xml?style=pdf).
Лікування. Природні та рекомбінантні альфа-ІФН продемонстрували ефективність при дефіциті природних кілерів при дослідженнях in vitro та in vivo. Зокрема, V.R. Bonagura та співавтори (1989) показали, що додавання альфа-ІФН в дозі 800 МО/мл до культури природних кілерів у пацієнта з якісним імунодефіцитом призводило до поступового зростання їх функціональної активності з 9,2×7,7% до 17,2×14,9% pt [9]. A.P. Kelly та співавтори (1984) здійснили подвійне сліпе плацебо-контрольоване дослідження, в якому показали відновлення порушеної функціональної активності природних кілерів у реципієнтів алогенної нирки під впливом терапії рекомбінантним альфа-ІФН, що забезпечувало профілактичний ефект щодо CMV-інфекції (cytomegalovirus) [32]. W.R. Frederick з колегами (1985) усунули індуковане ВІЛ пригнічення функції природних кілерів за допомогою альфа-ІФН, забезпечивши профілактичний ефект щодо епізодів реактивації CMV (n=19) [20]. D.M. See та J.G. Tilles у 1996 р. провели подвійне сліпе плацебо-контрольоване дослідження ефективності альфа2а-ІФН у пацієнтів із синдромом хронічної втоми, у яких відзначався ізольований дефіцит природних кілерів або поєднане імунне порушення, що додатково включало дисфункцію Т-клітин (n=26). Терапія тривала 12 тиж. Продемонстровано виражене підвищення активності природних кілерів — з 35,1±11,7 до 91,5±22,7 літичних одиниць (р<0,01) та підвищення якості життя пацієнтів, що оцінювали за критеріями QOL [51]. P. Portales та співавтори (2003) довели, що альфа-ІФН відновлює викликане ВІЛ пригнічення експресії перфорину в природних кілерах in vivo [44]. K. Shiozawa та S. Shiozawa (2006) продемонстрували ефективність малої дози альфа-ІФН (450 МО/добу) шляхом його перорального застосування у пацієнтів з аномально малою кількістю природних кілерів у крові з хворобою Шегрена [54]. N.N. Cac, Z.K. Ballas (2006) успішно застосували препарат альфа-ІФН у пацієнта з дефіцитом природних кілерів, що проявлявся рецидивними папіломами [10].
Якщо говорити про механізм дії препаратів альфа-ІФН у разі цього імунодефіциту, то, крім прямого противірусного ефекту та безпосередньої замісної функції, ці ліки посилюють секреторну активність природних кілерів, збільшують кількість цитоплазматичних гранул, потенціюють адгезію і кілінг мішеней, однак на проліферативну активність діють меншою мірою.
Слід зазначити, що іноді трапляється резистентність до альфа-ІФН, вперше описана G. Fleisher та співавторами в 1982 р. [19], а в подальшому ґрунтовно охарактеризована Y. Fujimiya та співавторами у 1986 р. [21], що вимагає проведення інших імунотерапевтичних втручань.
Препарати бета- та гамма-ІФН також ефективні у лікуванні дефіциту природних кілерів [60], однак мають меншу доказову базу, ніж альфа-ІФН. Ці лікарські засоби, особливо препарати гамма-ІФН, можуть бути випробувані у пацієнтів із резистентністю до стартової терапії альфа-ІФН. Y. Shi та C.T. Lutz (2002) показали, що гамма-ІФН забезпечує контроль над В-лімфоцитами, трансформованими під впливом EBV, і цей ефект опосередкований цитотоксичними Т-клітинами, що може бути ефективним компенсаторним механізмом у разі дефіциту природних кілерів [53]. T. Fujisaki та співавтори (1993) описали терапевтичний ефект препарату рекомбінантного гамма-ІФН при тяжкій хронічній активній EBV-інфекції в невеликому контрольованому дослідженні [22].
Застосування препаратів рекомбінантного інтерлейкіну (ІЛ)-2 також виявилося ефективним у лікуванні дефіциту природних кілерів in vitro та in vivo. Окрім безпосередньої замісної дії й опосередкованого посилення функції природних кілерів, ІЛ-2 забезпечує виражений проліферативний ефект, який може бути корисним при кількісних порушеннях. Однак висока вартість і частий розвиток вираженого грипоподібного синдрому обмежують клінічне застосування цих ліків. A.H. Rook та співавтори (1983) усунули депресію природних кілерів і досягли зростання цитотоксичного потенціалу цих клітин щодо лімфоцитів, інфікованих CMV, у пацієнтів зі СНІДом (n=6) під впливом рекомбінантного ІЛ-2 [48]. M. Caligiuri та співавтори (1987) апробували рекомбінантний ІЛ-2 у пацієнтів з дефіцитом природних кілерів, що проявлявся синдромом хронічної втоми EBV-етіології (n=41). Досягнуто відновлення здатності NK-клітин до кілінгу К562, хоча цитотоксичний ефект щодо EBV-інфікованих В-лімфоцитів залишався дещо ослабленим [11]. A. Plebani з колегами (2000) повідомили про повне відновлення функції природних кілерів у пацієнта з синдромом Грісцелі під впливом препарату ІЛ-2 [44]. Відповідно до цього, N.E. Kay та співавтори (1987) за допомогою рекомбінантного ІЛ-2 досягли відновлення функціональної активності NK-клітин у пацієнта з ізольованим дефіцитом природних кілерів, у якого розвинулася В-клітинна лейкемія [31]. S. Specter та співавтори (1989) показали, що за допомогою ІЛ-2 можна як усунути, так і запобігти розвитку супресії природних кілерів при застосуванні дельта-9-тетрагідроканабіолу [56]. E. Lotzová та співавтори (1991) досягнули генерації цитотоксичних природних кілерів у крові і кістковому мозку пацієнтів із гострим мієлолейкозом при тривалій інфузії рекомбінантного ІЛ-2 [34]. H.N. Lode та співавтори (1998) продемонстрували опосередковану природними кілерами ерадикацію метастазів нейробластоми в кістковому мозку при проведенні терапії з використанням ІЛ-2, зв’язаного за допомогою методів генної інженерії з антиcіалогангліозидними антитілами GD-2 [33]. N.J. Meropol та співавтори (1996) показали, що щоденні підшкірні ін’єкції рекомбінантного ІЛ-2 у низькій дозі стимулюють природні кілери in vivo без індукції суттєвої токсичності [38]. A. Toren та співавтори (2000) здійснювали успішну терапію середніми і високими дозами рекомбінантного ІЛ-2 підшкірними ін’єкціями протягом двох років після аутологічної пересадки кісткового мозку у 5 дітей з IV стадією нейробластоми. Відзначалося відновлення раніше порушеної кількості і функціональної активності природних кілерів, зокрема їх здатності знищувати K562 і клітини нейробластоми. У одного пацієнта, якому передчасно відмінили імунотерапію у зв’язку з розвитком енцефалопатії, трапився рецидив пухлини [58].
Існують поодинокі повідомлення щодо ефективності ридостину, лентінану і тимопоетину при дефіциті природних кілерів, однак ці дані мають бути перевірені в додаткових дослідженнях, перш ніж можуть бути рекомендовані до широкого застосування в клінічній практиці.
Група науковців на чолі з Y. Fujimiya (1987) розробили спеціальний метод замісної терапії — клонування і ампліфікацію природних кілерів, отриманих від самого хворого, у штучних умовах за присутності альфа-ІФН та ІЛ-2 [21]. Зважаючи на технічну складність і високу вартість методу, останній може бути апробований у лише деяких імуноскомпрометованих пацієнтів з тяжкими клінічними симптомами у разі резистентності до доступніших фармакотерапевтичних втручань.
Трансплантація кісткового мозку видається найрадикальнішим методом лікування при тяжких формах дефіциту природних кілерів, однак наразі бракує повідомлень і клінічних досліджень з цієї проблеми. L.D. Notarangelo та E. Mazzolari (2006) провели успішну пересадку алогенного кісткового мозку дитині віком 4,5 року з дефіцитом природних кілерів, що проявлявся тяжкою рецидивною VZV-інфекцією (varicella-zoster virus) [40]. Натомість C.A. Biron та співавтори (1990) засвідчили смерть пацієнта з дефіцитом природних кілерів від ускладнень після трансплантації з приводу рефрактерної апластичної анемії. Раніше імунодефіцит маніфестував герпесвірусними інфекціями (HSV-1, VZV, CMV) [7].
З-поміж доступних імунотерапевтичних агентів NKT-клітини відповідають активацією і проліферацією на ІФН різних класів, колонієстимулюючі фактори і тимозин-альфа1.
S. Yamagiwa зі співавторами (2008) у контрольованому випробуванні показали, що рекомбінантний альфа-ІФН в дозі 3 млн МО тричі на тиждень призводить до підвищення кількості внутрішньопечінкових NKT-клітин у пацієнтів з вірусним гепатитом С, у яких відзначається відповідний імунодефіцит до початку лікування [59]. В іншому невеликому контрольованому дослідженні, виконаному A. Okumura та співавторами (2005), продемонстровано вірогідне зростання кількості циркулюючих NKT-клітин і підвищення їх проліферативної активності у відповідь на α-GalCer під впливом терапії за допомогою рекомбінантного альфа-ІФН у пацієнтів з дефіцитом цих лімфоцитів із хронічним вірусним гепатитом С і вірус-індукованою гепатоцелюлярною карциномою [41]. Як показали S.J. Oosterling та співавтори (2009), періоперативна терапія за допомогою рекомбінантного альфа-ІФН сприяє підвищенню раніше зниженої кількості NKT-клітин у пацієнтів з колоректальним раком, що допомагає у профілактиці метастазування в післяопераційний період.
G. Gigli та співавтори (2007) встановили, що рекомбінантний бета-ІФН у дозі 44 мкг тричі на тиждень, що застосовується в лікуванні розсіяного склерозу, здатен призводити до зростання кількості циркулюючих NKT-клітин у пацієнтів неврологічного профілю з відповідним імунодефіцитом. Окрім проліферативного ефекту, за рахунок імунотерапії вдається підвищити експресію молекул CD80, CD40 і CD1d, важливих в антигенній презентації і взаємодії з дендритними клітинами [24].
H. Matsuda та співавтори (2010) показали у дослідженні in vivo здатність гамма-ІФН стимулювати проліферативну і функціональну активність NKT-клітин, тому препарати рекомбінантного гамма-ІФН людини можуть бути випробувані для усунення дефіциту цих лімфоцитів в окремих випадках [36].
Як встановили S. Sugahara та співавтори (2002) у невеликому неконтрольованому дослідженні, препарат тимозину-альфа1 в дозі 1,2 мг протягом 24 тиж зумовлює вірогідне і виражене збільшення кількості внутрішньопечінкових CD56, однак не CD57 NKT-клітин у пацієнтів із хронічним вірусним гепатитом В, у яких відзначається імунодефіцит до початку терапії. Це, на думку авторів, було визначальним у досягненні ремісії з боку вірусної інфекції [57].
O. Imataki та співавтори (2008) у контрольованому дослідженні показали, що препарати рекомбінантних колонієстимулюючих факторів, що призначаються для усунення агранулоцитозу у пацієнтів з лімфомами, здатні збільшувати кількість циркулюючих NKT-клітин у пацієнтів онкологічного профілю з дефіцитом цих лімфоцитів, хоча досягнутий стимуляційний ефект був нижчим, ніж у здорових людей [28].
Імуномодулюючий препарат, що містить у своєму складі альфа-/бета-дефензини, може бути новим компонентом арсеналу засобів базисної терапії вибіркового дефіциту NK- та/або NKT-клітин у людей. Так, у контрольованому клінічному дослідженні показано, що такий імунотерапевтичний агент нормалізував раніше знижену кількість NK- та/або NKT-клітин у периферичній крові у більшості дітей з генетичним дефіцитом фолатного циклу, які не відповіли належним чином на початкову 1-місячну терапію рекомбінантним альфа2b-ІФН людини [3]. В іншому контрольованому клінічному дослідженні препарат альфа-/бета-дефензинів забезпечив відновлення кількості NK- і/або NKT-клітин у периферичній крові у 13 із 17 дорослих з відповідним імунодефіцитом, у яких виявили відсутність відповіді на рекомбінантний альфа2b-ІФН [4]. Ці дані свідчать, що такий імунотерапевтичний агент може застосовуватися для імунотерапії ізольованого дефіциту NK- та/або NKT-клітин у людей як друга лінія лікування у разі резистентності до препаратів альфа-ІФН, у зв’язку з чим доцільним є проведення подальших клінічних досліджень в окресленому напрямку.
Результати наукових робіт вітчизняних дослідників показали здатність протефлазиду чинити протипухлинний ефект шляхом посилення ендокринної функції тимусу, індукції синтезу альфа1– і гамма-ІФН, а також речовин з тимозиноподібною активністю [1, 2], що свідчить про доцільність застосування також індукованої імунотерапії при лікуванні хворих з наявністю такої форми імунодефіциту.
Висновки
Наведені вище докази дозволяють стверджувати, що діагностика причинового імунодефіциту дає можливість встановити етіологію злоякісної пухлини, відкриваючи шлях до етіотропного лікування в онкології. Базисна імунотерапія імунодефіциту не тільки здатна допомогти у лікуванні неоплазії, але й сприяти профілактиці утворення пухлин в імуноскомпрометованих пацієнтів за рахунок посилення протипухлинного імунітету. Імунотерапевтичні втручання чинять комплексний позитивний вплив на всі прояви імунодефіциту, включаючи інфекційний, алергічний, аутоімунний, імунозапальний та онкологічний синдроми. Раціональна імунодіагностика та патогенетично адекватна імунотерапія можуть вивести клінічне ведення пацієнта з пухлиною на якісно новий, ефективніший рівень, тому вкрай необхідним є фокусування зусиль онкологів і лікарів інших спеціальностей на реабілітації порушених кількості та функціональної активності природних кілерів і природних кілерних Т-лімфоцитів у пацієнтів з неоплазіями.
Список використаної літератури
1. Гриневич Ю.А., Бендюг Г.Д., Атаманюк Н.П. (2005) Вплив протефлазиду на ендокринну функцію тимусу. Нова медицина, 4(21): 71–76.
2. Гриневич Ю.А. (2013) Иммунотерапия — путь к повышению эффективности основного лечения онкобольных. Consilium medicum Украина, 2(7): 20–22.
3. Мальцев Д.В. (2016) Расстройства спектра аутизма у детей с дефицитом фолатного цикла. К.: Центр научной литературы, 136 с. ISBN 978-617-673-455-0.
4. Мальцев Д.В. (2016) Эффективность иммунотерапии при дефиците естественных киллеров и/или естественных киллерных Т-лимфоцитов у людей. Імунологія та алергологія. Додаток №1. Матеріали Науково-практичної конференції з міжнародною участю «Епідеміологія, імунопатогенез, діагностика і лікування хламідіозу і TORCH-інфекцій, 23–24листопала 2016 р, м. Київ: 6–7.
5. Aoukaty A., Lee I.F., Wu J., Tan R. (2003) Chronic active Epstein-Barr virus infection associated with low expression of leukocyte-associated immunoglobul in-like receptor-1 (LAIR-1) on natural killer cells. J. Clin. Immunol., 23(2): 141–145.
6. Ballas Z.K., Turner J.M., Turner D.A. et al. (1990) A patient with simultaneous absence of «classical» natural killer cells (CD3-, CD16+, and NKH1+) and expansion of CD3+, CD4-, CD8-, NKH1+ subset. J. Allergy Clin. Immunol., 85(2): 453–459.
7. Biron C.A., Byron K.S., Sullivan J.L. (1989). Severe herpesvirus infections in an adolescent without natural killer cells. N. Engl. J. Med., 320(26): 1731–1735.
8. Bonagura V.R., Cunningham-Rundles S., Edwards B.L. et al. (1989) Common variable hypogammaglobulinemia, recurrent Pneumocystis carinii pneumonia on intravenous gamma-globulin therapy, and natural killer deficiency. Clin. Immunol. Immunopathol., 51(2): 216–231.
9. Bonagura V.R., Hatam L.J., Rosenthal D.W. et al. (2010) Recurrent respiratory papillomatosis: a complex defect in immune responsiveness to human papillomavirus-6 and -11. APMIS, 118(6–7): 455–470.
10. Cac N.N., Ballas Z.K. (2006) Recalcitrant warts, associated with natural killer cell dysfunction, treated with systemic IFN-alpha. J. Allergy Clin. Immunol., 118(2): 526–528.
11. Caligiuri M., Murray C., Buchwald D. et al. (1987) Phenotypic and functional deficiency of natural killer cells in patients with chronic fatigue syndrome. J. Immunol., 139(10): 3306–3313.
12. Caligiuri M. (2008) Human natural killer cells. Blood, 112(3): 461–469.
13. Crough T., Purdie D.M., Okai M. et al. (2004) Modulation of human Valpha24(+)Vbeta11(+) NKT cells by age, malignancy and conventional anticancer therapies. Br. J. Cancer, 91(11): 1880–1886.
14. de Vries E., Koene H.R., Vossen J.M. et al. (1996) Identification of an unusual Fc gamma receptor IIIa (CD16) on natural killer cells in a patient with recurrent infections. Blood, 88(8): 3022–3027.
15. Dellabona P., Casorati G., de Lalla C. et al. (2011) On the use of donor-derived iNKT cells for adoptive immunotherapy to prevent leukemia recurrence in pediatric recipients of HLA haploidentical HSCT for hematological malignancies. Clin. Immunol., 140(2): 152–159.
16. Dhodapkar M.V., Geller M.D., Chang D.H. et al. (2003) A reversible defect in natural killer T cell function characterizes the progression of premalignant to malignant multiple myeloma. J. Exp. Med., 197(12): 1667–1676.
17. Eidenschenk C., Jouanguy E., Alcaïs A. et al. (2006) Familial NK cell deficiency associated with impaired IL-2- and IL-15-dependent survival of lymphocytes. J. Immunol., 177(12): 8835–8843.
18. Fang X.C., Liu H.L., Sun Z.M. et al. (2010) Expression and abscission of activated receptors and their ligands on/from NK cells in peripheral blood of patients with acute leukemia. Zhongguo Shi Yan Xue Ye Xue Za Zhi, 18(2): 436–440.
19. Fleisher G., Starr S., Koven N. et al. (1982) A non-x-linked syndrome with susceptibility to severe Epstein-Barr virus infections. J. Pediatr., 100(5): 727–730.
20. Frederick W.R., Epstein J.S., Gelmann E.P. et al. (1985) Viral infections and cell-mediated immunity in immunodeficient homosexual men with Kaposi’s sarcoma treated with human lymphoblastoid interferon. J. Infect. Dis., 152(1): 162–170.
21. Fujimiya Y., Chang W.C., Bakke A. et al. (1987) Natural killer (NK) cell immunodeficiency in patients with chronic myelogenous leukemia. II. Successful cloning and amplification of natural killer cells. Cancer Immunol. Immunother., 24(3): 213–220.
22. Fujisaki T., Nagafuchi S., Okamura T. (1993) Gamma-interferon for severe chronic active Epstein-Barr virus. Ann. Intern. Med., 118(6): 474–475.
23. Gattazzo C., Teramo A., Miorin M. et al. (2010) Lack of expression of inhibitory KIR3DL1 receptor in patients with natural killer cell-type lymphoproliferative disease of granular lymphocytes. Haematologica, 95(10): 1722–1729.
24. Gigli G., Caielli S., Cutuli D., Falcone M. (2007) Innate immunity modulates autoimmunity: type 1 interferon-beta treatment in multiple sclerosis promotes growth and function of regulatory invariant natural killer T cells through dendritic cell maturation. Immunology, 122(3): 409–417.
25. Gineau L., Cognet C., Kara N. et al. (2012) Partial MCM4 deficiency in patients with growth retardation, adrenal insufficiency, and natural killer cell deficiency. J. Clin. Invest., 122(3): 821–832.
26. Holtan S.G., Creedon D.J., Thompson M.A. et al. (2001) Expansion of CD16-negative natural killer cells in the peripheral blood of patients with metastatic melanoma. Clin. Dev. Immunol., 2011: 316–314.
27. Imashuku S., Hyakuna N., Funabiki T. et al. (2002) Low natural killer activity and central nervous system disease as a high-risk prognostic indicator in young patients with hemophagocytic lymphohistiocytosis. Cancer, 94(11): 3023–3031.
28. Imataki O., Heike Y., Makiyama H. et al. (2008) Insufficient ex vivo expansion of Valpha24(+) natural killer T cells in malignant lymphoma patients related to the suppressed expression of CD1d molecules on CD14(+) cells. Cytotherapy. 10(5): 497–506.
29. Jordan M.A., Fletcher J., Baxter A.G. (2004) Genetic control of NKT cell numbers. Immunol. Cell Biol., 82(3): 276–284.
30. Kabalak G., Dobberstein S.B., Matthias T. et al. (2009) Association of immunoglobulin-like transcript 6 deficiency with Sjögren’s syndrome. Arthritis Rheum., 60(10): 2923–2925.
31. Kay N.E., Zarling J. (1987) Restoration of impaired natural killer cell activity of B-chronic lymphocytic leukemia patients by recombinant interleukin-2. Am. J. Hematol., 24(2): 161–167.
32. Kelly A.P., Schooley R.T., Rubin R.H., Hirsch M.S. (1984) Effect of interferon alpha on natural killer cell cytotoxicity in kidney transplant recipients. Clin. Immunol. Immunopathol., 32(1): 20–28.
33. Lode H.N., Xiang R., Dreier T. et al. (1998) Natural killer cell-mediated eradication of neuroblastoma metastases to bone marrow by targeted interleukin-2 therapy. Blood, 91(5): 1706–1715.
34. Lotzová E., Savary C.A., Schachner J.R. et al. (1991) Generation of cytotoxic NK cells in peripheral blood and bone marrow of patients with acute myelogenous leukemia after continuous infusion with recombinant interleukin-2. Am. J. Hematol., 37(2): 88–99.
35. Machaczka M., Klimkowska M., Chiang S. et al. (2013) Development of classical Hodgkin lymphoma in an adult with biallelic STXBP2 mutations. Haematologica, 98(5): 760–764.
36. Matsuda H., Takeda K., Koya T. et al. (2010) Plasticity of invariant NKT cell regulation of allergic airway disease is dependent on IFN-gamma production. J. Immunol., 185(1): 253–262.
37. McClain K., Gehrz R., Grierson H. et al. (1998) Virus-associated histiocytic proliferations in children. Frequent association with Epstein-Barr virus and congenital or acquired immunodeficiencies. Am. J. Pediatr. Hematol. Oncol., 10(3): 196–205.
38. Meropol N.J., Barresi G.M., Fehniger T.A. et al. (1998) Evaluation of natural killer cell expansion and activation in vivo with daily subcutaneous low-dose interleukin-2 plus periodic intermediate-dose pulsing. Cancer Immunol. Immunother., 46(6): 318–326.
39. Molling J.W., Langius J.A., Langendijk J.A. et al. (2007) Low levels of circulating invariant natural killer T cells predict poor clinical outcome in patients with head and neck squamous cell carcinoma. J. Clin. Oncol., 25(7): 862–868.
40. Notarangelo L.D., Mazzolari E. (2006) Natural killer cell deficiencies and severe varicella infection. J. Pediatr., 148(4): 563.
41. Okumura A., Ishikawa T., Maeno T. et al. (2005) Changes in natural killer T cells subsets during therapy in type C hepatitis and hepatocellular carcinoma. Hepatol. Res., 32(4): 213–217.
42. Orange J.S. (2006) Human natural killer cell deficiencies. Curr. Opin. Allergy Clin. Immunol., 6(6): 399–409.
43. Platsoucas C.D., Fernandes G., Gupta S.L. et al. (1980) Defective spontaneous and antibody-dependent cytotoxicity mediated by E-rosette-positive and E-rosette-negative cells in untreated patients with chronic lymphocytic leukemia: augmentation by in vitro treatment with interferon. J. Immunol., 125(3): 1216–1223.
44. Plebani A., Ciravegna B., Ponte M. et al. (2000) Interleukin-2 mediated restoration of natural killer cell function in a patient with Griscelli syndrome. Eur. J. Pediatr., 159(9): 713–714.
45. Portales P., Reynes J., Pinet V. et al. (2003) Interferon-alpha restores HIV-induced alteration of natural killer cell perforin expression in vivo. AIDS, 17(4): 495–504.
46. Portaro J.K., Zighelboim J., Fahey J.L. (1978) Hereditary deficiency of K cells in a normal subject. Clin. Immunol. Immunopathol., 11(4): 458–469.
47. Qiang Q., Zhengde X., Chunyan L. et al. (2012) Killer cell immunoglobulin-like receptor gene polymorphisms predispose susceptibility to EBV associated hemophagocytic lymphohistiocytosis in Chinese children. Microbiol. Immunol., 56(6): 378–384.
48. Rook A.H., Masur H., Lane H.C. et al. (1983) Interleukin-2 enhances the depressed natural killer and cytomegalovirus-specific cytotoxic activities of lymphocytes from patients with the acquired immune deficiency syndrome. J. Clin. Invest., 72(1): 398–403.
49. Ruco L.P., Procopio A., Maccallini V. et al. (1983) Severe deficiency of natural killer activity in the peripheral blood of patients with hairy cell leukemia. Blood, 61(6): 1132–1137.
50. Schneider E.M., Lorenz I., Walther P., Janka-Schaub G.E. (2003) Natural killer deficiency: a minor or major factor in the manifestation of hemophagocytic lymphohistiocytosis? J. Pediatr. Hematol. Oncol., 25(9): 680–683.
51. See D.M., Tilles J.G. (1996) Аlpha-Interferon treatment of patients with chronic fatigue syndrome. Immunol. Invest., 25(1–2): 153–164.
52. Shaw R.K., Issekutz A.C., Fraser R. et al. (2012) Bilateral adrenal EBV-associated smooth muscle tumors in a child with a natural killer celldeficiency. Blood, 119(17): 4009–4012.
53. Shi Y., Lutz C.T. (2002) Interferon-gamma control of EBV-transformed B cells: a role for CD8+ T cells that poorly kill EBV-infected cells. Viral. Immunol., 15(1): 213–225.
54. Shiozawa K., Shiozawa S. (2006) Interferon alpha (IFNalpha) treatment for Sjögren’s syndrome. Nihon. Rinsho., 64(7): 1345–1353.
55. Smith B.R., Rosenthal D.S., Ault K.A. (1985) Natural killer lymphocytes in hairy cell leukemia: presence of phenotypically identifiable cells with defective functional activity. Exp. Hematol., 13(3): 189–193.
56. Specter S., Rivenbark M., Newton C. et al. (1989) Prevention and reversal of delta-9-tetrahydrocannabinol induced depression of natural killer cell activity by interleukin-2. Int. J. Immunopharmacol., 11(1): 63–69.
57. Sugahara S., Ichida T., Yamagiwa S. et al. (2002) Thymosin-alpha1 increases intrahepatic NKT cells and CTLs in patients with chronic hepatitis. B. Hepatol. Res., 24(4): 346–354.
58. Toren A., Nagler A., Rozenfeld-Granot G. et al. (2000) Amplification of immunological functions by subcutaneous injection of intermediate-high dose interleukin-2 for 2 years after autologous stem cell transplantation in children with stage IV neuroblastoma. Transplantation, 70(7): 1100–1104.
59. Yamagiwa S., Matsuda Y., Ichida T. et al. (2008) Sustained response to interferon-alpha plus ribavirin therapy for chronic hepatitis C is closely associated with increased dynamism of intrahepatic natural killer and natural killer T cells. Hepatol. Res., 38(7): 664–672.
60. Yang C.M., Yang Y.H., Lin Y.T. et al. (2002) Natural killer cell deficiency associated with Hodgkin’s lymphoma: a case report. J. Formos. Med. Assoc., 101(1): 73–75.
61. Ziegler H.W., Kay N.E., Zarling J.M. (1981) Deficiency of natural killer cell activity in patients with chronic lymphocytic leukemia. Int. J. Cancer, 27(3): 321–327.
62. Ziegler-Heitbrock H.W., Rumpold H., Kraft D. et al. (1985) Patients with a deficiency of natural killer cell activity lack the VEP13-positive lymphocyte subpopulation. Blood, 65(1): 65–70.
Дефицит естественных киллеров и/или естественных киллерных Т-лимфоцитов как причина злокачественных новообразований у людей
Институт экспериментальной и клинической медицины Национального медицинского университета имени А.А. Богомольца, Киев
Ивано-Франковский национальный медицинский университет
Резюме. Дефициты естественных киллеров и естественных киллерных Т-лимфоцитов — одни из самых распространенных в человеческой популяции первичных иммунодефицитных болезней, которые проявляются в виде рецидивирующих инфекций, вызванных условно патогенными и оппортунистическими внутриклеточными микроорганизмами, а также аутоиммунных, аллергических, иммуновоспалительных и онкологических осложнений. Злокачественные новообразования являются характерным проявлением таких иммунодефицитов, учитывая важную роль киллерных клеток в обеспечении противоопухолевого иммунитета. В статье проведен анализ научных публикаций по проблеме онкологических проявлений дефицитов естественных киллеров и естественных киллерных Т-лимфоцитов у людей. В лечении этих иммунодефицитных болезней применяют препараты интерферонов различных классов, рекомбинантного интерлейкина-2 и тимозина-альфа1. Иммунотропный препарат альфа-/бета-дефензинов недавно продемонстрировал эффективность в устранении дефицита естественных киллеров и естественных киллерных Т-лимфоцитов у детей и взрослых в нескольких небольших контролируемых клинических исследованиях и является перспективным средством базисной иммунотерапии таких иммунодефицитов.
естественные киллеры; естественные киллерные Т-лимфоциты; иммунотерапия; онкология; дефензины.
Мальцев Дмитро Валерійович
01601, Київ, просп. Перемоги, 34
Інститут експериментальної і клінічної медицини
Національного медичного університету імені О.О. Богомольця
Тел.: (068) 100-85-95
E-mail: dmaltsev@ukr.net
Correspondence:
Maltsev Dmytro Valeriyovych
34 Peremohy ave., Kyiv 01601
Experimental and Clinical Medicine Institute
at the O.O. Bogomolets National Medical University
Tel.: (068) 100-85-95
E-mail: dmaltsev@ukr.net














Leave a comment