Зміни в парадигмі лікування множинної мієломи (2003–2013). Власні результати
Новосад О.І., Крячок І.А., Ульянченко К.О., Скрипець Т.В., Каднікова Т.В.
Резюме. Вступ. Варіанти та результати лікування пацієнтів із множинною мієломою (ММ) набули суттєвих змін за останні 10 років. Вибір лікування пацієнтів різних вікових груп вимагає ретельного врахування балансу між максимальною ефективністю та забезпеченням прийнятної переносимості. Мета. Основною кінцевою точкою даного дослідження було проведення порівняльного аналізу безрецидивної (БРВ) та загальної виживаності (ЗВ) у первинних хворих на ММ, які отримували поліхіміотерапевтичне лікування або лікування із застосуванням імуномодулюючих препаратів або інгібіторів протеасом. Матеріали та методи. Проаналізовано дані 100 пацієнтів зі вперше встановленим діагнозом ММ (медіана: 63, діапазон: 34–80 років; чоловіки: 63, жінки: 37), які отримували лікування в Національному інституті раку в період з січня 2006 по січень 2018 р. Пацієнтів розподілено на групи залежно від схеми лікування: 19% (19/100) пацієнтів отримали терапію за схемами М2, МР або DAV (група 1), 46% (46/100) — на основі талідоміду (група 2) та 35% (35/100) — схеми на основі бортезомібу (група 3). Хромосомні порушення [t(4:14), del13 та del17p13] оцінено у 28% пацієнтів. Проведено аналіз показників БРВ та ЗВ залежно від схеми лікування, кількості препаратів у схемі, віку хворих та цитогенетичних порушень. Результати. Загальний рівень відповіді на терапію 1-ї лінії становив 70% (повна відповідь, дуже добра часткова відповідь, часткова відповідь). Період спостереження становив 129 міс (діапазон 2–129 міс). За даний період зафіксовано рецидиви у 39% хворих протягом періоду спостереження після терапії 1-ї лінії. 61,1 проти 47,8 проти 17,1% випадків рецидиву діагностовано у групі 1 проти групи 2 проти групи 3 відповідно (р<0,05). Трирічний показник БРВ для групи 1 становив 18 проти 30% у групі 3 та 20 проти 30% для групи 2 проти групи 3 відповідно (р=0,002). ROC-аналіз підтвердив, що рівень БРВ при застосуванні комбінованих режимів із бортезомібом у пацієнтів з ММ вище (Se=81%; Sp=54%; AUC=0,7, p=0,0001). Виявлено, що рівень БРВ був вищим у хворих віком молодше 65 років у групі 2 (40 проти 18%, p<0,05). Трирічна ЗВ становила 45 проти 65% у пацієнтів віком старше та молодше 65 років відповідно (logrank-тест, р=0,009). Зафіксовано високий рівень ускладнень, таких як тромбоз, у групі 2 пацієнтів віком старше 65 років (20%) проти молодших 65 років (7,7%) (p<0,05). При аналізі рівня нейротоксичності в трьох дослідних групах виявлено подібну кількість випадків (58,6 проти 60 проти 63%). Трирічна БРВ та ЗВ подібні у групі 3 у хворих віком молодше 65 та старше 65 років (logrank-тест, p=0,4). Виявлено прогресування захворювання у 50 та 33,8% пацієнтів, які отримували 2- та 3-компонентні схеми відповідно (р<0,05). За допомогою ROC-аналізу підтверджено, що 2-компонентні режими асоціюються із більш низьким показником БРВ у літніх (старше 65 років) пацієнтів з ММ (Se=50%; Sp=100%; AUC=0,7, p=0,04). У пацієнтів з del17p13 спостерігалася більш висока частота рецидивів порівняно з хворими, у яких була відсутня del17p13 (p=0,09). Середній показник БРВ у хворих із наявністю del17p13 був нижчим без будь-якої кореляції з віком (10,9 проти 29,7 міс). Не виявлено суттєвого зв’язку між пацієнтами з наявністю делеції 13-ї хромосоми або t(4:14) та відповіддю на лікування. Висновки. Схеми на основі бортезомібу досі залишаються пріоритетними для лікування 1-ї лінії в різних вікових групах пацієнтів з ММ. Талідомідвмісні схеми лікування є також ефективною опцією для пацієнтів віком молодше 65 років, у той час як для хворих віком старше 65 років застосування таких режимів пов’язане з ризиком розвитку тромботичних ускладнень. Для досягнення кращої відповіді на терапію 1-ї лінії бажано використовувати 3-компонентні схеми.
Одержано: 31.05.2019
Прийнято до друку: 26.06.2019
DOI: 10.32471/clinicaloncology.2663-466X.39.22602
Вступ
Множинна мієлома (ММ) — це злоякісне захворювання, що асоційоване з ураженням кісткового мозку та характеризується клональною проліферацією неопластичних плазматичних клітин, наявністю моноклонального парапротеїну в крові або сечі і дисфункцією органів [1]. При аналізі 102 000 осіб у 2008 р. за даними Міжнародного журналу раку (International Journal of Cancer — IJC), ММ діагностовано у 12% серед всіх гематологічних злоякісних новоутворень та приблизно у 1% серед всіх онкологічних захворювань [2]. Середній вік при встановленні діагнозу становить приблизно 70 років [1].
Розробка нових препаратів та їх використання в лікуванні пацієнтів з ММ призвели до значного поліпшення рівня 5- та 10-річної виживаності. Так, показники 5- та 10-річної виживаності зросли з 32,8 і 15% в період з 1998 по 2002 р. до 40,3 і 20,8% з 2003 до 2007 р. відповідно [3]. Однак дотепер ММ залишається невиліковним захворюванням, і тому головною метою в лікуванні даної патології являється контроль над захворюванням, досягнення стійкої ремісії та оптимізація якості життя пацієнта.
Бортезоміб (Velcade, США), перший інгібітор протеасом, був широко вивчений при застосуванні його або в якості монотерапії, або в комбінації з іншими агентами для лікування ММ. Механізм дії даного препарату полягає в зміні регуляторного білка, що контролює розвиток циклу клітини та активацію фактора ядра NF-kB. Пригнічення протеасоми призводить до зупинки клітинного циклу та апоптозу. Також при ММ бортезоміб впливає на здатність клітин мієломи взаємодіяти з мікросередовищем кісткового мозку.
Бортезоміб є ефективним препаратом і добре переноситься при застосуванні в складі схеми першої лінії у раніше нелікованих пацієнтів з ММ. Так, у дослідженні III фази VISTA [4] у пацієнтів похилого віку з вперше встановленим діагнозом ММ, які не були кандидатами для проведення трансплантації, бортезоміб у комбінації з мелфаланом і преднізолоном (VMP) був ефективним і добре переносився. Так, рівень повної відповіді на лікування становив 71 vs 35% (p<0,001) порівняно з небортезомібвмісним режимом МР (мелфалан + преднізолон). На підставі даного дослідження режим VMP був визнаний високоефективним режимом лікування для групи пацієнтів похилого віку, які не розглядаються як кандидати для проведення високодозової хіміотерапії та був внесений до міжнародних рекомендацій (European Society of Medical Oncology — ESMO, National Comprehensive Cancer Network — NCCN та ін.).
У 2011 р. A. Kumar та співавторами [5] було проведено метааналіз, де порівнювали ефективність бортезомібу і талідоміду (як у поєднанні з мелфаланом, так і преднізолоном) у пацієнтів з вперше діагностованою ММ. Не було виявлено відмінностей у відповіді на терапію, але продемонстровано переваги в досягненні повної відповіді (ПВ) [RR 2,34; 95% CI 1,12–4,90] та в частоті побічних явищах 3-го та 4-го ступеня [RR 0,53; 95% CI 0,38–0,73], які спостерігалися частіше при використанні комбінації з бортезомібом.
При застосуванні режиму VMPT (бортезоміб + мелфалан + преднізолон + талідомід) в якості індукції та потім VT (бортезоміб + талідомід) як підтримувальної терапії в порівнянні зі схемою VMP у пацієнтів з ММ, які не були кандидатами для проведення аутологічної трансплантації кісткового мозку (АТКМ), за даними A. Palumbo та співавторів [6], виявили статистично значущу різницю показника ПВ на терапію та безрецидивної виживаності (БРВ) (у групі хворих, які отримували VT проти VMP 38 vs 24%, p<0,001 та 56 vs 41% відповідно, p=0,03).
При застосуванні бортезомібу в пацієнтів, які були кандидатами на АТКМ, P. Sonneveld та співавтори [7] виявили значно більш високий показник БРВ у пацієнтів, які отримували комбінацію бортезомібу, доксорубіцину та дексаметазону (PAD), ніж у хворих, які отримували лікування за схемою вінкристин, доксорубіцин та дексаметазон (VAD). Також, автори зафіксували статистично значущу різницю в досягненні ПВ на користь бортезомібу при застосуванні його в терапії індукції і при підтримувальній терапії (7 проти 2% і 21 проти 9% відповідно, р<0,001).
M. Cavo та співавтори [8] отримали значно кращі результати БРВ з тривалістю до 36 міс при використанні бортезомібу, дексаметазону та талідоміду порівняно з дексаметазоном і талідомідом (HR 0,63; 95% CI 0,45 проти 0,88; p<0,006). J.L. Harousseau та співавтори [9] порівнювали комбінацію бортезомібу з дексаметазоном та комбінацію вінкристину з доксорубіцином та дексаметазоном, однак рівень БРВ не досяг статистичної значущості на користь бортезомібу (р=0,057). Проте дослідники виявили статистично значущу відмінність у рівні ПВ на користь комбінації бортезомібу та дексаметазону як після завершення терапії індукції, так і після першої трансплантації (індукція: 14,8 проти 6,4%, p=0,004; перша трансплантація: 16,1 проти 8,7%, p=0,016). L. Rosinol та співавтори [10] виявили, що показник БРВ був статистично достовірно кращим у групі пацієнтів, що отримували бортезоміб та талідомід, ніж у пацієнтів, які отримували талідомід або інтерферон (2-річна БРВ: 78 проти 63 проти 49%; р=0,01).
Отже, результати численних досліджень II/III фаз у пацієнтів з ММ, які раніше не отримували лікування, вказують на перспективність використання бортезомібу в поєднанні з іншими хіміотерапевтичними засобами в якості індукційної терапії до проведення трансплантації. Вибір лікування для пацієнтів різних вікових груп вимагає ретельного розгляду та визначення балансу між максимальною ефективністю та забезпеченням прийнятної переносимості.
Мета дослідження
Провести порівняльний аналіз рівня загальної виживаності (ЗВ) та БРВ у пацієнтів з вперше діагностованою ММ при застосуванні стандартних хіміотерапевтичних режимів та режимів, які включають нові класи препаратів
Матеріали та методи
В основу дослідження покладено аналіз безпосередніх та віддалених результатів комплексного лікування 100 хворих з вперше встановленим діагнозом ММ (діапазон 34–80 років, медіана віку становила 63 роки; чоловіки: 63, жінки: 37), які перебували на лікуванні у відділенні онкогематології Національного інституту раку з 2006 до 2018 р.
Діагноз ММ визначали згідно з міжнародними критеріями IMWG. Пацієнтам дослідної групи проведено стадіювання за двома системами, а саме Durie-Salmon та ISS-шкалою: 92% (92/100) і 52% (52/100) пацієнтів відповідно (p<0,05).
Пацієнтів дослідної групи розподілено за групами відповідно до схем лікування, які вони отримали: група 1 отримала схеми М2, МР або DAV (19% (19/100)); група 2 — талідомідвмісні режими (46% (46/100)) та група 3 — схеми, що включали інгібітор протеасом (35% (35/100)). У даній роботі ми вивчали показники БРВ та ЗВ залежно від схеми лікування, кількості препаратів у схемі, віку хворих та цитогенетичних порушень. Аналіз хромосомних аномалій (t(4:14), del13 і del17p13) проведено у 28% пацієнтів.
Статистично матеріал оброблений за допомогою програм Statistica 10 та MedClac Version 12.6.1.0. Також використано Cox-тест за Спірманом, Chi-square тест, де р<0,05 вказує на статистично значущі відмінності. Криві виживаності отримані за методом Каплана — Мейєра. БРВ розрахована з першого дня діагностування ММ до дати рецидиву або прогресування захворювання. ЗВ розрахована з першого дня встановлення діагнозу до дати смерті або дати останнього спостереження.
Результати
Встановлено, що загальна позитивна вiдповiдь на лiкування становила 70% за рахунок повних, дуже добрих часткових та часткових ремісій. Тривалість періоду спостереження коливалася від 2 до 129 міс і в середньому становила (10,9 ± 1,2) міс.
Рецидиви зареєстровано у 39% хворих протягом періоду спостереження у пацієнтів після 1-ї лінії лікування. Безрецидивний період становив від 4 до 68 міс.
У групі 1 зареєстровано 61,1% випадків рецидивів проти 47,8 та 17,1% в порівнянні з групою 2 та групою 3 відповідно (р<0,05). Рівень 3-річної БРВ для пацієнтів групи 3 був найвищим у порівнянні з групою 1 та групою 2 (30 проти 18 проти 20% відповідно, p=0,002, Cox-тест) (рис. 1).
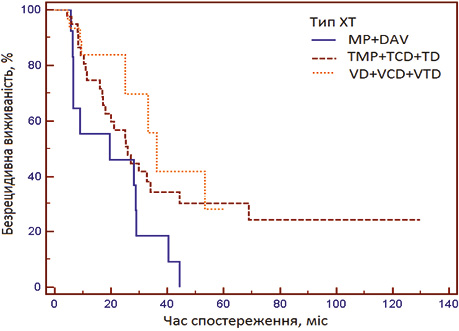
За допомогою ROC-аналізу підтверджено, що бортезомібвмісні (група 3) схеми лікування значно покращують рівень БРВ у пацієнтів з вперше встановленою ММ у порівнянні з даним показником у хворих, які отримували стандартні хіміотерапевтичні режими та талідомідвмісними режимами (Se=81%; Sp=54%; AUC=0,7, p=0,0001).
Таким чином, ефективність терапії за показником БРВ у пацієнтів, які отримували лікування за схемами М2, МР або DAV, більш низька в порівнянні з ефективністю лікування за схемами, які містять нові агенти.
У подальшому проведено аналіз ефективності лікування в різних досліджуваних групах залежно від таких факторів, як вік хворих (молодше та старше 65 років), кількість препаратів у режимі терапії (2- або 3-компонентні) та цитогенетичних порушень.
У групі 1 не виявлено статистично значущої різниці ефективності різних режимів поліхіміотерапії (ПХТ) в різних вікових групах пацієнтів.
Встановлено, що БРВ була вищою у пацієнтів, що отримували талідомідвмісні режими віком менше 65 років у порівнянні з хворими віком старше 65 років (40 проти 18%, р<0,05). Трирічна ЗВ становила 65 проти 45% у молодших вікових групах в порівнянні з літніми пацієнтами відповідно (logrank-тест, p=0,009) (рис. 2).
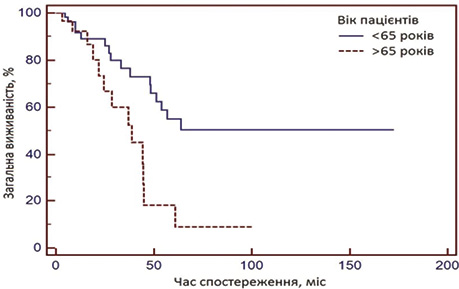
Слід зауважити, що в даній групі хворих зареєстровано високий рівень тромбозів, у пацієнтів віком старше 65 років (20%) в порівнянні з хворими, які були молодшими за 65 років (7,7%) (p<0,05). У пацієнтів груп 1 та 3 не зареєстровано жодного випадку тромбозів під час лікування.
Рівень 3-річної БРВ та ЗВ не залежав від віку пацієнтів (93 та 100% відповідно, logrank-тест, p=0,4) у групі 3.
При аналізі рівня нейротоксичності в трьох дослідних групах виявлено подібну кількість випадків (58,6 проти 60 проти 63%).
Встановлено статистично значущу різницю показників віддалених результатів лікування залежно від того, отримували пацієнти 2- або 3-компонентні схеми терапії. У пацієнтів, які отримували 2- та 3-компонентні схеми, зареєстровано 50 та 33,8% випадків прогресування захворювання відповідно (р<0,05).
При аналізі ефективності лікування залежно від цитогенетичних аномалій (або цитогенетичних несприятливих факторів) встановлено, що пацієнти з del17p13 мали тенденцію до більш високої частоти розвитку випадків рецидиву, порівняно з пацієнтами з відсутністю del17p13 (p=0,09, Cox-тест). Медіана БРВ у хворих з наявністю del17p13 була нижчою без будь-якої кореляції з віком (10,9 проти 29,7 міс відповідно, р<0,05).
Мультиваріабельний аналіз не виявив кореляційного статистично значимого зв’язку між наявністю del13 або t(4:14) і клінічними результатами лікування ММ незалежно від виду лікування, яке отримували хворі, що, можливо, пов’язано з наявністю недостатньої кількості цитогенетичних досліджень.
Обговорення
Застосування бортезомібу в комбінації з хіміотерапією призводить до покращення результатів лікування у пацієнтів з вперше встановленим діагнозом ММ, про що свідчать результати численних досліджень [4, 7–9, 11, 12]. В Україні дотепер для лікування ММ достатньо широко застосовуються режими ПХТ та талідомідвмісні режими.
Нами проведено порівняльний аналіз ефективності лікування хворих на ММ з вперше встановленим діагнозом за показниками БРВ та ЗВ у пацієнтів, які отримували ПХТ або талідомідвмісні режими, або бортезомібвмісні режими лікування.
Результати нашого дослідження показали, що рівень 3-річної БРВ був найвищим у групі пацієнтів, які отримували бортезомібвмісні режими в порівнянні з хіміотерапевтичними та талідомідвмісними режимами лікування (30 проти 18 проти 20% відповідно, p=0,002). Отримані дані узгоджуються з результатами дослідження VISTA, у якому порівнювали ефективність застосування схеми МР та VMP і авторами були показані переваги в показниках БРВ та ЗВ при застосуванні бортезомібвмісного режиму.
При аналізі показників виживаності залежно від віку (до 65 або старше 65 років) було показано, що БРВ була вищою у пацієнтів, молодших за 65 років, які отримували талідомідвмісні режими, у той час як при застосуванні інших схем не було виявлено різниці в ефективності терапії залежно від віку хворих.
Слід зауважити, що в групі хворих, які отримували талідомідвмісні режими, зареєстровано високий рівень тромбозів у пацієнтів віком старше 65 років (20%) у порівнянні з хворими, які були молодшими за 65 років (7,7%) (p<0,05), у той час як у пацієнтів, які отримували інші схеми лікування, не зареєстровано жодного випадку тромбозу під час лікування. Про ризик розвитку тромбозу повідомлялося в дослідженні S. Rajkumar та співавторів (2001) [11]. Отже, отримані результати свідчать про необхідність ретельного моніторингу та проведення профілактики тромботичних ускладнень у хворих, які отримують талідомідвмісні режими.
Відомо, що хворі на ММ з наявністю делеції 17-ї хромосоми, транслокацій 4;14 або 14;16 відносяться до групи високого ризику [12]. При аналізі ефективності лікування у хворих досліджуваної групи залежно від наявності del17p13 встановлено, що медіана БРВ у хворих з наявністю del17p13 була нижчою незалежно від віку хворого (10,9 проти 29,7 міс відповідно, р<0,05).
Продемонстровано також переваги застосування 3-компонентних схем терапії в порівнянні з 2-компонентними у хворих на ММ всіх досліджуваних груп.
На сьогодні одним з підходів для покращення відповіді на лікування є використання нових агентів з метою досягнення більш глибокої ремісії у пацієнтів, яким планується проведення АТКМ, та для тих пацієнтів, які не розглядаються як кандидати для трансплантації.
Висновок
Бортезомібвмісні режими лікування залишаються пріоритетними для лікування пацієнтів з ММ, які раніше не отримували лікування в якості терапії 1-ї лінії та для різних вікових груп. Талідомідвмісні схеми лікування є також ефективною опцією для пацієнтів віком молодше 65 років, у той час як для хворих віком старше 65 років застосування таких режимів пов’язане з ризиком розвитку тромботичних ускладнень. Для досягнення кращої відповіді на терапію 1-ї лінії бажано використовувати 3-компонентні схеми із застосуванням новітніх агентів для пацієнтів різних вікових груп.
Список використаної літератури
- Palumbo, A. & Anderson, K.C. (2011). Multiple myeloma. New England Journal of Medicine, 364, 1046–1060. doi: 10.1056/NEJMra1011442.
- Ferlay, J., Shin, H., Bray, F., Forman, D., Mathers, C.D. & Parkin, D.M. (2010). Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008. International Journal of Cancer, 127, 2893–2917. doi: 10.1002/ijc.25516.
- Pulte, D., Gondos, A. & Brenner, H. (2011). Improvement in survival of older adults with multiple myeloma: results of an updated period of analysis of SEER data. Oncologist, 16(11), 1600–1603. doi: 10.1634/theoncologist.2011-0229.
- San Miguel, J.F., Schlag, R., Khuageva, N.K., Dimopoulos, M.A., Shpilberg, O., Kropff, M. … Richardson, P.G. (2008). Bortezomib plus melphalan and prednisone for initial treatment of multiple myeloma. The New England Journal of Medicine, 359(9), 906–917. doi: 10.1056/NEJMoa0801479.
- Kumar, A., Hozo, I., Wheatley, K. & Djulbegovic, B. (2011). Thalidomide versus bortezomib based regimens as first-line therapy for patients with multiple myeloma: a systematic review. American Journal Hematolоgy, 86(1), 18–24. doi: 10.1002/ajh.21904.
- Palumbo, A., Bringhen, S., Rossi, D., Cavalli, M., Larocca, A., Ria, R. … Boccadoro, M. (2010). Bortezomib-melphalan-prednisone-thalidomide followed by maintenance with bortezomib-thalidomide compared with bortezomib-melphalan-prednisone for initial treatment of multiple myeloma: a randomized controlled trial. Journal of Clinical Oncology, 28(34), 5101–5109. doi: 10.1200/JCO.2010.29.8216.
- Sonneveld, P., Schmidt-Wolf, I.G., van der Holt, B., El Jarari, L., Bertsch, U., Salwender, H. … Goldschmidt, H.M. (2012). Bortezomib induction and maintenance treatment in patients with newly diagnosed multiple myeloma: results of the randomized phase III HOVON-65/ GMMG-HD4 trial. Journal of Clinical Oncology, 30(24), 2946–2955. doi: 10.1200/JCO.2011.39.6820.
- Cavo, M., Tacchetti, P., Patriarca, F., Petrucci, M.T., Pantani, L., Galli, M. … Baccarani, M. (2010). Bortezomib with thalidomide plus dexamethasone compared with thalidomide plus dexamethasone as induction therapy before, and consolidation therapy after, double autologous stem-cell transplantation in newly diagnosed multiple myeloma: a randomised phase 3 study. The Lancet, 376(9758), 2075–2085. doi: 10.1016/S0140-6736(10)61424-9.
- Harousseau, J.L., Attal, M., Avet-Loiseau, H., Marit, G., Caillot, D., Mohty, M. … Moreau, P. (2010). Bortezomib plus dexamethasone is superior to vincristine plus doxorubicin plus dexamethasone as induction treatment prior to autologous stem-cell transplantation in newly diagnosed multiple myeloma: results of the ifm 2005-01 phase III trial. Journal Clinical Oncology, 28(30), 4621–4629. doi: 10.1200/JCO.2009.27.9158.
- Rosinol, L., Cibeira, M.T., Mateos, M.V. & Martinez-Lopez, J. (2012). A phase III pethema/gem randomised trial of posttransplant maintenance in multiple myeloma: superiority of bortezomib. Bone Marrow Transplant, 47, S2. Retrieved from https://www.researchgate.net/publication/295643911.
- Rajkumar, S., Hayman, S., & Gertz, M. (2001). Deep Venous Thrombosis and Thalidomide Therapy for Multiple Myeloma. Blood, 344 (25), 1951–1952. doi: 10.1056/NEJM200106213442516.
- Sonneveld, P., Avet-Loiseau, H., Lonial, S., Usmani, S., Siegel, D., Anderson, K.C. … Orlowski, R. (2017). Treatment of multiple myeloma with high-risk cytogenetics: a consensus of the International Myeloma Working Group. Blood, 127(24), 2955–2962. doi.org/10.1182/blood-2016-01-631200.
Изменения в парадигме лечения множественной миеломы (2003–2013). Собственные результаты
Национальный институт рака, Киев
Резюме. Введение. Варианты и результаты лечения пациентов с множественной миеломой (ММ) существенно изменились за последние 10 лет. Выбор лечения пациентов разных возрастных групп требует тщательного учета баланса между максимальной эффективностью и обеспечением приемлемой переносимости. Цель. Основной конечной точкой данного исследования было проведение сравнительного анализа безрецидивной (БРВ) и общей виживаемости (ОВ) у первичных больных с ММ, которые получали полихимиотерапевтическое лечение или лечение с применением иммуномодулирующих препаратов или ингибиторов протеасом. Материалы и методы. Проанализированы данные 100 пациентов с впервые установленным диагнозом ММ (медиана: 63, диапазон: 34–80 лет мужчины: 63, женщины: 37), которые получали лечение в Национальном институте рака в период с января 2006 по январь 2018 г. Пациенты были разделены на группы в зависимости от схемы лечения: 19% (19/100) пациентов получили терапию по схемам М2, МР, DAV (группа 1), 46% (46/100) — на основе талидомида (группа 2) и 35% (35/100) — схемы на основе бортезомиба (группа 3). Хромосомные нарушения [t(4:14), del13 и del17p13] оценены у 28% пациентов. Проведен анализ показателей БРВ и ОВ в зависимости от схемы лечения, количества препаратов в схеме, возраста больных и цитогенетических нарушений. Результаты. Общий уровень ответа на терапию 1-й линии составил 70% (полный ответ, очень хороший частичный ответ, частичный ответ). Период наблюдения составил 129 мес (диапазон 2–129 мес). За данный период зафиксированы рецидивы у 39% пациентов в течение периода наблюдения после терапии 1-й линии. 61,1 против 47,8 против 17,1% случаев рецидива диагностировано в группе 1 против группы 2 против группы 3 соответственно (р<0,05). Трехлетний показатель БРВ для группы 1 составил 18 против 30% в группе 3 и 20 против 30% для группы 2 против группы 3 соответственно (р=0,002). ROC-анализ подтвердил, что уровень БРВ при использовании комбинированных режимов с бортезомибом у пациентов с ММ выше (Se=81%; Sp=54%; AUC=0,7, p=0,0001). Установлено, что уровень БРВ был выше у больных в возрасте моложе 65 лет в группе 2 (40 против 18%, p<0,05). Трехлетняя ОВ составила 45 против 65% у пациентов в возрасте старше и моложе 65 лет соответственно (logrank-тест, p=0,009). Зафиксирован высокий уровень осложнений, таких как тромбоз, в группе 2 пациентов в возрасте старше 65 лет (20%) в сравнении с пациентами младше 65 лет (7,7%) (p<0,05). При анализе уровня нейротоксичности в трех исследуемых группах выявлено одинаковое количество случаев (58,6 против 60 против 63%). Трехлетняя БРВ и ОВ сопоставимы в группе 3 у больных в возрасте младше 65 и старше 65 лет (logrank-тест, p=0,4). Выявлено прогрессированиезаболевания у 50 и 33,8% пациентов, получавших 2- и 3-компонентные схемы соответственно (р<0,05). С помощью ROC-анализа подтверждено, что 2-компонентные режимы ассоциируются с более низким показателем БРВ у пожилых (старше 65 лет) пациентов с ММ (Se=50%; Sp=100%; AUC=0,7, p=0,04). У пациентов с del17p13 наблюдалась более высокая частота рецидивов по сравнению с больными, у которых отсутствовала del17p13 (p=0,09). Средний показатель БРВ у больных с наличием del17p13 был ниже без какой-либо корреляции с возрастом (10,9 против 29,7 мес). Не выявлено существенной связи между пациентами с наличием делеции 13-й хромосомы или t(4:14) и ответом на лечение. Выводы. Схемы на основе бортезомиба до сих пор остаются приоритетными для лечения 1-й линии в разных возрастных группах пациентов с ММ. Талидомидсодержащие схемы лечения — также эффективная опция для пациентов в возрасте младше 65 лет, в то время как для больных в возрасте старше 65 лет использование таких режимов связано с риском развития тромботических осложнений. Для достижения лучшего ответа на терапию 1-й линии желательно использовать 3-компонентные схемы.
множественная миелома; бортезомиб, талидомид; выживаемость.
Новосад Ольга Ігорівна
03022, Київ, вул. Ломоносова, 33/43
Національний інститут раку
Тел.: (044) 257-21-56
E-mail: novosad.o.ua@gmail.com
Correspondence:
Novosad Olga
National Cancer Institute
33/43 Lomonosova Str., Kyiv 03022
Tel.: (044) 257-21-56
E-mail: novosad.o.ua@gmail.com














Leave a comment