Цитологічні особливості плазмоцитоми і диференційні ознаки пухлини Юїнга, неходжкінських лімфом і залозистого раку
Болгова Л.С., Алексеенко О.И., Туганова Т.Н., Ярощук Т.М.
Резюме. Мієломна хвороба або генералізована плазмоцитома (ПЦ) — злоякісна пухлина із плазматичних клітин, при якій переважає ураження кісткового мозку і кісткової системи. Це новоутворення характеризується клоновою проліферацією плазмоцитів, що визначається при наявності їх типових цитологічних ознак. Однак різний ступінь диференціювання і лізису пухлинних плазматичних клітин викликає значні складності в їх ідентифікації і в частині випадків дозволяє лише констатувати злоякісну круглоклітинну дрібноклітинну пухлину, а не встановити діагноз ПЦ. Мета. Представити різні за цитоморфологічними ознаками варіанти цитограм ПЦ для покращення їх цитологічної діагностики. Результати. Вивчені цитологічні препарати, пофарбовані за методом Паппенгейма, пункційних біопсій 22 хворих з клініко-рентгенологічним діагнозом ПЦ. Усі спостереження верифіковані гістологічним методом. Проведені дослідження цитограм ПЦ, які представлені у вигляді характерних мікрофотографій, дозволили виявити їх різновиди залежно від ступеня поліморфізму пухлинних клітин і дистрофічних змін. Описана диференційна діагностика ПЦ та інших дрібноклітинних злоякісних новоутворень — пухлини Юїнга, дрібноклітинних неходжкінських лімфом і залозистого раку. Висновки. Основними орієнтирами при цитологічній діагностиці ПЦ є: базофільна дрібнозерниста цитоплазма або її уривки, типова брильчата структура хроматину ядер, що розташовується переважно по периферії ядра, утворюючи «колесоподібну» форму, яка визначається хоча б у невеликій частині ядер.
Резюме. Миеломная болезнь, или генерализованная плазмоцитома (ПЦ) — злокачественная опухоль из плазматических клеток, при которой преобладает поражение костного мозга и костной системы. Это новообразование характеризуется клоновой пролиферацией плазмоцитов, что определяется при наличии их типичных цитологических признаков. Однако различная степень дифференцирования и лизиса опухолевых плазматических клеток вызывает значительные сложности в их идентификации и в ряде случаев позволяет лишь констатировать злокачественную круглоклеточную мелкоклеточную опухоль, а не установить диагноз ПЦ. Цель. Представить различные по цитоморфологическим признакам варианты цитограмм ПЦ для улучшения их цитологической диагностики. Результаты. Изучены цитологические препараты, окрашенные по методу Паппенгейма, пункционных биопсий 22 больных с клинико-рентгенологическим диагнозом ПЦ. Все наблюдения верифицированы гистологическим методом. Проведенные исследования цитограмм ПЦ, представленные в виде характерных микрофотографий, позволили выявить их разновидности в зависимости от степени полиморфизма опухолевых клеток и дистрофических изменений. Описана дифференциальная диагностика ПЦ и других мелкоклеточных злокачественных новообразований — опухоли Юинга, мелкоклеточных неходжкинских лимфом и железистого рака. Выводы. Основными ориентирами при цитологической диагностике ПЦ являются: базофильная мелкозернистая цитоплазма или ее обрывки, типичная глыбчатая структура хроматина ядер, располагающаяся преимущественно по периферии ядра, образуя «колесовидную» форму, которая прослеживается хотя бы в небольшой части ядер.
Одержано: 09.09.2019
Підписано до друку: 02.10.2019
DOI: 10.32471/clinicaloncology.2663-466X.40.22895
ВВЕДЕНИЕ
Миеломная болезнь, или множественная миелома, генерализованная плазмоцитома (ПЦ) или болезнь Рустицкого — Калера — злокачественная опухоль из плазматических клеток, представляет собой заболевание системы крови, относящееся к парапротеинемическим лейкозам. Свое название заболевание получило в связи с преимущественной локализацией процесса в костном мозге [1–3].
Частота встречаемости ПЦ (костной или экстрамедуллярной), по данным различных авторов, значительно варьирует [1, 4, 5]. В Украине в 2016–2017 гг. заболеваемость ПЦ составила 2,2 на 100 тыс. населения [6].
Парапротеинемические гемобластозы — опухоли системы В-лимфоцитов, при которых неопластические клетки дифференцируются до клеток, секретирующих иммуноглобулин. Морфологическим субстратом опухоли являются плазматические клетки или В-лимфоциты. Поскольку данные лейкозы, как и другие, возникают первоначально из одной озлокачествленной клетки, вся масса опухолевых клеток представляет собой один клон и секретирует один иммуноглобулин, в связи с чем эти заболевания называют моноклональными иммуноглобулинопатиями. Класс патологического иммуноглобулина в сыворотке больного определяет иммунохимический вариант миеломной болезни: G-миелома, А-миелома, D-миелома.
В пунктате костного мозга большинства больных выявляют десятки процентов плазматических клеток. При количестве плазматических клеток более 30% диагноз ПЦ является убедительным. В сомнительных случаях повторяют костномозговую пункцию или проводят трепанобиопсию.
Опухолевые плазматические клетки морфологически могут существенно не отличаться от клеток здорового человека, несмотря на то, что в препаратах нередко определяются многоядерные клетки. Ряд авторов описывают типичные цитологические признаки ПЦ, отмечая характерное строение хроматина ядра, эксцентричное расположение ядер в цитоплазме, морфофункциональные особенности цитоплазмы, определенные фоновые компоненты [5, 7–10].
По результатам части наблюдений, клетки ПЦ характеризуются выраженным полиморфизмом и атипией с уродливой формой ядер, крупными ядрышками или большим количеством мелких их вариантов, красноватым оттенком «пламенеющей» цитоплазмы, наличием гранул в ней и др. Отмечено, что цитоморфологические признаки опухолевых клеток у отдельных больных могут значительно варьировать [1, 11–13].
С учетом особенностей структуры ядра и цитоплазмы опухолевых клеток, в зависимости от степени их зрелости, обычно выделяют два основных цитологических варианта ПЦ, морфологический субстрат которых состоит из более или менее зрелых клеток [1, 4].
Следует отметить, что о степени дифференциации опухолевых плазматических клеток в цитологических препаратах судить очень сложно в связи с относительным полиморфизмом ядер. Лишь в отдельных цитограммах определяются ядра с крупными ядрышками, дистрофическими изменениями неопластических клеток, которые наблюдаются преимущественно в малодифференцированных формах опухоли. Кроме того, в части клеток цитоплазма лизирована, определяются только «голые» ядра, не сохраняется глыбчатая структура хроматина, что значительно усложняет оценку цитологического препарата. В литературе приводятся цитограммы с типичными признаками ПЦ [5, 7–10], в то время как в процессе цитологических исследований наблюдается весьма широкий спектр их разнообразных цитоморфологических проявлений.
Современная морфологическая диагностика предусматривает применение иммуноцитохимического метода для уточнения генеза новообразований. Основным, считающимся специфическим маркером, который часто используется для определения опухолевых плазмоцитов, является СD 138, однако эта реакция позитивна и при карциномах. При проведении дифференциальной диагностики между ПЦ и железистым раком (ЖР) следует учитывать, что мембранный эпителиальный антиген выявляют в новообразованиях эпителиального происхождения, в значительной части реактивных плазмоцитов и в клетках ПЦ, что затрудняет их идентификацию и требует использования более широкой панели моноклональных антител. При ПЦ отмечается экспрессия CD 38, CD 79а, CD 56, а также характерно отсутствие CD 19 и CD 45. В то же время цитоморфологические критерии опухолевых клеток общеприняты и в большинстве случаев способствуют точному определению нозологических форм новообразований.
Цель — представить цитоморфологические признаки различных вариантов плазмоцитом и дифференциальные критерии при опухоли Юинга, неходжкинских лимфомах (НХЛ) и ЖР для повышения уровня цитологической диагностики.
ОБЪЕКТ И МЕТОДЫ ИССЛЕДОВАНИЯ
Изучены цитологические препараты пункционных биопсий 22 больных с диагнозом ПЦ. Все наблюдения верифицированы гистологическим методом. Цитологические препараты окрашивали по методу Паппенгейма, изучали с помощью микроскопов OLYMPUS СX41 и OLYMPUS CX 21 при увеличениях ×200, ×400, ×1000.
Возраст больных определялся в интервале от 37 до 72 лет при среднем значении (58,3±2,1) лет. Женщины составили большинство (14; 64%), мужчин было почти в 2 раза меньше (8; 36%). При этом наблюдалось поражение костей таза у 10 (45,6%), костей скелета — 5 (22,8%), лопатки — у 2 (9,1%) пациентов, ребра, грудины, ключицы, позвонка, бедренной кости — по 1 (4,5%) больному.
Кроме того, исследовали также цитологические препараты опухоли Юинга у 5, НХЛ у 7 и ЖР у 8 пациентов.
РЕЗУЛЬТАТЫ
Изученный пункционный материал опухолей кости был информативен и состоял только из плазматических клеток различной степени сохранности. В цитологических препаратах миеломной болезни нами отмечено множество разнообразных микроскопических вариантов, в которых опухолевые клетки значительно отличались в зависимости от степени дифференцирования, структурной компоновки и выраженности дистрофических изменений. При этом часто наблюдался лизис цитоплазмы, морфологические проявления которой при исследовании ПЦ имели весомое значение. Сплошное разрушение цитоплазмы способствовало появлению «голых» ядер, изменению в них структуры хроматина, который являлся весьма важным диагностическим признаком.
Подобное состояние клеток и их составляющих часто затрудняло идентификацию и дифференциальную диагностику с клетками саркомы Юинга, НХЛ, ЖР и некоторых других мелкоклеточных опухолей [12, 13].
При типичном варианте ПЦ в цитологических препаратах на мелкозернистом фоне выявляли разрозненно расположенные плазмоциты с округлой и овальной базофильной цитоплазмой и своеобразной полосой околоядерного просветления. Преимущественно округлые небольшие ядра в цитоплазме определялись эксцентрично. Они отличались гиперхромностью с характерной неравномерной структурой хроматина, крупные глыбки которого локализовались, как правило, по периферии ядра и по форме рисунка напоминали спицы колеса (рис. 1). Отмечали двух-, трех- и многоядерные клетки с подобной структурой хроматина ядра и базофильной мелкозернистой цитоплазмой.
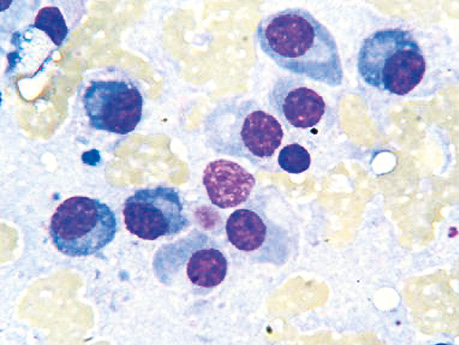
Другая разновидность цитограмм ПЦ содержала небольшое количество клеток, подобных плазматическим, но лишь единичные из них имели сохранную базофильную цитоплазму и характерную неравномерную мелко- и крупноглыбчатую структуру хроматина. Определяли немного «голых» гиперхромных ядер. Клетки располагались на фоне элементов крови и небольшого количества мелкозернистой субстанции, образовавшейся в результате распада цитоплазмы (рис. 2).
Следующий вариант цитологических препаратов ПЦ состоял в основном из мелких «голых» гиперхромных ядер различных размеров, расположенных на мелкозернистом довольно густом базофильном, изредка — оксифильном фоне (рис. 3). Только тщательное изучение структуры хроматина и выявляемая своеобразная глыбчатая его компоновка позволяли распознать ядра плазматических клеток. Уверенности в диагнозе придавало наличие единичных сохранных опухолевых клеток с базофильной цитоплазмой и околоядерным ободком просветления.
В некоторых цитограммах ПЦ отмечали скопления и напластования мелких «голых» относительно мономорфных, гиперхромных, реже — нормохромных ядер, напоминающих клетки при ЖР с лизированной цитоплазмой. В то же время выявление единичных неопластических клеток с типичной цитоплазмой и характерной глыбчатой структурой хроматина в «голых» ядрах позволяло идентифицировать ПЦ. Одним из дополнительных диагностических признаков ПЦ, был фоновый компонент, представленный мелкозернистой, чаще базофильной субстанцией вследствие распавшейся цитоплазмы, на которой располагались опухолевые плазмоциты и их «голые» ядра (рис. 4).
В части наблюдений ПЦ определяли умеренно полиморфные — овальные, округлые и неправильной формы «голые» гиперхромные ядра с неравномерной структурой хроматина. В базофильной цитоплазме единичных плазматических клеток отмечались множественные мелкие вакуоли. Важным цитологическим признаком ПЦ было выявление многоядерных клеток с характерной глыбчатой структурой хроматина и околоядерным просветлением. При этом ядра были разных размеров и формы. Элементы опухоли располагались на мелкозернистом базофильном фоне (рис. 5).
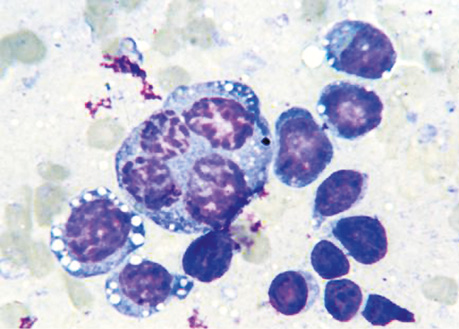
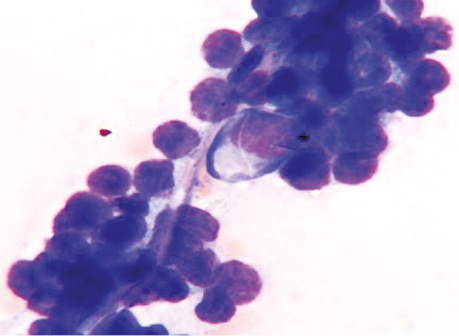
Некоторые цитологические препараты ПЦ было весьма сложно дифференцировать с клетками опухоли Юинга. Ядра в них обычно округлые с равномерной мелкозернистой структурой хроматина. В части клеток выявляли тонкую слабобазофильную, иногда оксифильную ажурную цитоплазму, содержащую мелкие вакуоли. Как правило, в пунктатах, полученных из опухоли Юинга, определялось большое количество мелких клеточных элементов с тонкой мелковакуолизированной небольшой цитоплазмой, но часто без нее, что вызывало сложности при цитологической дифференциальной диагностике (рис. 6).
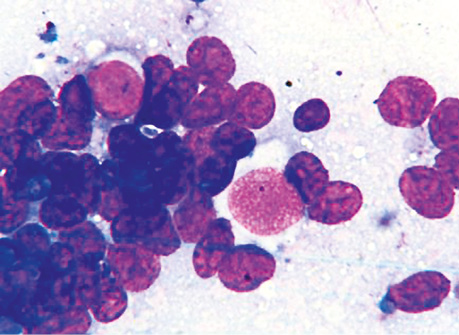
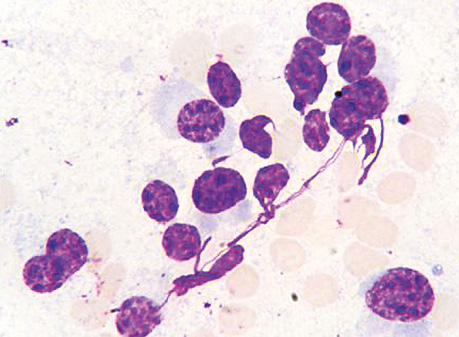
В отдельных случаях возникала необходимость в дифференциальной диагностике ПЦ с мелкоклеточными НХЛ, содержащими лимфоидные элементы небольших размеров. Значимым дифференциально-диагностическим признаком НХЛ был феномен выявления преимущественно мелких опухолевых лимфоидных клеток различной степени дифференциации. При этом в ядрах отмечалась неравномерная структура хроматина. Цитоплазма небольшая, интенсивно окрашивалась в базофильные тона. В зависимости от степени дифференцирования неопластические лимфоидные клетки отличались своеобразной цитоморфологией. Наблюдались клеточные элементы с расщепленными ядрами, что характерно именно для В-клеточных НХЛ. Фоновым компонентом были лептоны — шаровидные обрывки светлобазофильной цитоплазмы. Представленные особенности мелкоклеточных НХЛ позволяли провести их дифференциальную диагностику с ПЦ (рис. 7).
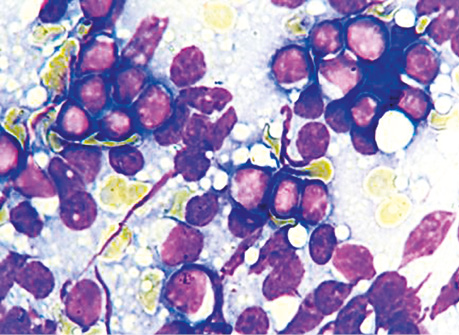
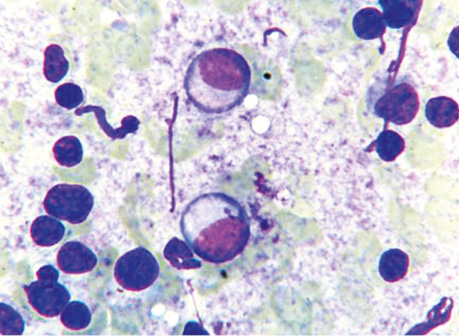
Сходный набор цитоморфологических признаков при ПЦ наблюдался и при ЖР с распадом опухолевых клеток. Но в цитологических препаратах ЖР с выраженным лизисом цитоплазмы ядра имели преимущественно гомогенную или мелкозернистую структуру хроматина, были более светлыми, чаще отмечали их тесные скопления, а также ядра-тени. Верификации ЖР способствовало выявление клеток с сохранной тонкой цитоплазмой и полиморфными ядрами с неравномерной мелкозернистой структурой хроматина и крупным одиночным центрально расположенным ядрышком. Кроме того, клетки ЖР в некоторых препаратах отмечались среди небольшого количества оксифильной субстанции (рис. 8). В тех случаях, когда в цитологическом препарате определялись только небольшие округлые «голые» ядра с мелкозернистой структурой хроматина без визуализированных ядрышек, провести дифференциальную диагностику с другими мелкоклеточными опухолями было весьма затруднительно.
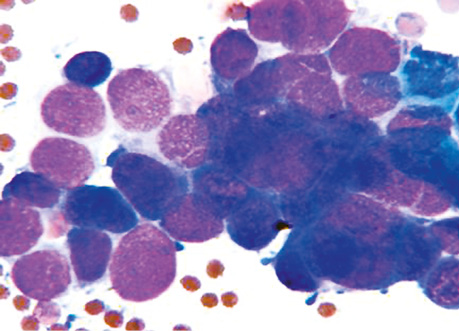
В каждом наблюдении очень важно учитывать тщательно собранный анамнез, данные рентгенологических и лабораторных исследований, которые способствовали формированию представления о клиническом проявлении заболеваний и проведению их дифференциальной диагностики.
Таким образом, полученные данные позволили констатировать, что в цитологических препаратах, приготовленных из пункционного материала ПЦ, как правило, много клеток, которые имели весьма разнообразный вид. Довольно часто выявляли «голые» ядра, цитоплазму клеток с различной степенью лизиса. В сохранных клетках вокруг ядра прослеживался ободок просветления, а также выявлялись опухолевые экземпляры с гомогенной цитоплазмой. Вероятнее всего, описанные клеточные элементы ПЦ относились к их незрелым формам. В клетках ПЦ ядра округлые, гиперхромные, эксцентрично расположенные в цитоплазме. В них определялась глыбчатая структура хроматина, которая являлась одним из важных дифференциально-диагностических признаков, отличающих ПЦ от других мелкоклеточных опухолей мезенхимального и эпителиального генеза.
В заключение необходимо отметить, что при цитологической диагностике ПЦ важно учитывать все варианты возможных изменений опухолевых клеток. Но основными цитоморфологическими ориентирами ПЦ являются: характерная мелкозернистая базофильная цитоплазма с просветлением вокруг ядра или ее обрывки, типичная глыбчатая структура хроматина, располагающегося преимущественно по периферии ядра и создающего своеобразную «колесовидную» организацию хроматиновых глыбок, которая прослеживается в определенной части ядер. Отличительным признаком ПЦ является также наличие многоядерных клеток с неравномерной глыбчатой структурой хроматина. Выявление специфических критериев ПЦ позволяет дифференцировать ее с клетками опухоли Юинга, НХЛ и ЖР.
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ
- 1. Байков, В. В. (2008). Множественная миелома (морфологическое и молекулярно-биологическое исследование (Автореф. дис. докт. мед. наук). Санкт- Петербург. Retrieved from https://www.dissercat.com/content/mnozhestvennaya-mieloma-morfologicheskoe-i-molekulyarno-biologicheskoe-issledovanie.
- 2. Бессмельцев, С. С. (2004). Диагностика и дифференциальная диагностика множественной миеломы. Вопросы онкологии, 4, 406–16.
- 3. Swerdlow, S. H., Campo, E., Harris, N. L., Jaffe, E. S., Pileri, S. A., Stein, H., & Thiele, J. (2017). WHO classification of tumours of hematopoietic and lymphoid tissues (4 еd.). Lyon: IARC.
- 4. Бессмельцев, С. С. (2013). Множественная миелома (патогенез, клиника, диагностика, дифференциальный диагноз). Клиническая онкогематология, 6(3), 237–257. Retrieved from http://bloodjournal.ru /mnozhestvennaya-mieloma-patogenez-klinika-diagnostika-differentsialnyj-diagnoz-chast-i/.
- 5. Husney, J., Guttmann, S., Anyadike, N., Mayer, I., & Rahmani, R. (2016). Endoscopic ultrasound-fine needle aspiration: A novel way to diagnose a solitary extramedullary plasmacytoma of the liver. Endoscopic Ultrasound, 5(2), 134–136. doi: 10.4103/2303-9027.180481.
- 6. Федоренко, З. П., Гулак, Л. О., Михайлович, Ю. Й., Горох, Є. Л., Рижов, А. Ю., Сумкіна, О. В., & Куценко, Л. Б. (2019). Рак в Україні, 2017–2018. Захворюваність, смертність, показники діяльності онкологічної служби. Бюлетень Національного канцер-реєстру України, 20. Retrieved from http://www.ncru.inf.ua/publications/BULL_20/index.htm.
- 7. Gochhait, D., Dey, P., & Verma, N. (2016). Cytology of plasma cell rich effusion in cases of plasma cell neoplasm. Journal of Cytology, 33(3), 150–153. doi: 10.4103/0970-9371.177147.
- 8. Фирсова, М. В., Менделеева, Л. П., Ковригина, А. М., Дейнеко, Н. Л., Соловьев, М. В., Гемджян, Э. Г., & Савченко, В. Г. (2018). Особенности морфологического строения субстрата опухоли у пациентов с множественной миеломой, осложненной плазмоцитомой. Онкогематология, 13(2), 73–81. doi: 10.17650/1818-8346-2018-13-2-73-81.
- 9. Goel, G., Rai, S., Naik, R., Gupta, A., Baliga, P., & Sinha, R. (2010). Cytodiagnosis of extramedullary plasmacytomas. Acta Cytologica, 54(3), 255–258. doi: 10.1159/000325031.
- 10. Gill, M. K, Makkar, M., & Bains, S. P. S. (2013). Solitari plasmocytoma of skull: a rare cytological diagnosis. Journal of Clinical and Diagnostic Research, 7(8): 1702–1703. doi: 10.7860/JCDR/2013/5555.3259.
- 11. Костюкова, М. Н., Якимович, О. Ю., Гривцова, Л. Ю. Купрышина, Н. А., Френкель, М. А., Вотякова, О. М.,… Тупицын, Н. Н. (2011). Плазмобластный вариант множественной миеломы с лимфоидной морфологией злокачественных клеток и экспресией CD 20. Описание наблюдения. Клиническая онкогематология, 4(1), 44–49. Retrieved from https://cyberleninka.ru /article/n/plazmoblastnyy-variant-mnozhestvennoy-mielomy-s-limfoidnoy-morfologiey-zlokachestvennyh-kletok-i-ekspressiey-cd20-opisanie.
- 12. Maqsood, U., Jones, H., Gey van Pittius, D., & Haris, M. (2016). Primary pulmonary plasmacytoma mimicking lung cancer diagnosed on endobronchial ultrasound (EBUS)-guided biopsy. BMJ Case Reports, Jun 14. pii: bcr2016215785. doi: 10.1136/bcr-2016-215785.
- 13. Ding, Y., Xi, Y., Sun, X. Q., Meng, S. Q., Liu, W.F., & Huang, X. Y. (2013). Small cell malignant tumors of bone: comparison between diagnosis using core needle biopsies and surgical spesimens. Zhonghua Bing Li Xue Za Zhi., 42(3), 163–167. doi: 10.3760/cma.j.issn.0529-5807.2013.03.005.
Болгова Лидия Севастьяновна
03022, Киев, ул. Ломоносова, 33/43
Национальный институт рака
Тел.: (044) 257-51-59
E-mail: bolgova2006@ukr.net
Bolgova Lidija
33/43 Lomonosova str., Kyiv 03022
National Cancer Institute
Tel.: (044) 257-51-59
E-mail: bolgova2006@ukr.net














Leave a comment