ДОСЛІДЖЕННЯ ВПЛИВУ ЕЛЕКТРОМАГНІТНОГО ОПРОМІНЕННЯ ТА МАГНІТОЧУТЛИВОГО НАНОКОМПЛЕКСУ НА КЛІТИНИ АДЕНОКАРЦИНОМИ
Орел В.Е.1, Бездєнєжних Н.О.2, Шевченко А.Д.3, Ніколов М.О.1, Романов А.В.1, Храновська Н.М.1, Скачкова О.В.1, Кудрявець Ю.Й.2, Щепотін І.Б.1
- 1Національний інститут раку, Київ
- 2Інститут експериментальної патології, онкології і радіобіології ім. Р.Є. Кавецького НАН України, Київ
- 3Інститут металофізики ім. Г.В. Курдюмова НАН України, Київ
Резюме. Проведено експериментальне дослідження можливості збільшення ефективності протипухлинної дії магніточутливого нанокомплексу (МК) на основі наночастинок оксиду заліза і доксорубіцину (ДР) при електромагнітному опроміненні (ЕО) клітин аденокарциноми. Використовували клітини мишей лінії LL та клітини людини А-549. У роботі досліджували вплив МК на основі наночастинок Fe3O4 з КСl та ДР при ЕО з частотою 40 МГц. Підрахунок живих та загиблих клітин здійснювали за допомогою камери Горяєва. Для аналізу індукції апоптозу та розподілу пухлинних клітин за фазами клітинного циклу проводили проточну цитофлуориметрію. Також за допомогою імуноцитохімічного методу досліджували експресію топоізомерази ІІ. Парамагнітний ДР, який входив до складу МК, мав більший цитотоксичний ефект, ніж офіцінальний ДР, а додаткове ЕО ініціювало подальше підвищення загибелі клітин LL та A-549. Комбінована дія ЕО та МК найбільш істотно збільшувала кількість апоптотичних клітин LL. Для клітин A-549 найбільший рівень індукції апоптозу спостерігали після використання МК без ЕО. Комбінована дія ЕО з одним із препаратів — офіцінальним ДР, парамагнітним ДР або МК — ініціювала суттєве зменшення процентного розподілу клітин LL та А-549 в S-фазі клітинного циклу. Обробка клітин парамагнітним ДР або МК більш ефективно знижувала експресію топоізомерази ІІ в клітинах А-549, ніж офіцінальний ДР.
Вступ

Експериментальні та клінічні дослідження, проведені за останнє десятиріччя, свідчать про перспективу використання в якості протипухлинних препаратів магніточутливих нанокомлексів (МК) на основі наночастинок оксиду заліза магнетиту (Fe3O4), маггеміту (γ-Fe2O3) та протипухлинного антибіотика антрациклінового ряду доксорубіцину (ДР). Основна теоретична привабливість цього підходу полягає в можливості дистанційно керованої цілеспрямованої доставки МК й наступне підсилення його протипухлинної активності електромагнітним опроміненням (ЕО) [4, 6].
Разом з цим пілотні клінічні дослідження, проведені в ряді країн світу з використанням наночастинок, свідчать про несуттєвий прогрес в результатах комплексного лікування онкологічних хворих. Основні проблеми, які гальмують широке впровадження в клінічну практику комплексного лікування онкологічних хворих з використанням МК при радіочастотній гіпертермії, можуть бути зведені до нижченаведеного переліку. Незначна поверхнева селективність мікро- та наночастинок поміж злоякісними та нормальними клітинами; радіочастотна гіпертермія МК, ініційована ЕО злоякісних пухлин при температурах понад 41°С, може супроводжуватися формуванням термотолерантності та терморезистентності на клітинному рівні внаслідок ініціювання синтезу білків теплового шоку; ймовірне виникнення побічних ефектів у серцево-судинній системі пацієнтів внаслідок обмеженої переносимості ними сеансу гіпертермії при температурах вище 41°С; сповільнена біодеструкція наночастинок в організмі й побічні ефекти накопичення їх в печінці, селезінці, м’язах та інших органах [7].
В основі вирішення нами вищезазначених проблем лежали 2 відомі фундаментальні наукові концепції. Перша — гіпоксія є однією з найбільш характерних ознак злоякісних пухлин та обумовлена значними структурними та функціональними аномаліями гетерогенної внутрішньопухлинної мікроциркуляції крові [3]. Друга — нелінійні динамічні процеси, ініційовані комбінованою дією механохімічного впливу та електромагнітного поля, можуть супроводжуватися спіновими ефектами в хімічних реакціях [11]. Це може сприяти ланцюговому утворенню вільних радикалів за участі активних форм кисню та азоту в процесі хіміотерапії ДР та збільшувати вірогідність пошкодження препаратом ДНК.
Протягом останніх років дослідниками [8] було показано, що при обробці пухлинних клітин хімічними факторами, які призводять до дволанцюгових розривів ДНК, відбувається підвищення рівня експресії топоізомерази ІІα в пухлинних клітинах, і що це явище корелює зі збільшенням кількості пошкоджень ДНК. У той же час дослідження інших вчених [12] засвідчили, що наявність в пухлинних клітинах топоізомерази ІІα підвищує чутливість цих клітин до дії антрациклінів.
Виходячи з вищезазначеного, метою даної роботи було експериментальне дослідження можливості збільшення ефективності протипухлинної дії МК на основі наночастинок оксиду заліза і ДР при ЕО клітин аденокарциноми.
Матеріали та методи дослідження
Культивування клітин.
У дослідженнях використовували клітини мишей лінії LL, отриманих з карциноми легені Льюїс, нормальні фібробласти та клітини людини А-549 (клітинна лінія з недрібноклітинного раку легені). Усі клітинні лінії отримані у клітинному банку ліній з тканин людини та тварин Інституту експериментальної патології, онкології та радіобіології ім. Р.Є. Кавецького НАН України. Клітини культивували в повному поживному середовищі RPMI-1640 та DMEM з 10% сироватки теляти, 40 мкг/мл гентаміцину у зволоженій атмосфері з 5% СО2 при 37°С з використанням стерильного посуду (Cенте-Лаб, Україна). Зміну середовища проводили кожні 2–3 доби. Після того, як клітини утворювали на субстраті щільний моношар (3-тя–4-та доба росту), здійснювали їх пересів, при цьому дисоціювали клітини за допомогою фосфатно-сольового буфера з 1 мМ ЕДТА (розчин Версену).
Магніточутливий нанокомплекс.
У роботі досліджували препарати, отримані з використанням механомагнетохімічної технології [2]. В якості самостійних частин або складових препаратів було використано наночастинки оксиду заліза Fe3O4 з КСl діаметром 20–40 нм, отримані із застосуванням технології електронно-променевого випаровування та конденсації в вакуумі неорганічних матеріалів [1], і ДР виробництва Пфайзер Італія С.р.л., Італія. Співвідношення у МК — ДР : Fe3O4 з КСl = 1 : 2.
Магнітні характеристики препарату досліджували методом магнітометрії на вібраційному магнітометрі «Vibrating Magnetometer 7404 VSM» (фірма «Lake Shore Cryotronics, Inc.», США) в магнітних полях з напруженістю до 13 кЕ. Чутливість магнітометра становила 10 емо, що дозволяло виконувати виміри магнітного моменту на зразках масою до одиниць міліграмів. Масу досліджуваних зразків визначали за допомогою електронних мікроваг AB135-S/FACT з автокомпенсацією (фірма «METTLER TOLEDO», Швейцарія). Чутливість ваг становила 10 г.
Магнітні дослідження зразків препаратів наведено в табл. 1. Слід відзначити, що відібрані для дослідження препарати мали суттєво різні магнітні характеристики. Офіцінальний (ОФ) ДР — діамагнетик, механомагнетохімічно активований парамагнітний (ПМ) ДР — парамагнетик та МК — м’який феромагнетик.
Таблиця 1. Магнітні характеристики зразків препаратів
| № | Об’єкт дослідження |
Магнітний момент насичення, емо/г |
Напруженість магнітного поля для mS Hms, Е | Коерцитивна сила Hc, Е |
|---|---|---|---|---|
| 1 | ОФ ДР | діамагнетик – 0,200 | – | – |
| 2 | ПМ ДР | парамагнетик + 0,068 | 3000 | – |
| 3 | МК | м’який феромагнетик mS=11,78 | 12000 | 45,66 |
Електромагнітне опромінення.
Для локального просторово-неоднорідного ЕО використовували прототип апарату «Магнітерм» (Радмір, Україна). Параметри ЕО: частота — 40 МГц, вихідна потужність — 60 Вт. Аплікатор апарата — рамковий розмірами 2×2,5 см та профілем у формі дуги з радіусом кривизни 2,3 см [5].
Цитотоксичність.
Для визначення чутливості клітин до досліджуваних препаратів суспензію клітин висаджували на 96-лункові планшети в концентрації 5×10–1×10 клітин/лунку в 100 мкл повного поживного середовища. Через 24 год вносили препарати, інкубували клітини за стандартних умов 48 год, після чого фарбували клітини за допомогою МТТ-тесту (3-[4,5-Dimetilthiazole-2-yl]-2,5-diphenyltetrazolium bromide; Thiazolyl blue) (SIGMA, США). Для цього в кожну лунку вносили по 10 мкл МТТ концентрацією 5 мг/мл та інкубували при 37°С у зволоженій атмосфері 3 год. Згодом планшет центрифугували (1500 об/хв протягом 5 хв), видаляли супернатант і додавали до кожної лунки по 50 мкл диметилсульфоксиду для розчинення кристалів формазану. Через 30 хв інкубації при кімнатній температурі визначали оптичну густину вмісту лунок при довжині хвилі 540 нм за допомогою мультилункового спектрофотометра Labsystems Multiskan PLUS (CША) [9]. За допомогою даного методу було встановлено різні індекси цитотоксичності для досліджуваних препаратів. Отримані дані були використані для подальших досліджень, зокрема для визначення ефекту комбінованої дії ЕО та досліджуваних хіміопрепаратів. При цьому клітини вирощували в чашках діаметром 40 мм (2×10 клітин на чашку) за стандартних умов протягом 24 год, після чого додавали досліджувані препарати та через деякий час опромінювали їх протягом 30 хв.
Підрахунок живих та загиблих клітин X здійснювали за допомогою камери Горяєва через 48 год після опромінення, фарбували клітини трипановим синім та визначали кількість клітин за формулою:
А/80×2 = Х×10 клітин у 1 мл середовища,
де А — кількість клітин, що була нарахована у камері Горяєва (у 5 квадратах), ×2 — розведення з трипановим синім (1 : 1).
Виходячи з раніше отриманих результатів у роботі [10] про більший цитотоксичний ефект механохімічно активованого ДР порівняно з ОФ ДР, для оптимального методичного підходу була визначена різниця протипухлинного впливу між механохімічно активованим ДР та ПМ ДР, який входив до складу МК. ПМ ДР та МК піддавали не лише механохімічному впливу, а й одночасному ЕО. Досліди на клітинних лініях аденокарцином LL, А-549 та нормальних фібробластах миші показали, що більший цитотоксичний та антипроліферативний ефекти мав ПМ ДР. Самостійно наночастинки Fe3O4 з КСl практично не впливали як на пухлинні клітини, так і на нормальні.
Цитофлуориметрія.
Проводили проточну цитофлуориметрію для аналізу впливу ДР та ЕО на індукцію апоптозу та розподіл пухлинних клітин за фазами клітинного циклу. Проточну цитофлуориметрію виконували на приладі FACalibur («Бектон Дікінсон», США), обладнаному 2 лазерами: аргоновим та гелій-неоновим, з довжиною хвиль 488 та 625 нм відповідно. Аналіз проводили за допомогою програми CellQuest. Для вимірювання флуоресценції йодиду пропідію застосовували фільтр з максимумом пропускання при 600 нм та смугою пропускання 35 нм. За допомогою проточної цитофлуориметрії оцінювали відсоток клітин, які припадають на гіподиплоїдну зону гістограми вмісту ДНК.
Імуноцитохімія.
За допомогою імуноцитохімічного методу досліджували експресію топоізомерази ІІ. При цьому фіксували досліджувані зразки за допомогою фіксуючого розчину протягом 2 год при температурі –20°С, відмивали та наносили 1% розчин бичачого сироваткового альбуміну на 20 хв. Потім наносили антитіла на 60 хв, після чого застосовували систему візуалізації UltraVision LP Value Detection System. Після проведення імуноцитохімічної реакції препарати дофарбовували за допомогою Hematoxylin згідно Mayer та враховували результати мікроскопіювання.
Статистика.
Статистичний аналіз вірогідності отриманих даних проводили за допомогою t‑критерію Стьюдента, використовуючи комп’ютерну програму Statistica 6.0 з попередньою перевіркою гіпотези про нормальний закон розподілу випадкової величини за критерієм Колмогорова — Смірнова.
Результати та їх обговорення
Цитотоксичність.
Для оцінки ефективності безпосереднього протипухлинного впливу МК та ЕО було проведено порівняльне дослідження з моноефектами ПМ й ОФ ДР та при комбінованому впливі останнього з ЕО. В табл. 2 представлено результати дослідження ефектів самостійного впливу хіміопрепаратів ОФ та ПМ ДР та комбінованого впливу хіміопрепаратів з ЕО на клітинну лінію LL. Аналізуючи наведені дані, можна відзначити, що ПМ ДР діє активніше в середньому на 12% на пухлинні клітини, ніж ОФ ДР. ЕО підвищує чутливість пухлинних клітин до дії протипухлинних агентів, зокрема МК, у середньому на 23,3% у порівнянні з дією ОФ ДР. Така ж тенденція спостерігалася і при дослідженні комбінованого впливу модифікованих препаратів на клітини аденокарциноми людини А-549, тобто підвищувалася їх чутливість до антрациклінів під дією опромінення до 12%.
Таблиця 2. Ефект протипухлинного впливу ЕО та МК на клітинну лінію LL
| № групи | Експеримент | Відсоток живих клітин, % |
|---|---|---|
| 1 | Контроль | 100 |
| 2 | ОФ ДР (0,25 мкг/мл) | 21±2,0 |
| 3 | ОФ ДР (0,25 мкг/мл)+ЕО | 20±0,8 |
| 4 | ПМ ДР (0,25 мкг/мл) | 20±3,1 |
| 5 | МК (0,25 мкг/мл)+ЕО | 15±1,1* |
| 6 | ОФ ДР (0,05 мкг/мл) | 27±2,1 |
| 7 | ОФ ДР (0,05 мкг/мл)+ЕО | 26±0,1 |
| 8 | ПМ ДР (0,05 мкг/мл) | 23±1,7 |
| 9 | МК (0,05 мкг/мл)+ЕО | 22±0,9* |
| 10 | ОФ ДР(0,025 мкг/мл) | 33±2,8 |
| 11 | ОФ ДР (0,025 мкг/мл)+ЕО | 25±1,1* |
| 12 | ПМ ДР(0,025 мкг/мл) | 32±0,9 |
| 13 | МК (0,025 мкг/мл)+ЕО | 27±0,5* |
| 14 | ОФ ДР (0,01 мкг/мл) | 54 ±2,9 |
| 15 | ОФ ДР (0,01 мкг/мл)+ЕО | 48±0,7 |
| 16 | ПМ ДР (0,01 мкг/мл) | 46±3,1 |
| 17 | МК (0,01 мкг/мл)+ЕО | 45±2,0 |
| 18 | ОФ ДР (0,005 мкг/мл) | 75,4±1,6 |
| 19 | ОФ ДР (0,005 мкг/мл)+ЕО | 60,5±2,1* |
| 20 | ПМ ДР (0,005 мкг/мл) | 64,3±2,4* |
| 21 | МК(0,005 мкг/мл)+ЕО | 52,4±2,7* |
*Статистично значуща відмінність порівняно з ОФ ДР (p<0,05).
Для більш детального уявлення про чутливість пухлинних клітин до дії препаратів та ЕО було досліджено їх вплив на наявність апоптотичних клітин та ефектів розподілу за фазами клітинного циклу з використанням проточної цитофлуориметрії й змін експресії топоізомерази ІІ.
Цитофлуориметрія.
Аналіз рівня індукції апоптозу клітин LL та А-549, проведений методом проточної цитофлуориметрії, наведено на рис. 1. Для обох ліній клітин самостійне ЕО без препаратів істотного впливу не чинило. Спостерігалася лише тенденція до збільшення на 2 та 5% апоптотичних клітин обох ліній відповідно. Додавання препаратів до клітин LL ініціювало велику кількість гіподиплоїдних клітин (від 17,9% для ОФ ДР до 24,9% для ПМ ДР). Комбінована дія ЕО і препаратів ще збільшувала кількість апоптотичних клітин LL. Найбільш істотно при спільній дії ЕО з МК — до 29,63%, у той час як в контролі кількість апоптотичних клітин LL не перевищувала 8,88%. Слід зазначити, що для клітин A-549 зміни рівнів індукції апоптозу в подібних експериментах були іншими. Так, мінімальна (9,37%) та максимальна (45,19%) кількість апоптотичних клітин спостерігалася під впливом ПМ ДР та МК відповідно. Під впливом спільної дії ЕО та ПМ ДР кількість апоптотичних клітин збільшувалася до 22,52%.
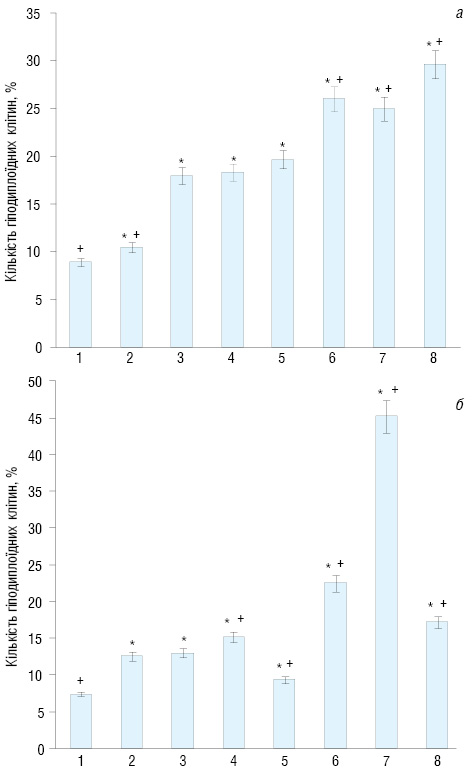
Таким чином, дія різних факторів впливу ініціювала суттєву різницю в рівнях індукції апоптозу клітин LL та А-549.
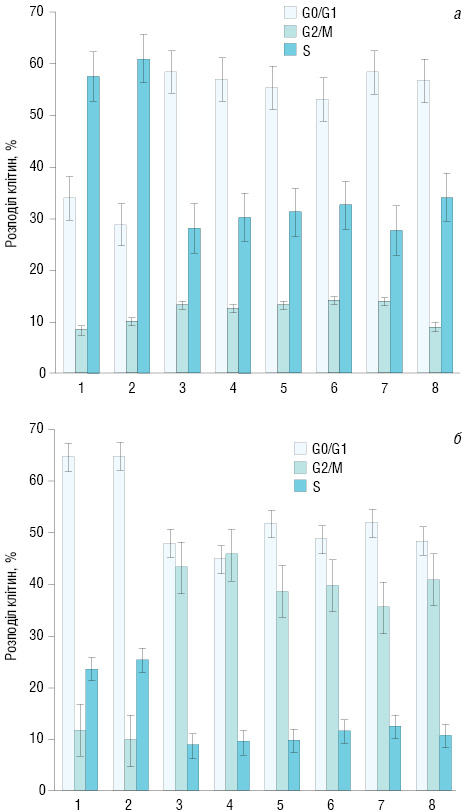
Результати процентного розподілу клітин LL та А-549 за фазами клітинного циклу (G0/G1, S та G2/M) представлено на рис. 2. Аналіз даних свідчить про наступне. Самостійне ЕО не вносило суттєвих змін у розподіл клітин LL та A-549 за фазами клітинного циклу в порівняні з контролем. Самостійний вплив препаратів та їх комбінована дія з ЕО суттєво змінювали процентний розподіл клітин у порівнянні з контролем. Кількість клітин LL в фазі G0/G1 збільшувалася у середньому на 40%, у фазі G2/М — на 51%, а в фазі S зменшувалася у середньому на 47% у порівнянні з контролем. В експериментах з клітинами А-549 у фазі G0/G1 їх кількість збільшувалася у середньому на 32%, у фазі G2/М — у 3,5 раза, а в фазі S зменшувалася у середньому в 2,2 раза в порівнянні з контролем.
Отже, під впливом використаних факторів, окрім самостійного впливу ЕО, зафіксовано суттєве зменшення процентного розподілу клітин LL та А‑549 в S-фазі клітинного циклу. Тобто, уповільнювався синтез ДНК, оскільки основною діючою речовиною у всіх препаратах був ДР.
Імуноцитохімія.
Встановлено, що при опроміненні клітин А-549 відсоток клітин, що експресують топоізомеразу ІІ, знижувався (рис. 3). Так, для контрольної групи клітин А-549 він становив 86±5,7%, а для клітин після ЕО — 67,3±1,8%. Відсоток клітин, що експресували топоізомеразу ІІ після обробки їх ОФ ДР, становив 86,3±2,0, а після комбінації ОФ ДР з ЕО було виявлено лише 46,3±8,8% клітин. При обробці клітин ПМ ДР та МК таких суттєвих відмінностей при сумісній дії з ЕО не було виявлено. Кількість клітин, що експресували топоізомеразу ІІ, коливалася в близьких межах: ПМ ДР — 45,3±2,9%, ПМ ДР+ЕО — 57,3±4,6%, МК — 41±4%, МК+ЕО — 41±9,0%. Це свідчить про безпосередній вплив ПМ ДР та МК на інгібування топоізомерази ІІ.
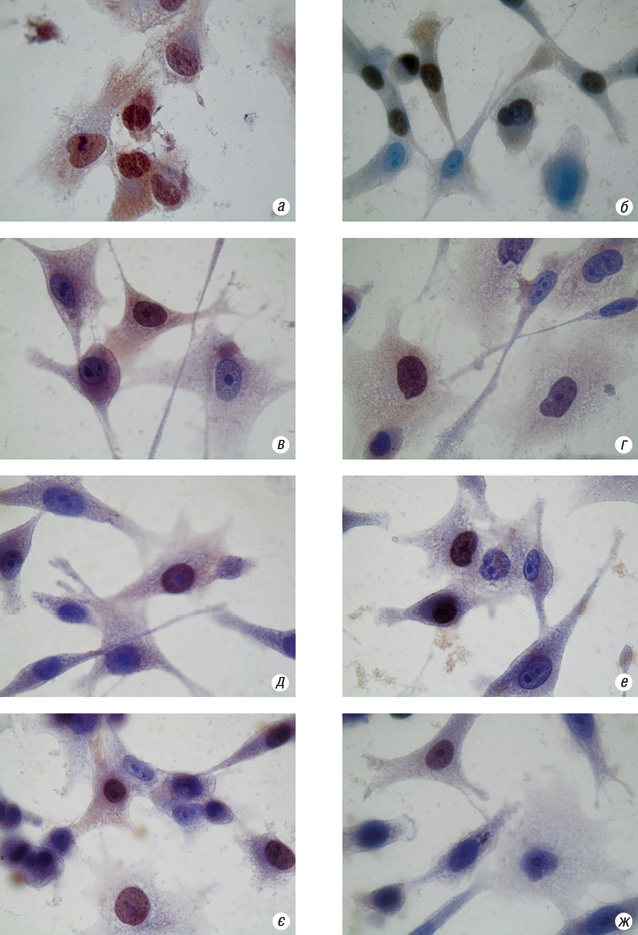
Таким чином, можна стверджувати про експериментальне підтвердження опосередкованої ролі топоізомерази ІІ в протипухлинних ефектах ДР під впливом ЕО, які були раніше прогнозовані в роботі [11], а також про безпосереднє інгібування ПМ ДР та МК рівня експресії топоізомерази ІІ в пухлинних клітинах А-549.
Висновки
1. ПМ ДР, який був складовою частиною МК, мав більший цитотоксичний ефект, ніж ОФ ДР, а додаткове ЕО ініціювало подальше підвищення загибелі клітин LL. Така ж тенденція спостерігалася і при дослідженні комбінованого впливу модифікованих препаратів на клітини А‑549.
2. Комбінована дія ЕО і МК ініціювала найбільшу кількість апоптотичних клітин LL. Для клітин A-549 найбільший рівень індукції апоптозу спостерігався після використання МК без ЕО.
3. Комбінована дія ЕО з одним із препаратів: ОФ ДР, ПМ ДР або МК — ініціювала суттєве зменшення процентної частини клітин LL та А-549 в S‑фазі клітинного циклу.
4. Комбінована дія ЕО з ОФ ДР та обробка клітин ПМ ДР або МК більш ефективно знижували експресію топоізомерази ІІ в клітинах А-549, ніж ОФ ДР.
Література
1. Мовчан Б.А. (2007) Электронно-лучевая нанотехнология и новые материалы в медицине — первые шаги. Вісн. фармакол. і фармації, 12: 5–13.
2. Орел В.Е., Шевченко А.Д. Мельник Ю.Г. та ін. (2010) Фізико-хімічні характеристики магніточутливого нанокомплексу, отриманого з використанням механомагнетохімічної технології сухого синтезу. Металлофизика и новейшие технологии, 9(32): 1157–1167.
3. Осинский С.П., Ваупель П. (2009) Микрофизиология опухолей. Киев: Наук. думка, 254 с.
4. Чехун В.Ф. (2008) Нанотехнології в онкології: від теорії до молекулярної візуалізації та керованої терапії. Онкология, 4(10): 414–419.
5. Apparatus for Short-Wave Inductothermy «Magnetotherm» / V. Orel, N. Nikolov, N. Dzyatkovskaya et al. Proceedings of NBC 2008., 294–298, Katushev A.; Dekhtyar Yu. & Spigulis J. (Eds), Springer-Verlag, Berlin, Heidelberg.
6. Arruebo M., Fernandez-Pacheco R., Ibarra M.R. (2007) Magnetic nanoparticles for drug delivery. J. Nanotoday, 3(2): 22–32.
7. Hergt R., Dutz S. (2007) Magnetic particle hyperthermia-biophysical limitations of a visionary tumour therapy. Journal of Magnetism and Magnetic Materials, 311: 187–192.
8. Mandraju R.K., Kannapiran P., Kondapi A.K. (2008) Distinct roles of Topoisomerase II isoforms: DNA damage accelerating alpha, double strand break repair promoting beta. Arch. Biochem. Biophys., 1: 27–34.
9. Niks M., Otto M. (1990) Towards an optimized MTT assay. J. Immunol. Meth., 1(130): 149–151.
10. Orel V.E., Kudryavets Y.I., Bezdenezhnih N.A. (2005) Mechanochemically activated doxorubicin nanoparticles in combination with 40 MHz frequency irradiation on A-549 lung carcinoma cells. Drug Delivery, 12: 171–178.
11. Orel V.E., Romanov A.V. (2010) The Effect of Spatially Inhomogeneous Electromagnetic Field and Local Inductive Hyperthermia on Nonlinear Dynamics of the Growth for Transplanted Animal Tumors. Nonlinear Dynamics, Book edited by Todd Evans, INTECH, Сhroatia, 285–308.
12. Rody A., Karn T., Ruckhäberle E. et al. (2008) Gene expression of topoisomerase II alpha (TOP2A) by microarray analysis is highly prognostic in estrogen receptor (ER) positive breast cancer. Breast. Cancer Res. Treat., 6: 645–653.
ИССЛЕДОВАНИЕ ВЛИЯНИЯ ЭЛЕКТРОМАГНИТНОГО ОБЛУЧЕНИЯ И МАГНИТОЧУВСТВИТЕЛЬНОГО НАНОКОМПЛЕКСА НА КЛЕТКИ АДЕНОКАРЦИНОМЫ
Национальный институт рака МЗ Украины, Киев
Институт экспериментальной патологии, онкологии и радиобиологии им. Р.Е. Кавецкого НАН Украины, Киев
Институт металлофизики им. Г.В. Курдюмова НАН Украины, Киев
Резюме. Проведено экспериментальное исследование возможности увеличения эффективности противоопухолевого действия магниточувствительного нанокомлекса на основе наночастиц оксида железа и доксорубицина при электромагнитном облучении клеток аденокарциномы. Использовали клетки мышей линии LL и клетки человека А-549. В работе исследовали влияние магниточувствительного нанокомлекса на основе наночастиц Fe3O4 с КСl и доксорубицина при электромагнитном облучении с частотой 40 МГц. Подсчет живых и погибших клеток осуществляли с помощью камеры Горяева. Для анализа индукции апоптоза и распределения опухолевых клеток по фазам клеточного цикла проводили проточную цитофлуориметрию. Также с помощью иммуноцитохимического метода исследовали экспрессию топоизомеразы ІІ. Парамагнитный доксорубицин, который входил составной частью в магниточувствительный нанокомлекс, имел больший цитотоксический эффект, чем официнальный доксорубицин, а дополнительное электромагнитное облучение инициировало последующее повышение гибели клеток LL и A-549. Комбинированное действие электромагнитного облучения и магниточувствительного нанокомлекса наиболее существенно повышали количество апоптотических клеток LL. Для клеток A-549 наибольший уровень индукции апоптоза наблюдался после использования магниточувствительного нанокомплекса без электромагнитного облучения. Комбинированное действие электромагнитного облучения с одним из препаратов: официнальным доксорубицином, парамагнитным доксорубицином или магниточувствительным нанокомлексом — инициировало существенное уменьшение процентного распределения клеток LL и А-549 в S-фазе клеточного цикла. Обработка клеток парамагнитными доксорубицином или магниточувствительным нанокомлексом более эффективно снижали экспрессию топоизомеразы II в клетках А-549, чем официнальный доксорубицин.
клетки аденокарциномы, магниточувствительный нанокомплекс, парамагнитный доксорубицин, электромагнитное облучение.














Leave a comment