Перспективні напрямки в онкохірургії
Резюме. Удосконалення хірургічної техніки, анестезіології, реаніматології, розвиток високотехнологічних методик та успіхи регенеративної медицини зумовили розширення показань до виконання радикальних операцій у пацієнтів, які донедавна вважалися інкурабельними. Однак можливості хірургічного лікування хворих із розповсюдженою пухлиною трахеї, у тому числі з ураженням її біфуркації та головних бронхів, та пацієнтів із супутньою тяжкою серцево-судинною патологією на теперішній час радикально переглядаються. Ці розділи онкохірургії тепер розвиваються найбільш динамічно, і, як показує досвід, є дуже перспективними.

Резюме. Совершенствование хирургической техники, анестезиологии, реаниматологии, развитие высокотехнологических методик и успехи регенеративной медицины обусловили расширение показаний к выполнению радикальных операций у пациентов, считавшихся до последнего времени инкурабельными. Однако возможности хирургического лечения больных с распространенной опухолью трахеи, в том числе с поражением ее бифуркации и главных бронхов, и пациентов с сопутствующей тяжелой сердечно-сосудистой патологией в настоящее время радикально пересматриваются. Эти разделы онкохирургии относятся сейчас к числу наиболее динамично развивающихся направлений и, как показывает опыт, являются весьма перспективными.
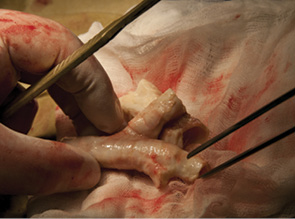
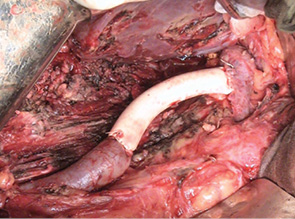
Одним из последних достижений онкохирургии в применении новых технологий стала аллотрансплантация трахеи при обширном ее поражении, в том числе и с поражением бифуркации трахеи и главных бронхов. Впервые подобная операция в объеме субтотальной резекции трахеи выполенена в торако-абдоминальной клинике Российского онкологического научного центра им. Н.Н. Блохина (РОНЦ РАМН) 2 больным раком в январе 2001 г. (рис. 1–4). Для пластики мы применяли лиофилизированную донорскую трахею, в просвет которой дополнительно был установлен стент с целью предупреждения коллапса трансплантата вследствие трахеомаляции. Пациенты благополучно перенесли операцию, однако нуждались в систематической эндоскопической санации трахеобронхиального дерева как непосредственно после хирургического вмешательства, так и в дальнейшем.
Обе пациентки прожили не более 1 года: одна из них умерла от прогрессирования опухоли (множественные метастазы в легких), вторая — от гнойных осложнений, связанных с длительным нахождением стента. Не вполне удовлетворительные функциональные результаты этих операций, а также осложнения стентирования побудили нас к поиску качественно иных методов подготовки трансплантата. Кроме того, применение лиофилизированной трахеи было практически невозможно для пластики бифуркационной зоны.
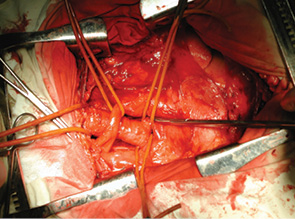
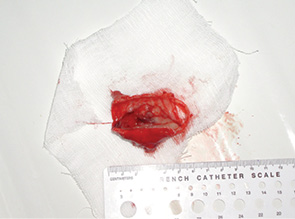
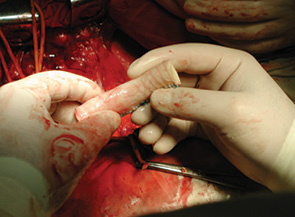
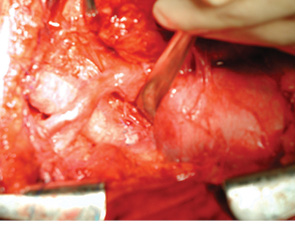
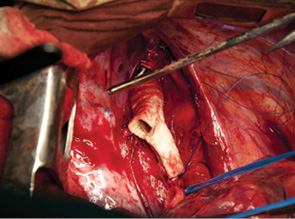
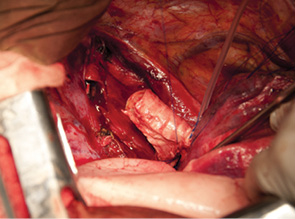
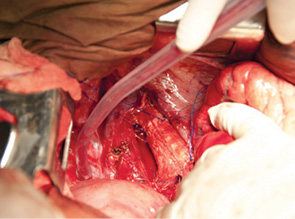
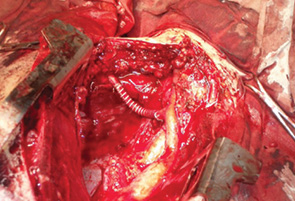
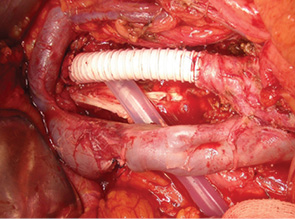
24 февраля 2011 г. в торако-абдоминальном отделении РОНЦ РАМН впервые в мире была выполнена трансплантация трахеи с обоими главными бронхами больной раком нижней трети трахеи с распространением на ее бифуркацию (рис. 5–8). Применялась деиммунизированная по оригинальной методике донорская трахея, обработанная стволовыми клетками костного мозга пациентки. Необходимости в проведении иммуносупрессивной терапии не было, что является принципиальным в лечении больных злокачественными опухолями. Очень важной особенностью этой методики является то, что она не требует установки стента. После операции трансплантат в полной мере сохраняет каркасные свойства, а небольшая флотация его мембранозной стенки аналогична физиологическому пролапсу мембранозной части естественной трахеи при дыхании и кашле. Дренажная функция легкого у больной после операции быстро восстановилась и уже в течение 1-й недели после операции не было необходимости в санационных бронхоскопиях. Более чем удовлетворительные непосредственные результаты позволяют надеяться на то, что разработанная в РОНЦ РАМН методика подготовки трахеобронхиального аллотрансплантата станет настоящим прорывом в лечении этой категории пациентов, обреченных в лучшем случае на малоэффективную паллиативную помощь до последнего времени.
Внедрение в клинику новых технологий позволило пересмотреть место хирургии в лечении пациентов с опухолями брюшной, грудной полости и забрюшинного пространства, инвазирующими магистральные сосуды, и с опухолями верхней грудной апертуры. Систематическое выполнение таких операций с приемлемым риском осложнений возможно в крупных клиниках, оснащенных необходимым оборудованием и обладающих большим опытом комбинированных и реконструктивных операций, а также опытом сосудистой хирургии, наличием высокопрофессиональной анестезиологической и реанимационной службы. Современный уровень медицины позволяет успешно выполнять резекцию и протезирование верхней и нижней полой вены, аорты и других крупных сосудов при их инвазии злокачественными новообразованиями, а также удаление массивных, стенозирующих просвет, магистральных сосудов и опухолевых тромбов с хорошими непосредственными и отдаленными результатами (рис. 9–12).

С появлением аппаратов типа «Cell Saver» для реинфузии эритроцитов хирургические вмешательства, сопровождающиеся большой кровопотерей, стали значительно более безопасными. Даже массивная острая кровопотеря при преднамеренном вскрытии крупных магистральных сосудов или их случайном повреждении позволяет, как правило, не только предотвратить летальный исход, но и избежать массивных трансфузий донорской крови и связанных с ними осложнений.
Лечение больных злокачественными опухолями, имеющих тяжелые сердечно-сосудистые заболевания, остается одним из наиболее сложных разделов онкохирургии. Многие из этих пациентов до недавнего времени были обречены на паллиативную или симптоматическую терапию. И на сегодняшний день остается множество открытых и дискуссионных вопросов в хирургической тактике у этой группы пациентов, поскольку опыт большинства клиник представлен единичными наблюдениями и гораздо реже небольшой группой больных. Отсутствие общепринятых стандартов стало мотивом активной разработки в РОНЦ РАМН методологии хирургического лечения, направленного на достижение полной ремиссии в условиях максимально возможной безопасности у этой категории больных. Чаще эту проблему приходится решать при планировании лечения у пациентов с выраженной коронарной патологией, которая вынуждает хирургов отказывать в радикальном лечении этим больным даже при наличии ранних стадий злокачественных новообразований. Проблема сложна, мало изучена, требует тесного сотрудничества высокопрофессиональных онкологов и кардиохирургов, наличия условий для проведения экстракорпорального кровообращения. В 1997 г. мировая статистика насчитывала 264 пациента, одномоментно оперированных по поводу злокачественной опухоли в сочетании с аортокоронарным шунтированием.
С 2004 по 2009 г. в РОНЦ РАМН было прооперировано 83 пациента со злокачественными опухолями различной локализации в сочетании с тяжелыми сопутствующими сердечно-сосудистыми заболеваниями, которые были представлены ишемической болезнью сердца, поражением клапанов сердца, аневризмой аорты, синдромом Лериша и стенозом сонных артерий. При этом одномоментно операции выполнены у 14 (16,9%) больных. Осложнения в послеоперационный период развились у 15,7% больных, а показатель летальности составил 7,2%.
Удовлетворительные результаты нашего собственного опыта в выполнении симультантных вмешательств (аортокоронарное шунтирование в сочетании с гастрэктомией, субтотальной резекцией желудка, резекцией легкого, трахеи, митральной комиссуротомии с пневмонэктомией и другое) свидетельствуют о том, что ряд пациентов со злокачественными опухолями и сопутствующей тяжелой сердечно-сосудистой патологией, традиционно считающиеся инкурабельными, могут быть успешно радикально оперированы.
Неотъемлемой частью развития этого сложнейшего раздела онкохирургии является совершенствование реанимационно-анестезиологического обеспечения, позволяющего выполнять оперативные вмешательства как в условиях искусственного кровообращения, так и без него. При этом внедрение в клиническую практику современных методов диагностики тяжелых сопутствующих сердечно-сосудистых заболеваний у онкологических больных позволяет стратифицировать пациентов по риску предстоящего оперативного вмешательства.
Разработка и внедрение принципиально новых хирургических приемов и высоких технологий открывают реальную перспективу расширения показаний к радикальным операциям у больных с тяжелыми сопутствующими заболеваниями, опухолями, инвазирующими жизненно важные органы и магистральные сосуды, синхронными первично-множественными опухолями. Большая часть этих вмешательств сопровождается обширными мультиорганными резекциями и является практически неклассифицируемой, требует соответствующего класса хирургической техники и реанимационно-анестезиологического обеспечения, что доступно пока лишь в крупных специализированных центрах. Возможно, сбылась мечта многих поколений хирургов — полноценная хирургическая помощь больным с опухолями трахеи, ее бифуркации и главных бронхов, требующих обширной резекции.














Leave a comment