Імплантат-асоційована анапластична крупноклітинна лімфома (огляд літератури)
Резюме. Впродовж останніх років з’являється все більше доказів того, що грудні імплантати в рідкісних випадках можуть бути асоційовані з розвитком анапластичної крупноклітинної лімфоми (АКЛ). Згідно з даними літератури частота виникнення первинної імплантат-асоційованої анапластичної крупноклітинної лімфоми (ІААКЛ) становить 1 на 30 000 жінок з текстурованими грудними імплантатами. ІААКЛ виникає в ложі імплантату після реконструкції грудної залози у жінок з раком грудної залози або аугментації. Гістологічно підтверджена ІААКЛ вимагає індивідуального лікування багатопрофільною командою у складі клінічного онколога, онкохірурга, пластичного хірурга і гематолога. Лікування ІААКЛ має набагато кращий прогноз, ніж при системній АКЛ. При цьому ІААКЛ, обмежена капсулою, має сприятливий прогноз після хірургічної капсулектомії, навіть без ад’ювантної хіміотерапії або променевої терапії. Однак у деяких пацієнтів розвивається інфільтративне захворювання з потенційно небезпечним для життя клінічним перебігом.
Одержано: 20.01.2020
Прийнято до друку: 10.02.2020
DOI: 10.32471/clinicaloncology.2663-466X.36-4.26626
Приблизно 450 000 грудних імплантатів встановлюється щорічно з косметичною або реконструктивною ціллю у США та приблизно 10 млн жінок у всьому світі мають грудні імплантати [9].
Упродовж останніх років з’являється все більше даних, які свідчать, що грудні імплантати іноді можуть бути асоційовані з розвитком анапластичної крупноклітинної лімфоми (АКЛ).
Лімфоми є найбільш поширеною групою гематологічних злоякісних новоутворень, які можуть виникати з В- або Т-лімфоцитів [26]. АКЛ є третім за поширеністю типом периферичної Т-клітинної лімфоми, що становить близько 2% усіх лімфом у зрілому віці [26].
Частота асоційованих з імплантатами АКЛ дуже низька, але тим не менш є помітно вищою порівняно з іншими первинними лімфомами грудної залози. Первинні лімфоми грудної залози (ПЛГЗ) вважаються дуже рідкісним видом і становлять <0,5% злоякісних пухлин грудної залози. Більшість ПЛГЗ мають В-клітинне походження [32, 35]. Захворюваність ПЛГЗ збільшилася за останні чотири десятиліття і продовжує зростати у жінок віком молодше 50 років [33].
На сьогодні у світі було зареєстровано 573 випадки імплантат-асоційованої анапластичної крупноклітинної лімфоми (ІААКЛ) [6, 10, 23, 25, 28, 29]. Інформацію щодо першого випадку АКЛ у жінки з грудними імплантатами було опубліковано в 1997 р. [20]. Наступні клініко-патологічні та епідеміологічні дослідження показали, що ІААКЛ є окремою нозологічною одиницею [2, 29].
У лютому 2011 р. Управління з контролю за харчовими продуктами та лікарськими засобами США (Food and Drug Administration — FDА) підтвердило на своєму вебсайті, що грудні імплантати можуть викликати рідкісну пухлинну структуру, відому як АКЛ [8]. У той час FDA не вдалося визначити фактори ризику її розвитку. Відповідно до інформації, опублікованої управлінням у березні 2018 р., станом на 30 вересня 2017 р. було зареєстровано загалом 414 повідомлень про небажані явища внаслідок ІААКЛ, включаючи 9 смертей [21]. Проте точну кількість епізодів і осіб, що мають такий ризик, визначити важко, оскільки фіксуються нові випадки захворювання, і федеральна звітність ІААКЛ має кілька обмежень [30].
У 2016 р. Всесвітня організація охорони здоров’я визначила ІААКЛ як Т-клітинну лімфому, яка може розвинутися після встановлення грудних імплантатів [31]. ІААКЛ — це не рак грудної залози — це тип неходжкінської лімфоми. У більшості випадків ІААКЛ виявляється в рубцевій тканині й рідині навколо імплантату. Індивідуальний ризик розвитку ІААКЛ вважається низьким, проте це серйозне захворювання, яке може призвести до летального наслідку.
Станом на 6 липня 2019 р. FDA отримало в цілому 573 медичних звіти про епізоди ІААКЛ в Америці та світі, включаючи 33 випадки смерті пацієнтів (таблиця).
| Смертність за даними медичних звітів та літератури | Летальність (n=33) | ||
| n | % | ||
| Вік на момент встановлення діагнозу (роки) | Медіана | 52 | |
| Діапазон | 37–83 | ||
| Не вказано (кількість звітів) | 13 | 39 | |
| Час від останньої імплантації до діагностики (роки) | Медіана | 9 | |
| Діапазон | 1–20 | ||
| Не вказано (кількість звітів) | 23 | 70 | |
| Поверхня імплантатів | Текстурована | 15 | 48 |
| Гладка | 1 | 3 | |
| Не вказано | 17 | 48 | |
| Заповнення імплантатів | Силікон | 14 | 42 |
| Сольовий розчин | 8 | 24 | |
| Не вказано | 11 | 33 | |
| Причина імплантації | Реконструкція | 5 | 15 |
| Аугментація | 17 | 52 | |
| Не вказано | 11 | 33 | |
| Клінічна форма (молочна залоза) | Серома | 6 | 18 |
| Набряк/біль у грудях | 3 | 9 | |
| Капсульна контрактура | 1 | 3 | |
| Периімплантатна маса | 13 | 39 | |
| Інше | 7 | 21 | |
| Не вказано | 7 | 21 | |
| Кіназа анапластичної лімфоми | Позитивний | 0 | 0 |
| Негативний | 12 | 36 | |
| Не вказано | 21 | 64 | |
| CD30-статус (білок клітинної мембрани, пов’язаний з діагностикою класичної лімфоми Ходжкіна та ІААКЛ | Позитивний | 12 | 36 |
| Негативний | 0 | 0 | |
| Не вказано | 21 | 64 | |
| Країна-репортер: США або будь-яка країна за межами США | США | 12 | 36 |
| Будь-яка країна за межами США | 21 | 64 | |
| Не вказано | 0 | 0 | |
Жодне з опублікованих досліджень не дозволяє зробити точні висновки про поширеність ІААКЛ. Оцінки варіюють від 1 до 3 випадків на мільйон жінок з грудними імплантатами на рік [11]. Поширеність змінюється від даних D. Jong та співавторів [11] про лише 5 випадків у Нідерландах, до цифр М. de Boer і співавторів [10], кумулятивний ризик котрих становить 1:35 000 для 50-річних пацієнтів (29 випадків на мільйон жінок з грудними імплантатами до 50 років), 1:12 000 у 70-річних пацієнтів (82 випадки на мільйон жінок до 70 років) та 1:7000 у 75-річних пацієнтів. Кількість жінок з імплантатом, яка необхідна для виникнення одного випадку АКЛ, була зазначена як 6920 [10]. У дослідженні E.L. Doren та співавторів, опублікованому в 2017 р., захворюваність на ІААКЛ для жінок з текстурованим грудним імплантатом становить 1:30 000 [13].
Ця варіабельність пов’язана з обмеженістю досі неструктурованого збору даних, потенційними повторними реєстраціями, незрозумілими клінічними та патологічними даними, відсутністю інформації про кількість встановлених імплантатів і недіагностованими випадками [13, 24]. Усі пацієнти, які мають грудні імплантати, або які думають про їх встановлення, обов’язково повинні бути поінформовані про ризик виникнення ІААКЛ.
ІААКЛ розвивається в ложі імплантату після реконструкції грудної залози у жінок з раком грудної залози або аугментації [21]. Приблизно у 60% випадків лімфома клінічно себе проявляє у вигляді уповільненого накопичення рідини навколо імплантату, у 17% — внутрішньокапсулярної клітинної маси, та приблизно в 20% випадків виявляють як серому, так і масу солідних пухлин [21] (рис. 1).
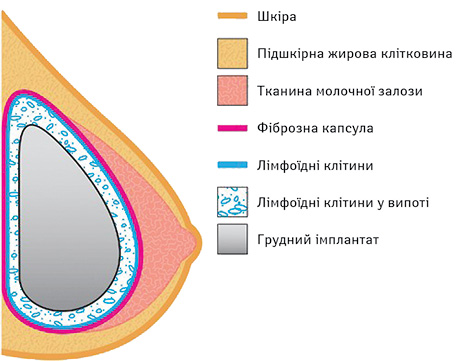
Майже у 89% пацієнток із зареєстрованими ІААКЛ, за даними FDA, імплантат був текстурованим [14]. На відміну від гладких імплантатів поверхня текстурованих є нерівною. Спочатку використовувані протези з гладкою поверхнею не могли утримувати імплантат у одній позиції, що призводило до ротації та провисання. Текстурування стало необхідним для забезпечення широкої стабільної інтеграції імплантату з тілом реципієнта.
Зв’язок із властивостями поверхні імплантатів підтверджений експериментом австралійських учених на тваринах. У свинячих моделях текстуровані імплантати спричиняли набагато більшу імміграцію лімфоцитів із переважанням Т-клітин, ніж імплантати з гладкими стінками [18]. У дослідженні G.S. Brody та співавторів було проаналізовано 79 випадків, інформація щодо яких була опублікована, та 94 раніше не зафіксованих випадків АКЛ. Кожна з пацієнток мала текстурований імплантат [6].
На тепер FDA не рекомендує видаляти ті чи інші типи грудних імплантатів у пацієнтів, які не мають симптомів захворювання, у зв’язку з низьким рівнем розвитку ІААКЛ [8].
Патогенез ІААКЛ залишається невідомим. Предметом дискусії залишається імплантат-індуковане хронічне запалення [4, 16], а також генетична схильність у вигляді важкої реактивної дисплазії у відповідь на хронічне запалення [27]. Інші підозрювані причини включають ерозію частинок імплантатів, субклінічну біоплівку або хронічну стимуляцію Т-клітин [18].
Першим симптомом, що вказує на ІААКЛ, є майже завжди одностороння або двостороння пізня серома, принаймні, через рік після імплантації. Вона викликає набряк грудей, асиметрію або біль. Були описані шкірні симптоми (наприклад запалення) і лімфаденопатія [7]. Більшість випадків ІААКЛ були виявлені через 7–10 років після імплантації, однак у одного пацієнта інтервал між хірургічним втручанням і діагностикою становив лише 2 роки, а в іншої жінки — 32 роки [21]. Середній час прояву становить 8–10 років після імплантації.
На сьогодні ІААКЛ є ALK-негативною у всіх звітах і пов’язана зі сприятливим прогнозом. Також стає загальновизнаним те, що ІААКЛ характеризується спектром клініко-патологічних проявів, пов’язаних з різними наслідками: обмежений випотом ІААКЛ з наступною проліферацією анапластичних клітин у капсулу фіброзного рубця; об’єднання плеоморфних клітин у масу, що прогресує та інфільтрує сусідні тканини й інвазує в грудну стінку; ураження регіонарного лімфатичного вузла; і, рідко, віддалене метастазування [22].
За результатами нещодавно проведеного дослідження, у якому оцінювали клінічні та гістопатологічні особливості лімфатичних вузлів у 70 пацієнтів із ІААКЛ, повідомляли про ураження лімфатичних вузлів у 20% пацієнтів [15]. ІААКЛ поза капсулою асоціювалася з підвищеним ризиком ураження лімфатичних вузлів (38% порівняно з 12% у пацієнтів із пухлиною, обмеженою капсулою). П’ятирічна загальна виживаність (ЗВ) становила 75 та 98% відповідно для пацієнтів з ураженням лімфатичних вузлів і без них [15].
Діагностика має включати збір анамнезу та фізикальне обстеження, рутинні лабораторні дослідження (клінічний аналіз крові, комплексну метаболічну панель, рівень лактатдегідрогенази в сироватці крові) та позитронно-емісійну томографію/комп’ютерну томографію (ПЕТ/КТ) [7]. Якщо показана хіміотерапія на основі антрацикліну або антрацендіону, рекомендується також виконання ехокардіоскопії. Біопсія кісткового мозку потрібна лише селективним пацієнтам з розповсюдженим захворюванням або незрозумілою цитопенією [7].
Первинне обстеження має включати ультразвукове дослідження (УЗД) грудної залози або в окремих випадках магнітно-резонансну томографію (МРТ) чи ПЕТ/КТ. У пацієнтів з ІААКЛ чутливість УЗД для визначення випоту (84%) або маси (46%) була аналогічною чутливості МРТ (82 і 50% відповідно) [1]. У когорті з 44 пацієнтів В.Е. Adrada зі співавторами [1] спостерігав чутливість/специфічність різних методів діагностики сероми:
- УЗД — 84/75%;
- КТ — 55/83%;
- МРТ — 82/33%;
- ПЕТ-КТ — 38/83%.
Для виявлення солідних пухлин чутливість/специфічність становили:
- УЗД — 46/100%;
- КT — 50/100%;
- МРТ — 82/33%;
- ПЕТ-КТ — 64/88%.
Мамографія поступалася УЗД та МРТ за чутливістю та специфічністю, без відмінностей між серомою та солідними пухлинами (73/50%) [1].
Цитологічна оцінка та біопсія (тонкоголкова аспіраційна біопсія перипротезного випоту та/або біопсія пухлинної маси) з адекватним імунофенотипуванням (імуногістохімія та проточна цитометрія) є необхідними для підтвердження діагнозу ІААКЛ [12. 17]. Слід зібрати якомога більше рідини (мінімум 50 мл), щоб діагностувати захворювання [8]. Імуногістохімія і проточна цитометрія мають включати визначення CD2, CD3, CD4, CD5, CD7, CD8, CD30, CD45 та ALK [8].
Оскільки ІААКЛ є рідкісним захворюванням, у більшості медичних центрів збір клінічного анамнезу та зазначення патологоанатому примітки «виключення ІААКЛ» є корисним та пропонованим. Якщо після патологічної оцінки діагноз лімфоми не визначено, рекомендується вторинна консультація гематолога в онкологічному центрі. Якщо АКЛ не виявлено, пацієнта слід направити до пластичного хірурга для лікування доброякісної сероми [7].
Гістологічно підтверджена ІААКЛ вимагає індивідуального лікування багатопрофільною командою у складі клінічного онколога, онкохірурга, пластичного хірурга і гематолога. Відповідно до рекомендації FDA про всі випадки гістологічно підтвердженої ІААКЛ слід повідомляти до Breast Implant-Associated Anaplastic Large Cell Lymphoma PROFILE Registry [7].
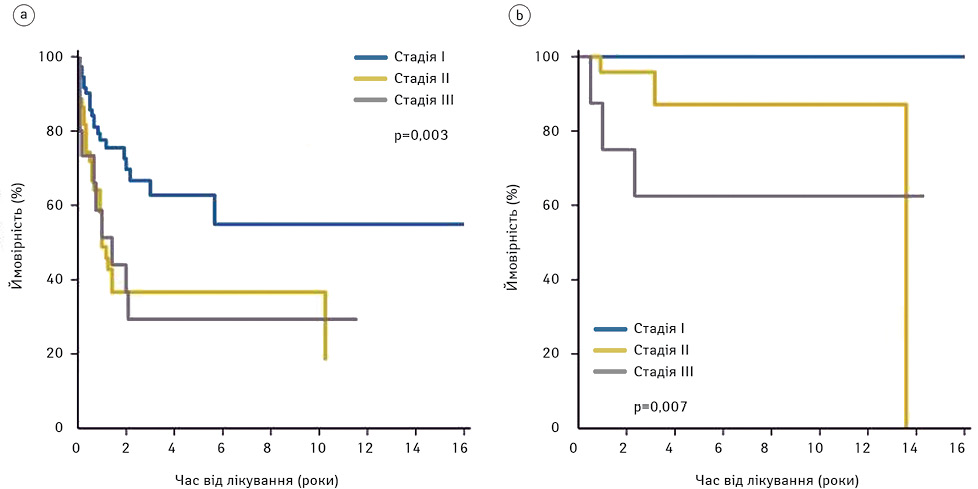
Модифікація Lugano, системи стадіювання Ann Arbor, яка використовується для первинних вузлових лімфом, не була адекватною для стадіювання ІААКЛ. За цією системою пацієнтів розділяли тільки на 2 прогностичні групи, у 86% пацієнтів було діагностовано I стадію захворювання. Була запропонована нова система стадіювання TNM (міжнародна класифікація стадій злоякісних новоутворень) для кращої стратифікації і прогнозування [9]. Ця система розділяє пацієнтів з ІААКЛ на кілька прогностичних груп: стадія IA (36%); стадія IB (12%); стадія IC (14%); стадія IIА (25%); стадія IIB (5%); стадія III (9%); і стадія IV (0%). Безрецидивна виживаність (БВ) була значно вищою у пацієнтів із захворюванням I стадії, ніж у осіб з більш високою стадією (р=0,003), а частота рецидивів була в 3 рази вищою у хворих з II або III стадією порівняно з пацієнтами з I стадією захворювання [9].
Лікування ІААКЛ має набагато кращий прогноз, ніж при системній АКЛ. Тотальна капсулектомія з видаленням грудного імплантату та висіченням будь-якої асоційованої маси з біопсією підозрілих лімфатичних вузлів рекомендується для всіх пацієнтів з ІААКЛ [8]. Необхідна консультація онкохірурга, оскільки тільки повне хірургічне висічення є оптимальним методом лікування пацієнтів із локалізованим захворюванням, які мають випіт без чіткої грудної маси. Оскільки ІААКЛ не є захворюванням паренхіми грудної залози, то мастектомія або біопсія сигнального лімфатичного вузла не відіграє ніякої ролі [8].
У ретроспективному дослідженні 87 пацієнтів із ІААКЛ (у 52 пацієнтів (60%) відмічали лише випіт; у 15 пацієнтів (17%) — лише масу, а у 17 пацієнтів (20%) — випіт і масу), 74 пацієнтам було проведено повне хірургічне висічення, а саме загальну капсулектомію з видаленням імплантатів грудної залози та повним видаленням будь-яких уражених тканин чи маси з негативними межами [9]. Показники пухлинних явищ після повної резекції становили 14,3% на стадії Т4 і 0% на стадіях Т1 і Т2 [9].
Показники 3-річної ЗВ та БВ становили 94 і 49% відповідно. П’ятирічна ЗВ та БВ становила 91 і 49% відповідно. Показник ЗВ був значно кращим (р<0,001) у пацієнтів, яким було виконана повна хірургічна ексцизія [9] (рис. 2–3).
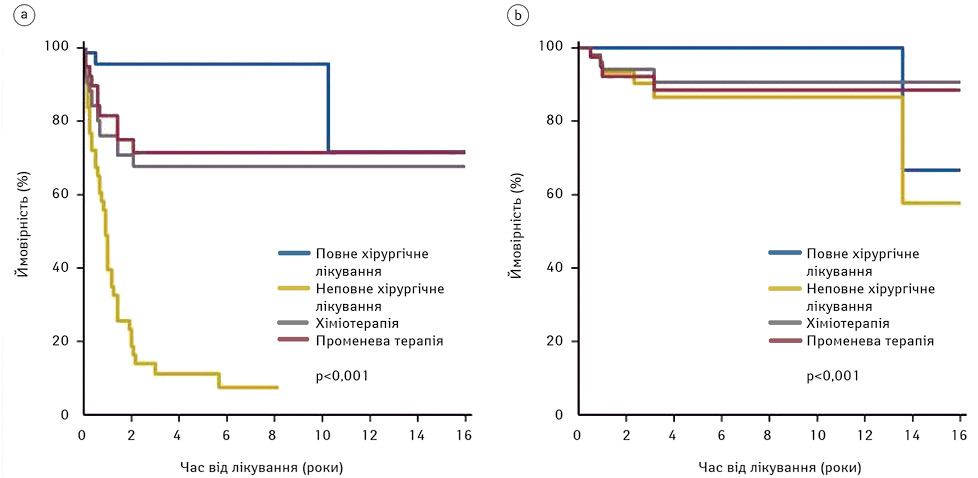
Видалення контралатерального імплантату також може бути розглянуто, оскільки приблизно у 5% пацієнтів з ІААКЛ відмічали одночасне або подальше двостороннє ураження грудної залози. Пацієнти із соматичними і зародковими мутаціями JAK1 і STAT3 також можуть бути схильні до розвитку захворювання [3, 5, 9].
Пацієнти з неоперабельною масою мають більш високу частоту рецидивів і можуть вимагати додаткової терапії (системна терапія і/або променева терапія) [7]. Проте наявні дуже обмежені дані, щоб рекомендувати оптимальний підхід для пацієнтів, яким було виконано неповне хірургічне видалення, або тим, хто має розповсюджене захворювання. Варіанти лікування повинні обговорюватися з багатопрофільною командою. Променева терапія для локального резидуального захворювання може бути корисною у разі, коли повне хірургічне видалення неможливе. Незважаючи на обмежені дані, системну терапію з режимами хіміотерапії першої лінії (наприклад CHOP або CHOEP) або брентуксимаб ведотин можна застосовувати у пацієнтів після неповного висічення та тих, хто має розповсюджене захворювання [9, 19].
Усім пацієнтам після завершення лікування рекомендується проводити контрольні обстеження кожні 3–6 міс протягом 2 років (фізикальне обстеження, КТ або ПЕТ/КТ з контрастуванням) [8].
У зв’язку з низькою поширеністю та поки що невідомою частотою ІААКЛ дані оцінки лікування базуються на звітах про випадки. Опубліковані гайдлайни знаходяться на рівні експертного консенсусу, тому на сьогодні рекомендації щодо лікування ІААКЛ недостатньо оцінені й не стандартизовані по відношенню до ад’ювантної терапії.
Висновки
1. Усі пацієнти, які мають грудні імплантати або які думають про їх встановлення, обов’язково повинні бути поінформовані про ризик виникнення ІААКЛ.
2. Встановлення діагнозу та лікування ІААКЛ потребує міждисциплінарного підходу.
3. Необхідні майбутні дослідження для визначення модифікованих факторів ризику виникнення ІААКЛ, враховуючи як особливості пацієнта, так і тип використовуваного грудного імплантату.
Конфлікт інтересів відсутній.
Список використаної літератури
- Adrada, B. E., Miranda, R. N., Rauch, G. M., Arribas, E., Kanagal-Shamanna, R., Clemens, M. W., … Yang, W. (2014). Breast implant-associated anaplastic large cell lymphoma: sensitivity, specificity, and findings of imaging studies in 44 patients. Breast Cancer Research and Treatment, 147(1), 1–14. doi: 10.1007/s10549-014-3034-3.
- Aladily, T. N., Medeiros, L. J., Amin, M. B., Haideri, N., Ye, D., Azevedo, S. J. … Miranda, R.N. (2012). Anaplastic large-cell lymphoma associated with breast implants: A report of 13 cases. The American Journal of Surgical Pathology, 36, 1000–1008. doi: 10.1097/PAS.0b013e31825749b1.
- Bautista-Quach, M. A., Nademanee, A., Weisenburger, D. D., Chen, W., & Kim, Y. S. (2013). Implant-Associated Primary Anaplastic Large-Cell Lymphoma With Simultaneous Involvement of Bilateral Breast Capsules. Clinical Breast Cancer, 13(6), 492–495. doi:10.1016/j.clbc.2013.08.009.
- Bizjak, M., Selmi, C., Praprotnik, S., Bruck, O., Perricone, C., Ehrenfeld, M., & Shoenfeld, Y. (2015). Silicone implants and lymphoma: The role of inflammation. Journal of Autoimmunity, 65, 64–73. doi: 10.1016/j.jaut.2015.08.009.
- Blombery, P., Thompson, E. R., Jones, K., Arnau, G. M., Lade, S., Markham, J. F., … Westerman, D. (2016). Whole exome sequencing reveals activating JAK1 and STAT3 mutations in breast implant-associated anaplastic large cell lymphoma anaplastic large cell lymphoma. Haematologica, 101(9), e387–e390. doi: 10.3324/haematol.2016.146118.
- Brody, G. S., Deapen, D., Taylor, C. R., Pinter-Brown, L., House-Lightner, S. R., Andersen, J. S. … Epstein, A. L. (2015). Anaplastic large cell lymphoma occurring in women with breast implants: analysis of 173 cases. Plastic and Reconstructive Surgery, 135, 695–705. doi: 10.1097/PRS.0000000000001033.
- Clemens, M. W., & Horwitz, S. M. (2017). NCCN Consensus Guidelines for the Diagnosis and Management of Breast Implant-Associated Anaplastic Large Cell Lymphoma. Aesthetic Surgery Journal, 37(3), 285–289. doi: 10.1093/asj/sjw259.
- Clemens, M. W., Jacobsen, E. D., & Horwitz, S. M. (2019). 2019 NCCN Consensus Guidelines on the Diagnosis and Treatment of Breast Implant-Associated Anaplastic Large Cell Lymphoma (BIA-ALCL). Aesthetic Surgery Journal, 39(1), S3–S13. doi: 10.1093/asj/sjy331.
- Clemens, M. W., Medeiros, L. J., Butler, C. E., Hunt, K. K., Fanale, M. A., Horwitz, S., … Miranda, R. N. (2016). Complete Surgical Excision Is Essential for the Management of Patients With Breast Implant-Associated Anaplastic Large-Cell Lymphoma. Journal of Clinical Oncology, 34(2), 160–168. doi: 10.1200/jco.2015.63.3412.
- de Boer, M., van Leeuwen, F. E., Hauptmann, M., Overbeek, L. I. H., de Boer, J. P., Hijmering, N. J. … de Jong, D. (2018). Breast Implants and the Risk of Anaplastic Large-Cell Lymphoma in the Breast. JAMA Oncology, 4, 335–341. doi: 10.1001/jamaoncol.2017.4510.
- de Jong, D., Vasel, W. L., de Boer, J. P., Verhave, G., Barbé, E., Casparie, M. K., & van Leeuwen, F. E. (2008). Anaplastic large-cell lymphoma in women with breast implants. The Journal of the American Medical Association, 300, 2030–2035. doi: 10.1001/jama.2008.585.
- Di Napoli, A., Pepe, G., Giarnieri, E., Cippitelli, C., Bonifacino, A., Mattei, M., … Giovagnoli, M. R. (2017). Cytological diagnostic features of late breast implant seromas: From reactive to anaplastic large cell lymphoma. PLOS One, 12(7), e0181097. doi: 10.1371/journal.pone.0181097.
- Doren, E. L., Miranda, R. N., Selber, J. C., Garvey, P. B., Liu, J., Medeiros, L. J., … Clemens, M. W. (2017). U.S. epidemiology of breast implant-associated anaplastic large-cell lymphoma. Plastic and Reconstructive Surgery, 139, 1042–1050. doi: 10.1097/PRS.0000000000003282.
- FDA: Medical device reports of breast implant-associated anaplastic large cell lymphoma. (2019). Retrieved from http://www.fda. gov/ MedicalDevices /ProductsandMedical Procedures/ImplantsandProsthetics/BreastImplants/ucm481899.htm.
- Ferrufino-Schmidt, M. C., Medeiros, L. J., Liu, H., Clemens, M. W., Hunt, K. K., Laurent, C., … Miranda, R. N. (2018). Clinicopathologic Features and Prognostic Impact of Lymph Node Involvement in Patients With Breast Implant-associated Anaplastic Large Cell Lymphoma. The American Journal of Surgical Pathology, 42(3), 293–305. doi: 10.1097/pas.0000000000000985.
- George, E. V., Pharm, J., Houston, C., Al-Quran, S., Brian, G., Dong, H. … Yang, L. J. (2013). Breast implant-associated ALK-negative anaplastic large cell lymphoma: a case report and discussion of possible pathogenesis. International Journal of Clinical and Experimental Pathology, 6(8), 1631–1642.
- Granados, R., Lumbreras, E. M., Delgado, M., Aramburu, J. A., & Tardío, J. C. (2016). Cytological Diagnosis of Bilateral Breast Implant-Associated Lymphoma of the ALK-Negative Anaplastic Large-Cell Type. Clinical Implications of Peri-Implant Breast Seroma Cytological Reporting. Diagnostic Cytopathology, 44(7), 623–627. doi: 10.1002/dc.23485.
- Hu, H., Jacombs, A., Vickery, K., Merten, S. L., Pennington, D. G., & Deva, A. K. (2015). Chronic Biofilm Infection in Breast Implants Is Associated with an Increased T-Cell Lymphocytic Infiltrate. Plastic and Reconstructive Surgery, 135(2), 319–329. doi: 10.1097/prs.0000000000000886.
- Johnson, L., O’Donoghue, J. M., McLean, N., Turton, P., Khan, A. A., Turner, S.D., … MacNeill, F. A. (2017). Breast implant associated anaplastic large cell lymphoma: The UK experience. Recommendations on its management and implications for informed consent. European Journal of Surgical Oncology (EJSO), 43(8), 1393–1401. doi: 10.1016/j.ejso.2017.05.004.
- Keech, J. A., & Creech, B. J. (1997). Anaplastic T-cell lymphoma in proximity to a saline-filled breast implant. Plastic and Reconstructive Surgery, 100, 554–555. doi: 10.1097/00006534-199708000-00065.
- Kricheldorff, J., Fallenberg, E. M., Solbach, C., Gerber-Schäfer, C., Rancsó, C., & von Fritschen, U. (2018). Breast implant-associated lymphoma. Deutsches Aerzteblatt Online, 115(38), 628–635. doi:10.3238/arztebl.2018.0628.
- Laurent, C., Delas, A., Gaulard, P., Haioun, C., Moreau, A., Xerri, L., … Lamant, L. (2015). Breast implant-associated anaplastic large cell lymphoma: two distinct clinicopathological variants with different outcomes. Annals of Oncology, 27(2), 306–314. doi: 10.1093/annonc/mdv575.
- Leberfinger, A. N., Behar, B. J., Williams, N. C., Rakszawski, K. L., Potochny, J. D., Mackay, D. R., & Ravnic, D. J. (2017). Breast implant-associated anaplastic large cell lymphoma: a systematic review. JAMA Surgery, 152, 1161–1168. doi: 10.1001/jamasurg.2017.4026.
- Loch-Wilkinson, A., Beath, K. J., Knight, R. J. W., Wessels, W. L. F., Magnusson, M., Papadopoulos, T. … Deva, A. K. (2017). Breast implant-associated anaplastic large cell lymphoma in Australia and New Zealand: high-surface-area textured implants are associated with increased risk. Plastic and Reconstructive Surgery, 140, 645–654. doi: 10.1097/PRS.0000000000003654.
- Miranda, R. N., Aladily, T. N., Prince, H. M., Kanagal-Shamanna, R., de Jong, D., Fayad, L. E. … Medeiros, L. J. (2014). Breast implant-associated anaplastic large-cell lymphoma: long-term follow-up of 60 patients. Journal of Clinical Oncology, 32, 114–120. doi: 10.1200/JCO.2013.52.7911.
- NIH: Adult non-hodgkin lymphoma treatment. (PDQ) — Patient Version. (2018). Retrieved from http://www.cancer.gov/types/lymphoma/patient/adult-nhl-treatment-pdq.
- Orciani, M., Sorgentoni, G., Torresetti, M., Di Primio, R., & Di Benedetto, G. (2016). MSCs and inflammation: new insights into the potential association between ALCL and breast implants. Breast Cancer Research and Treatment, 156(1), 65–72. doi: 10.1007/s10549-016-3745-8.
- Popplewell, L., Thomas, S. H., Huang, Q., Chang, K. L., & Forman, S. J. (2011). Primary anaplastic large-cell lymphoma associated with breast implants. Leukemia & Lymphoma, 52, 1481–1487. doi: 10.3109/10428194.2011.574755.
- Roden, A. C., Macon, W. R., Keeney, G. L., Myers, J. L., Feldman, A. L., & Dogan, A. (2008). Seroma-associated primary anaplastic large-cell lymphoma adjacent to breast implants: An indolent T-cell lymphoproliferative disorder. Modern Pathology, 21, 455–463. doi: 10.1038/modpathol.3801024.
- Srinivasa, D. R., Miranda, R. N., Kaura, A., Francis, A. M., Campanale, A., Boldrini, R. … Clemens, M. W. (2017). Global Adverse Event Reports of Breast Implant-Associated ALCL: An International Review of 40 Government Authority Databases. Plastic and Reconstructive Surgery, 139, 1029–1039. doi: 10.1097/PRS.0000000000003233.
- Swerdlow, S. H., Campo, E., Pileri, S. A., Harris, N. L., Stein, H., Siebert, R., … Jaffe, E. S. (2016). The 2016 revision of the World Health Organization classification of lymphoid neoplasms. Blood, 127(20), 2375–2390. doi: 10.1182/blood-2016-01-643569.
- Talwalkar, S. S., Miranda, R. N., Valbuena, J. R., Routbort, M. J., Martin, A. W., & Medeiros, L. J. (2008). Lymphomas involving the breast: a study of 106 cases comparing localized and disseminated neoplasms. The American Journal of Surgical Pathology, 32(9), 1299–1309. doi: 10.1097/PAS.0b013e318165eb50.
- Thomas, A., Link, B. K., Altekruse, S., Romitti, P. A., & Schroeder, M. C. (2017). Primary Breast Lymphoma in the United States: 1975–2013. Journal of the National Cancer Institute, 109(6). doi: 10.1093/jnci/djw294.
- US Food and Drug Administration. Questions and аnswers about Breast implant-associated anaplastic large cell lymphoma (BIA-ALCL). (2019). Retrieved from https://www.fda.gov/medical-devices/breast-implants/questions-and-answers-about-breast-implant-associated-anaplastic-large-cell-lymphoma-bia-alcl.
- Validire, P., Capovilla, M., Asselain, B., Kirova, Y., Goudefroye, R., Plancher, C., … Decaudin, D. (2009). Primary breast non-Hodgkin’s lymphoma: a large single center study of initial characteristics, natural history, and prognostic factors. American Journal of Hematology, 84(3), 133–139. doi: 10.1002/ajh.21353.
Імплантат-ассоциированная анапластическая крупноклеточная лимфома (обзор литературы)
1Запорожский государственный медицинский университет, Запорожье
2Медицинский центр «ОНКОЛАЙФ», Запорожье
Резюме. В последние годы появляется все больше доказательств того, что грудные имплантаты в редких случаях могут быть ассоциированы с развитием анапластической крупноклеточной лимфомы (АКЛ). Согласно данным литературы, частота возникновения первичной имплантат-ассоциированной анапластической крупноклеточной лимфомы (ИААКЛ) составляет 1 на 30 000 женщин с текстурными грудными имплантатами. ИААКЛ возникает в ложе имплантата после реконструкции грудной железы у женщин с раком грудной железы или аугментации. Гистологически подтвержденная ИААКЛ требует индивидуального лечения многопрофильной командой в составе клинического онколога, онкохирурга, пластического хирурга и гематолога. Лечение ИААКЛ имеет гораздо лучший прогноз, чем при системной АКЛ. При этом ИААКЛ, ограниченная капсулой, имеет благоприятный прогноз после хирургической капсулектомии, даже без адъювантной химиотерапии или лучевой терапии. Однако у некоторых пациентов развивается инфильтративное заболевания с потенциально опасным для жизни клиническим течением.
Ключевые слова: имплантат-ассоциированная анапластическая крупноклеточная лимфома, Т-клеточная лимфома, аугментация.
Адреса:
Колеснік Олексій Петрович
69091, Запоріжжя, вул. Нижньодніпровська, 4/238
Запорізький державний медичний університет
Тел: (097) 315-31-78
Факс: (0612) 96-34-96
Е-mail: oleksiikolesnik@gmail.com
Correspondence:
Kolesnik Oleksiy
4/238 Nyzhnodniprovska str., Zaporizhzhia 69091
Zaporizhzhia State Medical University
Tel.: (097) 315-31-78
Fax: (0612) 96-34-96
Е-mail: oleksiikolesnik@gmail.com














Leave a comment