Трансабдомінальна ультрасонографія в діагностиці раку товстої кишки
Резюме. Рак товстої кишки є найпоширенішою злоякісною пухлиною шлунково-кишкового тракту. Своєчасна та точна діагностика відіграє важливе значення для покращення прогнозу при колоректальному раку. Мета. Оцінити можливості трансабдомінальної ультрасонографії в діагностиці онкопатології товстої кишки. Матеріал та методи. Проведено ретроспективний аналіз результатів комплексного клініко-інструментального дослідження 101 пацієнта, у яких під час гістологічного аналізу матеріалів було діагностовано рак товстої кишки. Результати. Серед досліджених хворих у 16 (15,8±3,6%) пухлина локалізувалася в сліпій кишці, у 13 (12,9±3,3%) — у висхідній ободовій кишці, у 14 (13,9±3,4%) — у поперечній ободовій кишці, у 27 (26,7±4,4%) — у низхідній ободовій кишці та у 31 (30,7±4,6%) — у сигмовидній кишці. Локальне потовщення стінки (p <0,001) спостерігалося у 74 (73,3±4,4%), симптом хибної нирки — у 27 (26,7±4,4%). Локальне нерівномірне потовщення стінки товстої кишки на стадії Т2 спостерігалося у 21 (20,8±4,0%) випадку, на стадії Т3 — у 48 (47,5±5,0%), Т4 — у 5 (5,0±2,2%). Симптом хибної нирки на стадії Т2 не відзначали, на стадії Т3 виявляли у 4 (4,0±1,9%) пацієнтів, Т4 — у 23 (22,8±4,2%). Поліповидна форма пухлини товстої кишки спостерігалася у 9 (8,9±2,8%) хворих, виразково-інфільтративна — у 75 (74,3±4,3%) та екзофітна — у 17 (16,8±3,7%). Величина товщини стінки в межах 8,1-10,0 мм на стадії Т2 реєстрували в 4 (19,0±8,6%) випадках (p <0,001), на стадії Т3 — у 35 (67,3±6,5%) (p <0,001) та на стадії Т4 — у 9 (32,1±8,8%). Величина товщини стінки >10 мм на стадії Т2 не відзначалася, на стадії Т3 — виявляли у 9 (17,3±5,2%), на стадії Т4 — у 19 (67,9±8,8%) пацієнтів (p <0,001). Середня величина товщини ураженого сегмента на стадії Т2 становила 5,6±0,7 мм, на стадії Т3 — 8,9±1,5 мм (p <0,05), на стадії Т4 — 14,3±2,1 мм (p <0,001). Висновки. Локальне нерівномірне потовщення з втратою диференціації шарів стінки є основною ознакою раку товстої кишки. Симптом хибної нирки найбільш характерний для пізньої стадії раку товстої кишки. Виразково-інфільтративну форму виявляють достовірно частіше, ніж інші форми раку товстої кишки. Товщина стінки 8–10 мм спостерігається достовірно частіше на стадії Т3, а понад 10 мм — на стадії Т4. Непрямою ознакою інвазії стінки є наявність екзофітного компонента пухлини.
Одержано 9.11.2022
Прийнято до друку 17.11.2022
DOI: 10.32471/clinicaloncology.2663-466X.47-3.29128
Вступ
Колоректальна карцинома є третім найбільш поширеним видом раку в Сполучених Штатах Америки після онкопатології передміхурової залози та легені у чоловіків та після раку молочної залози та легені у жінок [1]. Рак товстої кишки (РТК) є найпоширенішою злоякісною пухлиною шлунково-кишкового тракту [2–4]. Найчастіше він розвивається з поліпів товстої кишки у зв’язку з їх трансформацією [5]. Рак ободової кишки виявляють частіше, ніж рак прямої кишки. У чоловіків частіше розвивається рак дистального відділу, а у жінок та осіб молодого віку — проксимального відділу ободової кишки. Колоректальний рак може бути діагностований під час скринінгу в осіб без симптомів або після того, як у пацієнта з’являться певні ознаки [6]. Своєчасна та точна діагностика має важливе значення для покращення прогнозу при колоректальному раку. Найбільш доступним та практичним методом діагностики є аналіз калу на приховану кров [7, 8]. Колоноскопія вважається золотим стандартом діагностики колоректального раку, водночас метод доступний не всім пацієнтам і вимагає високої кваліфікації фахівця [9, 10].
Найбільш визнаними та загальноприйнятими методами оцінки інвазії пристінкових шарів товстої кишки при раковому ураженні є комп’ютерна томографія (КТ) та магнітно-резонансна томографія. Ризик метастазування в лімфатичні вузли є вищим у молодих пацієнтів віком до 40 років з аденокарциномою товстої кишки на ранній стадії. КТ дозволяє візуалізувати лімфатичні вузли розмірами більше 1 см на підставі співвідношення діаметрів по короткій і довгій осі, внутрішньої неоднорідності, нерівної зовнішньої межі, значення загасання >100 одиниць Хаунсфілда (Hounsfield units — HU) та накопичення трьох або більше лімфатичних вузлів нормального розміру [11]. Абдомінальна ультрасонографія (УСГ) є неінвазивним, дешевим та доступним методом діагностики пухлин кишечнику [12, 13].
Мета дослідження. Метою дослідження є оцінка можливості трансабдомінальної УСГ у діагностиці РТК.
Матеріали та методи
Проведено ретроспективний аналіз результатів УСГ у 101 пацієнта з РТК. Діагноз було встановлено в результаті комплексного клінічного, лабораторного, комп’ютерно-томографічного та колоноскопічного дослідження з біопсією. Вік обстежуваних варіював у межах 61–85 років, серед них було 45 (44,6%) чоловіків та 56 (55,4%) жінок. Пацієнтів з раком прямої кишки до дослідження не включали, оскільки його діагностика ґрунтувалася на результатах трансректальної УСГ. УСГ органів черевної порожнини проводилася з приводу анемії, болю в животі, кишкової непрохідності. Деяким хворим УСГ черевної порожнини здійснювали для скринінгу. Після встановлення УСГ діагнозу РТК пацієнтам проводили колоноскопію та КТ.
Статистична обробка результатів дослідження проводилася з використанням однофакторного дисперсійного аналізу із застосуванням критеріїв хі-квадрат. Достовірність відмінностей між середніми показниками оцінювали за t-критерієм Стьюдента.
Результати
РТК у 16 (15,8±3,6%) пацієнтів локалізувався у сліпій кишці, у 13 (12,9±3,3%) — у висхідній ободовій кишці, у 14 (13,9±3,4%) — у поперечній ободовій кишці, у 27 (26,7±4,4%) — у низхідній ободовій кишці та у 31 (30,7±4,6%) — у сигмовидній кишці (табл. 1). Як видно з табл. 1, ураження сигмовидної кишки спостерігалося достовірно частіше, ніж сліпої (p <0,05), висхідної (p <0,01) і поперечної ободової (p <0,01) кишок. Крім того, пухлинне ураження низхідного відділу ободової кишки відмічали достовірно (p <0,05) частіше, ніж висхідного та поперечного відділів.
| Локалізація пухлини | Кількість випадків | |
| n | % | |
| Сліпа кишка | 16 | 15,8±3,6 |
| Висхідна ободова кишка | 13 | 12,9±3,3 |
| Поперечна ободова кишка | 14 | 13,9±3,4 |
| Низхідна ободова кишка | 27 | 26,7±4,4
p5–2 <0,05 p5–3 <0,05 |
| Сигмовидна кишка | 31 | 30,7±4,6
p5–1 <0,05 p5–2 <0,01 p5–3 <0,01 |
| Усього | 101 | 100,0 |
Під час діагностики РТК ми використовували найпростіші критерії, запропоновані M. Tomizawa зі співавторами. Цими критеріями вважалися локальне нерівномірне потовщення стінки товстої кишки або гіпоехогенне утворення з гіперехогенним центром (ультрасонографічний симптом хибної нирки). Периферія утворення відповідає стінці кишки, ураженої раком, а ехогенний центр — просвіту кишки, заповненої газом [12]. Як видно з табл. 2, локальне нерівномірне потовщення стінки сліпої кишки в ділянці ураження спостерігалося у 12 (11,9±3,2%) випадках, висхідної ободової кишки — у 5 (5,0±2,2%), поперечної ободової кишки — в 11 (10,9±3,1%), низхідної ободової кишки — у 15 (14,9±3,5%), сигмовидної кишки — у 31 (30,7±4,6%), а симптом хибної нирки — у 4 (4,0±1,9%), у 8 (8,0±2,7%), у 3 (3,0±1,7%) і у 12 (11,9%±3,2%) пацієнтів відповідно. Цей симптом був відсутній при раковому ураженні сигмовидної кишки, що свідчить про те, що пухлини цієї локалізації діагностують краще, ніж інших локалізацій.
| Локалізація пухлини | Тип ураження стінки кишки | |
| Локальненерівномірне потовщення | Симптом хибної нирки | |
| Сліпа кишка | 12 (11,9±3,2%)
p <0,05 |
4 (4,0±1,9%) |
| Висхідна ободова кишка | 5 (5,0±2,2%) | 8 (8,0±2,7%) |
| Поперечна ободова кишка | 11 (10,9±3,1%)
p <0,05 |
3 (3,0±1,7%) |
| Низхідна ободова кишка | 15 (14,9±3,5%) | 12 (11,9±3,2%) |
| Сигмовидна кишка | 31 (30,7±4,6%) | – |
| Усього | 74 (73,3±4,4%)
p <0,001 |
27 (26,7±4,4%) |
Частоту виявлення запропонованих M. Tomizawa і співавторами (2013) критеріїв діагностики РТК з урахуванням стадії Т представлено в табл. 3.
| Т-стадія пухлини | Тип ураження стінки товстої кишки | |
| Локальне нерівномірне потовщення | Симптом хибної нирки | |
| Т2 | 21 (20,8±4,0%)
p <0,001 p1–3 <0,001 |
– |
| Т3 | 48 (47,5±5,0%)
p <0,001 p2–1 <0,001 p2–3 <0,001 |
4 (4,0±1,9%) |
| Т4 | 5 (5,0±2,2%) | 23 (22,8±4,2%)
p <0,001 p3–2 <0,001 |
| Усього | 74 (73,3±4,4%)
p <0,001 |
27 (26,7±4,4%) |
Як видно з табл. 3, локальне нерівномірне потовщення стінки товстої кишки на стадії Т2 спостерігалося у 21 (20,8±4,0%) випадку, на стадії Т3 — у 48 (47,5±5,0%), Т4 — у 5 (5,0±2,2%). Симптом хибної нирки на стадії Т2 не спостерігався, на стадії Т3 відзначався у 4 (4,0±1,9%) пацієнтів, Т4 — у 23 (22,8±4,2%). На стадії Т4 симптом хибної нирки виявляли з високою достовірністю (p <0,001) частіше, ніж локальне нерівномірне потовщення стінки. Локальне нерівномірне потовщення стінки на стадії Т3 спостерігалося з високою достовірністю (p <0,001) частіше, ніж на інших стадіях.
Взаємозв’язок між стадією та локалізацією пухлини товстої кишки представлено в табл. 4. Як видно з табл. 4, стадію Т2 пухлини діагностували у 21 (20,8±4,0%) випадку, з них у сліпій кишці у 2 (2,0±1,4%), у висхідній ободовій кишці — у 3 (3,0±1,7%), у поперечній ободовій кишці — в 1 (1,0±1,0%), у низхідній ободовій кишці — у 3 (3,0±1,7%), у сигмовидній кишці — у 12 (11,9±3,2%).
| Локалізація пухлини | Т2 | Т3 | Т4 | Усього |
| Сліпа кишка | 2 (2,0±1,4%) | 8 (7,9±2,7%) | 6 (5,9±2,3%) | 16 |
| Висхідна ободова кишка | 3 (3,0±1,7%) | 6 (5,9±2,3%) | 4 (4,0±1,9%) | 13 |
| Поперечна ободова кишка | 1 (1,0±1,0%) | 9 (8,9±2,8%) | 4 (4,0±1,9%) | 14 |
| Низхідна ободова кишка | 3 (3,0±1,7%) | 13 (12,9±3,3%)
p <0,01 |
11 (10,9±3,1%)
p <0,05 |
27 |
| Сигмовидна кишка | 12 (11,9±3,2%)
p <0,05 |
16 (15,8±3,6%)
p <0,01 |
3 (3,0±1,7%) | 31 |
| Усього | 21 (20,8±4,0%) | 52 (51,5±5,0%) | 28 (27,7±4,5%) | 101 |
Стадію пухлини Т3 виявляли в 52 (51,5±5,0%) пацієнтів, з них у сліпій кишці — у 8 (7,9±2,7%), у висхідній ободовій кишці — у 6 (5,9±2,3%), у поперечній ободовій кишці — у 9 (8,9±2,8%), у низхідній ободовій кишці — у 13 (12,9±3,3%), у сигмовидній кишці — у 16 (15,8±3,6%). Стадію Т4 діагностовано у 28 (27,7±4,5%) випадках, з них у сліпій кишці — у 6 (5,9±2,3%), у висхідній ободовій кишці — у 4 (4,0±1,9%), у поперечній ободовій кишці — у 4 (4,0±1,9%), у низхідній ободовій кишці — в 11 (10,9±3,1%), у сигмовидній кишці — у 3 (3,0±1,7%). Т4 стадія пухлини в сигмовидній кишці спостерігалася достовірно рідше, ніж Т2 (p <0,05) і Т3 (p <0,01), а в низхідній ободовій кишці, навпаки, Т2 відзначалася достовірно рідше, ніж Т3 (p <0,01) та Т4 (p <0,05). Крім того, стадія Т4 в низхідній ободовій кишці спостерігалася достовірно (p <0,05) частіше, ніж у сигмовидній кишці (10,9±3,1% проти 3,1±1,7%).
J.E. Kim та співавтори пропонують класифікувати пухлини за їх формою: поліповидна, виразково-інфільтративна, екзофітна [14]. Поліповидна форма пухлини товстої кишки спостерігалася у 9 (8,9±2,8%) випадках, виразково-інфільтративна — у 75 (74,3±4,3%) та екзофітна — у 17 (16,8±3,7%). Поліповидну форму пухлини на стадії Т4, екзофітну форму на стадії Т2 не відзначали. На стадії Т2 поліпоподібну форму пухлини реєстрували у 7 (6,9±2,5%), на стадії Т3 — у 2 (2,0±1,4%), виразково-інфільтративну форму на стадії Т2 у 14 (13,9 ±3,4%), на стадії Т3 — у 45 (44,6±4,9%) та на стадії Т4 — у 16 (15,8±3,6%), екзофітну форму на стадії Т3 у 5 (5,0±2,2%), на стадії Т4 у 12 (11,9±3,2%) пацієнтів (табл. 5).
| Стадія пухлини | Форма пухлини | |||
| поліповидна | виразково-інфільтративна | екзофітна | Усього | |
| Т2 | 7 (6,9±2,5%) | 14 (13,9±3,4%) | 0 | 21 (20,8±4,0%) |
| Т3 | 2 (2,0±1,4%) | 45 (44,6±4,9%)
p <0,001 |
5 (5,0±2,2%) | 52 (51,5±5,0%) |
| Т4 | 0 | 16 (15,8±3,6%) | 12 (11,9±3,2%) | 28 (27,7±4,5%) |
| Усього | 9 (8,9±2,8%) | 75 (74,3±4,3%)
p <0,001 |
17 (16,9±3,7%) | 101 (100,0%) |
У табл. 6 представлено розподіл пацієнтів з урахуванням форми та локалізації РТК. Поліповидна пухлина в сліпій кишці та у висхідній ободовій кишці відзначалася у 2 (2,0±1,4%) випадках, у поперечній ободовій та сигмовидній кишці — в 1 (1,0±1,0%), у низхідній ободовій кишці — у 3 (3,0±1,7%). Виразково-інфільтративну форму пухлини в сліпій кишці діагностували у 13 (12,9±3,3%), у висхідній ободовій кишці — у 8 (7,9±2,7%), у поперечній ободовій кишці — у 11 (10,9±3,1%), у низхідній ободовій кишці — у 15 (14,9±3,5%) та у сигмовидній кишці — у 28 (27,7±4,5%) пацієнтів, а екзофітну форму — в 1 (1,0±1,0%), 3 (3,0±1,7%), 2 (2,0±1,4%), 9 (8,9±2,8%) і у 2 (2,0±1,4%) випадках відповідно. Виразково-інфільтративну форму пухлини в усіх відділах товстої кишки реєстрували достовірно частіше (p <0,01; p <0,001), ніж поліпоподібну та екзофітну форми.
| Локалізація пухлини | Форма пухлини | |||
| поліповидна | виразково-інфільтративна | екзофітна | Усього | |
| Сліпа кишка | 2 (2,0±1,4%) | 13 (12,9±3,3%)
p2–1 <0,001 p2–3 <0,001 |
1 (1,0±1,0%) | 16 |
| Висхідна ободова кишка | 2 (2,0±1,4%) | 8 (7,9±2,7%) | 3 (3,0±1,7%) | 13 |
| Поперечна ободова кишка | 1 (1,0±1,0%) | 11 (10,9±3,1%)
p2–1 <0,01 p2–3 <0,01 |
2 (2,0±1,4%) | 14 |
| Низхідна ободова кишка | 3 (3,0±1,7%) | 15 (14,9±3,5%) | 9 (8,9±2,8%) | 27 |
| Сигмовидна кишка | 1 (1,0±1,0%) | 28 (27,7±4,5%)
p2–1 <0,001 p2–3 <0,001 |
2 (2,0±1,4%) | 31 |
| Усього | 9 (8,9±2,8%) | 75 (74,3±4,3%)
p2–1 <0,001 p2–3 <0,001 |
17 (16,9±3,7%) | 101 |
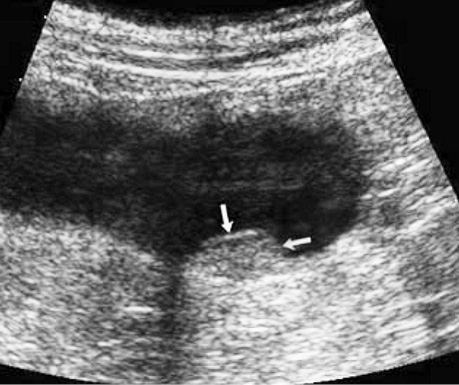
Ехографічно нормальна стінка товстої кишки має шарувату структуру і при заповненні просвіту рідиною не перевищує 4 мм. Товщина нормальної стінки варіювала в межах 2,1–3,9 мм, середня величина становила 2,9±0,3 мм, а в ділянці пухлини коливалася від 5,3 до 19,1 мм, у середньому становила 11,7±18 мм (рис. 1, 2). Погіршення або повна відсутність диференціації шарів стінки були важливими критеріями для підозри пухлинного ураження стінки кишки. Протяжність пухлинного ураження стінки варіювала від 19 мм до 86 мм, у середньому становила 45,2±6,3 мм.
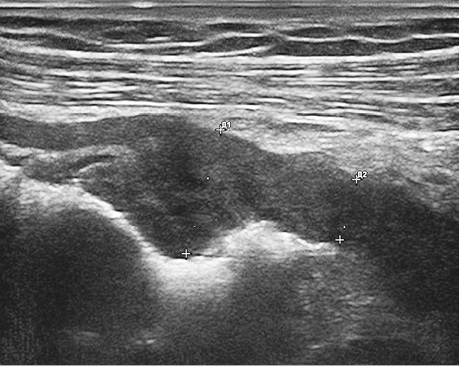
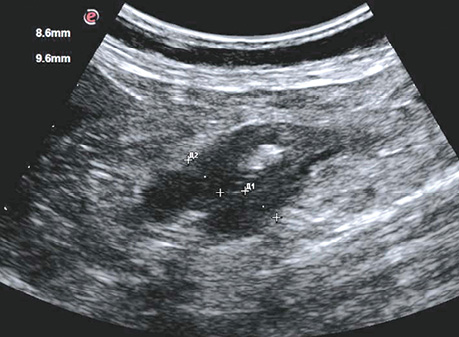
У табл. 7 наведено результати кількісного аналізу лінійних параметрів ураженого раком сегмента стінки товстої кишки. Товщина стінки ділянки пухлинного ураження має 4 градації: до 6 мм, 6,1–8,0 мм, 8,1–10,0 мм і більше 10 мм, а протяжність — менше 30 мм, 31–60 мм і більше 60 мм. Вивчено частоту виявлення цих інтервалів на стадії Т2, Т3 і Т4. Крім того, вивчено індекс співвідношення товщини та протяжності пухлини (табл. 7).
| Ехографічний параметр | РТК | ||
| Т2 | Т3 | Т4 | |
| n=21 | n=52 | n=28 | |
| Товщина стінки <6,0 мм | 1 (4,8±4,7%) | – | – |
| Товщина стінки 6,1–8,0 мм | 17 (81,0±8,6%)
p1–2 <0,001 |
8 (15,4±5,0%) | – |
| Товщина стінки 8,1–10,0 мм | 4 (19,0±8,6%) | 35 (67,3±6,5%)
p2–1 <0,001 p2–3 <0,01 |
9 (32,1±8,8%) |
| Товщина стінки >10,0 мм | – | 9 (17,3±5,2%) | 19 (67,9±8,8%)
p3–2 <0,001 |
| Середня величина товщини ураженого сегмента, мм | 5,6±0,7 | 8,9±1,5
p2–1 <0,05 |
14,3±2,1
p3–2 <0,05 p3–1 <0,001 |
| Протяжність ураженого сегмента <30 мм | 19 (90,5±6,1%)
p1–2 <0,001 |
11 (21,2±5,7%) | 1 (3,6±3,5%) |
| Протяжність ураженого сегмента 31,0–60,0 мм | 2 (9,5±6,1%) | 27 (51,9±6,9%)
p2–1 <0,001 |
16 (57,1±9,4%)
p3–1 <0,001 |
| Протяжність ураженого сегмента >60,0 мм | – | 14 (26,9±6,1%) | 11 (39,3±9,2%) |
| Середня величина протяжності ураженого сегмента, мм | 23,7±3,2 | 35,4±5,1
p2–1 <0,05 |
51,7±6,4
p3–1 <0,001 p3–1 <0,05 |
| Індекс товщини та протяжності | 0,24±0,05 | 0,25±0,06 | 0,28±0,06 |
Як видно з табл. 7, товщина ураженого сегмента стінки товстої кишки <6,0 мм на стадії Т2 відзначалися лише в 1 (4,8±4,7%) випадку. Товщину стінки в межах 6,1–8,0 мм на стадії Т2 виявляли у 17 (81,0±8,6%) пацієнтів (p <0,001), на стадії Т3 — у 8 (15,4±5,0%) і стадії Т4 — ні в одного хворого. Товщина стінки в межах 8,1–10,0 мм на стадії Т2 реєструвалася в 4 (19,0±8,6%) випадках (p <0,001), на стадії Т3 — у 35 (67,3±6,5%) (p <0,001) та на стадії Т4 — у 9 (32,1±8,8%)випадках. Товщина стінки >10 мм на стадії Т2 не відзначалася, на стадії Т3 — реєструвалася у 9 (17,3±5,2%), на стадії Т4 — у 19 (67,9±8,8%) пацієнтів (p <0,001). Середня величина товщини ураженого сегмента на стадії Т2 становила 5,6±0,7 мм, на стадії Т3 — 8,9±1,5 мм (p <0,05), на стадії Т4 — 14,3±2,1 мм (p <0,001).
Протяжність ураженого сегмента стінки товстої кишки <30,0 мм на стадії Т2 відзначалася в 19 (90,5±6,1%) випадках (p <0,001), на стадії Т3 — в 11 (21,2±5,7%) та на стадії Т4 — в 1 (3,6±3,5%). Величина протяжності пухлини в межах 31,0–60,0 мм на стадії Т2 реєструвалася у 2 (9,5±6,1%) пацієнтів, на стадії Т3 — у 27 (51,9±6,9%) (p <0,001) та на стадії Т4 — у 16 (57,1±9,4%). Протяжність пухлини >60 мм на стадії Т2 не відзначалася, на стадії Т3 — реєструвалася в 14 (26,9±6,1%), на стадії Т4 — в 11 (39,3±9,2%) випадках (p <0,001). Середня величина протяжності ураженого сегмента на стадії Т2 становила 23,7±3,2 мм, на стадії Т3 — 35,4±5,1 мм (p <0,05), на стадії Т4 — 51,7±6,4 мм (p <0,001). Співвідношення товщини та протяжності пухлини на стадії Т2 становило 0,24±0,05, на стадії Т3 — 0,25±0,06 та на стадії Т4 — 0,28±0,06.
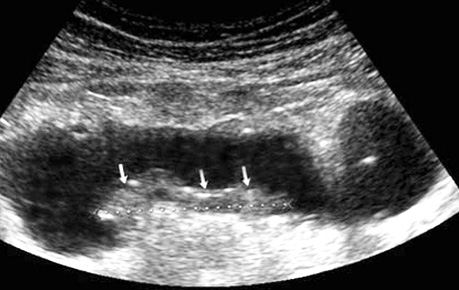
Ультрасонографічний симптом хибної нирки характеризується циркулярним раковим ураженням стінки порожнистого органа, яким є кишка. У цьому периферична гіпоехогенна зона відповідає стінці ураженого відділу з втратою диференціації шарів стінки, а центральна гіперехогенна зона — просвіту кишки, заповненої газом (рис. 3, 4).
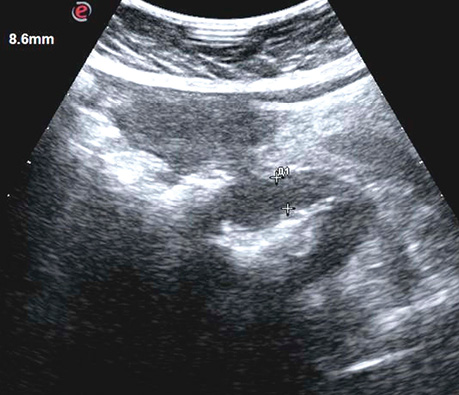
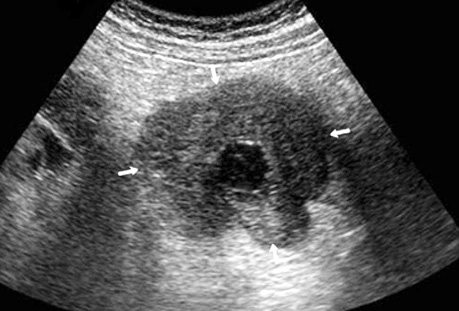
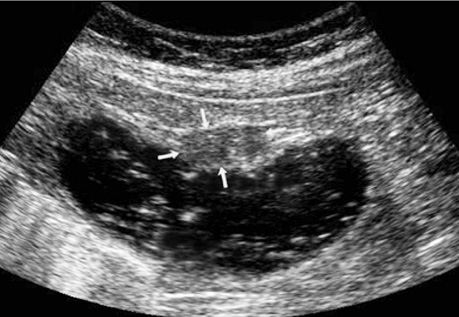
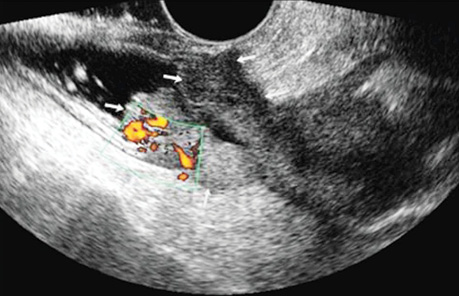
При поліпоподібній формі співвідношення товщини та ширини пухлини варіює в межах 0,4–0,6, утворення знаходиться на внутрішній поверхні кишки (рис. 5). Виразково-інфільтративна форма пухлини характеризується найбільшою протяжністю пухлинного ураження з відносно меншою товщиною. Співвідношення товщини та протяжності пухлини зазвичай не перевищує 0,2. Внутрішня поверхня пухлини зазвичай нерівна, горбиста, розмита (рис. 6). При екзофітній формі раку локальне потовщення стінки відбувається як у просвіт кишки, так і назовні (рис. 7, 8).
Обговорення
Порогове значення товщини стінки товстої кишки при УСГ черевної порожнини має важливе значення для первинної підозри на наявність пухлинного ураження. Верхня межа нормальної стінки товстої кишки становить 4 мм. E. Stermer та співавтори виконували колоноскопію у пацієнтів з потовщенням стінки >3 мм [15]. Із 46 пацієнтів у 30 стінка була товщою за 4 мм, але не було виявлено патологічних змін, які б дозволили припустити пухлину. У нашому дослідженні при пороговому значенні товщини стінки до 5 мм лише в одного пацієнта виявили пухлину. S.J. Choi та співавтори повідомили, що товщина стінки при РТК становить 14 мм на момент встановлення діагнозу за допомогою КТ [16], що дозволяє припустити, що граничне значення товщини стінки для діагностики РТК може бути нижчим при абдомінальному ультразвуковому дослідженні. Ця гіпотеза може бути підтримана тим фактом, що ультразвукове дослідження черевної порожнини дає докладніші дані в порівнянні з КТ [12]. Оцінка цілісності серозної оболонки має значення для визначення ступеня інвазії РТК. При цьому можливості ендоректальної УСГ при раку прямої кишки перевершують можливості трансабдомінальної ехографії [17, 18]. Проте ендоректальна УСГ не підходить для скринінгу, на відміну від черевної УСГ. Наші дослідження показують, що в діагностиці раку сигмовидної кишки результати УСГ є найкращими, оскільки існує можливість використовувати високочастотні датчики, що забезпечують більш якісну візуалізацію.
Висновки
Локальне нерівномірне потовщення з втратою диференціації шарів стінки є основною ознакою РТК. Симптом хибної нирки найбільш характерний для пізньої стадії РТК. Виразково-інфільтративну форму виявляють достовірно частіше, ніж інші форми РТК. Товщину стінки 8–10 мм відзначають достовірно частіше на стадії Т3, а понад 10 мм — на стадії Т4. Непрямою ознакою інвазії стінки є наявність екзофітного компонента пухлини.
Інформація щодо конфлікту інтересів: відсутній.
Список використаної літератури
1. Siegel, R., Ward, E., Brawley, O., & Jemal, A. (2011). Cancer statistics, 2011: the impact of eliminating socioeconomic and racial disparities on premature cancer deaths. Cancer Journal for Clinicians, 61, 212–236. doi: 10.3322/caac.20121.
2. Brenner, H., Kloor, M., & Pox, C. P. (2014). Colorectal cancer. The Lancet, 383, 1490–1502. doi: 10.1016/S0140-6736(05)17706-X.
3. Theilen, T. M., Chou, A. J., Klimstra, D. S., & LaQuaglia, M. P. (2016). Esophageal adenocarcinoma and squamous cell carcinoma in children and adolescents: report of 3 cases and comprehensive literature review. Journal of Pediatric Surgery Case Reports, 5, 23–29. doi: 10.1016/j.epsc.2015.12.008.
4. Xie, X., Yin, J., Zhou, Z., Dang, C., Zhang, H., & Zhang, Y. (2019). Young age increases the risk for lymph node metastasis in patients with early Colon Cancer. BMC Cancer, 19, 803. doi: 10.1186/s12885-019-5995-4.
5. Al-Sohaily, S., Biankin, A., Leong, R., Kohonen-Corish, M., & Warusavitarne, J. (2012). Molecular pathways in colorectal cancer. Journal of Gastroenterology and Hepatology, 27, 1423–1431. doi: 10.1007/s00428-016-1956-3.
6. Chen, L., Eng, C., Nieman, L. Z., Kapadia, A. S., & Du, X. L. (2011). Trends in colorectal cancer incidence by anatomic site and disease stage in the United States from 1976 to 2005. American Journal of Clinical Oncology, 34(6), 573–580. doi: 10.1097/COC.0b013e3181fe41ed.
7. Fleming, M., Ravula, S., Tatishchev, S. F., & Wang, H. L. (2012). Colorectal carcinoma: Pathologic aspects. Journal of Gastrointestinal Oncology, 3(3), 153–173. doi: 10.3978/j.issn.2078-6891.2012.030.
8. Benton, S. C., Seaman, H. E., & Halloran, S. P. (2015). Faecal occult blood testing for colorectal cancer screening: The past or the future. Current Gastroenterology Reports, 17, 428. doi: 10.1007/s11894-015-0428-2.
9. Stracci, F., Zorzi, M., & Grazzini, G. (2014). Colorectal cancer screening: tests, strategies, and perspectives. Frontiers in Public Health, 2, 210. doi: 10.3389/fpubh.2014.00210.
10. Wallace, M. B., & Kiesslich, R. (2010). Advances in endoscopic imaging of colorectal neoplasia. Gastroenterology, 138, 2140–2150. doi: 10.1053/j.gastro.2009.12.067.
11. Rollven, E., Blomqvist, L., Öistämö, E., Hjern, F., Csanaky, G., & Abraham-Nordling, M. (2019). Morphological predictors for lymph node metastases on computed tomography in colon cancer. Abdominal Radiology, 44, 1712–1721. doi: 10.1007/s00261-019-01900-z.
12. Tomizawa, M., Shinozaki, F., Hasegawa, R., Fugo, K., Shirai, Y., Ichiki, N., … Yoshida, T. (2013). Screening ultrasonography is useful for the diagnosis of gastric and colorectal cancer. Hepatogastroenterology, 60, 517–521. doi: 10.5754/hge12722.
13. Абдуллаев, Р. Я., Крыжановская, И. В., Дынник, О. Б., & Мечев, Д. С. (2014). Особенности ультразвуковой диагностики рака желудка и ободочной кишки. Променева діагностика, променева терапія, 4, 27–33.
14. Kim, J. E., Lee, J. M., Baek, J. H., Moon, S. K., Kim, S. H., Han, J. K., … Han, J. K. (2015). Differentiation of poorly differentiated colorectal adenocarcinomas from well- or moderately differentiated colorectal adenocarcinomas at contrast-enhanced multidetector CT. Abdominal Imaging, 40(1), 1–10. doi: 10.1007/s00261-014-0176-z.
15. Stermer, E., Lavy, A., Rainis, T., Goldstein, O., Keren, D., & Zeina, A. R. (2008). Incidental colorectal computed tomography abnormalities: Would you send every patient for a colonoscopy? Canadian Journal of Gastroenterology, 22, 758–760. doi: 10.1155/2008/901250.
16. Choi, S. J., Kim, H. S., Ahn, S. J., Jeong, Y. M., & Choi, H. Y. (2013). Evaluation of the growth pattern of carcinoma of colon and rectum by MDCT. Acta Radiologica, 54, 487–492. doi: 10.1177/0284185113475923.
17. Heo, S. H., Kim, J. W., Shin, S. S., Jeong, Y. Y., & Kang, H. K. (2014). Multimodal imaging evaluation in staging of rectal cancer. World Journal of Gastroenterology, 20, 4244–4255. doi: 10.3748/wjg.v20.i15.4244.
18. Xu, D., Ju, H. X., Qian, C. W., & Jiang, F. (2014). The value of TRUS in the staging of rectal carcinoma before and after radiotherapy and comparison with the staging postoperative pathology. Clinical Radiology, 69, 481–484. doi: 10.1016/j.crad.2013.12.005.
Адреса для листування:
Коваль Оксана Володимирівна
030049, Київ, Повітрофлотський просп., 9
E-mail: drkovalov@gmail.com
Сorrespondence:
Oksana Koval
9 Povitroflotskyi Ave, Kyiv 030049
E-mail: drkovalov@gmail.com














Leave a comment