Можливості та складності гістологічного типування солідних пухлин у дітей
Резюме. Рутинне гістологічне дослідження новоутворень у дітей у значній частині випадків не є достатньо доказовим при визначенні їх гістогенетичного типу. У зв’язку з цим імуногістохімія стає абсолютно необхідною для типування пухлин дитячого віку, які однозначно не були верифіковані мікроскопічно. Крім того, доцільно підтверджувати імуногістохімічно тип пухлин, який не викликав принципових сумнівів при вивченні рутинно забарвлених препаратів. Слід враховувати, що гістогенетичне типування солідних пухлин у дітей у невеликій частині випадків не може бути вирішене імуногістохімічними методами. У такій ситуації реальну допомогу надають дослідження геному пухлинних клітин та інші молекулярно-генетичні методи. Але сьогодні окремі пухлини ще не можуть бути типовані внаслідок радикальної зміни їх фенотипу в процесі онтогенезу. Для таких пухлин доцільно визначати ознаки, які навіть за відсутності встановленого гістологічного типу можуть виступати факторами прогнозу як розвитку захворювання, так і чутливості до лікування.
 Злоякісні пухлини дитячого віку становлять біля 2% від усіх злоякісних новоутворень. Але серед причин смерті у дітей вони стоять на одному з перших місць [3], й у розвинених країнах смертність у цій віковій групі від онкологічних захворювань займає 2-ге місце після нещасних випадків і сягає 10% [6]. У дітей солідні пухлини, за даними різних авторів [3, 42], становлять від 10 до 40% від усіх злоякісних новоутворень, а пік захворюваності припадає на перші 4 роки життя [3].
Злоякісні пухлини дитячого віку становлять біля 2% від усіх злоякісних новоутворень. Але серед причин смерті у дітей вони стоять на одному з перших місць [3], й у розвинених країнах смертність у цій віковій групі від онкологічних захворювань займає 2-ге місце після нещасних випадків і сягає 10% [6]. У дітей солідні пухлини, за даними різних авторів [3, 42], становлять від 10 до 40% від усіх злоякісних новоутворень, а пік захворюваності припадає на перші 4 роки життя [3].
Ефективність лікування онкологічних захворювань знаходиться в безпосередній залежності від визначення гістологічного типу пухлини та низки її властивостей. Особливо слід відзначити суттєве зростання вимог до точності гістологічного типування пухлин за останні десятиліття [13, 49], що пов’язано з розширенням уявлень про біологію пухлин та високою специфічністю сучасних способів лікування онкологічних хворих.
Більша частина пухлин у дітей походить з примітивних ембріональних клітин чи таких, які не завершили своє гістогенетичне становлення. Ці пухлини, маючи велику різноманітність морфологічних форм, часто не мають чітких ознак гістотипового диференціювання, характеризуються різкою анаплазією та варіабельністю клітинного складу в межах одного і того ж захворювання. Разом з тим новоутворення різного походження часто мають подібні загальні ознаки будови, що особливо проявляється в препаратах, забарвлених гематоксиліном і еозином. Все це робить типування пухлин дитячого віку значною проблемою для патологів [5, 6, 20]. Рутинна оцінка пухлини за цих умов у 60–80% базується, перш за все, на її «упізнаванні» при мікроскопії за загальною картиною з визначенням переважання клітин певної форми (круглоклітинна, веретеноподібноклітинна, епітеліоїдноклітинна, змішана) та носить виразний суб’єктивний характер. У третині з цих випадків первинне заключення не підтверджується.
Крім того, загальноприйняті підходи щодо визначення злоякісності та доброякісності не завжди повною мірою можна застосувати до пухлин у дітей. Наприклад, різко виражений атипізм та поліморфізм можливий при деяких доброякісних пухлинах надниркової залози [9]. Деякі доброякісні пухлини у маленьких дітей ростуть дуже швидко (невуси, гемангіоми) [42]. У таких пухлинах, не дивлячись на їх доброякісний характер, виявляється значна кількість мітозів та високий індекс проліферативної активності Кі-67 [10]. Інфільтруючий ріст типовий для ювенільної фіброми, капілярної гемангіоми, лімфангіоми [5, 9]. І навпаки, частина злоякісних пухлин у перші роки життя дитини іноді росте дуже повільно, наприклад нейробластома, звичайно має тонку капсулу і виходить за її межі [35].
Типування пухлин у дітей, як і в інших категорій онкологічних хворих, розпочинається з оцінки загальної будови пухлини. При цьому візуальна верифікація пухлини відбувається за рахунок «упізнавання», що безпосередньо залежить від досвіду патолога і значною мірою є суб’єктивною. Приблизно у половині випадків, за нашим досвідом, заключення не викликає сумнівів і підтверджується при застосуванні спеціальних методів дослідження. Але не рідкістю є ситуація, коли кількість взаємовиключних заключень дорівнює числу патологів, які вивчали матеріал. Крім того, у нашій практиці не один раз виникали випадки, коли при мікроскопії у декількох досвідчених патологів не виникало сумнівів стосовно типу пухлини, але при подальшому імуногістохімічному дослідженні встановлювався зовсім інший її гістогенетичний тип. Практично однозначно при первинному вивченні пухлини визначається переважаючий морфологічний тип клітин, з яких складається пухлина (табл. 1.).
Таблиця 1. Розподіл основних типів солідних пухлин дитячого віку за переважанням в їх складі клітин певної форми
| Пухлини, що складаютьсяз округлих клітин | Пухлини, що складаютьсяз веретеноподібних клітин | Пухлини, що складаютьсяз епітеліоїдних клітин |
|---|---|---|
| нейробластома | фібросаркома | епітеліоїдноклітинна синовіальна саркома |
| саркома Юїнга/ПНЕП (PNET) | веретеноклітинна рабдоміосаркома | епітеліоїдноклітинна саркома |
| мезенхімальна хондросаркома | лейоміосаркома | епітеліоїдноклітинна ангіосаркома |
| ембріональна та альвеолярна рабдоміосаркома | злоякісна пухлина периферичного нервовогостовбура | епітеліоїдноклітинна злоякісна пухлина нервового стовбура |
| ДДККП | веретеноклітинна ангіосаркома | склерозуюча епітеліоїдноклітинна фібросаркома |
| круглоклітинна ліпосаркома | монофазна веретеноклітинна синовіальна саркома | злоякісна фіброзна гістіоцитома |
| малігнізована рабдоїдна пухлина | епітеліоїдноклітинна лейоміосаркома |
Для подолання ситуації, коли настільки значна частина пухлин у дітей не може бути верифікована рутинним методом, постає питання про використання спеціальних методів дослідження. Серед них сьогодні провідне місце зайняла імуногістохімія (ІГХ), яка майже вдвічі підвищує достовірність діагнозу та яка в останні десятиріччя стала невід’ємним атрибутом у роботі онкоморфолога [6, 7, 29, 42, 51]. Особливою цінністю методу ІГХ є те, що для дослідження використовується матеріал після звичайної фіксації в формаліні та ущільненні у парафіні.
ІГХ дозволяє [3, 10, 22]:
- провести гістогенетичне типування пухлини і визначити нозологічний варіант новоутворення;
- визначити органоналежність первинної пухлини за метастазом невідомого походження;
- визначати ступінь злоякісної трансформації клітин пухлини;
- прогнозувати перебіг пухлинного захворювання;
- прогнозувати чутливість/резистентність пухлинних клітин до хіміотерапевтичних препаратів та променевої терапії;
- визначити можливість проведення таргетної терапії.
Сьогодні при верифікації пухлин дитячого віку використовується декілька десятків тільки основних ІГХ-маркерів. Тому інтерпретація отриманих даних дослідження потребує обов’язкового чіткого уявлення про специфіку кожного окремого антигену, його експресію в конкретних нормальних і трансформованих тканинах, локалізацію в клітинах чи позаклітинних складових тканин. Оскільки практично немає таких ІГХ-маркерів, які були б специфічними тільки для якогось конкретного типу пухлини, то для типування новоутворення повинна використовуватися панель з декількох антитіл. При цьому принципово важливим є визначення, у яких елементах пухлини експресуються ці маркери: у пухлинних клітинах, у стромі або клітинах запального інфільтрату.
Біля 90% злоякісних пухлин у дітей мають мезенхімальне походження. Це стосується пухлин, які походять як з ембріональних, так і зі зрілих тканин. З пухлин, які розвиваються з ембріональних тканин, 42% становлять новоутворення мезенхімального генезу, 35% — ектодермального, 22% — мезодермального, 1% –ентодермального та неясного генезу [5].
До групи пухлин, які складаються з дрібних округлих клітин, належать новоутворення, що найчастіше зустрічаються в дитячому віці. Вони зазвичай мають низьке диференціювання та високий ступінь злоякісності (табл. 2.).
Таблиця 2. Орієнтовна діагностична панель антитіл, що використовуються для верифікації основних типів дрібно-круглоклітинних пухлин м’яких тканин у дітей
| Тип пухлини | Маркери, що використовуються в рутинній діагностиці | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Vimentin | CK | Desmin | Synaptophysin | СD57 | СD99 | Osteocalcin | Miogenin | Mio D1 | S-100 | СD45 | |
| Нейробластома | – | – | – | +++ | + | – | – | – | – | +++у стромі | – |
| Рабдоміосаркома | +++ | – | +++ | – | – | – | – | +++ | +++ | – | – |
| Саркома Юїнга/PNET | + | – | – | ++ | + | +++ | – | – | – | – | – |
| Дрібноклітинна синовіальна саркома | +++ | +++ | – | – | +++ | – | – | – | – | + | – |
| Мезенхімальна хондросаркома | +++ | – | – | – | ++ | – | – | – | – | +++ | – |
| Дрібноклітинна остеосаркома | +++ | – | – | – | ++ | + | +++ | – | – | + | – |
| ДДККП | +++ | +++ | +++ | ++ | + | +++ | – | ++ | – | – | – |
| Злоякісна лімфома | ++ | – | – | – | – | ++ | – | – | – | – | +++ |
Примітка: «+++» — зустрічається в більш ніж 75% пухлин; «++» — зустрічається в 50–75% пухлин; «+» — зустрічається в 20–50% пухлин; «–» — зустрічається в менш ніж 20% пухлин
Нейробластома. Усі її різновиди експресують нейрональні маркери, такі як нейронспеціфічна енолаза (NSE), синаптофізин, хромограніни (CgA), СD56, СD57. Слід зауважити, що експресія S-100 протеїну та білків нейрофіламентів (NF) відбувається в більш диференційованих нейробластомах (гангліонейробластомі та гангліоневромі) та у шванівській стромі низькодиференційованої нейробластоми (підтип «нейробластома багата шванівською стромою») [16, 19, 35, 36, 44, 50].
Рабдоміосаркома. Всі її види експресують віментин і у більшості випадків десмін та м’язовий специфічний актин (MA). Основними ж її специфічними маркерами є міогенні ядерні регуляторні протеїни — міогенін та МуоD1, які є високоспецифічними саме для клітин-попередників поперечносмугастої м’язової тканини, а їх експресія в клітинах пухлини практично однозначно дозволяє встановити діагноз. Крім того, клітини рабдоміосаркоми в частині випадків можуть експресувати деякі нейрональні маркери, а також СD99 [24, 27, 31, 47].
Основними діагностичними маркерами для саркома Юїнга/примітивної нейроектодермальної пухлини (ПНЕП) є СD99 (продукт гена MIC2) та Fli-1. Також клітини цих пухлин експресують віментин, порівняно часто — синаптофізин, у рідких випадках — цитокератини (CK), CD57. При інтерпретації ІГХ дослідження потрібно бути обережним і враховувати всі дані (клінічні, гістологічні особливості), оскільки СD99 і Fli1 можуть експресуватися при деяких лімфомах та саркомах [2, 12, 20, 30, 46]. У пригоді може стати й ШИК-реакція, яка виявляє відповідні компоненти у складі цитоплазми пухлинних клітин [9].
Клітини мезенхімальної хондросаркоми експресують віментин, S-100 протеїн та, рідше, СD57. Оскільки маркери, що визначаються в цій пухлині, не є специфічними, то основним при її верифікації є виявлення у гістологічному дослідженні серед скупчень дрібних круглих клітин ділянок хрящової тканини [7, 8, 11, 20, 51]. Осередки хряща в складі хондросаркоми значно краще виявляються при забарвленні зрізів азур ІІ-еозином, толуїдиновим чи альціановим синім, ШИК-реакцією, ніж при застосуванні гематоксиліну та еозину.
Дрібноклітинна остеосаркома характеризується експресією віментину, остеокальцину, може спостерігатися експресія СD57 та СD99. Однак основною ознакою при постановці діагнозу є виявлення в пухлині остеоїду [7, 8, 11, 18, 20, 51].
Дрібноклітинна низькодиференційована синовіальна саркома, як і всі гістологічні типи синовіальних сарком (монофазна веретеноклітинна синовіальна саркома, поліморфноклітинна дедиференційована монофазна синовіальна саркома, епітеліоїдна синовіальна саркома), експресує CK, епітеліальний мембранний антиген (EMA), віментин, колаген ІV типу, частина — СD57 та СD99 [7, 18, 20, 34, 51].
Десмопластична дрібно-круглоклітинна пухлина (ДДККП) — дуже рідкісний вид надзвичайно агресивного новоутворення. Вона складається з компактних осередків дрібних, круглих, базофільних клітин, розмежованих десмопластичною стромою. При цьому співвідношення строми до паренхіми розрізняється від ділянки до ділянки пухлини, тому за дрібною біопсією діагноз встановити дуже важко. Імуногістохімічно ДДККП демонструє дивергентне диференціювання. Зазвичай, клітини цієї пухлини експресують епітеліальні (СК та ЕМА), мезенхімальні (віментин), міогенні (десмін) та нейральні (СD56, NSE) маркери. Крім того, майже всі ці пухлини позитивні до протеїну пухлини Вільямса (WT1) та СD99. Однак на відміну від саркоми Юїнга/ПНЕП, експресія СD99 у ДДККП цитоплазматична, а не мембранна. Десмопластична строма пухлини позитивна на віментин та гладком’язовий актин (SMA) [17, 37, 51].
До пухлин, які складаються з веретеноподібних клітин, перш за все належать новоутворення, що розвиваються з похідних мезенхім. Крім подібності клітин цих новоутворень з клітинами ембріональної сполучної тканини, вони мають і схожі імунофенотипічні риси (табл. 3.).
Таблиця 3. Орієнтовна діагностична панель антитіл, що використовуються для верифікації основних типів веретеноклітинних пухлин м’яких тканин у дітей
| Тип пухлини | Маркери, що використовуються в рутинній діагностиці | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Vimentin | CK | Desmin | SMA | СD57 | СD99 | CD31 | CD34 | Collagen ІV | S-100 | ЕМА | |
| Фібросаркома | +++ | – | – | – | ++ | – | – | – | – | – | – |
| Лейоміосаркома | +++ | – | +++ | +++ | – | + | – | – | +++ | – | – |
| Ангіосаркома | +++ | – | – | – | – | – | +++ | +++ | – | – | – |
| Монофазна веретеноклітинна синовіальна саркома | +++ | +++ | – | – | +++ | ++ | – | – | +++ | + | +++ |
| Злоякісна пухлина оболонки периферичного нервового стовбура | +++ | – | – | – | + | ++ | – | – | +++ | ++ | + |
| Гемангіоперицитома | +++ | – | – | – | – | ++ | – | +++ | – | – | – |
Оцінка частоти експресії маркерів – див. примітку табл. 2.
Фібросаркома (інфантильна фібросаркома) не має специфічного імунопрофілю. Завжди позитивна до віментину, в частині випадків — до SMA. У рідкісних випадках пухлинні клітини експресують CK, десмін, СD34, S-100 протеїн [10, 20, 26, 33, 48, 51].
Клітини лейоміосаркоми, як правило, експресують віментин, десмін, МА, SMA, кальдесмон; у 50% випадків — СD99 та СD57 [22, 25, 51].
Злоякісна пухлина оболонки периферичного нервового стовбура (ЗПОПНС) — веретеноклітинний та епітеліоїдноклітинний тип цієї пухлини мають не тільки гістологічні, але й ІГХ відмінності. Обидва типи експресують віментин, колаген IV типу та СD57. Веретеноклітинні ЗПОПНС мають слабку фокальну експресію S-100 протеїну, а ЗПОПНС з рабдоїдним диференціюванням ще також експресують десмін, міогенін та МіоD1. Епітеліоїдноклітинні ЗПОПНС мають стійку дифузну експресію S-100 протеїну [22, 38, 48, 52].
Ангіосаркоми (веретеноклітинні та епітеліоїдноклітинні) та саркома Капоші експресують CD31, CD34, Fli-1 та фактор фон Вілебранта (фактор VIII зв’язуючий протеїн) [22, 23, 28, 48, 53]. За даними деяких авторів [22, 23], до 25% ангіосарком, особливо епітеліоїдноклітинні, експресують низькомолекулярні СК.
Гемангіоперицитома/солітарна фіброзна пухлина м’яких тканин належить до новоутворень пограничних за своїм потенціалом злоякісності. Їхні клітини зазвичай експресують CD34, CD99 та bcl-2. У частині випадків, особливо в малігнізованих пухлинах, можлива експресія CK [22, 23].
Дерматофібросаркома протуберанс. Для цієї пухлини характерна дифузна позитивна реакція з CD34, в незначній кількості випадків може спостерігатися реакція з гладком’язовим актином та S-100 протеїном [18, 22, 51].
Пухлини, які складаються з епітеліоїдних клітин (частина цих пухлин була описана вище) характеризуються ознаками, притаманними спеціалізованим клітинним елементам сполучної тканини (міофібробласти, епітеліоїдні клітини судин, міоепітеліальні клітини) (табл. 4.).
Таблиця 4. Орієнтовна діагностична панель антитіл, що використовуються для верифікації основних типів епітеліоїдноклітинних пухлин м’яких тканин у дітей
| Тип пухлини | Маркери, що використовуються в рутинній діагностиці | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Vimentin | CK | Desmin | SMA | СD57 | Сaldesmon | Melan-A | CD68 | CD34 | S-100 | ЕМА | ALK | |
| Запальна фібросаркома | +++ | – | ++ | ++ | – | ++ | – | – | – | – | – | ++ |
| Злоякісна фіброзна гістіоцитома | +++ | – | – | – | – | – | – | ++ | – | – | ++ | – |
| PEC-оми | +++ | – | + | ++ | – | – | +++ | – | – | + | – | – |
| Епітеліоїдна саркома | +++ | +++ | – | – | – | – | – | – | ++ | – | + | – |
Оцінка частоти експресії маркерів – див. примітку табл. 2.
Злоякісна запальна міофібробластична пухлина (запальна фібросаркома) демонструє фокальну або дифузну імунореактивність з кальпоніном, SMA та десміном [18, 22, 26, 33], біля 50% випадків характеризується цитоплазматичною реакцією з ALK (70–90% в пухлинах урогенітального тракту) [18], в 30% — реактивна з цитокератинами.
Злоякісна фіброзна гістіоцитома має унікальні ІГХ властивості — у більш ніж 60% випадків її клітини мають коекспресію віментину, EMA та CD68, у деяких випадках спостерігається експресія MA, однак не експресуються міогенін і МіоD1, що дозволяє диференціювати цю пухлину від рабдоміосаркоми [18, 45, 51].
Періваскулярні епітеліоїдноклітинні пухлини (PEC-оми) — це група пухлин, до яких належать: ангіоміоліпома нирок (та інших локалізацій), світлоклітинна «цукрова» пухлина легень, лімфагіолейоміоматоз та ін. Клітини цих пухлин демонструють меланоцитарний імунофенотип (позитивні: мелан-А, НМВ45, тирозиназа) з коекспресією SMA. В частині випадків можлива експресія десміну та S-100 протеїну [18].
Епітеліоїдна саркома. Її клітини коекспресують віментин і СК, у 50% випадків — CD34 за відсутності експресії інших судинних маркерів. Може допомогти в диференційній діагностиці те, що клітини епітеліоїдної саркоми в 90% випадків не експресують білок INI-1, який притаманний частині сарком та карцином (наприклад плоскоклітинній карциномі) [18, 26, 39, 53].
Крім гістогенетичного типування пухлин, принципово важливою задачею ІГХ є визначення ступеня злоякісності пухлини та прогностичних маркерів [7, 13, 15, 40, 49], що дозволяє більш обґрунтовано прогнозувати перебіг хвороби та чутливість пухлини до лікувальних засобів.
В сучасній онкоморфологічній діагностиці надзвичайно важливим є визначення маркерів проліферації, рівень якої значною мірою є відображенням ступеня злоякісної трансформації клітини, та певною мірою «поведінку» пухлин. Серед цих маркерів на першому місці є антиген Кі-67, який експресується в усіх фазах мітотичного циклу. Численними дослідженнями було продемостровано [20], що індекс проліферації у різних пухлинах є незалежним прогностичним фактором, який визначає ймовірність виникнення рецидиву, загальну та безрецидивну виживаність. Крім того, є можливість використовувати цей маркер як показник лікувального патоморфозу [15, 41]. Сьогодні також особливу увагу онкологів привертають до себе фактори, які регулюють проходження клітин по мітотичному циклу, — цикліни, циклін-залежні кінази та їх інгібітори, фактори ангіогенезу, а також визначаються маркери, що можуть претендувати на специфічні при оцінці злоякісної трансформації клітин (високомолекулярні СК, AMACR) [1, 32, 40].
Крім того, існує цілий ряд маркерів, експресія яких пов’язана з прогнозом для лікування та життя хворого. Так, наприклад, при нейробластомі експресія глікопротеїну CD44 пов’язана зі сприятливим прогнозом, а експресія цього ж маркера в бластемному варіанті нефробластоми є несприятливим фактором прогнозу; експресія мутантного гена-супресора р53 є несприятливим фактором прогнозу та лікування при рабдоміосаркомі, саркомі Юїнга/ПНЕП, нейробластомі та багатьох інших пухлинах [22].
Отже, метод ІГХ став необхідним інструментом для вирішення діагностичних питань, що постають перед патологами, й практично удвічі підвищив достовірність гістологічного типування солідних пухлин у дітей. Але, за нашими спостереженнями, у кожному 10–12 випадку визначається імунопрофіль солідної пухлини дитячого віку, що не відповідає типовому. У половині з цих випадків діагноз допомагають встановити FISH-метод, каріотипування, ПЛР. Але незважаючи на досить потужні сучасні діагностичні можливості, невеличка частина пухлин дитячого віку не може бути верифікована за об’єктивними критеріями гістологічних, ІГХ, генетичних досліджень. Для пояснення можливості існування таких випадків слід звернутися до загальних закономірностей онтогенезу та гістогенезу.
Сьогодні загальновизнано, що рак є генетичним захворюванням. Пухлинні клітини виникають завдяки накопиченню мутацій у критичних протоонкогенах і генах-супресорах пухлинного росту. Відповідно до центральної догми молекулярної біології [21], реалізація спадкової інформації відбувається в ланцюгу ДНК→РНК→білок, що реалізується у певний фенотип. Множинні ж зміни у геномі при онкогенезі призводять до порушення багаточисленних внутрішньоклітинних процесів, які накладаються один на одний, що проявляється формуванням нового, «пухлинного» фенотипу з рядом характерних ознак, які й лягли в основу типування пухлин. Слід також зазначити, що генетичні порушення, що призводять до виникнення пухлини, супроводжуються змінами молекулярних сигнальних каскадів, які є певною мірою специфічними для кожної конкретної пухлини та привносять унікальні доповнення до загальних механізмів пухлинного росту [43] та до доповнення/збіднення фенотипу пухлини тими чи іншими ознаками.
Хоча в основі розвитку новоутворень лежать принципово інші генетичні й молекулярні механізми, ніж у нормальному гістогенезі, загальні закономірності для них є подібними. У зв’язку з цим для пояснення багатоманітності гістологічних типів пухлин у дітей вельми ілюстративними є теорії дивергенції Н.Г. Хлопіна [14] та паралелізмів О.О. Заварзіна [4] у гістогенезі. При їх екстраполяції на онкогенез стає зрозумілою різноманітність набуття пухлинами нових й/або втрати ознак вихідної тканини, їх відмінність від вихідних тканин та подібність з пухлинами інших гістогенетичних типів.
Відповідно до теорії дивергентного розвитку Н.Г. Хлопіна, з одного ембріонального зачатка можуть розвиватися декілька тканин (рис. 1.). Беручи до уваги цю загальну тенденцію, можна стверджувати, що з одного тканинного джерела (умовно, відповідно до схеми на рис. 1, гілки 5-го порядку) можуть виникнути декілька різновидів пухлин, що будуть відмінними як за будовою, так і за імунофенотипом.
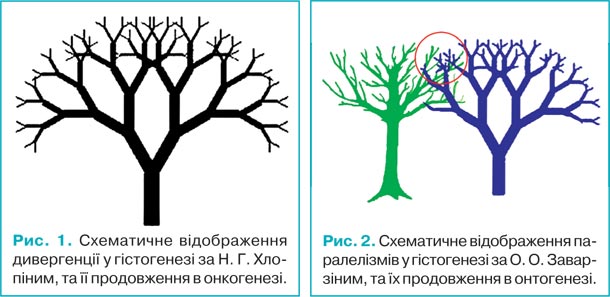
Згідно з теорією паралелізмів О.О. Заварзіна, тканини, які розвиваються з різних ембріональних джерел, але виконують подібні функції набувають і подібної будови (рис. 2). Відповідно, при онкогенезі, який відрізняється від природного гістогенезу значно більшою мінливістю, з різних тканин можуть виникати пухлини, які будуть подібними як за будовою, так і за імунофенотипом (область позначена червоною окружністю на рис. 2).
Отже, виходячи з вищесказаного, пухлини, що розвиваються з одного джерела, можуть різко відрізнятися, а пухлини, які виникають з різних джерел, можуть набувати схожих ознак. Погоджуючись з такими міркуваннями, можна дійти логічного висновку, що для певної частини пухлин неможливо розпізнати їх гістогенетичний тип, і патолог вимушений визначати їх як такі, що не класифікуються. Для пухлин дитячого віку, джерелом яких в значній частині випадків є клітини, які не набули ще остаточних дефінітивних ознак і які, таким чином, не можуть бути передані пухлинним клітинам-нащадкам, якраз і буде доволі часто характерна відсутність чітких відмінностей між різними пухлинами.
На нашу думку, в разі неможливості встановлення у дитини типу пухлини за об’єктивними критеріями, за умов впевненості у відсутності технологічних помилок слід її визначати як таку, що не підлягає класифікації. У цьому випадку доцільно проводити виявлення в пухлині низки неспецифічних прогностичних маркерів, які дадуть підстави для персоналізації лікування та підвищення його ефективності.
Таким чином, рутинне гістологічне дослідження новоутворень у дітей у значній частині випадків не є достатньо доказовим при визначенні гістогенетичного типу пухлини. Враховуючи це, ІГХ стає абсолютно необхідною для типування пухлин дитячого віку, які однозначно не були верифіковані при рутинній мікроскопії. Крім того, доцільно підтверджувати імуногістохімічно тип пухлин, який не викликав принципових сумнівів при вивченні препаратів, забарвлених гематоксиліном і еозином. Слід враховувати, що гістогенетичне типування солідних пухлин у дітей у деяких випадках не може бути вирішене імуногістохімічними методами. У такій ситуації реальну допомогу надають дослідження геному пухлинних клітин та інші молекулярно-генетичні методи. Але незважаючи на можливості всіх технологій сучасної верифікації пухлин, окремі з них сьогодні ще не можуть бути типовані внаслідок радикальної трансформації їх фенотипу в процесі онтогенезу. Для таких пухлин доцільно визначати ознаки, які навіть за відсутності встановленого гістологічного типу, можуть виступати факторами прогнозу як розвитку захворювання, так і чутливості новоутворення до лікування.
Література
1. Алиев М.Д., Мехтиева Н.И., Бохян Б.Ю. (2005) Факторы прогноза сарком мягких тканей. Вопр. Онкологии, 51(3): 288–299.
2. Буланов Д.В. (2008) Мелкокруглоклеточные опухоли костей и мягких тканей (Саркома Юинга/PNET), основные критерии морфологической и дифференциальной диагностики. Актуальные проблемы костной патологии у детей и взрослых: Материалы научно-практической конференции с международным участием ФГУ «Центральный научно-исследовательский институт травматологии и ортопедии им. Приорова Росмедтехнологий». М.: 48–50.
3. Афанасьев Б.В., Балдуева И.А., Белогурова М.Б. и др. (2002) Детская онкология. Руководство для врачей. Под ред. М.Б. Белогуровой. СПб.: Спец. Лит.: 351.
4. Заварзин А.А. (1941) Очерки эволюционной гистологии нервной системы. М.-Л.: Медгиз: 376.
5. Ивановская Т.Е., Гусман Б.С. (1988) Патологическая анатомия болезней плода и ребенка. М.: Медицина: 298.
6. Ланцковский Ф. (2005) Детская гематология и онкология (Пер. с англ. С.Шершаков). М.: Лори: 764.
7. Мацко Д.Е. (2010) Саркомы костей: классификация, гистологическое строение, особенности морфологической диагностики. Практическая онкология: 11(1): 184–187.
8. Нейштадт Э.Л., Маркочев А.Б. (2007) Опухоли и опухолеподобные заболевания костей. СПб.: Фолиант: 344.
9. Пальцев М.А., Аничков Н.М. (2005) Атлас патологии опухолей человека. М.: Медицина: 424.
10. Руководство по иммуногистохимической диагностике опухолей человека. (2004) Под ред. С.В. Петрова и Н.Т. Райхлина Казань: Титул: 452.
11. Рушковский С.Р., Афанасьева Е.С., Безруков В.Ф.и др. (2005) Молекулярные и цитогенетические маркеры солидных опухолей у детей. Онкология, 7(4): 33–24.
12. Скляренко Л.М., Глузман Д.Ф., Надгорная В.А. и др. (2005) Иммуноцитохимическая диагностика сарком из малых округлых клеток. Онкология, 7(4): 45–47.
13. TNM Классификация злокачественных опухолей. (2003) Шестое издание. Под. ред. Н.Н. Блинова. М.: ЭСКУЛАП: 243.
14. Хлопин Н.Г. (1964) Общебиологические и экспериментальные основы гистологии. М., Л.: Издательство АН СССР: 468.
15. Франк Г.А. (2004) Проблемы морфологической классификации и диагностики опухолей мягких тканей. Практическая онкология: 5(4): 23–26.
16. Ambros I.M., Attarbaschi A., Rumpler S. et al. (2001) Neuroblastoma cells provoke Schwann cell proliferation in vitro. Med Pediatr Oncol.: 36: 163–168.
17. Barnoud R., Sabourin J.C., Pasquier D. et al. (2000) Immunohistochemical expression of WT1 by desmoplastic small round cell tumor: a comparative study with other small round cell tumors. Am. J. Surg. Pathol.: 24: 830–836.
18. Bone and soft tissue pathology. (2010) Edited by A. L. Folpe, C. Y. Inwards 1st ed. New York: Ch. Livingstone: 462.
19. Bown N. (2001) Neuroblastoma tumour genetics: clinical and biological aspects. J. Clin Pathol.: 54(12): 897–910.
20. Coindre J.M. (2003) Immunohistochemistry in the diagnosis of soft tissue tumors. Histopathology: 43: 1–16.
21. Crick F. (1970) Central dogma of molecular biologia. Nature: 227: 561–563.
22. Dabbs D.J. (2010) Diagnostic Immunohistochemistry. 3 ed.New York: Ch. Livingstone: 941.
23. Deyrup A.T., Tighiouart M., Montag A.G. et al. (2008) Epithelioid hemangioendothelioma of soft tissue: a proposal for risk stratification based on 49 cases. Am. J. Surg. Pathol.: 32: 924–927.
24. Dias P., Chen B., Dilday B. et al. (2000) Strong immunostaining for myogenin in rhabdomyosarcoma is significantly associated with tumors of the alveolar subclass. Am. J. Pathol.: 156: 399–408.
25. Farshid G., Pradhan M., Goldblum J. et al. (2002) Leiomyosarcoma of somatic soft tissues: A tumor of vascular origin with multivariate analysis of outcome in 42 cases. Am. J. Surg. Pathol.: 26: 14–24.
26. Ferrari A., Casanova M., Bisogno G. et al. (2002) Clear cell sarcoma of tendons and aponeuroses in pediatric patients: a report from the Italian and German Soft Tissue Sarcoma Cooperative Group. Cancer: 94: 3269–3276.
27. Folpe A.L. (2002) MyoD1 and Myogenin expression in human neoplasia: A review and update. Adv. Anat. Pathol.: 9: 198–203.
28. Folpe A.L., Chand E.M., Goldblum J.R. et al. (2001) Expression of Fli-1, a nuclear transcription factor, distinguishes vascular neoplasms from potential mimics. Am. J. Surg. Pathol. 25: 1061–1066.
29. Folpe A.L., Deyrup A.T. (2006) Alveolar soft-part sarcoma: a review and update. J. Clin. Pathol.: 59: 1127–1132.
30. Folpe A.L., Goldblum J.R., Rubin B.P. et al. (2005) Morphologic and immunophenotypic diversity in Ewing family tumors. A study of 66 genetically confirmed cases. Am. J. Surg. Pathol.: 29: 1025–1033.
31. Furlong M.A., Fanburg-Smith J. (2001) Pleomorphic rhabdomyosarcoma in children: Four cases in the pediatric age group. Ann. Diagn. Pathol.: 5: 199–206.
32. Gordana J., Srđana Č., Jasminka S. et al. (2009) Vascular endothelial growth factor in children with neuroblastoma: a retrospective analysis. Journal of Experimental & Clinical Cancer Research: 28: 143.
33. Guillou L., Benhattar J., Gengler C. et al. (2007) Translocation-positive lowgradefibromyxoid sarcoma: Clinicopathologic and molecular analysis of a series expanding the morphologic spectrum and suggesting potential relationship to sclerosing epithelioid fibrosarcoma: A study from the French Sarcoma Group. Am. J. Surg. Pathol.: 31: 1387–1402.
34. Guillou L., Wadden C., Kraus M.D. et al. (1996) S-100 protein reactivity in synovial sarcomas: a potentially frequent diagnostic pitfall. Immunohistochemical analysis of 100 cases. Applied Immunohistochemistry: 4: 167–175.
35. Shimada H., Nakagawa A. (2006) Pathology of the Peripheral Neuroblastic Tumors. Laboratory Medicine: 37(11): 684–689.
36. Hoshi M., Otagiri N., Shiwaku H.O. et al. (2000) Detailed deletion mapping of chromosome band 14q32 in human neuroblastoma defines a 1.1-Mb region of common allelic loss. Brit. J. Cancer: 82 (11): 1801–7.
37. Lae M.E., Roche P.C., Jin L. et al. (2002) Desmoplastic small round cell tumor: a clinicopathologic, immunohistochemical, and molecular study of 32 tumors. Am. J. Surg. Pathol.: 26(7): 823–35.
38. Laskin W.B., Fetsch J.F., Lasota J. et al. (2005) Benign epithelioid peripheral nerve sheath tumors of the soft tissues: clinicopathologic spectrum of 33 cases. Am. J. Surg. Pathol.: 29: 39–51.
39. Laskin W.B., Miettinen M. (2003) Epithelioid sarcoma: new insights based on an extended immunohistochemical analysis. Arch. Pathol. Lab. Med.: 127: 1161–1168.
40. Malone V.S., Dobin Sh.M., Jones K.A., Donner L.R. (2010) CD99-positive large cell neuroendocrine carcinoma with rearranged EWSR1 gene in an infant: a case of prognostically favorable tumor. Virchows Arch.: 457: 389–395.
41. Mejia C., Navarro S., Pellin A. et al. (2003) Prognostic significance of cell proliferation in human neuroblastoma: comparison with other prognostic factors. Oncol. Rep.: 10: 243–247.
42. Pediatric Bone and Soft Tissue Sarcomas. (2006) Alberto Pappo (Ed.); Berlin Heidelberg: Springer-Verlag: 255.
43. Petricoin E.F., Bichesel V.E., Calvert V.S. et al. (2005) Mapping molecular networks using proteomics: a vision for patient-tailored combination therapy. Biochim. Biophys. Acta.: 23: 3614–3621.
44. Peuchmaur M., d’Amore E.S.G., Joshi V.V. et al. (2003) Revision of International Neuroblastoma Pathology Classification: Confirmation of favorable and unfavorable prognostic subsets in ganglioneuroblastoma, nodular. Cancer: 98: 2274–2281.
45. Randall R.L., Albritton K.H., Ferney B.J., Layfield L. (2004) Malignant fibrous histiocytoma of soft tissue: an abandoned diagnosis. Am. J. Orthop. (Belle Mead NJ): 33(12): 602–608.
46. Rossi S., Orvieto E., Furlanetto A. et al. (2004) Utility of the immunohistochemical detection of FLI-1 expression in round cell and vascular neoplasm using a monoclonal antibody. Mod. Pathol.: 17: 547–552.
47. Sebire N.J., Malone М. (2003) Myogenin and MyoD1 expression in paediatric rhabdomyosarcomas. J. Clin. Pathol.: 56: 412–416.
48. Spunt S.L., Skapek S.X., Coffin C.M. (2008) Pediatric nonrhabdomyosarcoma soft tissue sarcomas. Oncologist: 13(6): 668–78.
49. Sobin L.H., Compton С.C. (2010) TNM seventh edition: What’s new, what’s changed. Cancer: 116(22): 5336–5339.
50. Variend S., Burchill S.A. (2003) Neuroblastoma. Mol. Biol. Pathol. Paediatr. Cancer: 161–3.
51. WHO Classification of Tumours. Pathology and Genetics of Tumours of Soft Tissue and Bone. (2002) Eds. Ch.D.M. Fletcher, R.R. Unni, F. Mertens. Lyon: IARC Press: 367.
52. Woodruff J.M., Scheithauer B.W., Kurtkaya-Yapicier O. et al. (2003) Congenital and childhood plexiform (multinodular) cellular schwannoma: a troublesome mimic of malignant peripheral nerve sheath tumor. Am. J. Surg. Pathol.: 27: 1321–1329.
53. Zhong Gu, Lan Fang Tang, Zhi Min Chen et al. (2008) Childhood undifferentiated embryonal liver sarcoma: clinical features and immunohistochemistry analysis. Journal of Pediatric Surgery: 43: 1912–1919.
Возможности и сложности типирования солидных опухолей у детей
Национальный институт рака, Киев
Резюме. Рутинное гистологическое исследование новообразований у детей в значительной части случаев не является достаточно доказательным при определении их гистогенетического типа. В связи с этим иммуногистохимия является абсолютно необходимой для типирования опухолей детского возраста, которые не были однозначно верифицированы микроскопически. Кроме того, целесообразно иммуногистохимически подтверждать тип опухолей, который не вызвал принципиальных сомнений при изучении рутинно окрашенных препаратов. Следует учитывать, что гистогенетическое типирование солидных опухолей у детей в незначительном числе случаев не может быть осуществлено и иммуногистохимии. В такой ситуации реальную помощь оказывают исследования генома и другие молекулярно-генетические методы. Но сегодня некоторые опухоли еще не могут быть типированы вследствие радикального изменения их фенотипа в процессе онтогенеза. Для таких опухолей имеет смысл определять признаки, которые даже при отсутствии установленного гистологического типа могут являться факторами прогноза как развития заболевания, так и чувствительности к лечению.
опухоли детского возраста, гистологическое типирование, иммуногистохимия.














Leave a comment