Як покращити діагностику та лікування пацієнтів з раком передміхурової залози в Україні? Результати опитування 2023 р.
Резюме. Останніми роками можливості діагностики та лікування пацієнтів з раком передміхурової залози (РПЗ) в Україні значно розширилися. Зокрема, протягом 4–5 років значно покращилося забезпечення ліками за суспільний кошт (безкоштовно для пацієнтів). Про ці та інші тенденції останніх років йдеться в дослідженні за матеріалами опитувань експертів «Рак передміхурової залози в Україні», що проведено компанією «Medical Data Management» (MDM) влітку-восени 2023 р. Як зазначено у висновках, для покращення результатів та прогнозу пацієнтів необхідно фокусувати зусилля на більш ранній діагностиці захворювання, розширити використання позитронно-емісійної томографії (ПЕТ)/комп’ютерної томографії (КТ) з визначенням розподілення простат-специфічного мембранного антигену (ПСМА), фьюжн-біопсії, розширити державну підтримку забезпечення доступності основних препаратів для лікування РПЗ. Детальні висновки та рекомендації сформовано на основі аналізу глибинних інтерв’ю з профільними лікарями (7 — з онкологами, урологами та 3 — ключовими експертами), пацієнтами (9) та даними з медичної літератури.
DOI: 10.32471/clinicaloncology.2663-466X.52-4.31546
Актуальність проблеми, динаміка захворюваності та смертності
З 2005 р. кількість виявлених випадків РПЗ в Україні щорічно збільшувалася, досягнувши піку у 2012 та 2019 рр., що свідчить про підвищення рівня діагностування захворювання [1, 2]. При цьому РПЗ став частіше вражати пацієнтів більш молодого віку (до 65 років). За словами лікарів, є випадки діагностування хвороби і у більш ранньому віці (40+ років), причому часто — досить «агресивного», швидкопрогресуючого раку, переважно зі спадковою схильністю.
З 2006 р. (коли зафіксовано піковий показник 51,7%) спостерігається поступове зменшення частки пацієнтів, які помирають від РПЗ, і у 2021 р. співвідношення смертності від РПЗ до відповідної захворюваності становило 39,4%. Однак цей показник усе одно вищий, ніж у більшості розвинених країн (Європи та США). Так, в Україні наразі помирає більше третини всіх пацієнтів з діагностованим РПЗ, коли в інших країнах при вищому рівні захворюваності — від 13 до 23% пацієнтів (табл. 1).
| Країна | Середня очікувана тривалість життя чоловіків, років | Захворюваність (на 100 тис. населення), грубий показник | Смертність (на 100 тис. населення), грубий показник | Співвідношення смертність/захворюваність (%) |
| Франція | 79 | 209 | 29 | 13,7 |
| США | 74 | 127 | 20 | 15,5% |
| Іспанія | 80 | 151 | 25 | 16,8% |
| Італія | 81 | 132 | 23 | 17,6% |
| Німеччина | 79 | 165 | 38 | 22,8% |
| Великобританія | 79 | 194 | 45 | 23,2% |
| Туреччина | 73 | 44 | 12 | 28,1% |
Отже, хоча Україна і має відносно низький рівень захворюваності на РПЗ, смертність від цього захворювання є високою. Таке співвідношення свідчить про необхідність додаткових заходів з лікування та діагностики.
На жаль, недостатній рівень «онконастороги» в медичному суспільстві нерідко призводить до помилкового та пізнього встановлення діагнозу із гіршим прогнозом. За словами опитаних спеціалістів, сімейні лікарі, особливо в невеликих містах, часто нехтують рекомендацією призначати усім чоловікам віком старше 50 років тест на простат-специфічний антиген (ПСА). Онкоурологи вважають, що досить значна частина відповідальності за те, що пацієнти приходять до них уже з IV стадією, лежить саме на лікарях первинної ланки. Пацієнти ж більше скаржилися на неуважність та байдужість урологів, до яких вони зверталися.
Як зазначено робочою групою в нещодавно затвердженій вітчизняній тематичній настанові: «Діагностично-лікувальна допомога хворим на РПЗ у 2021 р. характеризується високим рівнем занедбаності (31,7%) і летальності до року (15,4%). Також виявлено, що у 12,3% хворих стадія не визначена, а у Волинській, Закарпатській, Запорізькій, Київській, Луганській, Одеській, Рівенській, Харківській областях та м. Київ таких випадків зафіксовано 13,0–42,0%, тобто критерії призначення терапії таким хворим залишаються невідомими» [3].
Проблеми діагностики
Згідно з дослідженням «Індекс здоров’я України» чоловіки майже удвічі рідше звертаються до уролога з метою профілактики, ніж жінки до гінеколога. Особливо чоловіки вікової групи 60+, які переважають серед пацієнтів з РПЗ, рідко відвідують уролога з профілактичною метою [4]. Статистичні дані також дозволяють оцінити негативний вплив пандемії COVID-19. Так, до її початку у 2020 р. лікарі виявляли РПЗ на профілактичних оглядах у 17–20% від загальної кількості нововиявлених пацієнтів, а після початку — у 13% пацієнтів [1].
У середньому діагноз «РПЗ» опитані пацієнти отримували через 3 міс після первинного звернення, переважно на III–IV стадії. Лише один — через декілька років, після тривалого лікування препаратом пальми повзучої — Serenoa repens.
Основними етапами діагностики РПЗ є тест ПСА, ректальне мануальне дослідження, трансректальна ультразвукова діагностика (УЗД), магнітно-резонансна томографія (МРТ), КТ та біопсія [3, 5] (рис. 1). Більшість лікарів віддають перевагу МРТ перед КТ, адже вважають її більш інформативним методом. Проте КТ вважають більш доступною для пацієнтів. Серед факторів, які негативно впливають на рівень діагностики, лікарі виділяли високу вартість нових методів. Також вони скаржилися на те, що у висновках з гістологічних лабораторій трапляється занижений показник Глісона.
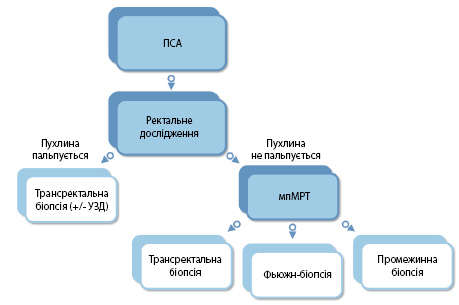
Згідно з результатами опитування, більшість лікарів поінформована щодо дослідження ПЕТ/КТ з визначенням розподілення простат-специфічного мембранного антигену (ПСМА). Цей метод перебуває на етапі впровадження в Україні і поки доступний лише в окремих клініках. У коментарі робочої групи уточняється, що це стосується ПЕТ/КТ ПСМА з маркуванням 18F. Водночас аналогічне дослідження з маркуванням 68Ga на території України наразі й в найближчій перспективі недоступно [3]. Проте й показання для проведення саме такого дослідження досить обмежені. Так, ПЕТ/КТ з ПСМА використовують за відсутності впевненості, що віддалене метастазування пов’язане з передміхуровою залозою, та при підозрі на рецидив [7]. У вітчизняній настанові встановлено: «ПЕТ/КТ з ПСМА є більш точним для визначення стадії, ніж КТ та сканування кісток при захворюванні високого ризику, але на сьогодні немає даних про результати для інформування про подальший контроль ведення пацієнтів» (рівень доказів 1b) [3].
Також, за словами опитаних спеціалістів, сучасним і ефективним методом діагностики є фьюжн (fusion) біопсія, що виконують за допомогою синтезу даних УЗД та МРТ-діагностики. Проте наразі в Україні цей метод використовують рідко через високу вартість обладнання і невелику кількість спеціалістів. Новітній метод дозволяє виявляти пухлини малих розмірів, наприклад, до 6 мм. За даними медичної літератури, поєднання (fusion) УЗД із МРТ зменшує ризик отримання хибно-позитивних результатів біопсії, дозволяючи точно спрямовуватися на клінічно значущі ураження, картувати їх та спостерігати за змінами при оцінці динаміки процесу та ефективності лікування [7].
Рекомендації
- Розширити використання в Україні ПЕТ/КТ з ПСМА шляхом включення цього методу діагностики до Програми медичних гарантій. Це зробить наведений метод доступним для пацієнтів та істотно підвищить якість діагностики.
- Розробити та впровадити програму навчання для лікарів щодо використання фьюжн-біопсії. Залучити кошти на закупівлю та підготовку обладнання для більш широкого використання цього методу.
- Сформувати єдині критерії серед патоморфологів щодо визначення балів за Глісоном для уникнення ситуації із заниженими показниками.
- Опитані онкоурологи пропонують ввести обов’язковий безкоштовний скринінг серед чоловіків старше 45–50 років. Лікарі вважають, що обов’язковий тест на ПСА раз на пів року та УЗД серед чоловіків, що входять у групу ризику, можуть істотно підвищити вірогідність виявлення хвороби на ранній стадії, коли її легше контролювати та лікувати. За основу пропонують взяти досвід країн Європи та США.
- Також лікарі, розуміючи проблему низької обізнаності щодо РПЗ серед лікарів інших спеціальностей, вважають, що про РПЗ потрібно постійно нагадувати. Першочергово тим, хто працює з пацієнтами старшого віку.
Алгоритми лікування
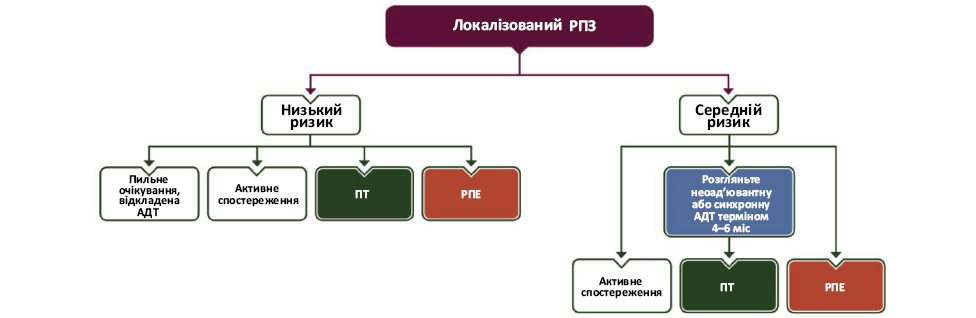
Стандарти та рекомендації щодо лікування локалізованого чи місцево-поширеного РПЗ враховують індивідуальну оцінку ризику та очікуваної тривалості життя [3, 5, 8, 9]. Алгоритми включають спостережливе очікування (Watchful waiting), різні методи активного спостереження (Active surveillance), променеву терапію (ПТ), радикальну простатектомію (РП) та АДТ (рис. 2). «Основна ідея полягає в тому, що для всіх захворювань з проміжним ризиком коротка тривалість АДТ близько 6 міс є оптимальною, тоді як довший період, близько 3 років, необхідний для пацієнтів високого ризику згідно з визначенням Національної мережі багатопрофільних онкологічних закладів США (National Comprehensive Cancer Network — NCCN)», — зазначено у вітчизняній настанові [3, 8].
Андрогенної депривації можна досягти шляхом пригнічення секреції тестикулярних андрогенів різними способами, зокрема двосторонньою орхіектомією або субкапсулярною енуклеацією (хірургічною кастрацією). Сучасні фармакотерапевтичні заходи, що використовують з аналогічною метою, також включають [3, 8, 9]:
- аналоги гонадотропін-рилізинг-гормону (ГРГ) (гозерелін, лейпрорелін, трипторелін);
- аналоги ГРГ у комбінації з антиандрогенами 1-го покоління (бікалутамід, флютамід і нілутамід (останній не зареєстрований в Україні станом на 18.12.2023 р.), зазвичай протягом 4 тиж, щоб запобігти підвищенню рівня тестостерону та загостренню симптомів на початку терапії;
- антагоністи ГРГ (дегарелікс або релуголікс);
- абіратерону ацетат — інгібітор CYP 17 (поєднання інгібіторів 17-гідролази та 17,20-ліази), забезпечує інгібування перетворення екстрагонадних стероїдів-попередників на тестостерон і дигідротестостерон (ДГТ);
- антиандрогени наступного покоління (апалутамід, ензалутамід та даролутамід).
Останні дві категорії засобів позначають як спрямовані (таргетні) щодо андрогенних рецепторів (androgen receptor targeted agents — ARTA) [3].
Традиційно АДТ вважають наріжним каменем лікування РПЗ, оскільки ріст та розвиток клітин залози, зокрема злоякісних, є гормонозалежним. Показання до різних стратегій АДТ залежать від того, чи наявне прогресування РПЗ лише у вигляді підвищення рівня ПСА чи метастазів, виявлених за допомогою традиційної візуалізації (відповідно неметастатичний та метастатичний типи) (табл. 2) [10]. При цьому монотерапію АДТ не слід пропонувати чоловікам із безсимптомним перебігом, які не можуть отримати місцеве лікування [3].
| Стадія процесу | Особливості | Стратегія лікування |
| Локальний РПЗ | Неоад’ювантна АДТ + радикальна ПТ + ад’ювантна АДТ + неоад’ювантний доцетаксел
РП + тазова лімфаденектомія |
|
| нмКРРПЗ | Високий ризик | АДТ + апалутамід або даролутамід або ензалутамід |
| Метастатичний РПЗ | Гормонозалежний | АДТ + абіратерон або доцетаксел або ензалутамід або апалутамід
ПТ при невеликому об’ємі Тільки АДТ, якщо симптоми занадто мало виражені. Засоби, що покращують мінералізацію |
| Резистентний до кастрації (1-ша лінія) | Абіратерон
Доцетаксел Ензалутамід 223Ra при непереносимості вищезазначених ліків |
|
| 2-га лінія або після доцетакселу | Абіратерон
Кабазітаксел Ензалутамід 223Ra |
Примітки. РПЕ — радикальна простатектомія.
Пацієнти, які отримують АДТ, досягають кастраційних рівнів (<50 нг/дл) циркулюючого тестостерону, зменшення пухлинного тягаря, покращення рівня виживаності та зменшення вираженості симптомів. За словами опитаних лікарів, при кастраційно чутливому раку простати пацієнти, як правило, мають сприятливий прогноз і після лікування можуть повернутися до нормального життя. Звісно, за умови, що вони будуть вчасно відвідувати лікаря та виконувати його рекомендації.
Неметастатичний кастраційно-резистентний РПЗ
Однак біологія росту пухлини є такою, що згодом у пацієнтів з РПЗ, які отримують АДТ, розвивається кастраційна резистентність. Від цього клінічного фенотипу — неметастатичного кастраційно-резистентного РПЗ (нмКРРПЗ) у більшості пацієнтів зафіксовано летальний наслідок, ця патологія є точкою прикладання інтенсивних зусиль з розробки ліків [10, 11].
Біофізіологічна причина цього феномену пов’язана із генетичною модифікацією метастатичних пухлин із реалізацію ферментативного шляху синтезу андрогенів у концентраціях, здатних активувати ARTA і підтримувати виживаність пухлинних клітин [12].
Встановлення діагнозу «нмКРРПЗ» має відповідати таким критеріям [13]:
- кастраційний рівень тестостерону (<50 нг/дл, або <1,7 нмоль/л);
- біохімічне прогресування (рівень ПСА >2 нг /мл, підвищення в 3 рази поспіль з різницею в 1 тиж або 2 рази на 50% від надиру — найнижчого із досягнутих значень);
- відсутність даних про наявність метастазів при стандартній променевій діагностиці.
Розуміння цього клінічного стану може змінюватися, оскільки більш чутливі методи візуалізації, такі як молекулярно-спрямована ПЕТ і дифузійно-зважена МРТ усього тіла, стають широко доступними в клінічній практиці та допомагають діагностувати метастази, які раніше не виявляли [10]. Незважаючи на це, пацієнтів з нмКРРПЗ визнають окремою популяцією з використанням для залучення їх у дослідження такого показника, як час подвоєння ПСА.
Проте згідно з результатами опитування тільки 2 з 10 онкологів використовують онлайн-калькулятори/програми для підрахунку рівня подвоєння ПСА, зокрема, Memorial Sloan Kettering PSA Doubling Time. Для більшості з них достатньо просто подивитися на результати аналізів без додаткових розрахунків: «Які ще калькулятори? Пацієнт здає кров з вени, дає мені результат, легко розрахувати час подвоєння» (ГІ1 Харків). Лише деякі лікарі вважають, що показнику «подвоєння ПСА» приділяється занадто мало уваги, що призводить до негативних наслідків для пацієнта.
Більше того, в Україні лікарі взагалі часто не зважають на стадію нмКРРПЗ. Про це йшлося в оглядовій статті з висловлюваннями експертів дворічної давнини [7]. Зокрема, зафіксовано, що онкологи й онкоурологи у своїй клінічній практиці не приділяють нмКРРПЗ належної уваги. І хоча вчасно й адекватно відкоригована терапія може відтермінувати розвиток метастазів, лікарі продовжують використовувати АДТ 1-ї лінії, незважаючи на фактори високого ризику.
Наразі під час опитування лікарі зазначили, що останнім часом тривалість життя пацієнтів з нмКРРПЗ стала довшою. Якщо раніше такі пацієнти жили в середньому 11–12 міс, то зараз тривалість уже вимірюється роками. Спеціалісти пов’язують це з тим, що зараз набагато раніше визначають резистентність і відразу починають терапію антиандрогенами 2-го покоління (в Україні ензалутамід зареєстровано у 2020 р.).
Ці нові засоби є нестероїдними антиандрогенами з вищою спорідненістю до ARTA, ніж бікалутамід. У той час як попередні нестероїдні антиандрогени все ще дозволяють переносити ARTA до ядра і діють як часткові агоністи, усі 3 засоби також блокують перенесення ARTA і, отже, пригнічують будь-яку можливу агоністоподібну активність [14–15].
Основним антиандрогеном нового покоління в Україні є ензалутамід, оскільки він має державну реєстрацію. Деякі зі спеціалістів також чули про апалутамід та даролутамід, зокрема, бачили результати досліджень з цими андрогенами. Лікарі висловлювали зацікавленість у них, але досвіду роботи з ними майже ні в кого з опитаних осіб немає. Ті, що застосовують ензалутамід, загалом задоволені його ефективністю, але скаржаться на його високу ціну, яка є важким фінансовим тягарем для пацієнтів (особливо тих, що приймають його роками).
Ензалутамід
Більшість з опитаних спеціалістів мають досвід роботи з ензалутамідом. На їхню думку, це — ефективний новітній антиандроген, який працює там, де інші (наприклад бікалутамід) уже неефективні. Також серед переваг ензалутаміду, порівняно з абіратероном, називали те, що його не потрібно комбінувати з преднізолоном. Опитані лікарі відмічали добру переносимість і високий рівень виживаності пацієнтів, які приймають ензалутамід. За їхніми словами, жоден з антиандрогенів не давав настільки високий показник тривалості життя пацієнтів (особливо тих, хто має кастраційно-резистентний РПЗ).
Основним недоліком ензалутаміду, за словами лікарів, є його ціна. На їхню думку, ситуацію потрібно виправляти, адже в більшості європейських країн ензалутамід надається за державний кошт, тобто безкоштовно для пацієнтів. Опитані лікарі не розуміють, чому в Україні досі немає закупівлі цього препарату.
Апалутамід
Більшість опитаних лікарів тільки чули про апалутамід, але не мають досвіду роботи з ним. Основною причиною цього є те, що цей антиандроген не має реєстрації в Україні, і тому лікарі можуть працювати з ним, тільки якщо пацієнт сам придбає його за кордоном і привезе. На думку лікарів, поява апалутаміду в Україні розширила б їх арсенал боротьби із хворобою, адже є непоодинокі випадки того, що у лікарів вичерпуються усі можливості для лікування та підтримки пацієнта з РПЗ.
Даролутамід
Даролутамід, як і апалутамід, не має реєстрації в Україні, тому опитані лікарі, в основному, не мають досвіду роботи з цим антиандрогеном. Лікарі не орієнтуються в тому, чим даролутамід відрізняється від апалутаміду, адже чули про нього тільки на конференціях і не дуже цікавилися відмінностями, бо все одно не мають можливості його призначати. Вони вважають, що поява цього антиандрогену (як і апалутаміду) може розширити їх можливості щодо лікування пацієнтів, резистентних до терапії.
Готовність пацієнтів сплачувати за лікування
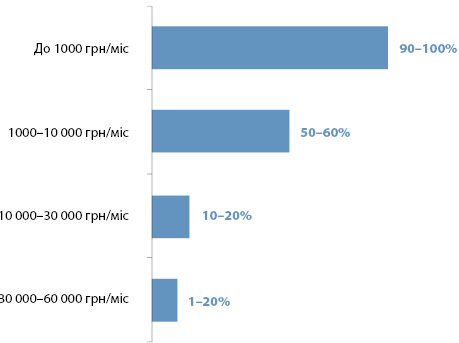
На думку лікарів, майже всі пацієнти з РПЗ готові платити за лікування 1000 грн на міс, тоді як суми, більші за 30 000 грн, можуть собі дозволити лише одиниці (рис. 3).
Звісно, у разі повної відсутності у пацієнта можливості оплачувати терапію, лікарі намагаються використовувати альтернативні, більш доступні варіанти:
- хірургічну кастрацію замість антагоністів ЛГРГ;
- доцектаксел замість абіратерону (якщо він недоступний за державний кошт);
- ПТ замість антиандрогенів 2-го покоління;
- естрогенотерапію замість антиандрогенів 2-го покоління.
Ситуацію могли б покращити державні закупівлі антиандрогенів 2-го покоління. Опитані спеціалісти розуміють, що вартість таких препаратів є досить високою, проте є декілька факторів, що дещо зменшать негативний економічний вплив від введення цих препаратів у державні закупівлі:
1. Пацієнтів, які потребують такі препарати, відносно небагато (близько 5% від усіх), тому препарати мають закуповуватися в невеликій кількості;
2. На сьогодні пацієнти навіть з метастатичною формою КРРПЗ при адекватній терапії живуть довше 5 років, причому досить повноцінним і активним життям, що, зі свого боку, означає сплату податків і створення нового валового внутрішнього продукту (ВВП) для країни [16].
Головні висновки
- В Україні наразі спостерігається дуже рідка діагностика пацієнтів з І стадією РПЗ. У структурі захворюваності частка пацієнтів з цією стадією становить <1%. Пацієнти можуть досить довго знаходитися на активному спостереженні, але в разі прогресування хвороби вчасно отримують допомогу. Це зекономить суспільні кошти, з одного боку, та покращить прогноз хворих, з другого. Метод активного спостереження пацієнтів з РПЗ в Україні майже не використовується. Частково це пов’язано з відсутністю відповідних пацієнтів.
- В Європі серед пацієнтів з РПЗ майже половина має IV стадію (48%), адже якісна та доступна терапія суттєво подовжує тривалість та підвищує якість життя пацієнтів. В Україні ж таких пацієнтів — третина, і арсенал для їх лікування досить обмежений, особливо при розвитку резистентності до гормональної терапії.
- Якщо у пацієнта розвивається резистентність, опитані лікарі в Україні починають підвищувати дозування антиандрогенів (як правило це бікалутамід) або замінювати їх на абіратерон і далі на ензалутамід. Також широко призначаємою є хіміотерапія.
Підсумкові рекомендації
- Фокусувати зусилля на більш ранній діагностиці захворювання.
- Проводити інформаційні кампанії серед чоловіків віком 40+ про особливості та небезпеку РПЗ. Мотивувати чоловіків самостійно приходити на профілактичні огляди до уролога та регулярно здавати тест на рівень ПСА. Сприяти впровадженню системи обов’язкових медичних оглядів, впровадити національні скринінгові програми для всіх чоловіків віком >50 років.
- Організовувати семінари та освітні заходи серед сімейних лікарів та урологів (особливо у невеликих містах). Треба постійно нагадувати лікарям алгоритм діагностики РПЗ.
- Додати діагностику РПЗ до Програми медичних гарантій за аналогією з мамографією.
- Проводити навчання серед лікарів стосовно застосування схем терапії при кастраційно-резистентних та метастатичних формах раку. Звертати увагу лікарів на правильне призначення антиандрогенів попередніх поколінь, особливо бікалутаміду.
- Включити антиандрогени 2-го покоління до державних закупівель та розглянути можливість надання подальших реєстрацій.
- Продовжувати державну підтримку забезпечення доступності основних препаратів для лікування РПЗ.
- Забезпечити інформування пацієнтів щодо доступних варіантів лікування та можливостей часткової або повної компенсації вартості препаратів.
Загалом опитані лікарі мають оптимістичний погляд на майбутнє. Вони впевнені, що найближчими роками терапія РПЗ в Україні буде покращуватися, адже вже зараз вони бачать позивні тенденції в боротьбі з РПЗ: набувають затребуваності нові методи діагностики (фьюжн-біопсія, ПЕТ/КТ), є можливість проводити робот-асистовані операції, брахітерапію тощо. На думку спеціалістів, державні закупівлі також будуть вдосконалюватися, додаватимуть нові препарати і можливості для ефективного лікування пацієнтів з будь-якою формою РПЗ.
список Використаної літератури
1. Федоренко, З. П., Сумкіна, О. В., Зуб, В. О., Горох, Є. Л., & Гулак, Л. О. (2023). Державне некомерційне підприємство «Національний інститут раку». Рак в Україні. Бюлетень Національного канцер-реєстру України, 24. http://www.ncru.inf.ua/publications/BULL_24/index.htm.
2. Wang, L., Lu, B., He, M., Wang, Y., Wang, Z., & Du, L. (2022) Prostate Cancer Incidence and Mortality: Global Status and Temporal Trends in 89 Countries From 2000 to 2019. Front Public Health, 10, 811044. doi: 10.3389/fpubh.2022.811044.
3. Барська, Ю., Захожа, В., Семігіна, Т., Степурко, Т., & Харченко Н. (2020). Індекс здоров’я. Україна — 2019: Результати загальнонаціонального дослідження. Київ. doi.org/10.13140/RG.2.2.24133.60647.
4. Клінічна настанова, заснована на доказах, «Рак передміхурової залози». КН 2023-1141. 22.06.2023 р., http://www.dec.gov.ua/ wp-content/uploads/ 2023/06/2023_06_14_kn-_rpz-compressed.pdf.
5. Стандарт медичної допомоги «Рак передміхурової залози», затверджений наказом МОЗ України від 22 червня 2023 р. № 1141. http://www.dec.gov.ua/wp-content/uploads/2023/06/ 47410-dn_1141_22062023_dod.pdf.
6. Кобільник, Ю. С., Мицик, Ю. О., Дутка, І. Ю., Строй, О. О., Комнацька, І. М., Дац, І. В., … Артищук, О. М. (2020). Аналіз корелятивних зв’язків між даними мультипараметричної МРТ та рідинними онкомаркерами у хворих на рак передміхурової залози. 8-й Національний конгрес з міжнародною участю «Радіологія в Україні-2020», с. 112. aru-ua.org.ua/ informacia/8-nacionalnij-kongres-z- miznarodnou-ucastu-radiologia-v-ukraini-onlajn-1-3-lipna-2020-roku.html.
7. Hofman, M. S , Lawrentschuk, N., Francis, R. J., Tang, C., Vela, I., Thomas, P., … Murphy, D. G. (2020). proPSMA Study Group Collaborators. Prostate-specific membrane antigen PET-CT in patients with high-risk prostate cancer before curative-intent surgery or radiotherapy (proPSMA): a prospective, randomised, multicentre study. Lancet? 395(10231),1208–1216. doi: 10.1016/S0140-6736(20)30314-7.
8. Schaeffer, E. M., Srinivas, S., Adra, N., An, Y., Barocas, D., Bitting, R., … Freedman-Cass, D. A. (2023). Prostate Cancer, Version 4.2023, NCCN Clinical Practice Guidelines in Oncology. Journal of the National Comprehensive Cancer Network, 21(10), 1067–1096. doi.org/10.6004/jnccn.2023.0050.
9. Parker, C., Castro, E., Fizazi, K., Heidenreich, A., Ost, P., Procopio, G., Tombal, B., & Gillessen, S. (2020). ESMO Guidelines Committee. Prostate cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol., 31(9): 1119–1134. doi: 10.1016/j.annonc.2020.06.011. Epub. 2020 Jun 25.
10. Desai, K., McManus, J. M., & Sharifi, N. (2021). Hormonal Therapy for Prostate Cancer. Endocr. Rev., 42(3), 354–373. doi: 10.1210/endrev/bnab002.
11. Стусь, В. П., Головко, С. В., Ковальов, О. О., Дійчук, Ю. П., & Антонян, І. М. (2021). Неметастатичний кастраційно-резистентний рак передміхурової залози у практиці українських лікарів. Медична газета «Здоров’я України». Тематичний номер «Онкологія, гематологія, хіміотерапія», 6(73), 2–3. repo.dma.dp.ua/7912.
12. Montgomery, R. B., Mostaghel, E. A., Vessella, R., Hess, D. L., Kalhorn, T. F., Higano, C. S., True, L. D., & Nelson, P. S. (2008). Maintenance of intratumoral androgens in metastatic prostate cancer: a mechanism for castration-resistant tumor growth. Cancer Res., 68(11), 4447–54. doi: 10.1158/0008-5472.CAN-08-0249.
13. European Medicines Agency. Erleada (apalutamide). 2019. [Access date December 2023]. http://www.ema.europa.eu/en/medicines/human/EPAR/erleada.
14. European Medicines Agency. Nubeqa (darolutamide). 2020. [Access date December 2023]. http://www.ema.europa.eu/en/medicines/human/EPAR/nubeqa.
15. European Medicines Agency. Xtandi (enzalutamide). 2013. [Access date December 2023]. http://www.ema.europa.eu/en/medicines/human/EPAR/xtandi.
16. Кукуруза, Г., Кухар, М., Лесик, М., & Любченко, О. (2023). Аналіз впливу на ВВП та державні фінанси захворюваності на рак передміхурової залози та якості його лікування в Україні, Український медичний часопис. doi: 10.32471/umj.1680-3051.157.248119.
Дар’я Полякова














Leave a comment