Непряме порівняльне дослідження з поправкою на відповідність пембролізумабу поєднано з хімієтерапією порівняно з комбінацією атезолізумабу та хімієтерапії поєднано чи без бевацизумабу в першій лінії лікування неплоскоклітинного недрібноклітинного раку легень
Резюме. Мета дослідження. Наразі існує кілька схвалених комбінацій імунотерапії та хімієтерапії для лікування поширеного недрібноклітинного раку легень (НДКРЛ), які не порівнювалися безпосередньо в рандомізованих клінічних дослідженнях. У цьому дослідженні проведено непряме порівняння ефективності комбінації пембролізумабу з хімієтерапією порівняно із застосуванням атезолізумабу з хімієтерапією поєднано чи без бевацизумабу у пацієнтів із неплоскоклітинним НДКРЛ без EGFR- або ALK-геномних аберацій, які раніше не отримували лікування. Матеріали та методи. Для аналізу використано методику непрямого порівняння з поправкою на відповідність, що ґрунтувалася на індивідуальних даних хворих із досліджень KEYNOTE-021 когорти G (KN021 G) (пембролізумаб + карбоплатин + пеметрексед; n=59) і KEYNOTE-189 (KN189) (пембролізумаб + пеметрексед + платиновмісна хімієтерапія; n=410). Ці дані порівнювалися з опублікованими сукупними даними досліджень IMpower 130 (атезолізумаб + карбоплатин + наб-паклітаксел; n=451) та IMpower 150 (атезолізумаб + карбоплатин + паклітаксел + бевацизумаб; n=356). Для корекції відмінностей у вихідних характеристиках між дослідженнями індивідуальні дані пацієнтів, які отримували пембролізумаб + хімієтерапію (KN021 G / KN189), були перезважені для досягнення відповідності вихідним характеристикам хворих, рандомізованих у групи атезолізумабу + хімієтерапії (IMpower 130) або атезолізумабу + хімієтерапії + бевацизумабу (IMpower 150). Результати дослідження включали загальну виживаність (ЗВ), виживаність без прогресування (ВБП), оцінену за даними незалежного огляду в засліпленому режимі, та частоту об’єктивної відповіді (ЧОВ). Тривалість спостереження за ЗВ та ВБП скориговано відповідно до дослідження з найкоротшим періодом спостереження. Додатково проведено аналіз чутливості без скорочення періоду дослідження ЗВ і ВБП. Результати. Після зіставлення відмінностей між досліджуваними групами скоригований розмір вибірки у групі пембролізумабу + хімієтерапії становив 428 та 389 осіб порівняно з дослідженнями IMpower 130 та IMpower 150 відповідно. Розраховані коефіцієнти ризику (КР) із 95% довірчим інтервалом (ДІ) для ЗВ та ВБП при застосуванні пембролізумабу + хімієтерапії порівняно із застосуванням атезолізумабу + хімієтерапії становили 0,80 (95% ДІ 0,67–0,95) та 0,79 (95% ДІ 0,67–0,93) відповідно. При порівнянні застосування пембролізумабу + хімієтерапії з використанням атезолізумабу поєднано з хімієтерапією та бевацизумабом показник КР (95% ДІ) становив 0,86 (95% ДІ 0,72–1,03) для ЗВ та 0,81 (95% ДІ 0,68–0,96) для ВБП. При порівнянні застосування пембролізумабу та хімієтерапії з атезолізумабом поєднано з хімієтерапією для ЧОВ співвідношення ризиків (95% ДІ) та абсолютна різниця ризиків (95% ДІ) становили 0,9 (95% ДІ 0,8–1,1) і −3,5% (95% ДІ −10,0 — 3,1%) відповідно. При порівнянні застосування пембролізумабу та хімієтерапії із застосуванням атезолізумабу та хімієтерапії з бевацизумабом відповідні показники становили 0,8 (95% ДІ 0,7–0,9) і −12,2% (95% ДІ −19,6 — −4,8%). Аналіз чутливості підтвердив узгодженість отриманих результатів для всіх оцінюваних показників. Висновки. Результати проведення непрямого порівняльного дослідження з поправкою на відповідність свідчать про значно вищі показники ЗВ та ВБП у пацієнтів, які отримували пембролізумаб та хімієтерапію, порівняно з прийомом атезолізумабу та хімієтерапії. Крім того, ВБП була значно вищою при застосуванні пембролізумабу та хімієтерапії порівняно із застосуванням атезолізумабу та хімієтерапії з бевацизумабом.
DOI: 10.32471/clinicaloncology.2663-466X.34072
Вступ
 Рак легень залишається провідною причиною смертності від онкологічних захворювань у світі, причому на НДКРЛ припадає близько 85% усіх випадків цієї патології. Захворюваність на пізніх стадіях НДКРЛ, як правило, характеризується несприятливим прогнозом [1–2]. Традиційно раніше стандартом першої лінії терапії для пацієнтів із поширеним НДКРЛ без специфічних мутацій була хімієтерапія на основі препаратів платини [3]. Однак із впровадженням імунотерапії відбулися значні зміни в підходах до лікування поширеного НДКРЛ [3–4]. Зокрема, усе більше доказів свідчить про потенційний синергетичний протипухлинний ефект комбінації хімієтерапії з імунотерапією [5]. Це сприяло розробці численних клінічних досліджень, спрямованих на оцінку ефективності інгібіторів білка програмованої клітинної смерті-1 (PD-1) / ліганду програмованої смерті 1 (PD-L1) поєднано з хімієтерапією для першої лінії лікування поширеного НДКРЛ.
Рак легень залишається провідною причиною смертності від онкологічних захворювань у світі, причому на НДКРЛ припадає близько 85% усіх випадків цієї патології. Захворюваність на пізніх стадіях НДКРЛ, як правило, характеризується несприятливим прогнозом [1–2]. Традиційно раніше стандартом першої лінії терапії для пацієнтів із поширеним НДКРЛ без специфічних мутацій була хімієтерапія на основі препаратів платини [3]. Однак із впровадженням імунотерапії відбулися значні зміни в підходах до лікування поширеного НДКРЛ [3–4]. Зокрема, усе більше доказів свідчить про потенційний синергетичний протипухлинний ефект комбінації хімієтерапії з імунотерапією [5]. Це сприяло розробці численних клінічних досліджень, спрямованих на оцінку ефективності інгібіторів білка програмованої клітинної смерті-1 (PD-1) / ліганду програмованої смерті 1 (PD-L1) поєднано з хімієтерапією для першої лінії лікування поширеного НДКРЛ.
Пембролізумаб, який є гуманізованим моноклональним антитілом до рецептора PD-1, затверджений у комбінації з хімієтерапією, специфічною до гістологічного типу пухлини, для лікування раніше нелікованого метастатичного НДКРЛ незалежно від рівня експресії PD-L1 [6–7]. У клінічному дослідженні ІІ фази KEYNOTE-021 (когорта G) (KN021 G) у пацієнтів із поширеним неплоскоклітинним НДКРЛ без EGFR- або ALK-мутацій комбінована терапія пембролізумабом, карбоплатином і пеметрекседом забезпечила значне підвищення ЗВ порівняно з хімієтерапією лише карбоплатином і пеметрекседом (КР=0,56; 95% ДІ 0,32–0,95; p=0,015) після 24 міс спостереження [8]. ВБП також була достовірно вищою в групі пембролізумабу (КР=0,53; 95% ДІ 0,33–0,86; p=0,005) [8]. У дослідженні III фази KEYNOTE-189 (KN189) комбінація пембролізумабу з пеметрекседом і платиновмісною хімієтерапією сприяла значному підвищенню ЗВ (КР=0,49; 95% ДІ 0,38–0,64; p <0,001) і ВБП (КР =0,52; 95% ДІ 0,43–0,64; p <0,001) порівняно з плацебо в комбінації з пеметрекседом та платиновмісною хімієтерапією [9].
Атезолізумаб, який є моноклональним антитілом до PD-L1, схвалений у комбінації з бевацизумабом, паклітакселом і карбоплатином або поєднано з наб-паклітакселом і карбоплатином для лікування метастатичного неплоскоклітинного НДКРЛ у пацієнтів без EGFR- або ALK-геномних мутацій [10–11]. У дослідженні IMpower 130 призначення комбінації атезолізумабу, карбоплатину та наб-паклітакселу зумовлювало підвищення ЗВ (КР=0,79; 95% ДІ 0,64–0,98; p=0,033) та ВБП (КР=0,64; 95% ДІ 0,54–0,77; p <0,0001), за оцінкою дослідника, порівняно з карбоплатином і наб-паклітакселом без імунотерапії у пацієнтів без EGFR- / ALK-геномних аберацій [12]. У дослідженні IMpower 150 додавання атезолізумабу до карбоплатину, паклітакселу та бевацизумабу також значно підвищило показники ЗВ (КР=0,78; 95% ДІ 0,64–0,96; p=0,020) і ВБП (КР=0,62; 95% ДІ 0,52–0,74; p <0,001) за оцінкою дослідника у осіб із метастатичним неплоскоклітинним НДКРЛ без EGFR- / ALK-мутацій [13].
Розуміння відмінностей між схваленими схемами лікування є важливим для ухвалення клінічних рішень, особливо в аспекті порівняння показників виживаності, таких як ЗВ та ВБП, з урахуванням безпеки та економічної доцільності терапії. Існують спеціальні інструменти оцінки ефективності нових методів лікування раку, зокрема Шкала величини клінічної користі Європейського товариства медичної онкології (European Society of Medical Oncology Magnitude of Clinical Benefit Scale — ESMO-MCBS), що застосовується у процесі оцінки медичних технологій у низці країн [14]. Попри те що використання обох схем — пембролізумаб + хімієтерапія та атезолізумаб + хімієтерапія ± бевацизумаб — зумовило клінічні переваги у відповідних дослідженнях порівняно з хімієтерапією на основі платинових препаратів, пряме порівняння цих режимів у рандомізованому клінічному дослідженні не проводилося. Виконання такого дослідження потребувало б значного розміру вибірки та тривалого періоду спостереження для отримання остаточних результатів.
За відсутності прямих порівняльних досліджень методи непрямого аналізу дозволяють оцінювати відносну ефективність різних терапевтичних режимів першої лінії. Метод непрямого порівняння з поправкою на відповідність є статистично обґрунтованим підходом, який дедалі частіше застосовується для порівняльного аналізу ефективності різних протипухлинних стратегій та використовується у процесі ухвалення клінічних рішень, а також в оцінці медичних технологій для різних типів раку [15–19]. Очікується, що результати методики непрямого порівняння з поправкою на відповідність, у яких порівнюються комбінації інгібіторів PD-1 / PD-L1 із хімієтерапією при НДКРЛ, нададуть цінну інформацію для онкологів, пацієнтів та осіб, відповідальних за формування політики в галузі охорони здоров’я. Так, основною метою цього дослідження була порівняльна оцінка ефективності пембролізумабу та хімієтерапії порівняно з атезолізумабом поєднано з хімієтерапією та комбінації атезолізумабу, хімієтерапії та бевацизумабу в першій лінії лікування пацієнтів із неплоскоклітинним НДКРЛ без EGFR– або ALK-мутацій за допомогою методики непрямого порівняння з поправкою на відповідність.
Матеріали та методи
Методика непрямого порівняння з поправкою на відповідність є підходом, який застосовується у випадках, коли для одного дослідження доступні індивідуальні дані пацієнтів, тоді як для іншого — доступні лише агреговані сукупні дані [20]. Методика непрямого порівняння з поправкою на відповідність дозволяє скоригувати середні вихідні характеристики пацієнтів (тобто прогностичні фактори та/або модифікатори ефекту) у дослідженні з наявними індивідуальними даними хворих, щоб узгодити їх із характеристиками, наведеними в дослідженні, де є лише сукупні дані [20]. У цьому дослідженні використовувалися індивідуальні дані пацієнтів для груп, які отримували комбінацію пембролізумабу, препаратів платини та пеметрекседу в дослідженнях KEYNOTE-021 (когорта G) (KN021 G) [21] та KEYNOTE-189 (KN189). Ці дані порівнювалися із сукупними даними, наведеними в публікаціях щодо груп, які отримували атезолізумаб + карбоплатин + наб-паклітаксел у дослідженні IMpower 130 [12, 23], а також атезолізумаб + карбоплатин + паклітаксел + бевацизумаб у дослідженні IMpower 150 [13, 24–25]. Усі 3 терапевтичні схеми схвалені регуляторними органами як варіанти першої лінії лікування раніше нелікованого метастатичного неплоскоклітинного НДКРЛ без наявності EGFR– або ALK-мутацій [6–7, 10–11].
Дослідження популяцій
Для аналізу використовувалися дані 4 клінічних досліджень, пов’язаних з першою лінією лікування метастатичного неплоскоклітинного НДКРЛ. Критерії залучення пацієнтів у ці дослідження були подібними: вік ≥18 років, функціональний стан за шкалою Східної кооперативної онкологічної групи (Eastern Cooperative Oncology Group — ECOG) ≤1, а також наявність IV стадії захворювання у 3 із 4 досліджень та стадія IIIb / IV в одному з них. Ці 4 дослідження також були включені до систематичного огляду медичної літератури, проведеного з метою оцінки ефективності інгібіторів PD-1/PD-L1 у першій лінії терапії поширеного НДКРЛ [26].
Дані зібрані з кількох кінцевих дат баз даних для кожного дослідження. Для ЗВ була обрана дата з найдовшим періодом спостереження. Для ВБП враховано найдовший період спостереження, при цьому прогресування захворювання оцінювалося за допомогою незалежного огляду.
Дослідження KN021 G (NCT02039674; дата завершення збору даних: 19 серпня 2019 р.) було відкритим рандомізованим дослідженням II фази, яке порівнювало ефективність комбінації пембролізумабу з карбоплатином і пеметрекседом із терапією лише карбоплатином та пеметрекседом у пацієнтів із неплоскоклітинним НДКРЛ стадії IIIB / IV, які не мали EGFR- або ALK-мутацій. Первинною кінцевою точкою була ЧОВ за даними незалежного центрального огляду в засліпленому режимі [21]. Дослідження KN189 (NCT02578680; дата завершення збору даних: 20 травня 2019 р.) було подвійним сліпим рандомізованим дослідженням III фази, яке оцінювало ефективність комбінації пембролізумабу з пеметрекседом та хімієтерапією на основі платини порівняно з плацебо в комбінації з пеметрекседом та хімієтерапією на основі платини у пацієнтів із метастатичним неплоскоклітинним НДКРЛ, які раніше не отримували лікування та не мали EGFR- або ALK-мутацій. Основними кінцевими точками були ВБП (за даними незалежного центрального огляду в засліпленому режимі) та ЗВ [9, 22].
IMpower 130 (NCT02367781; дата завершення збору даних для ЗВ: 4 вересня 2018 р.; для ВБП за даними незалежної оцінки та ЧОВ за оцінкою дослідника: 15 березня 2018 р.) було відкритим рандомізованим дослідженням III фази. Воно порівнювало ефективність комбінації атезолізумабу з карбоплатином і наб-паклітакселом із терапією лише карбоплатином та наб-паклітакселом у пацієнтів із метастатичним (IV стадією) неплоскоклітинним НДКРЛ, які раніше не отримували хімієтерапії та не мали EGFR- або ALK-мутацій. Основними кінцевими точками були ВБП (за оцінкою дослідника) та ЗВ [12, 23]. Популяція пацієнтів із «диким типом» пухлини (ITT-WT), які отримували атезолізумаб у комбінації з карбоплатином і наб-паклітакселом, охоплювала 451 пацієнта для аналізу вихідних характеристик та ВБП, 456 хворих для оцінки ЗВ і 447 осіб для аналізу ЧОВ [12, 23].
Дослідження IMpower 150 (NCT02366143; дата завершення збору даних для ЗВ: 13 вересня 2019 р.; для ВБП за оцінкою незалежного огляду: 15 вересня 2017 р.; для ЧОВ за оцінкою дослідника: 22 січня 2018 р.) було відкритим рандомізованим дослідженням III фази. Воно оцінювало ефективність комбінації атезолізумабу з карбоплатином і паклітакселом (з або без бевацизумабу) порівняно з карбоплатином, паклітакселом і бевацизумабом у пацієнтів із неплоскоклітинним НДКРЛ IV стадії, які отримували хімієтерапію [13, 24–25]. Основними кінцевими точками були ВБП (за оцінкою дослідника) та ЗВ. Дослідження сфокусоване на пацієнтах без EGFR- або ALK-мутацій, тому пацієнтів із цими генетичними змінами не залучали до аналізу методики непрямого порівняння з поправкою на відповідність. Популяція ITT-WT у групі атезолізумабу + карбоплатину + паклітакселу + бевацизумабу охоплювала 356 пацієнтів для аналізу вихідних характеристик та ВБП, а також 359 хворих для оцінки ЗВ і ЧОВ [13, 24–25].
Вимірювання результатів
Результати досліджень включали ЗВ, ВБП, оцінену незалежним оглядом у засліпленому режимі, а також ЧОВ, оцінену дослідником. Кількість пацієнтів, яких залучено для оцінки кожного показника (ЗВ, ВБП та ЧОВ), була отримана з публікацій клінічних досліджень відповідно до визначених порогових значень та кінцевих точок досліджень. У всіх дослідженнях використовувалися подібні критерії визначення клінічних кінцевих точок.
У дослідженнях KN189 / KN021 G та IMpower 130 / IMpower 150 ЗВ визначали як час від рандомізації до смерті з будь-якої причини (виражений у днях). ВБП визначалася як час від рандомізації до першого задокументованого прогресування захворювання відповідно до критеріїв оцінки відповіді при солідних пухлинах (RECIST 1.1) на основі незалежного огляду або до смерті з будь-якої причини (залежно від того, що відбулося раніше), також виражений у днях. ЧОВ визначалася як частка пацієнтів, у яких була зафіксована повна (ПВ) або часткова відповідь (ЧВ) на лікування.
Пацієнти, у яких не було задокументовано смерті, підлягали цензуруванню на дату останнього контакту для аналізу ЗВ. Для аналізу ВБП пацієнти без зафіксованої події (прогресування або смерті) під час останньої оцінки пухлини підлягали цензуруванню на дату останньої оцінки захворювання. У кожному з 4 досліджень використовували незалежний огляд для оцінки ВБП. ЧОВ оцінювалася дослідником, оскільки в дослідженні IMpower 130 не повідомлялося про ЧОВ, оцінену незалежними експертами.
Індивідуальні дані пацієнтів отримані для групи пембролізумаб + хімієтерапія з досліджень KN189 та KN021 G. Дані для групи атезолізумаб + хімієтерапія ± бевацизумаб взяті з публікацій досліджень IMpower. Для оцінки ефективності лікування щодо ЗВ та ВБП у контексті аналізу часу до події в цьому непрямому порівнянні криві Каплана — Меєра з публікацій досліджень IMpower були оцифровані за допомогою програми Digitizelt v2.3. Очікувані дані на рівні пацієнтів (псевдоіндивідуальні дані хворих) для досліджень IMpower отримані за методом, розробленим P. Guyot та співавт., 2012 [27], за допомогою використання кількості пацієнтів у групі ризику на певний момент часу разом із оцифрованими кривими Каплана — Меєра. Частку пацієнтів із ЧОВ також взято з кожного дослідження.
Статистичні методи
Першим етапом застосування методу непрямого порівняння з поправкою на відповідність є узгодження критеріїв включення та виключення для досліджень, що порівнюються. Цього досягнуто за допомогою виключення з набору даних повних індивідуальних даних тих пацієнтів, які не відповідали критеріям порівняльного дослідження. Дані з досліджень KN189 і KN021 G були об’єднані для збільшення потенційного ефективного розміру вибірки у групі пембролізумаб + хімієтерапія. Ефективний розмір вибірки — це кількість незалежних незважених пацієнтів, яка забезпечує таку ж точність оцінки, як і зважена вибірка. Відмічено певні відмінності у критеріях включення та виключення між дослідженнями KEYNOTE та IMpower. Зокрема, у дослідження IMpower 130 і IMpower 150 залучали лише пацієнтів із підтвердженою IV стадією неплоскоклітинного НДКРЛ, тоді як у дослідженні KN189 критеріями залучення передбачалося лише метастатичне захворювання, а у KN021 G досліджувалися хворі зі стадією IIIB або IV. Щоб усунути цю невідповідність у межах методу непрямого порівняння з поправкою на відповідність аналізу здійснено коригування за стадією захворювання, обмеживши вибірку лише пацієнтами із IV стадією. Крім того, між дослідженнями зафіксовано відмінності у тривалості спостереження. Об’єднані дані KN021 G / KN189 мали максимальну тривалість спостереження 55,6 міс у KN021 G і 38,8 міс у KN189, тоді як у дослідженнях IMpower 130 та IMpower 150 цей показник становив близько 37,5 та 49 міс у популяції ITT-WT відповідно. Щоб врахувати цю різницю у тривалості спостереження для аналізу ЗВ та ВБП, дані KN021 G / KN189 були скорочені до кінця періоду спостереження у IMpower 130 або IMpower 150. Це було здійснено за допомогою цензурування результатів пацієнтів, зафіксованих після цієї дати. Пацієнтів із досліджень KEYNOTE та IMpower зіставляли за низкою прогностичних змінних та потенційних модифікаторів ефекту, включно з віком, статтю, расою, функціональним статусом за шкалою ECOG, статусом куріння, локалізацією метастазів. Ці змінні були визначені відповідно до рекомендацій Національного інституту охорони здоров’я та догляду Великої Британії (The National Institute for Health and Care Excellence — NICE) та його Відділу з підтримки ухвалення рішень (Decision Support Unit — DSU) [19]. Вибір модифікаторів ефекту та прогностичних факторів базувався на статистичній оцінці вихідних характеристик пацієнтів, представлених у дослідженнях, клінічній експертизі, огляді клінічної медичної літератури [28–31].
Статус PD-L1 не використовувався як критерій відповідності через відмінності в чутливості аналізів Dako 22C3 (використовувався в дослідженнях KEYNOTE) та SP142 (використовувався в дослідженнях IMpower) для оцінки рівня експресії PD-L1 у пухлинах. Крім того, у цих дослідженнях використовували різні методи оцінки рівня експресії PD-L1 [32–33]. Зокрема, до аналізу Dako 22C3, що використовувався в дослідженнях KEYNOTE, входило оцінювання та стратифікування пацієнтів на основі експресії PD-L1 лише на пухлинних клітинах, тоді як в аналізі SP142, що використовувався в дослідженнях IMpower, визначалася експресія PD-L1 як на пухлинних, так і імунних клітинах.
Дані хворих, які отримували пембролізумаб, були зважені, щоб відповідати вихідним характеристикам пацієнтів, залучених у дослідження IMpower 130 або IMpower 150, які отримували атезолізумаб. Застосування вагових коефіцієнтів здійснювали за методом моментів, як це описано J.E. Signorovitch et al., 2010 [20]. Для повних індивідуальних даних пацієнтів з досліджень KN189 / KN021 G (пембролізумаб + хімієтерапія) вагові коефіцієнти визначали за допомогою статистичного зіставлення пацієнтів. Для псевдоіндивідуальних даних пацієнтів з досліджень IMpower 130 та IMpower 150 (атезолізумаб + хімієтерапія та атезолізумаб + хімієтерапія + бевацизумаб) усім хворим присвоєно вагу, що дорівнює 1. Для оцінки ефекту лікування використовували модель пропорційних ризиків Кокса, де лікування виступало коваріатою. Аналіз проводили на основі повних індивідуальних даних пацієнтів з об’єднаного KN189 / KN021 G та псевдоіндивідуальних даних хворих з досліджень IMpower 130 та IMpower 150. Перед початком розрахунків оцінювали припущення пропорційного ризику, яке передбачає стабільність оціненого КР у часі для ЗВ та ВБП. Завдяки аналізу встановлено відповідність припущенню пропорційного ризику для IMpower 130 (p-показник для ЗВ=0,408; p-показник для ВБП=0,433), для IMpower 150 (p-показник для ЗВ=0,749; p-показник для ВБП=0,224). Для аналізу ЧОВ використовували узагальнену лінійну модель із біноміальним розподілом. Для оцінки ризику використовували функції тотожності та логарифмічного зв’язку, що дозволило розрахувати абсолютну різницю ризику та співвідношення ризику.
Щоб перевірити вплив скорочених даних на результати аналізу та оцінити надійність методики непрямого порівняння з поправкою на відповідність, проведено аналіз чутливості для кінцевих точок ЗВ та ВБП з використанням повного періоду спостереження в кожному дослідженні.
Усі статистичні аналізи проводили у SAS 9.4.
Стандартні помилки для оцінок методики непрямого порівняння з поправкою на відповідність розраховували за допомогою надійного сендвіч-оцінювача, отриманого емпіричним методом, що враховував змінність вагових коефіцієнтів (оскільки ваги оцінюються, а не є фіксованими показниками) [20]. Слід зазначити, що ефективний розмір вибірки, як визначено у J.E. Signorovitch та співавт. [20], розраховується на основі лінійних комбінацій спостережень. Однак при використанні зважених оцінок виживаності, ефективний розмір вибірки не можна розрахувати безпосередньо, оскільки оцінка виживаності не є лінійною функцією спостережень. Отже, кількість пацієнтів у групі ризику, обчислена як сума вагових коефіцієнтів, може відрізнятися від ефективного розміру вибірки, представленого в таблиці з вихідними характеристиками.
Результати
Пембролізумаб + хімієтерапія проти атезолізумаб + хімієтерапія
Вихідні характеристики
До проведення статистичного зіставлення вихідні клінічні характеристики 2 популяцій загалом були співставними. Єдиною вихідною характеристикою, яка мала значну відмінність, була частка пацієнтів із кістковими метастазами. У групі застосування пембролізумабу та хімієтерапії (KN189 / KN021 G) частка осіб із кістковими метастазами на момент рандомізації була вищою (36,89 проти 27,94%) порівняно з групою застосування атезолізумабу та хімієтерапії (IMpower 130). Після корекції за вихідними характеристиками розподіл характеристик у табл. 1 став ідентичним, а ефективний розмір вибірки для групи застосування пембролізумабу та хімієтерапії становив 428 пацієнтів. Загалом після зважування зафіксовано тільки 9% зменшення вибірки порівняно з вихідними даними, що свідчить про високий рівень відповідності між 2 популяціями пацієнтів перед проведенням порівняльного аналізу.
| Група отримання атезолізумабу та хімієтерапії, дослідження IMpower 130 (n=451) | Група отримання пембролізумабу та хімієтерапії, дослідження KN189 / KN021 G |
||
| До зіставлення даних(n=469) | Після зіставлення даних(n=428a) | ||
| Вікова група (роки) | |||
| ≤64 | 50,33 | 49,47 | 50,33 |
| 65−74 | 38,58 | 42,22 | 38,58 |
| ≥75 | 11,09 | 8,32 | 11,09 |
| Стать | |||
| Чоловік | 58,98 | 58,85 | 58,98 |
| Жінка | 41,02 | 41,15 | 41,02 |
| Статус куріння | |||
| Теперішній / колишній курець | 89,36 | 86,78 | 89,36 |
| Ніколи не курили | 10,64 | 13,22 | 10,64 |
| Расова приналежність | |||
| Європеоїдна раса | 89,14 | 92,75 | 89,14 |
| Функціональний статуc за шкалою ECOG | |||
| 0 | 41,91 | 44,56 | 41,91 |
| 1 | 57,87 | 54,37 | 57,87 |
| Інший бал або відсутність даних | 0,22 | 1,07 | 0,22 |
| Наявність метастазів | |||
| У кістки | 27,94 | 36,89 | 27,94 |
| У печінку | 15,30 | 15,57 | 15,30 |
Результати представлені у відсотках, якщо не зазначено інше.
KN021 G: KEYNOTE 21 когорти G; KN189: KEYNOTE 189.
аЕфективний розмір вибірки обчислюється як квадрат суми ваг, поділений на суму квадратів ваг.
Аналіз вихідного випадку
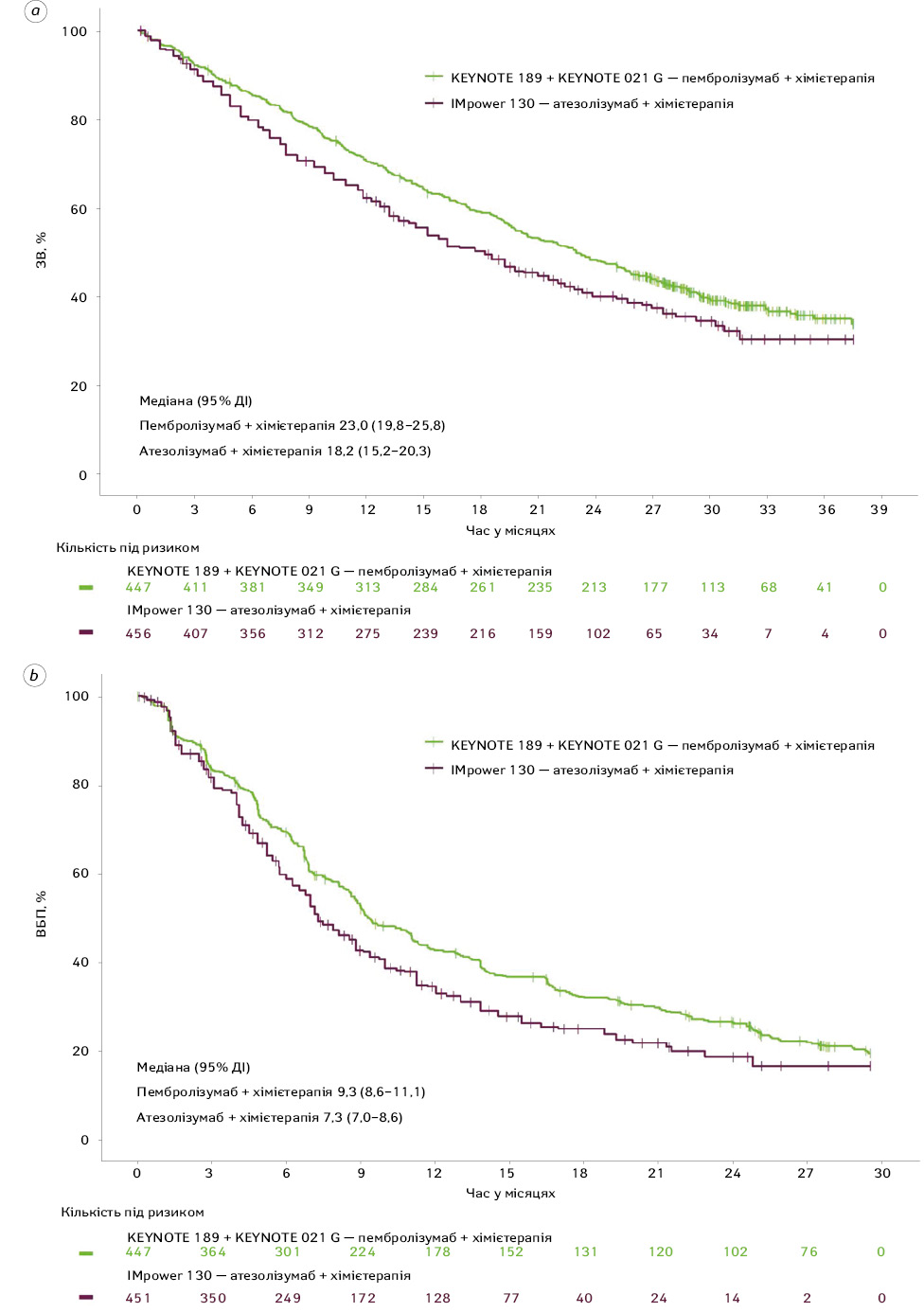
У табл. 2 представлено результати аналізу ЗВ та ВБП у пацієнтів із неплоскоклітинним НДКРЛ без EGFR– / ALK-мутацій після коригування вихідних характеристик. Лікування пембролізумабом поєднано з хімієтерапією сприяло кращим результатам як щодо ЗВ, так і щодо ВБП порівняно із застосуванням атезолізумабу разом із хімієтерапією.
| Результати | ||
| ЗВ | ВБП | |
| КР (95% ДІ)a, значення pb | 0,80 (0,67–0,95), 0,012 | 0,79 (0,67–0,93), 0,004 |
| Кількість подій / кількість під ризикомc, d (%) | ||
| Пембролізумаб + хімієтерапія | 274 / 447 (61,3) | 339 / 447 (75,8) |
| Атезолізумаб + хімієтерапіяe | 269 / 456 (59,0) | 316 / 451 (70,1) |
| Медіана, місяці (95% ДІ) | ||
| Пембролізумаб + хімієтерапія | 23,0 (19,8; 25,8) | 9,3 (8,6; 11,1) |
| Атезолізумаб + хімієтерапія | 18,2 (15,2; 20,3) | 7,3 (7,0; 8,6) |
| Показник виживаності на визначеному етапі (%) — пембролізумаб + хімієтерапія проти атезолізумаб + хімієтерапія | ||
| 6 міс | 85,6 проти 79,8 | 69,3 проти 59,7 |
| 1 рік | 70,5 проти 62,2 | 42,6 проти 34,5 |
| 2 роки | 48,2 проти 40,0 | 26,3 проти 18,5 |
Примітки: ITT — намір лікувати; ITT-WT — намір лікувати дикий тип; KN021 G: когорта G дослідження KEYNOTE 021; KN189: дослідження KEYNOTE 189.
aЗасновано на моделі регресії Кокса.
bДвосторонній показник p (критерій Вальда).
cКількість пацієнтів: ITT; розмір вибірки після зіставлення даних для KN021 G / KN189 був розрахований як сума ваг.
dЕфективний розмір вибірки – це кількість незалежних незважених індивідуумів, необхідна для отримання такої ж точності оцінки, як у зваженій вибірці [19]. У контексті аналізу виживаності метод розрахунку дещо змінюється, щоб точніше оцінити співвідношення кількості подій до загальної кількості пацієнтів (%). Тому ці показники ризику відрізняються від ефективного розміру вибірки, наведеного в табл. 1.
eITT-WT для дослідження IMpower 130.
КР для ЗВ після зіставлення даних становив 0,80 (95% ДІ 0,67–0,95) для групи пембролізумабу та хімієтерапії порівняно з атезолізумабом поєднано з хімієтерапією, що є зіставним із показником до зіставлення — 0,80 (0,68–0,94). Медіана ЗВ була вищою серед хворих, які отримували пембролізумаб + хімієтерапію, порівняно з тими, хто отримував атезолізумаб + хімієтерапію (після зіставлення даних: 23,0 міс (95% ДІ 19,8–25,8) проти 18,2 міс (95% ДІ 15,2–20,3) відповідно).
За оцінками незалежних експертів, КР для ВБП у групі пембролізумабу + хімієтерапії порівняно з атезолізумабом та хімієтерапією після зіставлення даних становив 0,79 (95% ДІ 0,67–0,93), що узгоджується з даними до зіставлення — 0,81 (0,69–0,94). Подібно до ЗВ медіана ВБП була вищою серед пацієнтів, які отримували пембролізумаб + хімієтерапію, порівняно з тими, хто отримував атезолізумаб + хімієтерапію (після зіставлення: 9,3 міс (95% ДІ 8,6–11,1) проти 7,3 міс (95% ДІ 7,0–8,6) відповідно).
Аналіз показників ЗВ та ВБП через 6 міс, 1 та 2 роки підтвердив вищу ефективність лікування пембролізумабом із хімієтерапією порівняно з атезолізумабом із хімієтерапією (див. табл. 2). Після зіставлення даних рівень 2-річної ЗВ у групі пембролізумабу становив 48,2%, водночас як у групі атезолізумабу цей показник становив 40,0%. Подібним чином після зіставлення даних рівень 2-річної ВБП у групі пембролізумабу становив 26,3 проти 18,5% для пацієнтів, які отримували атезолізумаб та хімієтерапію.
Графіки Каплана — Меєра, що демонструють рівень ЗВ та ВБП після зіставлення даних, представлено на рис. 1. Вони вказують на стабільну перевагу пембролізумабу + хімієтерапії протягом усього періоду спостереження.
Згідно з оцінкою дослідника, частка пацієнтів, які позитивно відреагували на лікування (досягли ПВ або ЧВ), у групі пембролізумабу до зіставлення даних становила 45,8% і залишалася майже незмінною після зіставлення — 45,3%. Після зіставлення даних КР (95% ДІ) у групі пембролізумабу + хімієтерапії порівняно з атезолізумабом + хімієтерапією становив 0,9 (95% ДІ 0,8–1,1), а різниця ризиків −3,5% (−10,0–3,1) (p=0,305).
Аналіз чутливості, проведений із використанням повних даних спостереження для кожного дослідження, дав такі ж результати, як і основний аналіз, що базувався на усічених даних. Після зіставлення характеристик пацієнтів та без застосування обмежень щодо кінцевих дат дослідження оцінений КР (95% ДІ) становив 0,80 (0,67–0,95) для ЗВ та 0,79 (0,67–0,93) для ВБП.
Пембролізумаб + хімієтерапія проти атезолізумабу + хімієтерапія + бевацизумаб
Вихідні характеристики
До зіставлення даних вихідні характеристики 2 груп пацієнтів загалом були схожими. Єдиною суттєвою відмінністю була расова приналежність: у групі пембролізумабу + хімієтерапії (KN189 / 021 G) частка пацієнтів європеоїдної раси була більшою (92,75%) порівняно з групою атезолізумабу + хімієтерапії + бевацизумабу (IMpower 150), де цей показник становив 82,58%. Після коригування розподіл вихідних характеристик у групах (табл. 3) став ідентичним, а ефективний розмір вибірки для групи пембролізумабу + хімієтерапії становив 389 осіб. Це відповідало зменшенню вибірки на 17% від вихідного розміру. Хоча цей рівень скорочення вибірки був вищим, ніж у попередньому аналізі порівняння пембролізумабу + хімієтерапії з атезолізумабом + хімієтерапією, він свідчить про високий ступінь відповідності між порівнюваними групами пацієнтів.
| Група отримання атезолізумабу, хімієтерапії та бевацизумабу, дослідження IMpower 150 (n=356) | Група отримання пембролізумабу та хімієтерапії, дослідження KN189 / KN021 G | ||
| До зіставлення даних (n=469) | Після зіставлення даних (n=389a) | ||
| Вікова група, роки | |||
| ≤64 | 53,65 | 49,47 | 53,65 |
| 65−74 | 36,52 | 42,22 | 36,52 |
| ≥75 | 9,83 | 8,32 | 9,83 |
| Стать | |||
| Чоловік | 60,96 | 58,85 | 60,96 |
| Жінка | 39,04 | 41,15 | 39,04 |
| Статус куріння | |||
| Теперішній / колишній курець | 83,71 | 86,78 | 83,71 |
| Ніколи не курили | 16,29 | 13,22 | 16,29 |
| Расова приналежність | |||
| Європеоїдна раса | 82,58 | 92,75 | 82,58 |
| Функціональний статуc за шкалою ECOG | |||
| 0 | 39,04 | 44,56 | 39,04 |
| 1 | 60,11 | 54,37 | 60,11 |
| Інший бал або відсутні дані | 0,84 | 1,07 | 0,84 |
| Наявність метастазів | |||
| У печінку | 13,20 | 15,57 | 13,20 |
Результати представлені у відсотках, якщо не зазначено інше.
KN021 G: KEYNOTE 21 когорти G; KN189: KEYNOTE 189.
аЕфективний розмір вибірки обчислюється як квадрат суми ваг, поділений на суму квадратів ваг.
Аналіз вихідного випадку
У табл. 4 представлено результати аналізу ЗВ та ВБП у хворих із неплоскоклітинним НДКРЛ без EGFR- / ALK-мутацій після коригування вихідних характеристик.
| Результати | ||
| ЗВ | ВБП | |
| КР (95% ДІ)a, показник pb | 0,86 (0,72–1,03), 0,099 | 0,81 (0,68–0,96), 0,014 |
| Кількість подій / кількість під ризикомc, d (%) | ||
| Пембролізумаб + хімієтерапія | 272 / 433 (62,8) | 325 / 433 (75,0) |
| Атезолізумаб + хімієтерапіяe | 258 / 359 (71,9) | 246 / 356 (69,1) |
| Медіана, місяці (95% ДІ) | ||
| Пембролізумаб + хімієтерапія | 22,4 (19,5–25,5) | 9,2 (8,3–11,0) |
| Атезолізумаб + хімієтерапія + бевацизумаб | 19,3 (17,1–22,1) | 8,5 (7,5–9,6) |
| Показник виживаності на визначеному етапі (%) — пембролізумаб + хімієтерапія проти атезолізумаб + хімієтерапія + бевацизумаб | ||
| 6 міс | 85,7 проти 84,0 | 68,5 проти 64,4 |
| 1 рік | 68,6 проти 67,1 | 40,9 проти 36,7 |
| 2 роки | 47,2 проти 41,6 | 24,3 проти 7,6 |
KN021 G: когорта G дослідження KEYNOTE 021; KN189: дослідження KEYNOTE 189.
aЗасновано на моделі регресії Кокса.
bДвосторонній показник p (критерій Вальда).
cКількість пацієнтів: ITT; розмір вибірки після коригування для KN021 G / KN189 був розрахований, як сума ваг.
dЕфективний розмір вибірки – це кількість незалежних незважених індивідуумів, необхідна для отримання такої ж точності оцінки, як у зваженій вибірці [19]. У контексті аналізу виживаності метод розрахунку дещо змінюється, щоб точніше оцінити співвідношення кількості подій до загальної кількості пацієнтів (%), тому ці показники ризику відрізняються від ефективного розміру вибірки, наведеного в табл. 3.
eITT-WT для дослідження IMpower 150.
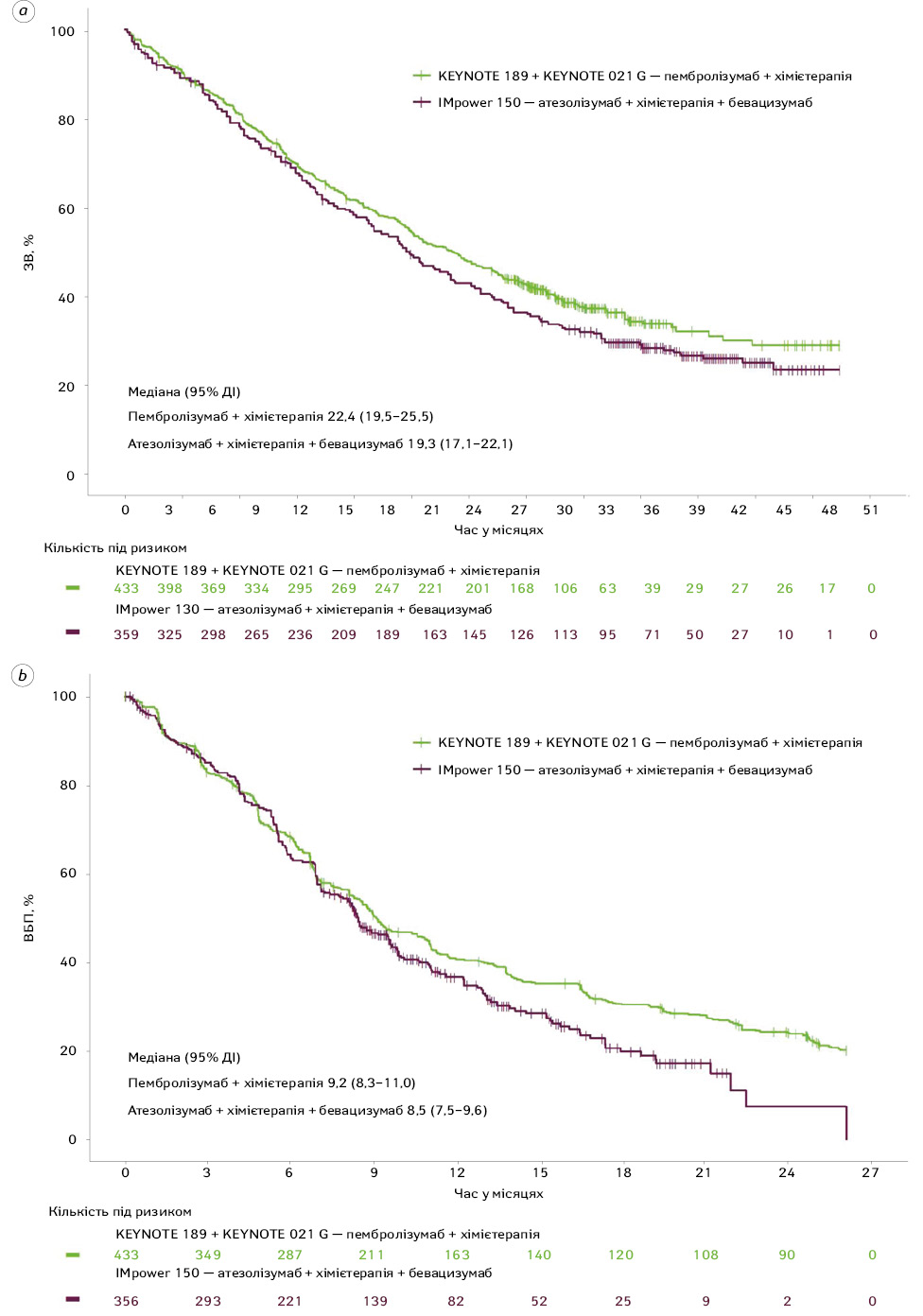
Для ЗВ КР (95% ДІ) після зіставлення даних для групи пембролізумабу та хімієтерапії порівняно з групою атезолізумабу, хімієтерапії та бевацизумабу становив 0,86 (0,72–1,03), що узгоджується з показником до зіставлення даних 0,84 (0,71–0,99). Медіана ЗВ була подібною в обох групах лікування.
За незалежною оцінкою ВБП, КР (95% ДІ) після зіставлення даних для групи пембролізумабу та хімієтерапії порівняно з групою атезолізумабу, хімієтерапії та бевацизумабу становив 0,81 (0,68–0,96), що відповідало показнику до зіставлення — 0,79 (0,67–0,93). Медіана ВБП після зіставлення даних становила 9,2 міс (95% ДІ 8,3–11,0) у групі пембролізумабу та хімієтерапії проти 8,5 міс (95% ДІ 7,5–9,6) у групі атезолізумабу, хімієтерапії та бевацизумабу.
Аналіз показників ЗВ та ВБП через 6 міс, 1 рік та 2 роки, який відповідав аналізу вихідних даних, підтвердив вищу ефективність лікування пембролізумабом із хімієтерапією порівняно з атезолізумабом із хімієтерапією та бевацизумабом (див. табл. 4). Після коригування характеристик пацієнтів 2-річний рівень ЗВ становив 47,2% у групі пембролізумабу та хімієтерапії проти 41,6% у групі атезолізумабу, хімієтерапії та бевацизумабу. Аналогічно 2-річний рівень ВБП був вищим у хворих, які отримували пембролізумаб та хімієтерапію (24,3%), ніж у тих, хто отримував атезолізумаб, хімієтерапію та бевацизумаб (7,6%), що свідчить про абсолютну різницю на близько 15%.
Графіки Каплана — Меєра, що ілюструють динаміку ЗВ та ВБП після зіставлення даних, наведені на рис. 2. Аналіз цих графіків фіксує тенденцію до підвищення ЗВ у пацієнтів, які отримували пембролізумаб + хімієтерапію, порівняно з групою застосування атезолізумабу, хімієтерапії та бевацизумабу. Для ВБП через 9 міс відмічалося розходження кривих на користь пембролізумабу + хімієтерапії.
Згідно з оцінкою дослідника, частка пацієнтів, які позитивно відреагували на лікування (досягли ПВ або ЧВ) у групі пембролізумабу + хімієтерапії до зіставлення даних, становила 45,9% і залишалася подібною після зіставлення (43,2%). Після зіставлення даних КР (95% ДІ) для групи пембролізумабу та хімієтерапії порівняно з групою атезолізумабу, хімієтерапії та бевацизумабу становив 0,8 (0,7–0,9), а різниця ризиків становила −12,2% (95% ДІ −19,6 — −4,8) (p=0,001).
Аналіз чутливості, що враховував повний період спостереження без обмеження граничних дат, дав результати, ідентичні основному аналізу на усічених даних. Після зіставлення даних КР (95% ДІ) становив 0,86 (0,72–1,03) для ЗВ та 0,81 (0,68–0,96) для ВБП.
За допомогою аналізу чутливості без обмеження періоду спостереження для режиму лікування з довшим періодом спостереження встановлено такі ж результати, як і при вихідному аналізі, проведеному із використанням усічених даних. Після коригування КР (95% ДІ) становив 0,86 (0,72–1,03) для ЗВ і 0,81 (0,68–0,96) для ВБП без обмеження за граничними датами дослідження.
Обговорення
За результатами цього дослідження виявлено переваги ЗВ та ВБП при застосуванні пембролізумабу та хімієтерапії порівняно з атезолізумабом та хімієтерапією. КР для ЗВ та ВБП у цих групах був подібним. ЧОВ, оцінена дослідниками, виявилася схожою між групами пембролізумабу та хімієтерапії та групою атезолізумабу та хімієтерапії. При порівнянні з комбінацією атезолізумабу, хімієтерапії та бевацизумабу схема пембролізумабу та хімієтерапії сприяла вищому показнику ВБП, тоді як ЗВ у цих групах була приблизно однаковою. Водночас ЧОВ, оцінена дослідниками, була вищою у пацієнтів, які отримували атезолізумаб, хімієтерапію та бевацизумаб. В усіх випадках аналіз чутливості, що враховував повний період спостереження щодо ЗВ та ВБП, узгоджувався з основними результатами, підтверджуючи їхню стабільність.
Отримані результати узгоджуються з даними мережевого метааналізу (National Medical Association — NMA), проведеного U. Dafni та співавт. у 2019 р. У цьому аналізі оцінювали ефективність терапії на основі 12 досліджень III фази, включно з 4 дослідженнями, використаними в цій методиці непрямого порівняння з поправкою на відповідність. Аналіз охоплював дослідження імуноонкологічних препаратів, застосованих як монотерапія або в комбінації з хімієтерапією, у першій лінії лікування прогресуючого плоскоклітинного та неплоскоклітинного НДКРЛ [34]. У первинному NMA у когорті пацієнтів із неплоскоклітинним НДКРЛ використання схеми пембролізумабу та хімієтерапії сприяло вищому показнику ВБП, ніж застосування атезолізумабу та хімієтерапії (КР=0,83; 95% ДІ 0,68–1,02), що відповідає результатам цього дослідження (КР=0,81; 95% ДІ 0,68–0,96). Водночас схема із застосуванням атезолізумабу, хімієтерапії та бевацизумабу не була включена в аналіз неплоскоклітинного НДКРЛ. Щодо ЗВ, застосування пембролізумабу та хімієтерапії зумовило вищі результати, ніж застосування атезолізумабу та хімієтерапії (КР=0,61; 95% ДІ 0,48–0,79) і застосування атезолізумабу, хімієтерапії та бевацизумабу (КР=0,69; 95% ДІ 0,50–0,96) [34]. Проте існували певні методологічні відмінності між дослідженням NMA (Dafmi U. та співавт.) і цією методикою непрямого порівняння з поправкою на відповідність. Зокрема, NMA включав дослідження IMpower 132 (атезолізумаб + платина + пеметексед), в якому не виявлено підвищення ЗВ у проміжному та фінальному аналізах. Це дослідження не розглядалося в цьому аналізі, оскільки відповідна схема лікування не схвалена у США та Європі. По-друге, U. Dafmi та співавт. використовували проміжні результати IMpower 132, IMpower 150 і KEYNOTE 189, тоді як у цьому аналізі розглядалися остаточні результати ЗВ. У NMA U. Dafmi та співавт. для IMpower враховували ВБП, оцінену дослідниками, а для KEYNOTE — ВБП, оцінену незалежним комітетом. Натомість у цьому аналізі використовувалися лише дані незалежної оцінки ВБП [34].
У наведеному дослідженні за відсутності прямого рандомізованого клінічного дослідження для порівняння ефективності схем пембролізумаб + хімієтерапія та режиму атезолізумаб + хімієтерапія з/без бевацизумабу використано методику непрямого порівняння з поправкою на відповідність. Загальноприйняті методи непрямого порівняння, такі як NМА, базуються на сукупних даних клінічних досліджень, однак їхні результати можуть бути спотворені через відмінності в характеристиках пацієнтів або дизайнах досліджень. Використана в цьому аналізі методика непрямого порівняння з поправкою на відповідність є більш надійним статистичним методом, оскільки дозволяє скоригувати відмінності між дослідженнями за допомогою врахування спотворювальних факторів і модифікаторів ефекту, що допомагає мінімізувати похибку в оцінках ефективності лікування [20].
Висновки цього дослідження залежать від ступеня відповідності відібраного набору клінічних досліджень припущенням методики непрямого порівняння з корекцією на відповідність. Через відсутність спільного хімієтерапевтичного компаратора оцінка ускладнювалася. Тому використано методику непрямого порівняння з корекцією на відповідність, яка передбачає коректну ідентифікацію, однакове вимірювання та врахування всіх ключових прогностичних факторів і модифікаторів ефекту в розрахунках. Це є суттєвим припущенням, яке не підлягає емпіричній перевірці, що може спричинити невідомий рівень похибки в оцінках. Попри це, у дослідженні був включений широкий спектр прогностичних факторів і модифікаторів ефекту, що допомагає знизити ризик упередженості. Крім того, подібність критеріїв включення та виключення у вибраних дослідженнях свідчить про те, що пацієнти обох груп відібрані з порівнянних популяцій. Хоча деякі відмінності між дослідженнями, такі як тривалість спостереження, враховані завдяки аналізу повних і скорочених даних, наявність неврахованих та невимірюваних розбіжностей між групами пацієнтів може потенційно вплинути на об’єктивність отриманих результатів.
Через відмінності в підходах до збору, реєстрації та моніторингу побічних ефектів у різних клінічних дослідженнях порівняння профілів безпеки включених методів лікування не було проведено в цьому аналізі.
Оптимальний вибір між схемами пембролізумаб + хімієтерапія та атезолізумаб + хімієтерапія з/без бевацизумабу щодо їхньої ефективності можна було б визначити лише за допомогою прямого рандомізованого клінічного дослідження. Однак таке дослідження для хворих з поширеним неплоскоклітинним НДКРЛ без цільових мутацій наразі відсутнє, що пояснюється складністю його реалізації, необхідністю значної вибірки пацієнтів та тривалим періодом спостереження.
В умовах браку прямого порівняльного рандомізованого клінічного дослідження методологія непрямого порівняння з поправкою на відповідність дає клінічно значущі результати, оскільки вона використовує корекцію за ключовими факторами, що впливають на ефективність лікування. Крім того, у цьому аналізі використані найактуальніші дані клінічних досліджень IMpower та KEYNOTE, що підвищує достовірність отриманих висновків. Беручи до уваги схвалення та доступність схем пембролізумаб + хімієтерапія та атезолізумаб + хімієтерапія з/без бевацизумабу для лікування пацієнтів з НДКРЛ без цільових мутацій, ці результати є корисними для лікарів та осіб, які ухвалюють клінічні рішення. Вибір оптимальної терапії має також враховувати переносимість лікування та його вартість.
Результати аналізу свідчать про те, що у пацієнтів із неплоскоклітинним НДКРЛ, які отримували пембролізумаб + хімієтерапію, можуть відмічатися вищі показники ЗВ та ВБП порівняно з тими, хто отримував атезолізумаб + хімієтерапію з/без бевацизумабу. Водночас комбінація атезолізумаб + хімієтерапія + бевацизумаб може сприяти вищій ЧОВ, оціненій дослідниками, порівняно з пембролізумабом + хімієтерапією для тієї ж популяції хворих. В усіх аналізах щодо ЗВ та ВБП встановлено статистично значущі відмінності між пембролізумабом та хімієтерапією та атезолізумабом, хімієтерапією з/без бевацизумабу, за винятком порівняння ЗВ у групі атезолізумаб + хімієтерапія + бевацизумаб.
Адаптований переклад за Halmos, B., Burke, T., Kalyvas, C., Vandormael, K., Frederickson, A., & Piperdi, B. (2021). Pembrolizumab + chemotherapy versus atezolizumab + chemotherapy+/-bevacizumab for the first-line treatment of non-squamous NSCLC: A matching-adjusted indirect comparison. Lung Cancer, 155, 175–182. doi: 10.1016/j.lungcan.2021.03.020.
Стаття друкується у скороченому вигляді.
Список використаної літератури знаходиться в редакції.
Ірина Неміш














Leave a comment