Матеріали ІІІ З’їзду ГО «Українська асоціація цитопатологів» «Оптимальна морфологічна діагностика пухлин з використанням класичних цитологічних, гістологічних і сучасних методів дослідження» (19–20 травня 2025 р., Київ)
DOI: 10.32471/clinicaloncology.2663-466X.34537
Гістопатологічні зміни та імуногістохімічна експресія Ubiquitin у перитуморальній тканині яєчка
С.В. Базалицька, А.М. Романенко
ДУ «Інститут урології ім. акад. О.Ф. Возіанова НАМН України», Київ, Україна
Актуальність. Високі показники захворюваності на герміногенні пухлини яєчка (ГПЯ), які за статистичними даними в Україні посідають 4-те місце серед причин летальності від онкологічних захворювань у молодих чоловіків репродуктивного віку, зумовлюють актуальність досліджень передракових станів гонад у чоловіків та розробки методів ранньої діагностики, у тому числі із використанням імуногістохімічних (ІГХ) маркерів, що пов’язано з їх діагностичною цінністю та успіхами таргетної терапії.
Мета. Визначити передракові гістопатологічні зміни та особливості ІГХ експресії протеїну Ubiquitin у перитуморальній тканині хворих на ГПЯ.
Матеріали та методи дослідження. Досліджено перитуморальну тканину та пухлини 40 хворих на ГПЯ з використанням гістологічних та ІГХ-методів дослідження протеїну Ubiquitin, визначенням показників ІГХ-коефіцієнта (ІГХК) і статистичним аналізом.
Результати. У перитуморальній тканині хворих на ГПЯ у 95% випадків виявлені сім’яні канальці з блоком сперматогенезу на різних рівнях, серед яких у 60% осіб визначено атипові клітини — неоплазія герміногенних клітин in situ (germ cell neoplasia in situ — GCNIS); також у 82,5% спостережень мала місце інтенсивна гіперплазія клітин Лейдіга. При цьому в сперматогенному епітелії в клітинах Сертолі та Лейдіга при блокованому сперматогенезі порівняно зі збереженим сперматогенезом виявлена більш інтенсивна експресія Ubiquitin, де показники ІГХК у цитоплазмі сперматогоній становили 8,2±0,07, сустентоцитів — 6,8±0,07, клітин Лейдіга — 6,9±0,16 (р ≤0,001).
Висновки. Визначено закономірні гістопатологічні та ІГХ-зміни перитуморальної тканини яєчка, які необхідно вважати передраковими.
Підвищена експресія Ubiquitin свідчить про роль процесів убіквітинації в регуляції сперматогенезу та участь компонентів убіквітин-протеолізної системи в ініціації канцерогенезу ГПЯ.
Цитоморфологічні ознаки бронхіолоальвеолярного раку легень
Л.С. Болгова, Т.М. Туганова, О.І. Алексєєнко
ДНП «Національний інститут раку», Київ, Україна
Актуальність. У діагностичній практиці найбільш часто (85%) трапляється залозистий і плоскоклітинний рак легень (РЛ). Значно рідше визначається дрібноклітинний та інші типи онкопатології. Усі перелічені варіанти РЛ досить детально описані у вітчизняних і зарубіжних спеціальних посібниках. Цитологічні ознаки бронхіолоальвеолярного РЛ (БАРЛ) майже не згадуються. В останніх Міжнародних гістологічних класифікаціях (МГК) цей тип РЛ відноситься як підтип залозистого і називається lipidic — «той, що стелиться». Наші багаторічні дослідження дозволили установити єдине джерело розвитку РЛ — стовбурову клітину, яка є альвеолоцитом ІІ типу. Тобто РЛ розвивається з альвеол, що впливає на клінічні прояви та ефективність лікування. Це спонукало нас навести детальні ознаки БАРЛ.
Мета. Визначити цитологічні особливості БАРЛ.
Матеріали та методи дослідження. Вивчені цитологічні ознаки БАРЛ у 30 хворих за матеріалами промивних вод, мазків з бронхів та трансторакальних пунктатів. Препарати забарвлювали за методами Паппенгейма та Папаніколау. Цитологічні висновки зіставляли з гістологічними, які узгоджені із сучасною МГК Всесвітньої організації охорони здоров’я (ВООЗ). Використали мікроскоп OLYMPUS BX41.
Результати. Клітини БАРЛ мають характерні ознаки. Вони трапляються порізно, зрідка в групах, з різними розмірами — від дрібних, в яких ядро займає майже всю цитоплазму, до великих — в 3–5 разів більших з розвиненою світлою базофільною цитоплазмою різної форми: округлою, видовженою, відростчатою, овальною і у вигляді тонкої, що лізується. У цитоплазмі частини клітин виявляються дрібні світлі вакуолі, що підкреслює їхній залозистий генез. Ядра значно збільшені і розміщуються найчастіше ексцентрично. Одною з характерних ознак є наявність у клітинах ≥2, у частині клітин овальних і поліморфних ядер. Ядра клітин мають рівномірну структуру хроматину, забарвлюються нормохромно, але трапляються і гіперхромні екземпляри. Переважають округлі ядра. Досить часто в ядрах виявляються збільшені 1–3 округлих ядерця. Крім клітин з наявною цитоплазмою, трапляються «голі» збільшені округлі або неправильної форми ядра, переважно гіпохромні, часто з рівномірною структурою хроматину.
Висновки. БАРЛ характеризується в основному порізно розташованими і зрідка в групах клітинами з тонкою, різної форми цитоплазмою, переважно округлими ядрами, багатоядерними клітинами і збільшеними ядерцями, що дозволяє встановити правильний діагноз.
Імуноцитохімічні особливості маркера щільних контактів E-cadherin в лаважній мокроті у дітей при захворюваннях органів дихання на тлі воєнної агресії
Ю.М. Бондаренко, С.М. Килихевич, Т.Р. Уманець, В.О. Дзісяк, Т.Д. Задорожна
ДУ «Всеукраїнський центр материнства та дитинства НАМН України», Київ, Україна
Актуальність. Функція E-Cadherin полягає в підтримці цілісності та структури епітеліальних тканин. Його особливо багато в ділянках з’єднання клітин, які забезпечують механічну міцність і полегшують зв’язок між сусідніми епітеліальними клітинами. Він відіграє ключову роль для клітинної адгезії, що є життєво важливим у процесах ембріонального розвитку, морфогенезу тканин та регенерації. E-Cadherin допомагає встановити та підтримувати полярність та організацію епітеліальних клітин, забезпечуючи правильну архітектуру тканин. Білок щільних контактів також бере участь у шляхах передачі сигналу, впливаючи на клітинну проліферацію, диференціацію та виживання клітин. Уперше досліджено особливості пошкодження респіраторного епітелію при бронхіальній астмі на тлі воєнної агресії.
Мета. Визначити імуноцитохімічні особливості експресії маркера щільних контактів Е-cadherin при захворюваннях органів дихання у дітей на тлі воєнної агресії.
Матеріали та методи дослідження. Отримані цитологічні препарати за допомогою апарату Сytospin 4 (Thermo scientific) із лаважної мокроти фарбувалися азур-еозином за Романовським — Гімзою та Папаніколау; проводилися імуноцитохімічні дослідження: маркера E-Cadherin та маркера макрофагів СD68 з контролем.
Результати. При проведенні імуноцитохімічних досліджень у мазках індукованого мокротиння у дітей з бронхіальною астмою на тлі стресогенних чинників воєнної агресії встановлено трансформацію клітин бронхіального епітелію із порушенням їх мембранних структур. Виявлено адгезію клітин бронхіального епітелію з денудацією поверхневих мембран, повною чи частковою на тлі формування конгломератів клітин (рисунок). Позитивна експресія E-Cadherin визначалася у вогнищах адгезії з мікроструктурами мембран, на поверхні чи поза клітинами. Відмічена позитивна експресія E-Cadherin в мембранах поодиноких клітин епітелію бронхів при бронхіальній астмі. При загостренні бронхіальної астми не виявлено особливостей експресії E-Cadherin.
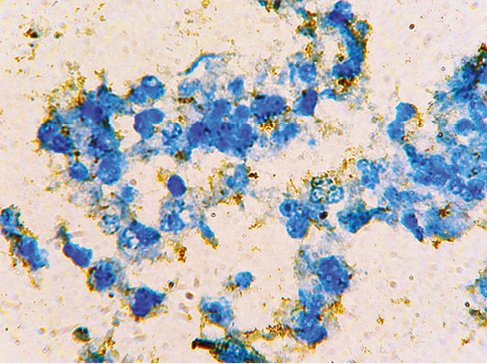
Порівняно з групою дослідження без бронхіальної астми у мазках мокротиння структури адгезії не встановлені. Відмічено позитивну експресію E-Cadherin в мембранах епітелію бронхів.
У паралельному дослідженні маркера макрофагів CD68 при бронхіальній астмі зафіксовано позитивну експресію в 40–50% випадків. Виявлено, що при загостренні процесу підвищення кількості макрофагів становить >80%.
Висновки. Імуноцитохімічне дослідження свідчить про низьку експресію E-Cadherin, що є маркером ураження щільних контактів та трансформації клітин епітелію бронхів та уразливості респіраторного бар’єра. При порівняльному дослідженні встановлено зниження експресії E-Cadherin унаслідок руйнування мембранних структур клітин респіраторного епітелію бронхів та їх адгезію.
Зафіксовано підвищення рівня маркера позитивних макрофагів CD68, особливо у групи дітей із загостренням бронхіальної астми.
Огляд оновлених стандартів цервікального скринінгу в Україні
П.М. Боцюн
ТОВ «CSD LAB», Київ, Україна
Актуальність. У всьому світі захворюваність на рак шийки матки (РШМ) і смертність посідає 4-те місце. Він виліковний за умови раннього виявлення та належного лікування.
В Україні у 2022 р. за даними Національного канцер-реєстру України зареєстровано 3004 нових випадки злоякісних новоутворень (ЗН) шийки матки та 1106 відповідних летальних випадків. Усього у 2023 р. на обліку перебувало 58 419 жінок із ЗН шийки матки.
У 2020 р. Всесвітня організація охорони здоров’я (ВООЗ) оприлюднила Глобальну стратегію елімінації РШМ з метою усунення цього захворювання як проблеми громадського здоров’я, що включає вакцинацію проти вірусу папіломи людини (ВПЛ), скринінг і лікування передракових станів, виявлення й лікування інвазивного раку на ранніх стадіях.
Мета. Проаналізувати нові державні стандарти скринінгу, які набули чинності у 2024–2025 рр.
Матеріали та методи дослідження. У нашій роботі опрацьовано Клінічну настанову та стандарт «Скринінг раку шийки матки. Ведення пацієнток з аномальними результатами скринінгу та передраковими станами шийки матки» від 18.06.2024 р., наказ Міністерства охорони здоров’я (МОЗ)України від 5.08.2024 р. № 1368 «Про забезпечення скринінгу і ранньої діагностики окремих видів раку та моніторингу стану здоров’я пацієнтів з груп ризику».
Результати. Ключові положення нормативних документів: затверджено новий порядок скринінгу і ранньої діагностики РШМ та моніторингу стану здоров’я пацієнток з груп ризику, які набули чинності з 1 січня 2025 р.; стандартизовано організацію скринінгу РШМ та надання медичної допомоги при аномальних результатах скринінгу і передракових станах. Стратегії скринінгу включають або первинний скринінг на ВПЛ, або цитологічне дослідження. Рутинний скринінг РШМ проводиться лише у жінок, які не здійснювали скринінгу раніше, первинне скринінгове тестування на ВПЛ виконується із генотипуванням 1 раз на 10 років, починаючи з віку 35 років.
Висновки. В Україні набули чинності нові стандарти цервікального скринінгу, регламентовані наказами МОЗ від 18.06.2024 р. та 5.08.2024 р., які набули чинності з 1 січня 2025 р. Впроваджується первинне ВПЛ-тестування. Позитивний результат тестування на ВПЛ потребує проведення сортувального генотипування та цитологічного дослідження. Позитивний результат цитологічного дослідження потребує ВПЛ-тестування.
Випадки шкіряної форми лейшманіозу. Аспекти цитоморфологічної діагностики
В.М. Бочаров
Одеський національний медичний університет, Одеса, Україна
Актуальність. Лейшманіози посідають 1-ше місце за поширеністю в тропічній медицині: реєструються в 98 країнах світу, де наражаються на ризик зараження більш ніж 350 млн осіб. За оцінками експертів Всесвітньої організації охорони здоров’я (ВООЗ), щороку виникають від 0,7 до 1,2 млн нових випадків лейшманіозу. Захворювання, на жаль, діагностується на неналежному рівні, тому багато випадків залишаються невідомими. У зв’язку з цим можна припустити, що в ендемічних районах захворюваність вища, ніж реєструється.
Мета. Зауважити на особливості цитоморфології виразок при шкіряних формах лейшманіозу в роботі лікарів-лаборантів та цитоморфологів.
Матеріали та методи дослідження. Проведено забір та дослідження матеріалу з місць ураження шкіри хворих на лейшманіоз на базі Комунального некомерційного підприємства «Міська клінічна інфекційна лікарня» Одеської міської ради. Цитоморфологічне дослідження мазків відбитків з виразок проводилося за пофарбованими препаратами за Романовським — Гімзою.
Результати. При цитологічному дослідженні вміст матеріалу в препаратах досить мізерний, виявляється кілька білих кров’яних тілець на тлі невеликої кількості еритроцитів та великої кількості фібрину. Лейкоцити представлені лімфоцитами, нейтрофілами і макрофагами, в яких, як і міжклітинному просторі, у великій кількості виявляються найпростіші, що ідентифіковані як Leishmania spp.
Висновки. У зв’язку з тим, що дана патологія є рідкісною та не характерною для України, обізнаність лікарів щодо цієї нозології не є достатньою. Так, на себе звертає увагу необхідність своєчасного та правильного забору матеріалу із зони ураження, фіксування та фарбування мазків з подальшим правильним інтерпретуванням отриманих результатів.
Фолікулярна аденома щитоподібної залози з химерними ядрами: проблеми цитологічної та гістологічної діагностики
Н.І. Белемець1, О.О. Гузь2, К.О. Дрига1
1ДНП «Український науково-практичний центр ендокринної хірургії, трансплантації ендокринних органів і тканин МОЗ України», Київ, Україна
2КНП «Київський міський клінічний онкологічний центр», Київ, Україна
Актуальність. Патологія щитоподібної залози охоплює гетерогенну групу клініко-морфологічних утворень, зокрема рідкісні та діагностично складні нозології. Фолікулярні пухлини щитоподібної залози мають багато спільних клінічних та цитоморфологічних особливостей, що створює труднощі в диференціюванні доброякісних та злоякісних новоутворень щитоподібної залози як при цитологічному дослідженні при доопераційній діагностиці, так і при гістологічному дослідженні операційного матеріалу. Фолікулярна аденома з химерними ядрами (ФАХЯ) є одним із рідкісних підтипів аденом, пов’язаних з мутацією пухлинного гена-супресора ТР53.
Мета. Визначити діагностичні цитоморфологічні, гістологічні та імуногістохімічні ознаки ФАХЯ.
Матеріали та методи дослідження. Для дослідження відібрані 10 гістологічно верифікованих випадків ФАХЯ з доопераційною тонкоголковою аспіраційною пункційною біопсією у хворих з тиреоїдектомією. За цитологічним висновком вузли мали класифікаційні категорії Bethesda IV, V, VI. Вивчалися гістологічні препарати, забарвлені гематоксилін-еозином та цитологічні біоптати, пофарбовані за Май-Грюнвальд — Гімзою. Проведено імуногістохімічне дослідження з використанням антитіл HBME-1, р53, галектину-3.
Результати. При цитологічному дослідженні в біоптатах визначали гіперхромні великі химерні ядра, при гістологічному дослідженні — інкапсульовані аденоматозні вузли макро-мікрофолікулярної будови. Виявлялися зони мікрофолікулярної будови з химерними гіперхромними ядрами без мітозів, що імуногістохімічно позитивно забарвлювалися на p53 та мали низький рівень індексу проліферації Ki-67, негативну реакцію до антитіл HMBE-1 та галектину-3.
Висновки. Застосування комплексного підходу до діагностики фолікулярних утворень щитоподібної залози дозволить уникнути гіпердіагностики та знизити кількість хибнопозитивних результатів.
Випадок мукоепідермоїдної карциноми щитоподібної залози
А.В. Демчук
КНП «Вінницьке обласне патологоанатомічне бюро Вінницької обласної ради», Вінниця, Україна
Мукоепідермоїдна карцинома щитоподібної залози — рідкісне злоякісне новоутворення низького ступеня злоякісності з епідермоїдним та муцинозним компонентами.
Мета. Визначити основні діагностичні морфологічні критерії мукоепідермоїдної карциноми щитоподібної залози.
Матеріали та методи дослідження. Проведено гістологічне дослідження операційного матеріалу щитоподібної залози з вузлами в обох долях, надіслану блоком після тиреоїдектомії у пацієнтки С., 36 років. Для визначення гістогенезу компонентів пухлини використовували додаткове гістохімічне фарбування (конго червоний, альціановий синій, ШИК-реакція) та імуногістохімічне дослідження.
Результати. У правій долі щитоподібної залози виявлено вузол у капсулі розміром 45 мм, який мав досить щільну консистенцію, на розрізі — з жовтуватими та бурими ділянками. При мікроскопії пухлина представлена округлими, полігональними, витягнутими клітинами, що формують солідні поля, залозоподібні структури, гнізда, розділені прошарками фіброзної тканини різної товщини з явищами гіалінозу, міксоматозу, невеликими скупченнями лімфоцитів та плазмоцитів, які подекуди розташовані периваскулярно, групами помірно повнокровних судин середнього та дрібного калібру. Пухлинні клітини характеризуються широкою або помірною нечіткою цитоплазмою, збільшеними округлими та овальними ядрами з блідим (везикулярним) хроматином, поодинокими чіткими нуклеолами. При імуногістохімічному дослідженні встановлена імунореактивність до панцитокератину, TTF-1, PAX 8, вогнищево — СК 19, пухлинні клітини не експресували кальцитонін, тиреоглобулін, синаптофізин, хромогранін, CD5, мали низьку проліферативну активність: Кі-67 до 2%. Депозити амілоїду відсутні. Відмічалося позитивне специфічне забарвлення на позаклітинний муцин, наявність гіаліноподібних глобул у цитоплазмі деяких клітин новоутворення. Поза пухлиною спостерігались явища хронічного лімфоцитарного тиреоїдиту.
Висновки. На основі даних морфологічної картини, гістохімічного та імуногістохімічного досліджень виявленого новоутворення діагностовано мукоепідермоїдну карциному щитоподібної залози.
Новітні підходи до цитологічної діагностики та прогнозування поведінки папілярного раку щитоподібної залози
Г.В. Зелінська, Г.М. Кулініченко, Г.Я. Устименко
ДУ «Інститут ендокринології та обміну речовин ім. В.П. Комісаренка» НАМН України, Київ, Україна
Актуальність. Найбільш ефективним методом доопераційної діагностики новоутворень щитоподібної залози (ЩЗ) є тонкоголкова аспіраційна пункційна біопсія (ТАПБ) з наступним цитологічним дослідженням. Проблеми цитологічної діагностики пов’язані зі складністю визначення фолікулярної неоплазії, фолікулярного варіанта папілярних карцином (ПК), ПК з недостатньо вираженими цитологічними ознаками малігнізації, що потребує розробки більш ефективних методів цитологічної діагностики. Актуальною проблемою діагностики та лікування ПКЩЗ є радіойодрезистентні метастази (РЙРМ), для яких терапія радіойодом (РЙ) є неефективною. Тому актуальними є дослідження цитологічних особливостей клітин пунктатів ПКЩЗ та їх метастазів, що є основою розробки методів їх точної передопераційної діагностики та прогнозування поведінки пухлин.
Мета. Виявлення цитологічних та імуноцитохімічних маркерів малігнізації та РЙ-резистентності ПКЩЗ.
Матеріали та методи дослідження. Цитологічні та імуноцитохімічні дослідження проведені на матеріалі ТАПБ та відбитках, що отримані від 188 пацієнтів з РЙРМ та 154 хворих ПКЩЗ з позитивним ефектом РЙ-терапії, а також пунктатах 230 ПКЩЗ та 120 доброякісних новоутворень ЩЗ. Використовували моноклональні антитіла до тиреоїдної пероксидази (ТПО), тиреоглобуліну, цитокератину 17 (ЦК-17). Статистичну обробку даних проводили за допомогою критерію Манна — Уїтні та методом кореляційного аналізу при достовірних показниках p <0,05. Розрахунки виконано в пакеті Statistica 12 StatSoft.
Результати. Виявлено, що вміст ЦК-17-позитивних тиреоцитів статистично імовірно вищий, а вміст ТПО — нижчий в пунктатах злоякісних новоутворень ЩЗ порівняно з доброякісними (р <0,001). Встановлено, що експресія ЦК-17 статистично імовірно вища в пунктатах ПКЩЗ у пацієнтів з розвитком РЙ-резистентності порівняно з хворими з високою ефективністю РЙ-терапії (р <0,001). Доведено зворотний кореляційний зв’язок між вмістом ТПО-позитивних клітин та особливих клітинних фенотипів у пунктатах ПКЩЗ та частотою їх післяопераційного метастазування (p <0,05). Показано статистично імовірну різницю між відсотком ТПО-позитивних клітин у пунктатах РЙРМ та РЙ-чутливих метастазів ПКЩЗ.
Висновки. В якості цитологічних маркерів малігнізації вперше запропоновано сумісне визначення експресії ЦК-17 та ТПО в епітелії пунктатів новоутворень ЩЗ. Для виявлення РЙ-резистентності та ефективності РЙ-терапії ПКЩЗ проводиться імуноцитохімічна реакція до ЦК-17 в пунктатах ПКЩЗ та ТПО в пунктатах післяопераційних метастазів ПКЩЗ. Наявність імунореактивності на ТПО та особливих фенотипів клітин у пунктатах ПКЩЗ може бути використано для прогнозування їхньої агресії (післяопераційного метастазування та РЙ-резистентності).
Цитологічна оцінка уражень слинних залоз за Міланською системою звітності
В.В. Карпачова
ТОВ «CSD LAB», Київ, Україна
Актуальність. Цитологічне дослідження уражень слинних залоз методом тонкоголкової аспіраційної біопсії (Fine Needle Aspiration — FNA) є важливим інструментом діагностики. Міланська система звітності цитопатології слинних залоз (Milan System for Reporting Salivary Gland Cytopathology — MSRSGC) дозволяє стандартизувати підхід до оцінки матеріалу, зосереджуючись не на встановленні конкретного діагнозу, а на стратифікації ризику злоякісності (Risk of Ovarian Malignancy — ROM) для кожної категорії.
Мета. Систематизувати оцінку зразків уражень слинних залоз за категоріями ризику MSRSGC.
Матеріали та методи дослідження. У своїй роботі медична лабораторія CSD LAB використовує традиційні мазки. Зразки фарбуються за Паппенгеймом. Дослідження проводиться з урахуванням морфологічних характеристик клітин та фону препарату. Для забезпечення якості аналізу застосовуються сучасні мікроскопи та стандартизовані протоколи обробки зразків, що підвищує точність оцінки.
Результати. Використання MSRSGC у медичній лабораторії CSD LAB дозволило систематизувати оцінку зразків уражень слинних залоз за категоріями ризику. Зразки слинних залоз оцінюються відповідно до 6 основних категорій MSRSGC: Non-Diagnostic (клітини нормальної слинної залози, лізовані еритроцити, жировий детрит, кістозний вміст); Non-Neoplastic (сіалолітіаз, сіалоаденіт, реактивна лімфоїдна гіперплазія, онкоцитоз); AUS: атипія клітин, що не виключає неоплазію, часто пов’язана з реактивними змінами; Neoplasm IV A: доброякісні пухлини, зокрема плеоморфна аденома, пухлина Уортіна; Neoplasm IV B (SUMP): пухлини з невизначеними ознаками злоякісності, наприклад, плеоморфна аденома з атипією клітин; Suspicio us for Malignancy: поодинокі ознаки злоякісності, що не дозволяють встановити точний діагноз; Malignant (карциноми, лімфоми, метастази).
Міланська система підвищує ефективність комунікації між цитологами і клiніцистами, полегшує прийняття рішень щодо подальшого лікування. Вона сприяє чіткому розмежуванню категорій ризику, що допомагає клініцистам визначати необхідність хірургічного втручання або додаткових досліджень. Оцінка цитологічних препаратів уражень слинних залоз потребує не лише морфологічної інтерпретації, але й ґрунтується на тісному взаємозв’язку з клінічними, радіологічними та лабораторними даними. Важливо пам’ятати, що результат тонкоголкової аспіраційної біопсії не є остаточним діагнозом, а є частиною комплексного діагностичного процесу.
Висновки. Впровадження MSRSGC дозволяє стандартизувати оцінку уражень слинних залоз, знижує кількість хибнопозитивних і хибнонегативних результатів, сприяє підвищенню діагностичної точності. Для ефективного застосування системи важливе вдосконалення навичок цитологів у виявленні морфологічних патернів та інтерпретації результатів.
Унікальний клінічний випадок множинної мієломи, що був підтверджений даними гістопатології
Н.Ю. Красовська, М.А. Косогор, А.В. Соміна
КНП «Запорізька обласна клінічна лікарня» Запорізької обласної ради, Запоріжжя, Україна
Актуальність. Діагноз множинної мієломи (ММ) встановлюється на основі морфологічної верифікації патологічного процесу (аспірації кісткового мозку) та виявлення парапротеїнів у сироватці крові та сечі. Критерії діагностики ММ: наявність моноклональних плазматичних клітин у кістковому мозку ≥10% та/або плазмоцитоми, підтвердженої гістологічно, наявність моноклонального парапротеїну в сироватці крові та/або сечі. За відсутності специфічних клінічних проявів діагноз ММ може бути запідозрений на підставі оцінки гематологічних показників та літичних уражень кісток за результатами рентгенологічного дослідження та комп’ютерної томографії (КТ).
Мета. Визначити можливості та значення цитологічного методу в діагностиці ММ. Аналіз випадку виявлення ММ при цитологічному дослідженні плевральної рідини, порівняння з даними КТ, гістології.
Матеріали та методи дослідження. Представлений випадок з практики: ММ, ISS II, IgG та Карра-позитивна, з ураженням легень, плеври, хребців, кісток таза, стегнових кісток. Цитологічне дослідження плевральної рідини проводилося за стандартною методикою з фарбуванням за Паппенгеймом.
Результати. У пацієнта Г., 59 років, при черговому профілактичному огляді на рентгенограмі органів грудної клітини виявлено периферичне утворення верхньої долі лівої легені, лівобічний гідроторакс. При КТ-дослідженні — ознаки вторинного ураження плеври, лівобічного гідротораксу, вторинної лімфаденопатії середостіння, заочеревинного простору, вторинного вогнищевого ураження (остеолітичного типу) тіл хребців, кісток таза, стегнових кісток.
Проведено плевральну пункцію зліва, аспіровано до 110 мл геморагічного ексудату. Висновок цитологічного дослідження плевральної рідини: тип IV — підозра на злоякісний процес (Suspicious for malignancy — SFM), плазмоцитому, згідно з Міжнародною цитологічною класифікацією випітних рідин (The international system for reporting serous fluid cytopathology — ISRSFC), 2020 р. Для підтвердження клонального походження плазмоцитів була рекомендована проточна цитометрія плевральної рідини, дослідження кісткового мозку, загальний аналіз крові, біохімічні дослідження.
При дослідженні кісткового мозку кількість плазмоцитів з морфологічними ознаками атипії становила 28%. Висновок: цитологічна картина кістковомозкового пунктату відповідає ММ.
При біохімічному дослідженні загальний білок — 106,4 г/л, М-градієнт — 36,2 г/л, білок сечі — 0,173 г/л, лактатдегідрогеназа (ЛДГ) — 130,9 Од/л, β2-мікроглобулін — 3798 нг/мл. Імунофіксація парапротеїнів сироватки крові: у зоні гамма-глобулінів виявлено парапротеїн IgG та легкий ланцюг каппа у кількості 34%.
Проведено трепан-біопсію новоутворення лівої легені під КТ-контролем. Патогістологічний висновок: плазмоклітинна пухлина (ММ або екстрамедулярна плазмоцитома).
Висновки. Цитологічний висновок ММ за випітною рідиною іноді досить складно встановити тільки на підставі цитоморфології, необхідні додаткові дослідження, але він дає змогу спрямувати клініциста в потрібному діагностичному напрямку.
Застосування новітніх технологій у нейрохірургії: клініко-морфологічні зіставлення у визначенні предикторів діагностичних похибок
О.Ю. Малишева, В.В. Васлович
ДУ «Інститут нейрохірургії ім. акад. А.П. Ромоданова НАМН України», Київ, Україна
Актуальність. При різних формах пухлин центральної нервової системи (ЦНС) топографо-анатомічні співвідношення структур індивідуально змінені. Інтраопераційний нейромоніторинг (ІОНМ) широко використовується, у США — входить до переліку обов’язкового обладнання нейрохірургічної операційної, однак протоколи, засновані на доказових засадах, ще лише формуються. Коректне обґрунтоване застосування ІОНМ має певні аспекти: анатомічні, функціональні особливості нервової системи, широкий спектр певних модальностей ІОНМ, технічні вимоги до приміщень і обладнання, варіативна анатомія, значна гетерогенність патології, досвід оцінки даних.
Мета. Аналіз даних результативності і обґрунтування диференційованого застосування ІОНМ в нейрохірургії й морфологічне обґрунтування варіативності результатів за даними наукової літератури і перших власних спостережень.
Результати. ІОНМ сприяє об’єктивізації функціонального стану ЦНС, доповнюючи візуальну ідентифікацію патологічних новоутворень і анатомічних нервових структур щодо виважених рішень під час операції. Власний клінічний матеріал потребує систематизації і порівнянь з індивідуальними морфологічними змінами головного мозку, патологічного вогнища, зумовлених ними неврологічними розладами, особливостями моніторингу різних анатомічних ділянок та принципів оцінювання його результатів. Мультимодальний ІОНМ, враховуючи специфічність і чутливість кожної з методик, є найбільш ефективним і точним для запобігання периопераційній травмі, особливо з врахуванням гістологічних і анатомічних характеристик патологічних новоутворень ЦНС.
Висновки. Предикторами діагностичних похибок можна вважати анатомо-топографічні варіанти та їх просторове спотворення в разі поширення пухлини відносно провідних шляхів і ядерних формацій; складнощі візуалізації та ідентифікації у зіставленні із інтраопераційно зміненою нейроанатомією; відсутність стандартів його застосування; сертифікація обладнання для нейромоніторингу та умови ефективного і безпечного його функціонування під час операції; особливості анестезіологічного забезпечення операцій з ІОНМ. Запорука максимального результату для пацієнта — злагоджена синхронна командна робота нейрохірурга, нейрофізіолога та анестезіолога. Майбутні дослідження мають бути зосереджені на розробці методології застосування ІОНМ, впровадженні практичних протоколів та узгоджених клінічних рекомендацій. Оскільки проспективні дослідження щодо визначення ефективності втручань з ІОНМ малоймовірні через етичні, правові та страхові обмеження, потреба у проспективних когортних дослідженнях є виправданою.
Еволюція класифікацій пухлин нервової системи. Окремі положення 5-ї редакції класифікації ВООЗ
Т.А. Малишева, О.Г. Черненко, Г.А. Шмельова
ДУ «Інститут нейрохірургії ім. акад. А.П. Ромоданова НАМН України», Київ, Україна
Актуальність. Класифікація пухлин центральної нервової системи (ЦНС) відрізняється від класифікації новоутворень інших органів і систем, зважаючи на унікальну кластерну будову ЦНС, відмінності від загальних в онкології принципів. Раніше вона базувалася на суто гістологічних принципах, згодом — із врахуванням імуногістохімічних та ультраструктурних ознак, а віднедавна — з визначенням генетичних і молекулярних маркерів, які набули певної значущості щодо валідності прогнозу відповіді на лікування, особливостями і варіативністю перебігу захворювання.
Пʼята редакція класифікації пухлин ЦНС (CNS5) Всесвітньої організації охорони здоров’я (ВООЗ) 2021 р. включає окремі молекулярні зміни з доведеною практичною прогностичною значущістю за даними багатоцентрових когортних досліджень, важливих для «протокольних» схем лікування. Основними етапами формування морфологічного діагнозу пухлини ЦНС є: I етап — встановлення патогістологічного компонента морфологічного діагнозу, II етап — імуногістохімічне (ІГХ) або молекулярно-генетичне дослідження, що визначає молекулярний профіль клітин переважного пулу проліферату (статус ІDН, МGМТ), III етап — синтез заключення із зіставленням клінічного діагнозу, даних нейровізуалізації з гістологічним висновком з врахуванням молекулярного критерію, отже — інтегральний. Якщо повне визначення мутацій у гліомі IDH неможливе, діагноз звучить як дифузна астроцитома NOS (Not Otherwise Specified) (або БДУ — без додаткового уточнення) II–IV ступеня злоякісності (G).
Основні зміни 5-ї редакції класифікації пухлин ЦНС 2021 р.: сформульована концепція структури морфологічного діагнозу пухлин ЦНС в молекулярну еру. У групі дифузних гліом (молекулярні варіанти) представлений новаторський підхід до розподілу гліальних пухлин «педіатричного» типу. Гліоми дитячого і дорослого типу високого ступеня злоякісності (pНGG і aНGG), маючи спільні гістологічні характеристики, відрізняються за локалізацією, біологічною поведінкою, молекулярно-генетичним профілем, прогнозом. Дифузні гліоми дитячого типу розподілено на низькозлоякісні (low-grade) та високозлоякісні (high-grade) із підтипами, відповідно, LGG і HGG, що свідчить про ключову роль фактора віку в їх морфогенезі. Спадкові синдроми, асоційовані із розвитком гліом (NF-1, TSC), пов’язані зі специфічними типами гліом низького ступеня злоякісності, які виникають у дітей, осіб молодого віку і, на відміну від aLGG, pLGG, характеризуються наявністю принаймні однієї мутації, шляху MAPК. Основною відмінністю aHGG від pHGG є мутації IDH 1/2, експресія гена EGFR, мутації TERT, зміни хромосом (+7 / -10) та мутація TP53, які стосуються прогнозу перебігу гліом HGG. Представлено перебудову групи ембріональних пухлин, з розподілом медулобластом на гістологічні і молекулярні типи; перегрупування за віком, локалізацією та генетичними характеристиками епендимом; введено в класифікацію аденом гіпофіза пітуїтарних нейроендокринних пухлин (PitNET G1-3); вилучено термін «примітивна нейроектодермальна пухлина» (РNЕТ).
Висновки. Експерти ВООЗ CNS5 адаптували класифікацію пухлин ЦНС, зберігши ключові аспекти традиційної структури розподілу пухлин ЦНС у нейроонкології, проте лише окремі типи новоутворень сертифіковані за певними молекулярними характеристиками, що, зрозуміло, у подальшому змінюватиметься, зважаючи на новітні методологічні, аналітичні й семантичні принципи. Класифікація дозволяє досягти верифікації гістологічного діагнозу за відсутності молекулярних даних у реальних ситуаціях (NOS / NES) за допомогою застосування «інтегральних» показників та мультидисциплінарних консиліумів у високоспеціалізованих фахових установах. Сподіваємося, що зміни щодо характеристики пухлин ЦНС стануть практичним керівництвом для нейрохірургів, патологів, нейроонкологів й принесуть користь пацієнтам.
СOVID-19: морфологічні прояви і зміни головного мозку
Т.А. Малишева, О.Г. Черненко, Г.А. Шмельова, О.Ю. Малишева, В.В. Васлович
ДУ «Інститут нейрохірургії ім. акад. А.П. Ромоданова НАМН України», Київ, Україна
Актуальність. Науковці прогнозують довгострокові наслідки COVID-19, зважаючи на морфологічні зміни тканин, зокрема і центральної нервової системи. Показано взаємодію TSP1 з ліпопротеїновими рецепторами VLDLR і ApoER2, які зосереджені в тканинах головного мозку (ГМ).
Мета. Виявлення і оцінка морфологічних та імуногістохімічних (TSP-1, р-53) характеристик тканин ГМ з врахуванням термінів COVID-19, які клінічно протікали як гостре порушення мозкового кровопостачання (ГПМК) з летальним наслідком.
Матеріали та методи дослідження. Представлені 4 летальні випадки з клінічними проявами ГПМК (цереброваскулярна хвороба за ішемічним і змішаним типами) та 1 — з пухлиною на тлі пневмонії. В усіх випадках виконано аутопсію з наступним гістологічним дослідженням (2021). З них — 4 чоловіки і 1 жінка віком від 45 до 72 років. Етіологію COVID-19 в усіх підтверджено за допомогою полімеразної ланцюгової реакції (ПЛР). Терміни прогресування симптомів становили від 2 до 23 діб. З 5 випадків — 2 оперовані (видалення інсульт-гематом). Використовували гістологічні забарвлення: оглядові, MSB (модифікація), тіоніном за Ніссле; морфометричний метод дослідження (вимірювання абсолютних розмірів різних клітин та їх співвідношення (індекси)); імуногістохімічний — виявлення антигенів TSP-1, р-53 за допомогою системи полімерної детекції UltraVision Quanto.
Результати. При розтинах виявлено системну коагулопатію, у легенях — гострий респіраторний дистрес, у ГМ — крововиливи, гострі гіпоксично-ішемічні зміни, лакунарні інфаркти ГМ, нейронофагію, сателітоз, демієлінізацію з аксональними кулями, фокальний астрогліоз, мікрогліальні вузлики, фокальне лімфоїдне запалення, у нюхових цибулинах — статистично значуще зниження щільності спеціалізованих нейронів з корелятивними зв’язками з терміном захворювання. Імуногістохімічно виявлено експресію тромбоспоніну в зонах деструкції мієліну (ішемічних ділянках і вогнищах демієлінізації провідних шляхів), що, на нашу думку, опосередковано свідчить про гостру асинапсію.
Патогенез ушкодження тканин ГМ при COVID-19 включає прямий механізм та опосередковані події. Імуногістохімічне визначення TSP-1 як маркера пошкодження мієлінізованих шляхів ГМ, виявлене нами, є перспективним щодо подальших досліджень танатогенезу COVID-19. Ендотеліальна дисфункція зумовлює системне порушення мікроциркуляції, вазоконстрикцію зі збільшенням вираженості ішемії ГМ, запаленням і набряком тканини й клінічних віддалених проявів і наслідків коронавірусної хвороби. Наші дані корелюють і узгоджуються з даними інших авторів (Yong Н., 2021–2022).
Висновки. Стратегічне спрямування щодо оцінки наслідків COVID-19 з врахуванням виявлених морфологічних змін ГМ, не лише постмортальних, є актуальним особливо для груп ризику щодо прогнозування та попередження перебігу клінічних проявів дисфункції ендотелію (артеріальна гіпертензія, цукровий діабет, ожиріння та серцево-судинні захворювання).
Освіта та підготовка цитотехнологів у Європі: рекомендації Європейського комітету
І.В. Панько
ТОВ «CSD LAB», Київ, Україна
Актуальність. Цитотехнологія є однією з ключових дисциплін лабораторної медицини, що забезпечує раннє виявлення передракових та ракових змін у клітинних зразках. Європейський консультативний комітет з цитотехнології (European Advisory Committee of Cytotechnology — EACC) та Європейська федерація товариств цитології (European Federation of Cytology Societies — EFCS) розробили рекомендації, спрямовані на встановлення єдиних стандартів освіти, що сприятимуть підвищенню якості цитологічної діагностики та професіоналізму фахівців.
Мета. Впровадження стандартів підготовки цитотехнологів за програмою EFCS.
Матеріали та методи дослідження. Запропонована освітня програма для підготовки цитотехнологів включає 3 основні модулі: гінекологічна цитологія (вивчення клітин шийки матки, виявлення передракових змін та карциноми in situ); негінекологічна ексфоліативна цитологія (оцінка клітин органів дихання, сечостатевої системи, рідин порожнин тіла); цитологія тонкоголкової аспірації (дослідження аспіратів тканин, включно з органами та лімфатичними вузлами).
Навчання має тривати не менше 1 року та поєднувати теоретичні курси в університетських закладах із практичною підготовкою в сертифікованих цитологічних лабораторіях. До обов’язкових вимог до викладачів входить наявність мінімум 5-річного досвіду в цитоморфології. Практичне навчання повинно охоплювати оцінку великої кількості різноманітних клінічних випадків.
Результати. Успішне завершення програми підтверджується сертифікацією за стандартами EFCS, що свідчить про відповідність високим європейським вимогам.
Висновки. Рекомендації EACC спрямовані на забезпечення єдиного високого стандарту підготовки цитотехнологів у Європі. Реалізація цих стандартів сприяє підвищенню якості цитологічної діагностики та своєчасному виявленню патології; забезпечує рівномірний розподіл професійної компетентності серед фахівців різних країн; підвищує загальний рівень охорони здоров’я завдяки більш точному і ранньому виявленню захворювань.
Успішне впровадження цих рекомендацій потребує підтримки з боку медичних закладів, навчальних установ і державних органів охорони здоров’я, а також активної участі самих цитотехнологів у процесі постійного професійного розвитку.
Анальна цитологія: сучасні підходи та перспективи розвитку
М.І. Панько
ТОВ «CSD LAB», Київ, Україна
Актуальність. Анальна цитологія набуває дедалі більшої значущості в сучасній медицині як метод раннього виявлення передракових змін і анального раку, зокрема серед груп пацієнтів із підвищеним ризиком (особи з вірусом імунодефіциту людини (ВІЛ), чоловіки, які мають секс із чоловіками, жінки після цервікальної інтраепітеліальної неоплазії (Cervical intraepithelial neoplasia — CIN)). Підвищення частоти анального раку останніми роками потребує вдосконалення методів скринінгу. Якісне проведення всіх етапів дослідження та правильна інтерпретація результатів є основою ефективного скринінгу та моніторингу пацієнтів груп ризику.
Мета. Вивчити можливості анальної цитології як методу скринінгу передракових змін анального каналу і анального раку.
Матеріали та методи дослідження. Матеріалом для дослідження є клітинні зразки, отримані шляхом обережного вишкрібання слизової оболонки анального каналу стерильним тампоном або спеціальною щіточкою. Зразки фарбуються за методикою Папаніколау, що забезпечує якісну візуалізацію клітинних деталей. Інтерпретація результатів здійснюється за адаптованою системою Bethesda, яка передбачає класифікацію змін за ступенем дисплазії та виявлення анальної інтраепітеліальної неоплазії (Anal intraepithelial neoplasia — AIN) різних ступенів тяжкості.
Результати. У ході аналізу анальних цитологічних препаратів встановлено, що інфекція вірусом папіломи людини (ВПЛ) є основним етіологічним чинником розвитку диспластичних змін. AIN виявляється у значної частки обстежених пацієнтів груп ризику, причому частота змін варіює залежно від рівня імунного статусу та супутніх факторів.
Підкреслено важливість комбінування анальної цитології з високороздільною аноскопією для підвищення точності діагностики. Додаткове тестування на ВПЛ сприяє кращій стратифікації ризику та визначенню потреби в подальшому обстеженні або лікуванні.
Висновки. Анальна цитологія є ефективним і перспективним методом скринінгу для виявлення передракових станів анального каналу, особливо у групах високого ризику. Її інтеграція у клінічну практику дозволяє знизити захворюваність та смертність від анального раку.
Важливими завданнями на сучасному етапі є стандартизація методики забору матеріалу та підготовки препаратів, вдосконалення інтерпретаційних критеріїв, розширення програм скринінгу із залученням тестування на ВПЛ та високороздільної аноскопії.
У майбутньому очікується впровадження чітких національних рекомендацій для скринінгу анального раку, що сприятиме підвищенню якості діагностики та ранньому виявленню патологічних процесів. Разом із впровадженням новітніх технологій та розширенням знань у сфері анальної цитології необхідним залишається підвищення кваліфікації спеціалістів у цій галузі.
Глибокий інфільтративний ендометріоз кишечнику: клінічний випадок
О.В. Рубан, В.В. Мед, Л.В. Скорода
ДНП «Національний інститут раку», Київ, Україна
Актуальність. Ендометріоз — це хронічне прогресуюче захворювання, яке значно впливає на якість життя жінок репродуктивного віку, супроводжується вираженим больовим синдромом і зниженням репродуктивної функції. Статистичні дані свідчать, що загальна кількість жінок з ендометріозом зросла з 9 млн у 2015 р. до 11 млн у 2025 р. Особливо складною залишається діагностика глибоких вісцеральних форм ураження, зокрема кишечнику. Глибокий ендометріоз кишечнику часто маскується під інші захворювання шлунково-кишкового тракту, що ускладнює своєчасну діагностику та лікування.
Мета. Аналіз випадку глибокого інфільтративного ендометріозу кишечнику.
Результати. Жінка, 39 років, була ургентно госпіталізована в один з обласних хірургічних центрів із симптомами гострої кишкової непрохідності. Проведено колоноскопію, під час якої виявлено неопластичне новоутворення товстої кишки. Під час ендоскопічного обстеження виконано біопсію пухлини, за результатами якої встановлено підозру на рак прямої кишки. Надалі пацієнтці проведено лапароскопічну наднизьку передню резекцію ураженої ділянки прямої кишки з формуванням сигморектоанастомозу та енуклеацію ендометріоїдної кісти яєчника. За результатами гістологічного дослідження, виконаного в іншій лабораторії, встановлено муцинозну аденокарциному G3 на тлі дифузного ендометріозу. Пацієнтку скеровано до Національного інституту раку для подальшої консультації та визначення оптимальної тактики лікування. При консультативному перегляді гістопрепаратів та проведенні імуногістохімічного дослідження (ER+, PR+, CDX2-) діагноз «муцинозна аденокарцинома G3» кишки було виключено та діагностовано дифузний глибокий ендометріоз стінки товстої кишки.
Висновки. Глибокий інфільтративний ендометріоз кишечнику є однією з найскладніших форм захворювання через свою клінічну поліморфність. Характерними ознаками є проникнення ендометріоїдних структур у м’язову та серозну оболонку кишечнику, що потребує чіткої диференціації з пухлинними ураженнями.
Клінічна настороженість щодо нетипових проявів ендометріозу, особливо у пацієнток молодого віку, має важливе значення в контексті онкологічної діагностики, у тому числі органів шлунково-кишкового тракту. Гістологічне та імуногістохімічне дослідження є золотим стандартом для остаточного встановлення діагнозу та диференційної діагностики з онкологічними процесами, що може принципово змінити менеджмент лікування, значно поліпшити його результати та якість життя пацієнтів.
Цитологічна та імуногістохімічна діагностика метастазів з використанням клітинних блоків
К.П. Тумасова, Н.В. Чепур
ДУ «Національний науковий центр хірургії та трансплантології ім. О.О. Шалімова НАМН України», Київ, Україна
Актуальність. Цитологічне дослідження рідин, отриманих із серозних порожнин при різних патологічних пухлинних та непухлинних процесах, залежить від наявності різних клітинних елементів та збільшення вираженості змін морфології клітин у рідинному середовищі, а саме виникнення виражених ознак атипії, що утруднює ідентифікацію клітин. Тільки зіставлення цитологічної картини з імуногістохімічними дослідженнями дозволяє визначити первинну локалізацію пухлини.
Мета. Покращити морфологічну діагностику наявності дисемінації пухлинного процесу.
Матеріали та методи дослідження. Після проведення цитологічних досліджень випітних рідин у разі наявності клітин з ознаками атипії, коли ступінь їхньої вираженості не дозволив кількісно або якісно визначити ці клітини як злоякісні, з осаду цих рідин виготовляли цитоблоки. Матеріал для них центрифугували та фіксували у 10% розчині формаліну, після чого клітинний згорток ущільнювали в парафіні за загальноприйнятою схемою, отримуючи клітинні блоки. На зрізах товщиною 2 мкм для діагностики пухлин проводили імуногістохімічні реакції з використанням маркерів PAX-8, EpCAM, Claudin-4.
Результати. Діагностика отриманого матеріалу здійснювалася за Міжнародною цитологічною класифікацією випітних рідин (The international system for reporting serous fluid cytopathology — ISRSFC), 2020. При цитологічному дослідженні препаратів осаду рідин (плевральної, асцитичної), коли відмічалися клітини з різним ступенем ознак атипії, залозисті або папілярні структури, скупчення клітин з поліморфними ядрами, що містили ядерця та мали дистрофічні та дегенеративні зміни (діагностична категорія 2, 3, 4), а також клітини з ознаками злоякісності (діагностична категорія 5), проводилася додаткова верифікація. Для підтвердження або виключення злоякісного процесу проводили імуногістохімічні дослідження препаратів, отриманих з цитоблоків. Це дозволяло уточнити імунофенотип пухлин.
Висновки. Проведені дослідження свідчать, що тільки при зіставленні цитологічної картини з імуногістохімічними даними, отриманими на матеріалах цитоблоків, можливо вірогідно визначити локалізацію злоякісного процесу.
Тенденції захворюваності на рак шийки матки у жінок репродуктивного віку в Україні
Н.П. Ціп, З.П. Федоренко, О.В. Сумкіна, Ю.Й. Михайлович, Л.Б. Куценко
ДНП «Національний інститут раку», Київ, Україна
Актуальність. Незважаючи на візуальну локалізацію, рак шийки матки (РШМ) залишається однією з найпоширеніших злоякісних пухлин у жінок. За даними Міжнародного агентства з вивчення раку (International Agency for Research on Cancer — IARC) щорічно у світі реєструються 661 021 новий випадок захворювання — нова пацієнтка кожні 48 с! Щорічно помирають від РШМ 348 189 жінок — 1 смерть кожні 1,5 хв!
Мета. Скласти прогностичну оцінку рівня захворюваності на РШМ (C53) у жінок репродуктивного віку в Україні до 2026 р.
Матеріали та методи дослідження. Застосовано методи статистичного аналізу, що використовуються в описовій онкоепідеміології. Когорта пацієнток з РШМ включала 56 579 випадків. Розрахунок показників захворюваності проведено на основі 100 тис. населення, а також стандартизовано відповідно до світового стандарту. Обробку даних проводили за допомогою програм інформаційної системи Національного канцер-реєстру України.
Результати. За прогностичними оцінками, показник захворюваності на РШМ у групі віком 0–29 років має сталу тенденцію до зростання і до 2026 р. досягатиме 23,4%. Рівень захворюваності на РШМ у жінок віком 30–39 років у 2026 р. дорівнюватиме 39,30/0000, тобто приріст становитиме 23,4%; у групі віком 40–49 років цей показник зросте до 61,30/0000 з приростом 29,8% (рисунок).
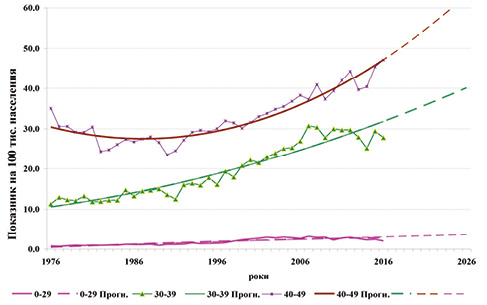
Висновки. Онкоепідеміологічна ситуація в когорті жінок репродуктивного віку підкреслює гостроту проблеми популяційного скринінгу РШМ в Україні.
Цитоморфологічні характеристики пітуїтарних нейроендокринних пухлин (PitNET) та їх роль у визначенні ступеня злоякісності (Grading)
Черненко О.Г.
ДУ «Інститут нейрохірургії ім. акад. А.П. Ромоданова НАМН України», Київ, Україна
Актуальність. Нейроендокринні пухлини гіпофіза (PitNET) — група новоутворень, неоднорідних за морфологічною будовою та клінічною поведінкою, для яких ще досі не встановлено чітких критеріїв ступеня злоякісності (Grade). На відміну від інших нейроендокринних пухлин, критерії наявної системи стратифікації PitNET, їх агресивності, знаходяться в процесі формування та потребують подальшого вивчення.
Мета. Вивчення можливих цитоморфологічних критеріїв агресивності перебігу PitNET для вдосконалення системи стратифікації цих пухлин. Проведення морфометричних досліджень субпопуляцій клітин гормонально неактивних та різних типів гормонально активних PitNET та встановлення кореляції між ядерно-цитоплазматичним співвідношенням (ЯЦС) та індексом проліферації Ki-67.
Матеріали та методи дослідження. Проведено клініко-морфологічне зіставлення 40 випадків аденом гіпофіза у пацієнтів, які були прооперовані в ДУ «Інститут нейрохірургії ім. академіка А.П. Ромоданова НАМН України» за 2018–2020 рр. З них 28 жінок та 12 чоловіків віком від 18 до 52 років. Випадки включали 22 гормонально неактивних аденоми, 18 — гормонально активних, з них 10 — продукують адренокортикотропний гормон (АКТГ), 5 — продукують соматотропний гормон (СТГ), 3 — продукують пролактин. Проводилося комплексне цитологічне, гістологічне та імуногістохімічне дослідження. Для загальної оцінки ступеня злоякісності (Grade) використовувалися цитоморфологічні характеристики та маркери проліферації (індекс Ki-67).
Результати. Дані морфометрії клітин гормонально неактивних аденом гіпофіза (PitNET G1): площа ядра (NA) 38,5±6,2 мкм², площа цитоплазми (CA) 82,3±10,7 мкм², ядерно-цитоплазматичне співвідношення (ЯЦС) (N/C) 0,47±0,05. Дані морфометрії клітин гормонально неактивних аденом гіпофіза (PitNET G2): площа ядра (NA) 41,3±4,2 мкм², площа цитоплазми (CA) 79,5±12,1 мкм², ЯЦС (N/C) 0,64±0,07.
Залежність між ЯЦС та індексом проліферації Ki-67 у гормонально активних аденомах гіпофіза: пролактинома 0,42±0,04 мкм², Ki-67 1,2±0,02%, соматропінома 0,45±0,06 мкм², Ki-67 3,8±0,03%, кортикотропінома 0,43±0,05 мкм², Ki-67 2,7±0,02%. Встановлена помірна варіація обох показників залежно від типу пухлини.
Висновки. Має місце позитивна залежність у гормонально неактивних PitNET: збільшення ЯЦС співвідноситься з вищою агресивністю новоутворення (Grade 2). Також встановлено кореляцію між ЯЦС та індексом проліферації Ki-67 R=0,72, p <0,01 — сильна позитивна кореляція.
У гормонально активних PitNET параметри відрізнялися від гормонально неактивних PitNET. Встановлено залежність між ЯЦС та індексом проліферації Ki-67 у гормонально активних PitNET. Існує помірна варіація обох показників залежно від типу пухлини. R=0,35, p=0,12 — слабка кореляція.
Цитоморфологічні показники з даними морфометрії можна використовувати як один з критеріїв стратифікації (градації) PitNET.














Leave a comment