Сучасні підходи до лікування раннього ВПЛ-асоційованого раку ротоглотки
- 1Державне некомерційне підприємство «Національний інститут раку», Київ, Україна
- 2Національний медичний університет ім. О.О. Богомольця, Київ, Україна
Резюме. Мета. Аналіз сучасних наукових даних щодо ефективності основних підходів до лікування раннього раку ротоглотки, а також висвітлення власного клінічного досвіду використання трансоральної СО₂-лазерної мікрохірургії як первинного методу лікування у пацієнтів із пухлинами ротоглотки стадії T1–T2 N0–N2 M0. Матеріали і методи дослідження. Проведено ретроспективний аналіз результатів лікування 64 пацієнтів із плоскоклітинним раком ротоглотки (ПРРГ) стадії T1–T2 N0–N2 M0, що відповідає раннім формам захворювання, згідно з класифікацією Американського об’єднаного комітету з питань раку (American Joint Commission on Cancer — AJCC) (8-ме видання). Серед них 57 пацієнтів (89,1%) мали ВПЛ-асоційовані (p16-позитивні) пухлини, з яких у 41 випадку (64,1%) діагностовано I клінічну стадію, а у 16 (25,0%) — II стадію. Решта 7 пацієнтів (10,9%) мали ВПЛ-негативний рак, серед яких у 4 (6,25%) встановлено I стадію, а у 3 (4,6%) — II стадію захворювання. Результати. У 59 пацієнтів (92,2%) трансоральну CO₂-лазерну резекцію ротоглотки виконано з використанням орального ретрактора та/або орофарингоскопа. Натомість у 5 пацієнтів (7,8%) через анатомічні особливості ротової порожнини, що унеможливлювали адекватну візуалізацію кореня язика за допомогою орофарингоскопа, хірургічне втручання проведено з формуванням додаткового доступу — «вікна» в ділянці дна ротової порожнини для часткового виведення язика в підпідборідну ділянку, що дозволило візуалізувати корінь язика в анфас для проведення трансоральної СО₂-лазерної резекції. У 58 пацієнтів (90,6%) у ранній післяопераційний період розвивалися транзиторна одинофагія та дисфагія, що є типовим наслідком травматизації слизової оболонки ротоглотки під час трансоральної CO₂-лазерної мікрохірургії. Ці функціональні порушення носили оборотний характер і повністю регресували впродовж 2–4 тиж після втручання завдяки локальному загоєнню тканин та відновленню координації ковтального акту. З метою підтримки адекватного нутритивного статусу 55 пацієнтам (85,9%) встановлено назогастральний зонд, який у середньому видаляли на 5–7 добу післяопераційного періоду. Жоден із пацієнтів не потребував тривалого зондового харчування або гастростомії. У 24 пацієнтів (37,5%) за допомогою гістологічного дослідження первинної пухлини виявлено наступні несприятливі прогностичні фактори (лімфоваскулярну інвазію, периневральну інвазію або близькі краї резекції), що потребувало призначення ад’ювантної променевої терапії (ПТ). У 3 пацієнтів (4,7%) через наявність високого ризику рецидиву (встановлено екстранодальне поширення та/або позитивний хірургічний край резекції (R1)) призначено ад’ювантну хімієпроменеву терапію. Загалом ад’ювантне лікування, ПТ або хімієпроменеву терапію проведено у 27 хворих, що становить 42,2% від загальної кількості залучених у дослідження. У 37 пацієнтів (57,8%) після хірургічного лікування ад’ювантну терапію не призначали, пацієнти перебували під спостереженням. Хірургічні ускладнення були поодинокими та клінічно незначущими. Зокрема, у 4 осіб (6,25%) відзначалася помірна післяопераційна кровотеча, яку було успішно контрольовано консервативними заходами — шляхом місцевої коагуляції та застосування гемостатичних матеріалів. Жоден випадок не потребував повторного хірургічного втручання або трансфузійної підтримки. Особливої уваги заслуговує досвід малоінвазивного хірургічного лікування 5 пацієнтів (7,8%) з локалізацією пухлини в ділянці кореня язика, у яких використано доступ з формуванням «вікна» в ділянці дна ротової порожнини. Оцінка результатів цієї техніки свідчить про її високу ефективність і безпеку. Не відмічалося таких специфічних ускладнень, як нейропраксія під’язикового нерва чи формування під’язикових ранул. Протягом 12-місячного періоду динамічного онкологічного спостереження, що включало регулярні клінічні огляди, ендоскопічний моніторинг та контрольні комп’ютерну томографію / магнітно-резонансну томографію (КТ/МРТ), не виявлено жодного випадку рецидиву або прогресування захворювання. Отримані результати підтверджують онкологічну ефективність трансорального CO₂-лазерного підходу за умови ретельного відбору пацієнтів та дотримання хірургічного протоколу. Висновки. Отримані результати свідчать, що трансоральна СО₂-лазерна мікрохірургія є високоефективним та безпечним первинним методом лікування ранніх форм раку ротоглотки (T1–T2 N0–N2 M0) за умови ретельного відбору пацієнтів та дотримання хірургічного протоколу. Необхідні подальші дослідження порівняння трансоральної СО₂-лазерної мікрохірургії та ПТ як первинних методів лікування раннього раку ротоглотки з оцінкою ефективності, функціональних результатів та якості життя пацієнтів.
Одержано 28.07.2025
Прийнято до друку 15.08.2025
DOI: 10.32471/clinicaloncology.2663-466X.34824
ВСТУП
Світові показники захворюваності на плоскоклітинний рак ротоглотки (ПРРГ), що асоційований з вірусом папіломи людини (ВПЛ), продовжує неухильно зростати [1]. ВПЛ-асоційовані пухлини ротоглотки здебільшого діагностують у молодих пацієнтів без анамнезу тютюнопаління чи зловживання алкоголем, на відміну від ВПЛ-негативного раку ротоглотки [2]. ВПЛ-асоційовані пухлини ротоглотки характеризуються вищою чутливістю до хіміє- та ПТ, що зумовлює вищі показники 5-річної загальної виживаності (ЗВ) порівняно з ВПЛ-негативними пухлинами [3].
Основними методами лікування раннього ПРРГ (І–ІІ стадії за 8-м виданням AJCC) є ПТ, одночасна хімієпроменева терапія або хірургічне втручання. Враховуючи зіставні онкологічні результати радикальної ПТ та хірургії, вирішальну роль при виборі методу лікування відіграють частота ускладнень та функціональні результати. У багатьох медичних закладах перевагу надають ПТ, оскільки деякі дослідження свідчать про вищу частоту ускладнень у пацієнтів після хірургічного лікування. Водночас більшість цих побічних ефектів пов’язані переважно з використанням традиційних відкритих хірургічних доступів до ротоглотки [4].
Останніми десятиріччями набувають популярності малоінвазивні хірургічні методи, такі як трансоральна роботизована хірургія (ТОРХ) або трансоральна СО2-лазерна мікрохірургія (ТОЛМ), в якості методів первинного лікування. У рандомізованих дослідженнях, в яких порівнювали результати ПТ та трансоральної малоінвазивної хірургії (ТМХ), свідчать, що відмінностей у ЗВ та виживаності без прогресування (ВБП) немає, однак ці методи зумовили різні профілі токсичності, що ускладнює вибір оптимального підходу. Попри численні спроби деескалації терапії при ВПЛ-асоційованому ПРРГ — зокрема, шляхом зниження дози ПТ або використання менш інвазивних хірургічних методів — у зв’язку зі сприятливішим прогнозом, чинні клінічні рекомендації щодо лікування наразі залишаються незмінними незалежно від ВПЛ-статусу [5].
Вибір методу лікування раннього раку ротоглотки залишається предметом обговорення. Наразі бракує переконливих даних, що однозначно підтверджують переваги ПТ або ТМХ. Це зумовлює певну невизначеність у виборі оптимальної лікувальної тактики. У цьому контексті дедалі більшої ваги набуває індивідуальний підхід до лікування, який передбачає ретельний вибір первинної стратегії та прагнення до зниження інтенсивності лікування, зокрема через уникнення 3-компонентних схем. З огляду на високі показники ЗВ у пацієнтів із ВПЛ-асоційованими пухлинами дедалі важливішими стають питання пізньої токсичності та збереження якості життя [4, 6].
Метою дослідження є аналіз сучасних наукових даних щодо ефективності основних підходів до лікування раннього раку ротоглотки, а також висвітлення власного клінічного досвіду використання ТОЛМ як первинного методу лікування у пацієнтів із пухлинами ротоглотки стадії T1–T2 N0–N2 M0.
Епідеміологія та прогностичні фактори при ранньому ВПЛ-асоційованому раку ротоглотки
Відомо, що злоякісні пухлини голови та шиї виникають внаслідок взаємодії генетичних факторів та впливу канцерогенів довкілля. Основними етіологічними чинниками раку ротоглотки залишаються тютюнопаління та зловживання алкоголем. У країнах з високим рівнем доходу, зокрема у США та більшості держав Європи, протягом останніх десятиліть відмічається зростання захворюваності на ВПЛ-асоційований ПРРГ. Основним шляхом інфікування в таких випадках вважається орально-генітальний, що корелює зі змінами сексуальної поведінки населення, кількості статевих партнерів, молодшим віком дебюту статевого життя та зменшенням використання бар’єрної контрацепції. Така епідеміологічна тенденція зумовлює актуальність досліджень, спрямованих на удосконалення профілактики, раннього виявлення та персоналізованого лікування ВПЛ-асоційованих пухлин. У цих регіонах частка ВПЛ-позитивного раку ротоглотки нині становить 60–70% від усіх випадків цієї локалізації [7]. Поширеність ВПЛ-асоційованого ПРРГ в Україні залишається недостатньо вивченою, що підкреслює актуальність подальших епідеміологічних досліджень у цьому напрямі.
Клінічно ВПЛ-асоційовані пухлини ротоглотки відзначаються кращим прогнозом порівняно з ВПЛ-негативними. ВПЛ-асоційований рак ротоглотки характеризується вищою чутливістю до хіміє- та ПТ.
Радіочутливість значною мірою пов’язана зі зміненими механізмами відповіді на пошкодження клітинної ДНК при ВПЛ-позитивних пухлинах і, зокрема, з передачею сигналів і відновленням дволанцюгових розривів ДНК, що зумовлює вищі показники 5-річної ЗВ порівняно з ВПЛ-негативними пухлинами [8].
За даними 8-го видання AJCC, 5-річна ЗВ при ВПЛ-позитивному ранньому раку ротоглотки досягає 93,9%. З огляду на суттєві біологічні та прогностичні відмінності ВПЛ-асоційований рак ротоглотки виділено в окрему категорію у 8-му виданні класифікації AJCC [9].
У дослідженні Kim D.-Y. та співавт., присвяченому порівнянню ефективності лікування пацієнтів з ранніми стадіями раку ротоглотки (І–ІІ стадії), при середньому періоді спостереження 45,6 міс встановлено, що 2-річні показники ЗВ, ВБП і локорегіонального контролю (ЛК) у пацієнтів, яким проведено ПТ або хірургічне лікування, становили відповідно 97,8 та 96,4%. Водночас виявлено, що наявність екстранодального поширення (Extranodal enlargement — ENE) або конгломерату уражених лімфатичних вузлів з ознаками ENE (ENEcong) суттєво погіршує клінічні результати у хворих на ВПЛ-асоційований ПРРГ. Зокрема, у таких пацієнтів зафіксовано значне зниження ЗВ, а 2-річна ВБП становила лише 83,9% порівняно з 94,4% у пацієнтів без ознак ENE чи ENEcong, так само відмічалося зниження показників ЛК [10].
Біологія ВПЛ-асоційованих пухлин
На біологічному рівні ВПЛ-асоційовані пухлини значно відрізняються від ВПЛ-негативних. В останніх переважають множинні мутації в генах-супресорах пухлинного росту (TP53, PIK3CA), нормальна функція яких полягає в захисті клітин від розвитку злоякісних пухлин. Натомість у ВПЛ-позитивних пухлинах ключову роль відіграють вірусні онкогени E6 та E7, що інактивують білки p53 і Rb, сприяючи неконтрольованому клітинному росту. Отже, для розвитку ВПЛ-індукованого ПРРГ потрібно менше додаткових мутацій [11].
Сучасні підходи в лікуванні раннього раку ротоглотки
Нині у пацієнтів із І та ІІ стадіями раку ротоглотки використовують наступні методи лікування.
- ТОЛМ та ТОРХ є сучасними малоінвазивними підходами, що поступово здобувають ширше клінічне використання завдяки нижчій травматичності, високій точності резекції та скороченню термінів післяопераційної реабілітації порівняно з традиційними відкритими методами [12–14].
Низка досліджень свідчить, що при лікуванні пацієнтів із ранніми стадіями ПРРГ перевага часто надається первинній радикальній ПТ, що зумовлено попередніми даними про вищу частоту ускладнень після відкритих хірургічних втручань. Водночас упровадження малоінвазивних хірургічних підходів, зокрема ТОРХ, суттєво змінює співвідношення потенційних ризиків і клінічних переваг, відкриваючи нові можливості для хірургічного лікування цієї категорії пацієнтів [4]. Після затвердження ТОРХ Управлінням з контролю за харчовими продуктами і лікарськими засобами США (Food and Drug Administration — FDA) у грудні 2009 р. як методу лікування плоскоклітинної карциноми ротоглотки, у численних дослідженнях встановлено її переваги: зменшення тривалості операції, терміну госпіталізації та підвищення якості життя пацієнтів порівняно з відкритими хірургічними методами [15]. Незважаючи на зростаючу кількість доказів ефективності ТОРХ, на момент проведення перших досліджень бракувало переконливих порівняльних даних щодо її переваг перед відкритою хірургією. Ранні результати базувалися на обмежених вибірках та даних з окремих центрів, що й стало підґрунтям для подальших досліджень з метою безпосереднього порівняння обох підходів. Після впровадження ТОРХ для лікування ПРРГ в одному з перших масштабних досліджень, проведеному Nguyen A.T. та співавт., проаналізовано дані 9745 пацієнтів. У період з 2010 до 2015 р. частка роботизованих хірургічних втручань при пухлинах T1–T2 ротоглотки зросла з 18,3 до 35,5% (p=0,003).
При використанні ТОРХ частота позитивних хірургічних країв була нижчою (12,5 проти 20,3%; p <0,001), а потреба в ад’ювантній хімієпроменевій терапії — меншою (28,6 проти 35,7%; p <0,001) порівняно з відкритими хірургічними підходами. Показники 5-річної ЗВ були 84,8% у групі ТОРХ проти 80,3% у групі відкритої хірургії (p=0,001) [16].
У систематичному огляді 2020 р., проведеному Rosello A. та співавт., який охопив 371 пацієнта (186 — ТОРХ, 185 — відкрита хірургія), порівнювалися результати двох підходів для лікування ПРРГ. Згідно з отриманими даними, тривалість госпіталізації після ТОРХ була значно коротшою і становила в середньому 3–5 днів, тоді як після відкритої хірургії — 7–12 днів. Частота проведення трахеотомії в групі ТОРХ була нижчою ніж 10%, у той час як серед пацієнтів після відкритого втручання вона сягала до 30%. Крім того, пацієнти після ТОРХ значно рідше потребували харчування через назогастральний зонд, а якщо така потреба виникала, тривалість його використання була значно меншою порівняно з відкритою хірургією, після якої ентеральне зондове харчування могло тривати кілька місяців. Післяопераційні ускладнення, зокрема кровотечі, інфекції та респіраторні порушення, виникали значно рідше у групі ТОРХ (10–15%) порівняно з групою відкритої хірургії (30–35%) [17].
Відкриті хірургічні підходи, зокрема трансмандибулярні та трансфарингеальні, використовуються рідко при ранніх стадіях ПРРГ через високу частоту ускладнень, яка сягає 45–60%. Такі втручання майже завжди супроводжуються необхідністю виконання трахеотомії (98–100%) [18–21], характеризуються тривалішим періодом відновлення, а також гіршими естетичними та функціональними результатами.
Попри наявність ефективніших та менш травматичних альтернатив, таких як ТМХ та ПТ, у певних клінічних ситуаціях — наприклад, при вираженому тризмі або наявності в анамнезі попереднього опромінення — відкриті оперативні втручання можуть залишатися єдиним можливим варіантом лікування [4].
Протягом останнього десятиліття фіксується стійке зростання застосування ТМХ для лікування раннього ПРРГ. Ця тенденція зумовлена переконливими перевагами малоінвазивних підходів над відкритою хірургією, зокрема кращими функціональними результатами, нижчою частотою післяопераційних ускладнень та збереженням еквівалентної ефективності в контролі захворювання [22].
ТМХ зазвичай рекомендована для лікування пухлин стадій T1–T2, однак в окремих ретельно відібраних випадках її застосування може бути обґрунтованим і при пухлинах стадії T3 за умови належного передопераційного планування. У таких ситуаціях ключовим фактором є ретельне передопераційне планування з метою досягнення резекції з чистими хірургічними краями. За наявності технічних можливостей доцільним є інтраопераційний контроль країв резекції за допомогою швидкої гістологічної оцінки (заморожених зрізів); у разі її відсутності необхідно забезпечити чітке маркування резекційного матеріалу для подальшого патологічного аналізу. Однак слід врахувати, що товщина м’язів верхніх констрикторів глотки в ділянці піднебінного мигдалика іноді становить лише 2–3 мм, і це ускладнює досягнення рекомендованого хірургічного краю в 1,5–2,0 мм згідно з настановами Національної мережі багатопрофільних онкологічних закладів США (National Comprehensive Cancer Network — NCCN) [4, 23–26].
Ferris R.L. та співавт. зазначають, що в окремих випадках після хірургічного втручання у пацієнтів з p16-позитивним раком ротоглотки можливо використовувати лише ПТ замість стандартної хімієпроменевої. Зокрема, у пацієнтів з негативними або близькими краями резекції розглядається деескалація дози променевого лікування до 50 Гр. Докладніше про підходи до деескалації наведено в наступному розділі [27].
Станом на сьогодні в жодному дослідженні не оцінювався локорегіонарний контроль (ЛК), а також онкологічні та функціональні результати ТОРХ порівняно з ТОЛМ у проспективному форматі. Наразі порівняльні дослідження між ТОРХ та ТОЛМ не виявили статистично значущої різниці в частоті позитивних хірургічних країв [28, 29]. Разом з тим не існує жодного дослідження, яке б проспективно порівнювало ЛК, а також онкологічні та функціональні результати між цими двома підходами.
Попри свої переваги, ТМХ має певні анатомічні та онкологічні обмеження, що визначають перелік протипоказань до її використання. До них належать поширення пухлини на парафарингеальний простір, інфільтрація магістральних судин (сонної артерії, внутрішньої яремної вени), ураження кісткових структур (нижньої щелепи, основи черепа), а також наявність вираженого тризму, що унеможливлює адекватний трансоральний доступ.
До клінічних переваг ТОЛМ та ТОРХ належать мінімальна операційна травматизація, збереження цілісності м’язів язика, глотки та дна ротової порожнини, збереження іннервації функціонально важливих зон, відсутність потреби в остеотомії та, як результат, — збереження анатомічної цілісності нижньої щелепи, забезпечують технічну можливість швидкого переходу до відкритого хірургічного втручання в умовах інтраопераційної необхідності.
Водночас слід зважати на недоліки таких втручань, серед яких обмежене хірургічне поле зору, складний контроль гoмeостазу, а також висока вартість обладнання, що особливо актуально у випадку роботизованих систем та може обмежувати їх впровадження в рутинну хірургічну практику [30, 31].
Пухлини Т1–Т2 м’якого піднебіння потребують особливого підходу при плануванні первинного методу лікування, оскільки хірургічне втручання навіть на ранніх стадіях може спричинити розвиток велофарингеальної недостатності. Дуже поверхневі ураження можуть бути видалені шляхом часткової резекції в межах товщі слизової оболонки, залишаючи дефект для вторинного загоєння, що зазвичай забезпечує добрі функціональні результати. Натомість у разі розширених резекцій із залученням усієї товщі м’якого піднебіння, які охоплюють понад 50% м’якого піднебіння, необхідна реконструкція для запобігання вираженим функціональним порушенням. У зв’язку з цим доцільність хірургічного втручання при ранніх ураженнях м’якого піднебіння слід ретельно оцінювати, зважаючи на можливі переваги менш інвазивних методів, таких як ПТ, яка зумовлює задовільні функціональні та онкологічні результати [32].
Менеджмент шийних лімфатичних вузлів
Ротоглотка характеризується розвиненою лімфатичною системою. Частота виявлення як клінічно виражених, так і прихованих метастазів у лімфатичні вузли становить від 15 до 75% залежно від анатомічної локалізації первинного вогнища та поширеності пухлини. Це означає, що переважна більшість пацієнтів з ранніми стадіями ПРРГ потребують проведення шийної лімфодисекції.
Також слід завжди враховувати можливе ураження ретрофарингеальних лімфатичних вузлів, а також необхідність селективної шийної лімфодисекції контралатеральних лімфатичних вузлів, коли ураження діагностують з одного боку, а пухлина розташована по центру або перетинає серединну лінію [33, 34].
Проведення шийної лімфодисекції має перевагу у вигляді можливості проведення гістопатологічної оцінки стану лімфатичних вузлів порівняно з ПТ.
Однак цінність шийної дисекції при ПРРГ може бути менш надійною, ніж при пухлинах іншої локалізації голови та шиї. Це зумовлено менш передбачуваними шляхами лімфатичного відтоку при ПРРГ і складністю хірургічного доступу до ретрофарингеальних лімфатичних вузлів [33]. Саме цей аргумент часто висувається прихильниками ПТ під час обговорення варіантів лікування пацієнтів із ранніми стадіями ПРРГ. Водночас досі не було доведено, що це сприяє кращим онкологічним результатам, оскільки більшість ретроспективних досліджень представляють однакові показники ВБП після хірургії та ПТ [12–14].
Більшість пацієнтів, яким проводять селективну шийну дисекцію, мають певний ступінь порушення функції додаткового нерва, що проявляється так званим синдромом плеча: біль, слабкість та функціональний дефіцит плеча. Хоча найчастіше ці порушення з часом оборотні, їх слід враховувати під час вибору оптимального методу лікування пацієнтів із ранньою стадією ПКРРГ [35, 36].
- Радикальна ПТ для пухлин Т0-2 та за наявності ураженого одного лімфатичного вузла розміром <3 см — зокрема ПТ з модуляцією інтенсивності (Intensity-Modulated Radiation Therapy — IMRT) або з використанням одночасного інтегрованого підвищення (SIB-IMRT), що дозволяє досягати конформного розподілу дози з кращим збереженням здорових тканин [37].
Лікування ПРРГ за допомогою ПТ здійснюється методом зовнішнього променевого опромінення з використанням високоенергетичних фотонів, що генеруються лінійним прискорювачем. Точне визначення локалізації пухлини за допомогою традиційної (КТ або МРТ) та метаболічної позитронно-емісійної томографії (ПЕТ) для візуалізації є обов’язковим для ефективної топометрії та мінімізації ускладнень, уникаючи непотрібного опромінення здорових тканин. Інтенсивно-модульована променева терапія (IMRT) і променева терапія з візуальним контролем (Image-guided radiation therapy — IGRT) стали стандартом лікування пухлин голови та шиї. Наступним етапом удосконалення цих технологій стала адаптивна променева терапія з візуальним контролем (Image-guided Adapted Radiation Therapy — IGART), що дозволяє ще ефективніше обмежити опромінення здорових тканин і, відповідно, знизити рівень токсичності [38].
Використання заряджених частинок, таких як протони чи іони вуглецю, наразі знаходиться на стадії досліджень. Протонна терапія забезпечує краще збереження здорових навколишніх тканин під час лікування відносно невеликих пухлин [39]. Однак нещодавні результати рандомізованого дослідження III фази (ASCO 2024) свідчать, що IMPT може мати переваги над фотонною терапією, зокрема у вигляді зниження токсичності та підвищення якості життя пацієнтів без зниження онкологічної ефективності, що підтверджує клінічну значущість фізичних переваг протонів [40].
Як уже згадувалося, пацієнтів з ранніми стадіями ПРРГ можна ефективно лікувати або ПТ, або хірургічним шляхом. Тому основна увага при обговоренні варіантів лікування повинна приділятися функціональним результатам, запобіганню пізнім ускладненням та ризику розвитку другої первинної пухлини в уже опроміненій зоні. Незважаючи на значний прогрес у радіотерапевтичних технологіях та зниженні пізньої токсичності, ці проблеми залишаються актуальними.
Найпоширенішим довгостроковим ускладненням ПТ є ксеростомія — сухість у роті, спричинена ураженням слинних залоз [41, 42]. Це ускладнення більш виражене при додаванні хімієтерапії. Однак із впровадженням IMRT ця побічна дія стала менш помітною, що підтверджується кількома проспективними дослідженнями [43–45].
Остеорадіонекроз (ОРН) нижньої щелепи — ще одне серйозне ускладнення ПТ, яке може суттєво вплинути на якість життя [46]. Симптоми ОРН можуть варіювати від безсимптомного до тяжкого перебігу некрозу із ризиком формування нориць, інфекцій та патологічних переломів. ПРРГ є фактором ризику розвитку остеорадіонекрозу. Його виникнення може бути відтермінованим на декілька років після завершення лікування [47]. У нещодавньому систематичному огляді 31 дослідження, що охоплювало понад 4200 пацієнтів, частота ОРН становила від 5 до 7% [48]. Важливо, що тип ПТ (зокрема IMRT) не впливав суттєво на частоту цього ускладнення, що робить його й надалі актуальним.
Тризм є ще одним можливим ускладненням ПТ, що проявляється у вигляді обмеження відкривання рота внаслідок фіброзу та скорочення жувальної мускулатури. Цей стан ускладнює прийом їжі, мовлення та дотримання гігієни ротової порожнини. Деякий ступінь тризму трапляється майже в кожного пацієнта з ПРРГ незалежно від методу лікування. Але його частота вища у тих, хто проходив ПТ [49]. При використанні традиційних методів (двовимірні або тривимірні конформні) ПТ частота сягала 25% [50], проте із впровадженням IMRT цей показник знизився до 5% [51].
Ішемічний інсульт є потенційним пізнім ускладненням ПТ у пацієнтів із пухлинами голови та шиї [52], особливо серед молодих пацієнтів із високою очікуваною тривалістю життя. У ретроспективному когортному дослідженні серед 367 пацієнтів віком до 60 років, які отримували 50–60 Гр опромінення шиї, відносний ризик інсульту становив 5,6% (очікуваний — 2,5; 95% довірчий інтервал (ДІ) = 3,1–9,4%), а кумулятивний ризик на 15 років — 12% (95% ДІ = 6,5–21,4%) порівняно з популяційними показниками [53].
З урахуванням вищезазначених ризиків пізньої токсичності, на думку Monnier Y. та співавт., якщо ранній рак ротоглотки можна лікувати методом ТМХ з виконанням дисекції шиї за потреби, пацієнтам слід насамперед пропонувати цей варіант або залучати їх до клінічного дослідження, що порівнює ТМХ та IMRT. Така стратегія підтримується багатьма авторами. Проте її слід застосовувати лише у випадках, коли очікується належний функціональний результат та низька ймовірність необхідності ад’ювантної терапії. Якщо передопераційні фактори свідчать про ймовірність негативних функціональних або онкологічних наслідків після хірургії (наприклад, значне ураження м’якого піднебіння або наявність клінічно позитивного ретрофарингеального вузла), тоді слід розглядати радіотерапію [4].
- Адʼювантна ПТ після хірургічного лікування — призначається в разі позитивних або близьких країв резекції, наявного екстранодального поширення (pENE), множинних метастазів у лімфатичні вузли, а також при виявленні периневральної або лімфоваскулярної інвазії [10].
- Ад’ювантна одночасна хімієпроменева терапія — рекомендована пацієнтам за наявності несприятливих патоморфологічних ознак, зокрема позитивного резекційного краю R1 або екстранодального поширення (pENE).
Ferris R.L. та співавт. вказують на можливість застосування лише ПТ як альтернативи хімієпроменевій терапії після хірургічного втручання у пацієнтів із p16 (ВПЛ) — позитивним раком ротоглотки з ураженням не більше ніж 4 лімфатичних вузлів, негативними або близькими краями резекції, N1–N2, без ознак двобічного ураження лімфатичних вузлів та з екстранодальним поширенням, яке не перевищує 1 мм. Також розглядається деескалація дози ПТ до сумарної вогнищевої дози (СВД) 50 Гр. Ці підходи акцентують важливість тісної співпраці з патогістологами для точного визначення патоморфологічних характеристик, необхідних для обґрунтованого вибору лікувальної тактики [27].
Стратегія деескалації лікування ВПЛ-асоційованого раку ротоглотки
Протягом останніх десятиліть підхід до ПТ у лікуванні плоскоклітинного раку голови та шиї зазнав суттєвого розвитку. Починаючи з використання високих доз опромінення у класичному фракціонуванні, були впроваджені нові технології, спрямовані на посилення локорегіонарного контролю пухлини та зниження токсичності лікування. Впровадження гіперфракціонування (наприклад у дослідженнях EORTC 22791 та RTOG 90-03) дозволило посилити локорегіонарний контроль, особливо в лікуванні місцево-поширеного раку, однак не було досягнуто підвищення ЗВ [54, 55].
Запровадження технології інтенсивно-модульованої променевої терапії (IMRT), підтверджене результатами досліджень PARSPORT та RTOG 00-22, суттєво покращило безпековий профіль лікування. Завдяки більш точному спрямуванню дози опромінення вдалося зменшити пошкодження здорових тканин, зокрема слинних залоз, що сприяло зниженню частоти розвитку ксеростомії та розладів ковтання [56–58]. Впровадження дисфагійно-оптимізованої IMRT (DO-IMRT) стало черговим етапом еволюції ПТ, спрямованим на мінімізацію функціональних порушень та збереження високого рівня якості життя пацієнтів після лікування [59]. З огляду на високу токсичність одночасної хімієпроменевої терапії, представлену в аналізі Machtay M. та співавт. на основі досліджень RTOG 91-11, 97-03 і 99-14, актуалізувалася необхідність у деескалації лікувальних підходів для пацієнтів із ВПЛ-позитивним раком ротоглотки [60]. Ці тенденції підтримали дослідження режимів деескалації із застосуванням зниженої дози ПТ (до СВД 60 Гр) із щотижневим цисплатином або без нього (дослідження Chera B.S. та співавт. та NRG HN002), що зумовили високу ефективність та нижчу токсичність [61, 62].
Значна частина сучасних досліджень зосереджена на деескалації лікування ВПЛ-асоційованих плоскоклітинних карцином ротоглотки. Основні напрями включають зменшення СВД ПТ, зниження інтенсивності опромінення при ад’ювантній хімієпроменевій терапії або застосування лише ПТ у пацієнтів із негативними або близькими краями резекції (<3 мм). Незважаючи на обнадійливі проміжні результати, ці підходи залишаються предметом вивчення в межах клінічних досліджень, і наразі відповідно до чинних рекомендацій NCCN відмінностей у лікувальних підходах до ВПЛ-позитивних та ВПЛ-негативних пухлин не передбачено. Отже, хоча ідея деескалації є привабливою з точки зору зниження токсичності при збереженні ефективності лікування, її рутинне впровадження в клінічну практику потребує подальших доказів на основі високоякісних рандомізованих досліджень та оновлення клінічних настанов відповідно до їх результатів [27].
Порівняння хірургічного та променевого лікування ВПЛ-асоційованого раку ротоглотки: дані клінічних досліджень
У сучасній літературі триває активне обговорення щодо оптимального вибору первинного методу лікування ВПЛ-асоційованого раку ротоглотки, особливо на ранніх стадіях захворювання. Рандомізовані контрольовані, а також багатоцентрові дослідження дозволяють порівняти ефективність та функціональні результати хірургічного підходу й ПТ.
У дослідження ORATOR залучено 68 пацієнтів на ВПЛ-асоційований рак ротоглотки T1–T2, N0–N2 (за умови, що розмір лімфатичних вузлів не перевищував 4 см) без віддалених метастазів (M0). Пацієнтів розподілено у співвідношенні 1:1 на 2 групи: ТМХ з лімфодисекцією та ПТ у дозі 70 Гр. За наявності ураження лімфатичних вузлів (N1–N2) проведено хімієпроменеву терапію. Середній період спостереження хворих становив 5,1 року (міжквартильний розмах: 5,0–5,3 року).
Через рік після завершення лікування середній показник за шкалою MDADI був вищим у пацієнтів, які отримали ПТ (86,9±11,4), ніж у групі хірургічного лікування (80,1±13,0; p=0,042), що свідчить про кращу збереженість функції ковтання у пацієнтів після ПТ. Однак ця різниця не досягла порогу клінічно значущих змін (≥10 балів). Побічні ефекти 2–5 ступенів відмічалися з подібною частотою в обох групах: 91% у пацієнтів, які отримували ПТ, та 97% — у групі трансоральної хірургії (p=0,61). Водночас характер токсичності відрізнявся: нейтропенія та порушення слуху частіше фіксувалися після ПТ, тоді як дисфагія та больовий синдром переважали у пацієнтів після хірургічного втручання. Важливо, що між групами не виявлено статистично значущої різниці в ЗВ і ВБП [63].
У багатоцентровому дослідженні ORATOR II основною метою було оцінити безпеку деескалаційних стратегій — застосування зниженої дози ПТ або виключно хірургічного лікування без подальшої ад’ювантної терапії. Проте дослідження було достроково зупинено через летальні ускладнення у групі хірургічного лікування [64].
Паралельно триває велике рандомізоване дослідження:
- Best-of (NCT02984410): багатоцентрове дослідження фази III, яке порівнює ефективність ТМХ і ПТ як первинних методів лікування у пацієнтів із ВПЛ-позитивним раннім раком ротоглотки. Основною кінцевою точкою є якість життя за шкалою MDADI. Набір пацієнтів завершено, однак результати дослідження наразі ще не оприлюднено [65].
У публікації Rujan S.A. та співавт. здійснено порівняння трансоральної хірургії та ПТ як первинних методів лікування у пацієнтів з ранніми стадіями раку ротоглотки. Автори дійшли висновку, що обидва підходи забезпечують високі показники локорегіонарного контролю та ЗВ. Проте функціональні результати суттєво відрізнялися: хірургічне лікування асоціювалося з вищою якістю життя, нижчою частотою хронічних ускладнень — таких як ксеростомія, дисфагія та порушення мовлення. Пацієнти після хірургії мали вищі показники за анкетами EORTC QLQ-C30 та QLQ-H&N35, що стосуються ковтання, соціального функціонування та больового синдрому. Водночас ПТ, попри подібну ефективність у контролі захворювання, була пов’язана з вищою частотою віддаленої токсичності, включно з персистивною дисфагією, мукозитом, сенсоневральною приглухуватістю та потребою в гастростомії [66].
Узагальнювальні сучасні дані свідчать про порівнянну ефективність хірургічного лікування та ПТ при лікуванні ранніх стадій ВПЛ-асоційованого раку ротоглотки. Водночас вибір оптимальної тактики лікування має ґрунтуватися на індивідуальному підході з урахуванням стадії пухлини, її анатомічної локалізації, супутніх захворювань пацієнта, доступності високоспеціалізованого хірургічного забезпечення, поширення пухлини, зокрема на парафарингеальний простір, сонну артерію, внутрішню яремну вену, ураження кісткових структур (нижньої щелепи, основи черепа), вираженості тризму та переваг самого пацієнта [4]. Поточне дослідження (EORTC-1420-HNCG-ROG) має дати остаточну відповідь на питання, який підхід забезпечує кращі результати [64].
У випадках, коли можливо досягти негативних хірургічних країв резекції та не виявлено клінічно несприятливих ознак у шийних лімфатичних вузлах, слід розглядати хірургічне лікування. Основна перевага хірургічного лікування перед ПТ полягає в можливості стратифікації ризику прогресування захворювання на основі виявлених гістопатологічних факторів ризику, таких як периневральна інвазія, лімфоваскулярна інвазія, наявність мікрометастазів у лімфатичні вузли, а також ознаки екстранодального поширення (ENE) [4]. Залежно від виявлених факторів ризику пацієнтам із високим ризиком може бути рекомендоване додаткове променеве або хімієпроменеве лікування, тоді як особам із низьким ризиком така ад’ювантна терапія не показана. Це дозволяє мінімізувати ризик пізніх побічних ефектів, пов’язаних із променевим впливом, зберегти цю терапевтичну опцію на майбутнє та сфокусувати інтенсифікацію лікування у тих пацієнтів, хто дійсно цього потребує. Попри зростання кількості випадків ВПЛ-асоційованого раку ротоглотки, значна частина пацієнтів усе ще має пухлини, асоційовані з тютюнопалінням і зловживанням алкоголем. У цієї категорії хворих ризик виникнення другого первинного злоякісного новоутворення верхніх відділів дихальної та травної систем становить до 20% [67]. Для таких пацієнтів перевагою є застосування лише хірургічного лікування, оскільки в разі необхідності подальшого променевого втручання воно буде доступним. Адже прогноз при повторному опроміненні тієї ж анатомічної зони, яка вже піддавалася лікуванню, зазвичай є несприятливим [68]. Чи поширюється цей підхід на пацієнтів із ВПЛ-асоційованими пухлинами — залишається предметом наукової дискусії, оскільки в цієї групи ризик розвитку другого первинного новоутворення значно нижчий [69, 70].
ВЛАСНИЙ КЛІНІЧНИЙ ДОСВІД ЗАСТОСУВАННЯ ТРАНСОРАЛЬНОЇ CO₂-ЛАЗЕРНОЇ МІКРОХІРУРГІЇ В ЛІКУВАННІ РАННЬОГО РАКУ РОТОГЛОТКИ
Матеріали та методи дослідження
Проведено ретроспективний аналіз результатів лікування 64 пацієнтів із ПРРГ T1–T2 N0–N2 M0, що відповідає ранньому раку ротоглотки згідно з AJCC 8-го видання. Усі учасники дослідження надали інформовану згоду на участь у дослідженні після ознайомлення з його метою та завданнями. Ми забезпечували повну конфіденційність особистих даних учасників. 57 осіб (89,1%) — мали ВПЛ-асоційовані (p16-позитивні) пухлини. Серед них у 41 пацієнта (64,1%) встановлено I клінічну стадію захворювання, а у 16 осіб (25%) — II стадію. Решта 7 пацієнтів (10,9%) мали ВПЛ-негативну форму раку. У цій підгрупі у 4 хворих (6,25%) встановлено I стадію, а у 3 пацієнтів (4,6%) — II стадію патології. Розподіл хворих за TNM-класифікацією (T — tumor, «пухлина»; N — nodus, «вузол»; M — metastasis, «метастази»), клінічною стадією та ВПЛ-статусом представлено в таблиці.
| TNM | ВПЛ+ | ВПЛ– | ||
| I стадія,
n (%) |
ІI стадія,
n (%) |
I стадія,
n (%) |
IІ стадія,
n (%) |
|
| T1N0 | 9 (14,1) | 0 (0,0) | 4 (6,25) | 0 (0,0) |
| Т2N0 | 17 (26,5) | 0 (0,0) | 0 (0,0) | 3 (4,7) |
| T1N1 | 7 (10,9) | 0 (0,0) | 0 (0,0) | 0 (0,0) |
| T1N2 | 0 (0,0) | 10 (15,6) | 0 (0,0) | 0 (0,0) |
| T2N1 | 8 (12,5) | 0 (0,0) | 0 (0,0) | 0 (0,0) |
| T2N2 | 0 (0,0) | 6 (9,3) | 0 (0,0) | 0 (0,0) |
| Разом | 41 (64,1) | 16 (25) | 4 (6,25) | 3 (4,7) |
Результати
У 59 пацієнтів (92,2%) трансоральну CO₂-лазерну резекцію ротоглотки виконано з використанням орального ретрактора та/або орофарингоскопа.
Натомість у 5 осіб (7,8%) через анатомічні особливості ротової порожнини, що унеможливлювали адекватну візуалізацію кореня язика за допомогою орофарингоскопа, хірургічне втручання проведено з формуванням додаткового доступу — «вікна» в ділянці дна ротової порожнини для часткового виведення язика в підпідборідну ділянку, що дозволило візуалізувати корінь язика в анфас для проведення трансоральної СО2-лазерної резекції.
У 58 пацієнтів (90,6%) у ранній післяопераційний період виявлено транзиторну одинофагію та дисфагію, що є типовим наслідком травматизації слизової оболонки ротоглотки під час трансоральної CO₂-лазерної мікрохірургії. Ці функціональні порушення носили оборотний характер і повністю регресували впродовж 2–4 тиж після втручання завдяки локальному загоєнню тканин та відновленню координації ковтального акту. З метою підтримки адекватного нутритивного статусу 55 пацієнтам (85,9%) встановлено назогастральний зонд, який у середньому видаляли на 5-ту–7-му добу післяопераційного періоду. Жоден із хворих не потребував тривалого зондового харчування або гастростомії.
У 24 пацієнтів (37,5%) за допомогою гістологічного дослідження первинної пухлини виявлено наступні несприятливі прогностичні фактори (лімфоваскулярну інвазію, периневральну інвазію або близькі краї резекції), що потребувало призначення ад’ювантної ПТ.
У 3 хворих (4,7%) через наявність високого ризику рецидиву (встановлене екстранодальне поширення та/або позитивний хірургічний край резекції (R1)) призначено ад’ювантну хімієпроменеву терапію.
Загалом ад’ювантне лікування ПТ або хімієпроменевою терапією проведено у 27 пацієнтів, що становить 42,2% від загальної кількості залучених у дослідження. У 37 осіб (57,8%) після хірургічного лікування адʼювантну терапію не призначали, хворі перебували під спостереженням.
Хірургічні ускладнення були поодинокими та клінічно незначущими. Зокрема, у 4 пацієнтів (6,25%) зафіксовані помірна післяопераційна кровотеча, яку було успішно контрольовано консервативними заходами — шляхом місцевої коагуляції та застосування гемостатичних матеріалів.
Жоден випадок не потребував повторного хірургічного втручання або трансфузійної підтримки.
Особливої уваги заслуговує досвід малоінвазивного хірургічного лікування 5 пацієнтів (7,8%) з локалізацією пухлини в ділянці кореня язика, у яких застосовано доступ з формуванням «вікна» в ділянці дна ротової порожнини. За допомогою оцінки результатів цієї техніки встановлено її високу ефективність і безпеку. Не відмічалося таких специфічних ускладнень, як нейропраксія під’язикового нерва чи формування під’язикових ранул.
Протягом 12-місячного періоду динамічного онкологічного спостереження, що включало регулярні клінічні огляди, ендоскопічний моніторинг та контрольні КТ / МРТ, не виявлено жодного випадку рецидиву або прогресування захворювання. Отримані результати підтверджують онкологічну ефективність трансорального CO₂-лазерного підходу за умови ретельного відбору пацієнтів та дотримання хірургічного протоколу.
Подальші напрями дослідження
У подальшому етапі дослідницької роботи передбачається проведення порівняльного аналізу ефективності, функціональних результатів та якості життя пацієнтів після застосування 2 стратегій лікування раннього раку ротоглотки — ТОЛМ та первинної ПТ.
Клінічний випадок № 1
Пацієнт В., 40 років. Встановлено діагноз — плоскоклітинна карцинома м’якого піднебіння T2N0M0. Проведено трансоральну CO₂-лазерну резекцію м’якого піднебіння. Етапи хірургічного втручання представлені на рис. 1–2.
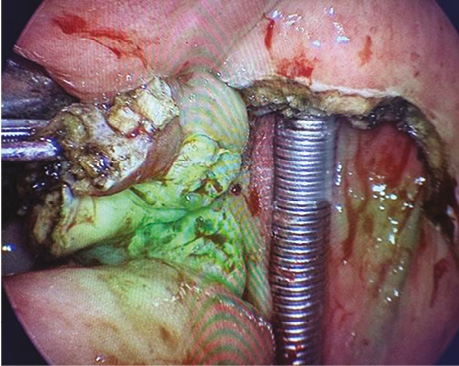
Рис. 1. Трансоральна CO₂-лазерна резекція м’якого піднебіння із попередньою візуалізацією зони ураження за допомогою індоціанінового зеленого барвника (ICG) для точнішого визначення меж пухлинного ураження
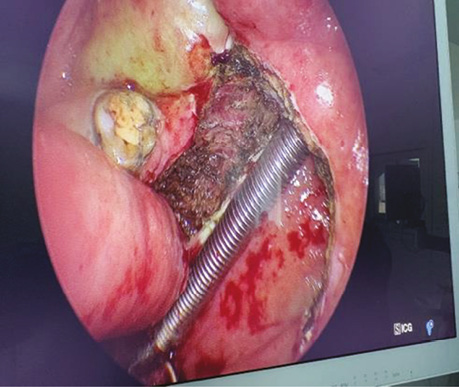
Рис. 2. Вид операційної рани після виконаної трансоральної CO₂-лазерної резекції м’якого піднебіння
Клінічний випадок № 2
Пацієнт С., 56 років. Діагностовано плоскоклітинну карциному передньої піднебінної дужки з поширенням на корінь язика T2N0M0. Проведено трансоральну CO₂-лазерну резекцію бічної стінки ротоглотки та кореня язика доступом через сформоване «вікно» в ділянці дна ротової порожнини. На рис. 3–6 наведено етапи хірургічного втручання.
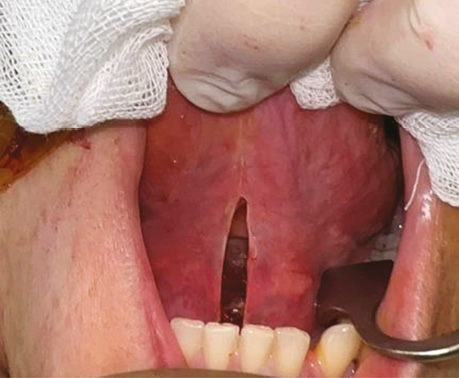
Рис. 3. Виконано розріз по серединній лінії дна ротової порожнини між під’язиковим мʼясцем у сагітальній площині
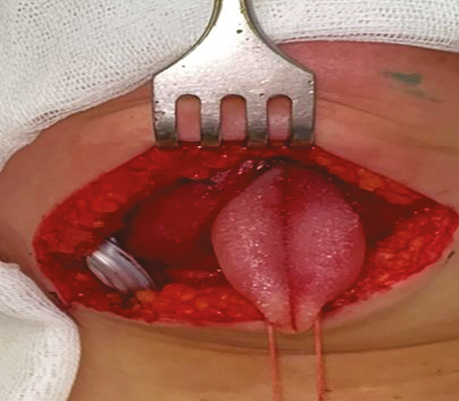
Рис. 4. Дисекція в напрямку до підпідборідного простору між черевцями підборідно-язикового та підборідно-під’язикового м’язів через щелепно-під’язиковий м’яз і між передніми черевцями двочеревцевого м’яза. Накладено лігатуру на кінчик язика, язик виведено через сформоване «вікно» дна ротової порожнини, що забезпечило візуалізацію кореня язика в анфас
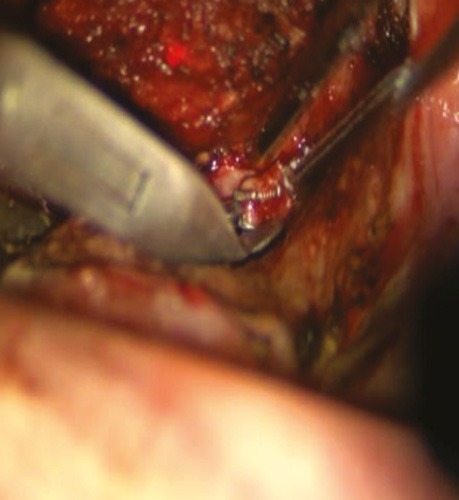
Рис. 5. Виділено та кліповано a. dorsalis linguae
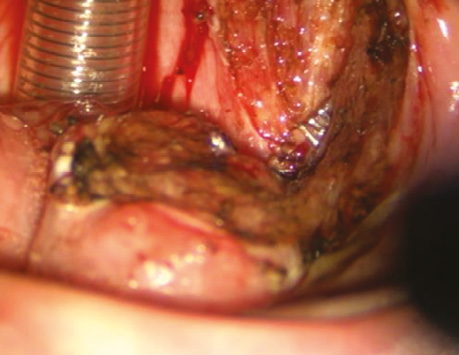
Рис. 6. Вид операційної рани після трансоральної CO₂-лазерної резекції бічної стінки ротової частини глотки та кореня язика
Клінічний випадок № 3
Пацієнт П., 53 роки. Діагностовано плоскоклітинну ВПЛ-асоційовану карциному задньої стінки оральної частини глотки T1N2M0. Проведено трансоральну CO₂-лазерну резекцію задньої стінки ротоглотки. На рис. 7–9 представлено етапи хірургічного втручання.
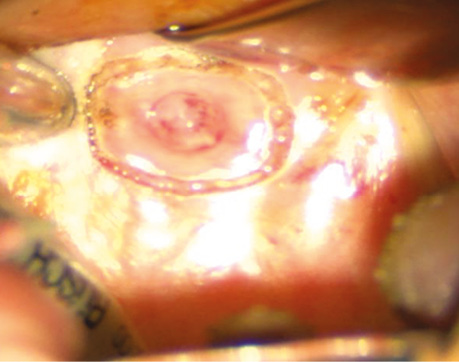
Рис. 7. Маркування меж резекції
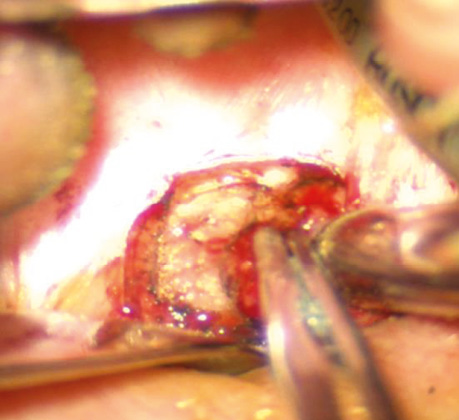
Рис. 8. Пухлина видаляється разом із листком вісцеральної фасції, що дозволяє візуалізувати розташовану позаду крильну фасцію. Розсічення тканин здійснюється в міжфасціальному просторі — між вісцеральною та крильною фасціями
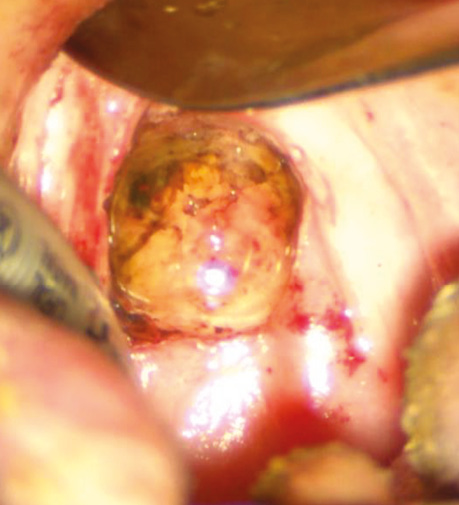
Рис. 9. Вид операційної рани — візуалізується крильна фасція, яка формує задню межу резекції
Клінічний випадок № 4
Пацієнт С., 47 років. Плоскоклітинна ВПЛ-асоційована карцинома передньої піднебінної дужки зліва з поширенням на піднебінний мигдалик та уздовж глотково-язикової складки, стадія T2N0M0. Виконано трансоральну CO₂-лазерну резекцію бічної стінки ротоглотки, кореня язика. На рис. 10–13 наведено основні етапи хірургічного втручання.
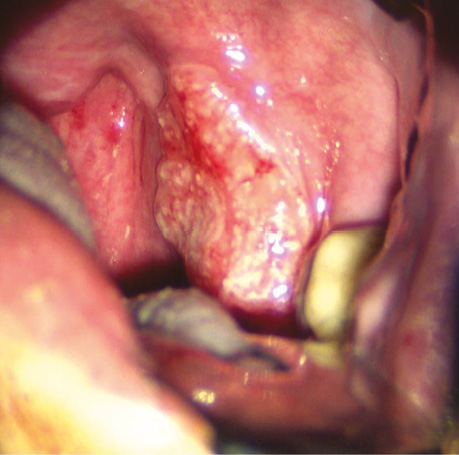
Рис. 10. Інфільтративне пухлинне ураження передньої піднебінної дужки з поширенням на піднебінний мигдалик та уздовж глотково-язикової складки
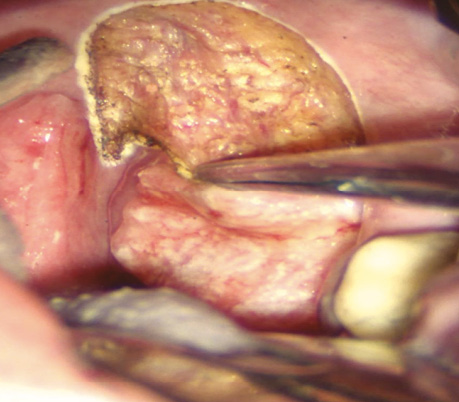
Рис. 11. СО2-лазером проводиться розсічення підслизового шару ротоглотки для візуалізації сполучнотканинної капсули піднебінного мигдалика
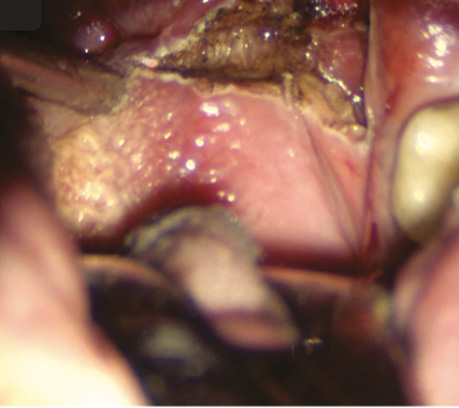
Рис. 12. СО2-лазером проводиться резекція кореня язика
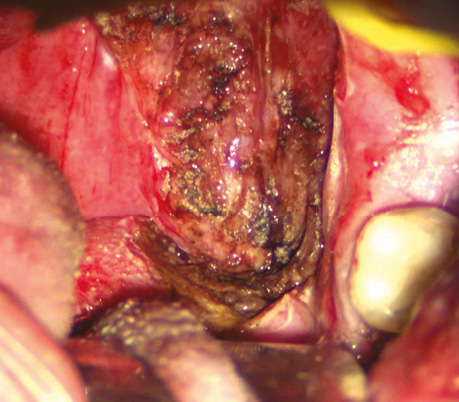
Рис. 13. Вид операційної рани. Представлено ранову поверхню після трансоральної СО2-лазерної резекції бічної стінки ротоглотки та кореня язика, з чіткою візуалізацією глибини дефекту та анатомічних структур бічної стінки ротоглотки
ВИСНОВКИ
Отримані результати підтверджують, що ТОЛМ є високоефективним та безпечним первинним методом лікування ранніх форм раку ротоглотки (T1–T2 N0–N2 M0) за умови ретельного відбору пацієнтів та дотримання хірургічного протоколу.
Необхідні подальші дослідження порівняння ТОЛМ та ПТ як первинних методів лікування раннього раку ротоглотки з оцінкою ефективності, функціональних результатів та якості життя пацієнтів.
СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ
1. Parkin, D. M., Bray, F., Ferlay, J., & Pisani, P. (2005). Global cancer statistics, 2002. CA: A Cancer Journal for Clinicians, 55(2), 74–108. doi: 10.3322/canjclin.55.2.74.
2. Sturgis, E. M., & Ang, K. K. (2011). The epidemic of HPV-associated oropharyngeal cancer is here: is it time to change our treatment paradigms? Journal of the National Comprehensive Cancer Network, 9(6), 665–673. doi: 10.6004/jnccn.2011.0055.
3. Wuerdemann, N., Wittekindt, C., Sharma, S. J., Prigge, E. S., Reuschenbach, M., Gattenlöhner, S., … Wagner, S. (2017). Risk factors for overall survival in HPV-negative and positive patients with oropharyngeal cancer. Oncology Research and Treatment, 40(6), 320–328. doi: 10.1159/000477097.
4. Monnier, Y., & Simon, C. (2015). Surgery versus radiotherapy for early oropharyngeal tumors: A never-ending debate. Current Treatment Options in Oncology, 16(9), 42. doi: 10.1007/s11864-015-0362-4.
5. Hilal, L., Moukarbel, R., Ollaik, F., Yang, P., & Youssef, B. (2021). Patient Selection for Surgery vs Radiotherapy for Early Stage Oropharyngeal Cancer. Cancer control, 10732748211050770. doi: 10.1177/10732748211050770.
6. Anthony, C. N., Theurer, J., Prisman, E., Read, N., Berthelet, E., Tran, E., … David, A. (2019). Radiotherapy versus transoral robotic surgery (ORATOR): A phase 2, randomized trial. The Lancet Oncology, 20(10), 1349–1359. doi: 10.1016/S1470-2045(19)30410-3.
7. O’Sullivan, B., Huang, S. H., Su, J., Garden, A. S., Sturgis, E. M., Dahlstrom, K., … Wei, X. (2016). Development and validation of a staging system for HPV-related oropharyngeal cancer by the International Collaboration on Oropharyngeal Cancer Network for Staging (ICON-S): A multicentre cohort study. The Lancet Oncology, 17(4), 440–451. doi: 10.1016/S1470-2045(15)00560-4.
8. Anderson, K. S., Gerber, J. E., D’Souza, G., Pai, S. I., Cheng, J. N., Alam, R., … Posner, M. (2015). Biologic predictors of serologic responses to HPV in oropharyngeal cancer: The HOTSPOT study. Oral Oncology, 51(8), 751–758. doi: 10.1016/j.oraloncology.2015.05.007.
9. Yamashita, Y., Ikegami, T., Hirakawa, H., Uehara, T., Deng, Z., Agena, S., … Ganaha A. (2019). Staging and prognosis of oropharyngeal carcinoma according to the 8th edition of the American Joint Committee on Cancer staging manual in the era of human papillomavirus infection. European Archives of Oto-Rhino-Laryngology, 276(3), 827–836. doi: 10.1007/s00405-018-05263-x.
10. Kim, D. Y., Wu, H. G., Kim, J. H., Lee, J. H., Ahn, S. H., Chung, E. J., … Wee, C. W. (2022). Radiotherapy versus surgery in early-stage HPV-positive oropharyngeal cancer. Cancer Research and Treatment, 54(2), 406–416. doi: 10.4143/crt.2021.441.
11. Howard, J. D., & Chung, C. H. (2012). Biology of Human Papillomavirus-Related Oropharyngeal Cancer. Seminars in Radiation Oncology, 22(3), 187–193. doi: 10.1016/j.semradonc.2012.03.002.
12. de Almeida, J. R., Byrd, J. K., Wu, R., Stucken, C. L., Duvvuri, U., Goldstein, D. P., … Genden, E. M. (2014). A systematic review of transoral robotic surgery and radiotherapy for early oropharynx cancer: a systematic review. The Laryngoscope, 124(9), 2096–2102. doi.org/10.1002/lary.24712.
13. Kelly, K., Johnson-Obaseki, S., Lumingu, J., & Corsten, M. (2014). Oncologic, functional and surgical outcomes of primary transoral robotic surgery for early squamous cell cancer of the oropharynx: a systematic review. Oral Oncology, 50(8), 696–703. doi: 10.1016/j.oraloncology.2014.04.005.
14. Morisod, B., & Simon, C. (2014). A meta-analysis on survival of patients treated with trans-oral surgery (TOS) versus radiotherapy (RT) for early stage squamous cell carcinoma of the oropharynx (OPSCC). Head Neck, 38(S1), E2143–E2150. doi: 10.1002/hed.23995.
15. Moore, E. J., Olsen, S. M., Laborde, R. R., García, J. J., Walsh, F. J., Price, D. L., … Kasperbauer, J. L. (2012). Long-term functional and oncologic results of transoral robotic surgery for oropharyngeal squamous cell carcinoma. Mayo Clinic Proceedings, 87(3), 219–225. doi: 10.1016/j.mayocp.2011.10.007.
16. Nguyen, A. T., Luu, M., Mallen-St Clair, J., Mita, A. C., Scher, K. S., Lu, D. J., … Zumsteg, Z. S. (2021). Comparison of survival after transoral robotic surgery vs nonrobotic surgery in patients with early-stage oropharyngeal squamous cell carcinoma. JAMA Oncology, 7(2), 230–237. doi: 10.1001/jamaoncol.2020.3172.
17. Roselló, À., Albuquerque, R., Roselló-Llabrés, X., Marí-Roig, A., Estrugo-Devesa, A., & López-López, J. (2021). Transoral robotic surgery vs open surgery in head and neck cancer. A systematic review of the literature. Medicina Oral Patologia Oral y Cirugia Bucal, 25(5), e599–e607. doi: 10.4317/medoral.23632.
18. Williams, C. E., Kinshuck, A. J., Derbyshire, S. G., Upile, N., Tandon, S., Roland, N. J., … Jones, T. M. (2014). Transoral laser resection versus lip-split mandibulotomy in the management of oropharyngeal squamous cell carcinoma [OPSCC]: a case match study. European Archives of Otorhinolaryngol, 271(2), 367–372. doi: 10.1007/s00405-013-2501-5.
19. Dziegielewski, P. T., Mlynarek, A. M., Dimitry, J., Harris, J. R., & Seikaly, H. (2009). The mandibulotomy: friend or foe? Safety outcomes and literature review. Laryngoscope, 119(12), 2369–2375. doi: 10.1002/lary.20694.
20. Zafereo, M. E., Weber, R. S., Lewin, J. S., Roberts, D. B., & Hanasono, M. M. (2010) Complications and functional outcomes following complex oropharyngeal reconstruction. Head Neck, 32(8), 1003–1011. doi: 10.1002/hed.21290.
21. Tsue, T. T., Desyatnikova, S. S., Deleyiannis, F. W., Futran, N. D., Stack, B. C. Jr., Weymuller, E. A. Jr., & Glenn, M. G. (1997). Comparison of cost and function in reconstruction of the posterior oral cavity and oropharynx. Free vs pedicled soft tissue transfer. Archives of otolaryngology head & neck surgery, 123(7), 731–737. doi: 10.1001/archotol.1997.01900070075012.
22. Holsinger, F. C., Ismaila, N., Adkins, D. R., Barber, B. R., Burnette, G., Fakhry, C., … Ku, J. A. (2025). Transoral robotic surgery in the multidisciplinary care of patients with oropharyngeal squamous cell carcinoma: ASCO guideline. Journal of Clinical Oncology, 43(11), 1369–1392. doi: 10.1200/JCO-24-02755.
23. Gorphe, P., & Simon, C. (2019). A systematic review and meta-analysis of margins in transoral surgery for oropharyngeal carcinoma. Oral Oncology, 98, 69–77. doi: 10.1016/j.oraloncology.2019.09.017.
24. Haughey, B. H., Hinni, M. L., Salassa, J. R., Hayden, R. E., Grant, D. G., Rich, J. T., … Krishna, M. (2011). Transoral laser microsurgery as primary treatment for advanced-stage oropharyngeal cancer: a United States multicenter study. Head Neck, 33(12), 1683–1694. doi: 10.1002/hed.21669.
25. Haughey, B. H., & Sinha, P. (2012). Prognostic factors and survival unique to surgically treated p16+ oropharyngeal cancer. Laryngoscope, 122(2), S13–33. doi: 10.1002/lary.23493.
26. Quon, H., Cohen, M. A., Montone, K. T., Ziober, A. F., Wang, L. P., Weinstein, G. S., & O’Malley, B. W. Jr. (2013). Transoral robotic surgery and adjuvant therapy for oropharyngeal carcinomas and the influence of p16 INK4a on treatment outcomes. Laryngoscope, 123(3), 635–640. doi: 10.1002/lary.22172.
27. Ferris, R. L., & Westra, W. (2023). Oropharyngeal Carcinoma with a Special Focus on HPV-Related Squamous Cell Carcinoma. Annual Review of Pathology, 18, 515–535. doi: 10.1146/annurev-pathmechdis-031521-041424.
28. Cohen, M. A., Weinstein, G. S., O’Malley, B. W. Jr., Feldman, M., & Quon, H. (2011). Transoral robotic surgery and human papillomavirus status: oncologic results. Head Neck, 33(4), 573–580. doi: 10.1002/hed.21500.
29. Grant, D. G., Hinni, M. L., Salassa, J. R., Perry, W. C., Hayden, R. E., & Casler, J. D. (2009). Oropharyngeal cancer: a case for single modality treatment with transoral laser microsurgery. Archives of otolaryngology head & neck surgery, 135(12), 1225–1230. doi: 10.1001/archoto.2009.185.
30. Mella, M. H., Chabrillac, E., Dupret-Bories, A., Mirallie, M., & Vergez, S. (2023). Transoral robotic surgery for head and neck cancer: Advances and residual knowledge gaps. Journal of clinical medicine, 12(6), 2303. doi: 10.3390/jcm12062303.
31. Chen, M. M., Roman, S. A., Kraus, D. H., Sosa, J. A., & Judson, B. L. (2014). Transoral robotic surgery: a population-level analysis. Otolaryngology head and neck surgery, 150(6), 968–975. doi: 10.1177/0194599814525747.
32. Brown, J. S., Zuydam, A. C., Jones, D. C., Rogers, S. N., & Vaughan, E. D. (1997). Functional outcome in soft palate reconstruction using a radial forearm free flap in conjunction with a superiorly based pharyngeal flap. Head Neck, 19(6), 524–534. doi: 10.1002/(sici)1097-0347(199709)19:6<524::aid-hed10>3.0.co;2-5.
33. Candela, F. C., Kothari, K., & Shah, J. P. (1990). Patterns of cervical node metastases from squamous carcinoma of the oropharynx and hypopharynx. Head Neck, 12(3), 197–203. doi: 10.1002/hed.2880120302.
34. Lim, Y. C., Koo, B. S., Lee, J. S., Lim, J. Y., & Choi, E. C. (2006). Distributions of cervical lymph node metastases in oropharyngeal carcinoma: therapeutic implications for the N0 neck. Laryngoscope, 116(7), 1148–1152. doi: 10.1097/01.mlg.0000217543.40027.1d.
35. Kuntz, A. L., & Weymuller, Jr. E. A. (1999). Impact of neck dissection on quality of life. Laryngoscope, 109(8), 1334–1338. doi: 10.1097/00005537-199908000-00030.
36. Terrell, J. E., Welsh, D. E., Bradford, C. R., Chepeha, D. B., Esclamado, R. M., Hogikyan, N. D., & Wolf, G. T. (2000). Pain, quality of life, and spinal accessory nerve status after neck dissection. Laryngoscope, 110(4), 620–626. doi: 10.1097/00005537-200004000-00016.
37. Shivhare, V., Rath, S., Shah, I. B., Dash, N. K., Parikh, A., & Kunikullaya, U. S. (2024). Survival outcomes and failure patterns for oropharyngeal cancers treated with simultaneous integrated boost in intensity modulated radiotherapy (SIB-IMRT) and concurrent chemotherapy. Klinická onkologie: casopis Ceské a Slovenské onkologické spolecnosti, 37(3), 202–208. doi: 10.48095/ccko2024202.
38. Lee, N., Puri, D. R., Blanco, A. I., & Chao, K. S. (2007). Intensity-modulated radiation therapy in head and neck cancers: an update. Head Neck, 29(4), 387–400. doi: 10.1002/hed.20332.
39. Holliday, E. B., & Frank, S. J. (2014). Proton radiation therapy for head and neck cancer: a review of the clinical experience to date. International journal of radiation oncology, biology, physics, 89(2), 292–302. doi: 10.1016/j.ijrobp.2014.02.029.
40. Frank, S. J., Busse, P., Rosenthal, D. I., Hernandez, M., Swanson, D. M., Garden, A. S., … Robert, L. F. (2024). Phase III randomized trial of intensity-modulated proton therapy (IMPT) versus intensity-modulated photon therapy (IMRT) for the treatment of head and neck oropharyngeal carcinoma (OPC). Journal of Clinical Oncology, 42(16), 6006. doi.org/10.1200/JCO.2024.42.16_suppl.6006.
41. Braam, P. M., Roesink, J. M., Moerland, M. A., Raaijmakers, C. P., Schipper, M., & Terhaard, C. H. (2005). Long-term parotid gland function after radiotherapy. International journal of radiation oncology, biology, physics, 62(3), 659–664. doi: 10.1016/j.ijrobp.2004.12.015.
42. Deasy, J. O., Moiseenko, V., Marks, L., Chao, K. S., Nam, J., & Eisbruch, A. (2010). Radiotherapy dose-volume effects on salivary gland function. International journal of radiation oncology, biology, physics, 76(3), S58–63. doi: 10.1016/j.ijrobp.2009.06.090.
43. Gupta, T., Agarwal, J., Jain, S., Phurailatpam, R., Kannan, S., Ghosh-Laskar, S., … D’Cruz, A. (2012). Three-dimensional conformal radiotherapy (3D-CRT) versus intensity modulated radiation therapy (IMRT) in squamous cell carcinoma of the head and neck: a randomized controlled trial. Radiotherapy and oncology, 104(3), 343–348. doi: 10.1016/j.radonc.2012.07.001.
44. Kam, M. K., Leung, S. F., Zee, B., Chau, R. M., Suen, J. J., Mo, F., … Chan, A. T. (2007). Prospective randomized study of intensity-modulated radiotherapy on salivary gland function in early-stage nasopharyngeal carcinoma patients. Journal of clinical oncology, 25(31), 4873–4879. doi: 10.1200/JCO.2007.11.5501.
45. Nutting, C. M., Morden, J. P., Harrington, K. J., Urbano, T. G., Bhide, S. A., Clark, C., … Hall, E. (2011). Parotid-sparing intensity modulated versus conventional radiotherapy in head and neckcancer (PARSPORT): a phase 3 multicentre randomised controlled trial. The Lancet. Oncology, 12(2), 127–136. doi: 10.1016/S1470-2045(10)70290-4.
46. Mendenhall, W. M. (2004). Mandibular osteoradionecrosis. Journal of clinical oncology, 22(24), 4867–4868. doi: 10.1200/JCO.2004.09.959.
47. Monnier, Y., Broome, M., Betz, M., Bouferrache, K., Ozsahin, M., & Jaques, B. (2011). Mandibular osteoradionecrosis in squamous cell carcinoma of the oral cavity and oropharynx: incidence and risk factors. Otolaryngology head and neck surgery, 144(5), 726–732. doi: 10.1177/0194599810396290.
48. Peterson, D. E., Doerr, W., Hovan, A., Pinto, A., Saunders, D., Elting, L. S., … Brennan, M. T. (2010). Osteoradionecrosis in cancer patients: the evidence base for treatment-dependent frequency, current management strategies, and future studies. Supportive care in cancer, 18(8), 1089–1098. doi: 10.1007/s00520-010-0898-6.
49. Wetzels, J. W., Merkx, M. A., de Haan, A. F., Koole, R., & Speksnijder, C. M. (2014). Maximum mouth opening and trismus in 143 patients treated for oral cancer: a 1-year prospective study. Head and Neck, 36(12), 1754–1762. doi: 10.1002/hed.23534.
50. Bensadoun, R. J., Riesenbeck, D., Lockhart, P. B., Elting, L. S., Spijkervet, F. K., & Brennan, M. T. (2010). A systematic review of trismus induced by cancer therapies in head and neck cancer patients. Supportive care in cancer, 18(8), 1033–1038. doi: 10.1007/s00520-010-0847-4.
51. Chao, K. S., Ozyigit, G., Blanco, A. I., Thorstad, W. L., Deasy, J. O., Haughey, B. H., … Sessions, D. G. (2004). Intensity-modulated radiation therapy for oropharyngeal carcinoma: impact of tumor volume. International journal of radiation oncology, biology, physics, 59(1), 43–50. doi: 10.1016/j.ijrobp.2003.08.004.
52. Scott, A. S., Parr, L. A., & Johnstone, P. A. (2009). Risk of cerebrovascular events after neck and supraclavicular radiotherapy: a systematic review. Radiotherapy and oncology, 90(2), 163–165. doi: 10.1016/j.radonc.2008.12.019.
53. Dorresteijn, L. D., Kappelle, A. C., Boogerd, W., Klokman, W. J., Balm, A. J., Keus, R. B., … Bartelink, H. (2002). Increased risk of ischemic stroke after radiotherapy on the neck in patients younger than 60 years. Journal of clinical oncology, 20(1), 282–288. doi: 10.1200/JCO.2002.20.1.282.
54. Fundakowski, C. E., & Lango, M. (2016). Considerations in surgical and nonsurgical management of HPV-positive oropharyngeal cancer. Head & Neck Cancers, 1, 6. doi: 10.1186/s41199-016-0007-8.
55. Horiot, J. C., Le Fur, R., N’Guyen, T., Chenal, C., Schraub, S., Alfonsi, S., … Bolla, M. (1992). Hyperfractionation versus conventional fractionation in oropharyngeal carcinoma: final analysis of a randomized trial of the EORTC cooperative group of radiotherapy. Radiotherapy and Oncology, 25(4), 231–241. doi: 10.1016/0167-8140(92)90242-m.
56. Fu, K. K., Pajak, T. F., Trotti, A., Jones, C. U., Spencer, S. A., Phillips, T. L., … Ang, K. K. (2001). A Radiation Therapy Oncology Group (RTOG) phase III randomized study to compare hyperfractionation and two variants of accelerated fractionation to standard fractionation radiotherapy for squamous cell carcinomas of the head and neck: First report of RTOG 9003. International Journal of Radiation Oncology, Biology, Physics, 48(1), 7–16. doi: 10.1016/s0360-3016(00)00663-5.
57. Nutting, C. M., Morden, J. P., Harrington, K. J., Urbano, T. G., Bhide, S. A., Clark, C., … Hall, E. (2011). Parotid-sparing intensity modulated versus conventional radiotherapy in head and neck cancer (PARSPORT): A phase 3 multicentre randomized controlled trial. The Lancet Oncology, 12(2), 127–136. doi: 10.1016/S1470-2045(10)70290-4.
58. Eisbruch, A., Harris, J., Garden, A. S., Chao, C. K., Straube, W., Harari, P. M., … Ang, K. K. (2010). Multi-institutional trial of accelerated hypofractionated intensity-modulated radiation therapy for early-stage oropharyngeal cancer (RTOG 00-22). International Journal of Radiation Oncology, Biology, Physics, 76(5), 1333–1338. doi: 10.1016/j.ijrobp.2009.04.011.
59. Nutting, C., Finneran, L., Roe, J., Sydenham, M. A., Beasley, M., Bhide, S., … Hall, E. (2023). Dysphagia-optimised intensity-modulated radiotherapy versus standard intensity-modulated radiotherapy in patients with head and neck cancer (DARS): a phase 3, multicentre, randomised controlled trial. The Lancet Oncology, 24(7), 868–880. doi: 10.1016/S1470-2045(23)00265-6.
60. Machtay, M., Moughan, J., Trotti, A., Garden, A. S., Weber, R. S., Cooper, J. S., … Ang, K. K. (2008). Factors associated with severe late toxicity after concurrent chemoradiation for locally advanced head and neck cancer: An RTOG analysis. Journal of Clinical Oncology, 26(21), 3582–3589. doi: 10.1200/JCO.2007.14.8841.
61. Chera, B. S., Amdur, R. J., Tepper, J., Qaqish, B., Green, R., Aumer, S. L., … Mendenhall, W. (2015). Phase 2 trial of de-intensified chemoradiation therapy for favorable-risk human papillomavirus-associated oropharyngeal squamous cell carcinoma. International Journal of Radiation Oncology, Biology, Physics, 93(5), 976–985. doi: 10.1016/j.ijrobp.2015.08.033.
62. Yom, S. S., Torres-Saavedra, P., Caudell, J. J., Waldron, J. N., Gillison, M. L., Xia, P., … Le, Q. T. (2021). Reduced-dose radiation therapy for HPV-associated oropharyngeal carcinoma (NRG Oncology HN002). Journal of Clinical Oncology, 39(9), 956–965. doi: 10.1200/JCO.20.03128.
63. Nichols, A. C., Theurer, J., Prisman, E., Read, N., Berthelet, E., Tran, E., … Palma, D. A. (2019). Radiotherapy versus transoral robotic surgery and neck dissection for oropharyngeal squamous cell carcinoma (ORATOR): an open-label, phase 2, randomised trial. Lancet Oncology, 20, 1349–1359. doi: 10.1016/S1470-2045(19)30410-3.
64. Palma, D. A., Prisman, E., Berthelet, E., Tran, E., Hamilton, S., Wu, J., … Nichols, A. C. (2022). Assessment of toxic effects and survival in treatment deescalation with radiotherapy vs transoral surgery for HPV-associated oropharyngeal squamous cell carcinoma: The ORATOR2 phase 2 randomized clinical trial. JAMA Oncology, 8(10), 1–9. doi: 10.1001/jamaoncol.2022.0615.
65. Stelmes, J. J., Vu, E., Grégoire, V., Simon, C., Clementel, E., Kazmierska, J., … Weber, D. C. (2021). Quality assurance of radiotherapy in the ongoing EORTC 1420 “Best of” trial for early stage oropharyngeal, supraglottic and hypopharyngeal carcinoma: Results of the benchmark case procedure. Radiation Oncology, 16(81). doi: 10.1186/s13014-021-01809-2.
66. Rujan, S. A., Bertesteanu, S. V. G., Grigore, R., Popescu, B., Condeescu-Cojocarita, M., Alexandru, N., … Taher, B. P. (2024). A Review and Comparative Analysis of Transoral Surgical Treatment versus Conservative Management in Early-Stage Oropharyngeal Cancer. Journal of Personalized Medicine, 14(3), 283. doi: 10.3390/jpm14030283.
67. Rennemo, E., Zätterström, U., & Boysen, M. (2008). Impact of second primary tumors on survival in head and neck cancer: an analysis of 2,063 cases. Laryngoscope, 118(8), 1350–1356. doi: 10.1097/MLG.0b013e318172ef9a.
68. Ho, A. S., Kraus, D. H., Ganly, I., Lee, N. Y., Shah, J. P., & Morris, L. G. (2014). Decision making in the management of recurrent head and neck cancer. Head and Neck, 36(1), 144–151. doi: 10.1002/hed.23227.
69. Morris, L. G., Sikora, A. G., Patel, S. G., Hayes, R. B., & Ganly, I. (2011). Second primary cancers after an index head and neck cancer: subsite-specific trends in the era of human papillomavirus-associated oropharyngeal cancer. Journal of Clinical Oncology, 29(6), 739–746. doi: 10.1200/JCO.2010.31.8311.
70. Peck, B. W., Dahlstrom, K. R., Gan, S. J., Caywood, W., Li, G., Wei, Q., … Sturgis, E. M. (2013). Low risk of second primary malignancies among never smokers with human papillomavirus-associated index oropharyngeal cancers. Head and Neck, 35(6), 794–799. doi:10.1002/hed.23033.
Адреса для листування:
Фокін Геннадій Геннадійович
01601, Київ, просп. Берестейський, 34
Національний медичний університет ім. О.О. Богомольця
E-mail: fokinhennadii@gmail.com
Correspondence:
Fokin Hennadii
34 Beresteisky ave., Kyiv, 01601
Bogomolets National Medical University
E-mail: fokinhennadii@gmail.com














Leave a comment