Лікування інгібіторами тирозинкінази пацієнтів з метастатичним диференційованим раком щитоподібної залози, рефрактерним до радіойодотерапії
Солодянникова О.І., Даниленко В.В.
Резюме. Мета дослідження — розробити та впровадити спосіб лікування йод-негативних метастазів диференційованого раку щитоподібної залози (ДРЩЗ). Матеріали та методи дослідження. Проліковано 38 хворих з йод-негативними метастазами ДРЩЗ, з яких у 10 ефективність лікування оцінювалася за допомогою сцинтиграфії всього тіла (СВТ) з технецієм (99mTс) сестамібі (Technetium-99m sestamibi — 99mTc-MIBI); у 10 — з технецієм (99mTс) димеркаптосукциновою кислотою (Technetium-99m-dimercaptosuccinic acid — 99mTc-DMCA); у 10 хворих безпосередні результати лікування інгібіторами тирозинкінази оцінювалися за допомогою позитронно-емісійної томографії (ПЕТ) з 18F-фтордезоксиглюкозою (ФДГ); група, в якій за наявності ураження кісток лікування здійснювалося за допомогою радіонуклідної та дистанційної променевої терапії, становила 8 пацієнтів. Результати. Проведення досліджень з одержанням метаболічних зображень у пацієнтів з йод-негативною формою ДРЩЗ до та після проведення таргетної терапії дозволило оцінити її ефективність як за розмірами метастатичного вогнища, так і рівнем його функціональної активності. Висновки. Наведені результати можливостей радіонуклідних методів діагностики для оцінки ефективності лікування метастазів йод-негативного раку щитоподібної залози. За критеріями інформативності оцінені можливості радіофармацевтичних препаратів (РФП) 99mTc-MIBI, 99mTc-DMCA та 18F-ФДГ. Визначено показники статистичного аналізу ефективності лікування ДРЩЗ інгібіторами тирозинкінази. Встановлено відсоток найвищої чутливості застосованих РФП.
Одержано 4.11.2025
Прийнято до друку 14.11.2025
DOI: 10.32471/clinicaloncology.2663-466X.35101
ВСТУП
Значною медико-соціальною проблемою останніх десятиріч є радіойодорезистентні (РР) форми ДРЩЗ, при яких метастази папілярних та фолікулярних карцином втрачають здатність до накопичення радіойоду. Як наслідок, стає неефективною і недоцільною радіойодотерапія (РЙТ), яка, згідно з Європейським консенсусом щодо ведення хворих на диференційовану карциному щитоподібної залози (European consensus for the management of patients with differentiated thyroid carcinoma of the follicular epithelium), 2010 р., є обов’язковим етапом комплексного лікування ДРЩЗ [1, 2].
Сучасний менеджмент лікування йод-негативних метастазів ДРЩЗ має свої особливості. По-перше, це супресивна гормональна терапія тироксином під контролем рівня тиреотропного гормону (ТТГ) <0,1 мО/л [3]. По-друге, за необхідності — променеве лікування окремого локуса. При прогресуванні призначається таргетна терапія першої лінії. Контроль за ефективністю лікування здійснюється за допомогою діагностичного дослідження з одержанням зображення кожні 4–6 міс.
Останніми роками в Україні зареєстровані та почали застосовуватися в лікуванні рефрактерних форм ДРЩЗ інгібітори тирозинкінази (сорафеніб, сунітиніб). Проте лише в поодиноких дослідженнях вивчали цитологічні аспекти у прогнозуванні РР папілярного раку щитоподібної залози [4], розроблявся радіонуклідний моніторинг та діагностичний алгоритм для виявлення рецидивів і метастазів у хворих з йод-негативними формами ДРЩЗ [5–8]. Водночас науково-клінічні аспекти лікування РР папілярного раку щитоподібної залози в українській онкології та радіології практично не досліджуються.
Останнім десятиріччям за кордоном в європейській та американській онкології широко вивчається можливість використання найновіших діагностичних та лікувальних технологій для виявлення і терапії рецидивів та метастазів у хворих з йод-негативними вогнищами при ДРЩЗ.
Слід відзначити, що віддалені метастази діагностують у 10–15% хворих на ДРЩЗ. Половину метастазів виявляють при первинному обстеженні, інші — при наступному спостереженні з медіаною 3–4 роки; 15% віддалених метастазів діагностують більш ніж за 10 років після первинного лікування, що свідчить про необхідність спостереження цих хворих протягом усього життя [9]. Зазвичай віддалені метастази виникають у легенях та кістках, значно рідше, у близько 3% хворих — в головному мозку, печінці, шкірі [10]. Майже всі хворі з віддаленими метастазами мають високий рівень тиреоглобуліну (ТГ) і у 2/3 пацієнтів відмічається накопичення радіойоду.
РЙТ є важливим і дієвим компонентом лікування, але вона може ставати неефективною у зв’язку з розвитком РР.
Радіорезистентність осередків ДРЩЗ тією чи іншою мірю виникає первинно або в процесі лікування у 5–15% хворих. Розвиток РР суттєво погіршує прогноз, знижуючи загальну 10-річну виживаність до 10%. Виживаність хворих на РР ДРЩЗ з віддаленими метастазами становить 2,5–3,5 року [11].
Щодо лікування йод-негативних форм ДРЩЗ, досліджуються можливості хімієтерапії. У літературних джерелах наводяться результати застосування комбінації доксорубіцин + цисплатин, однак відмічається її висока токсичність [12]. Представлені перші результати клінічних досліджень із застосування молекулярно-таргетних препаратів, деякі з них уже застосовуються в схемах лікування рефрактерних форм ДРЩЗ [13, 14].
Інноваційним методом є застосування нової таргетної монотерапії протипухлинним препаратом, інгібітором протеїнкіназ Нексавар® (сорафеніб) метастазів ДРЩЗ, які за результатами сканування з натрію йодидом (131I-NaI) є нечутливими до РЙТ. Показанням до використання методу є первинна чи індукована форма РР у пацієнтів з метастазами ДРЩЗ.
Згідно з результатами багатоцентрових клінічних досліджень, Нексавар® суттєво знижує ризик прогресування захворювання, що становить 41% порівняно з плацебо. Медіана виживаності без прогресування (ВБП) дорівнює 10,8 міс у групі сорафенібу (Нексавар®) порівняно з 5,8 міс у групі плацебо. Максимальне зменшення цільової ділянки ураження досягається у 73% осіб у групі сорафенібу порівняно з 27% при плацебо. Контроль над захворюванням встановлюється у 54% пацієнтів завдяки стабілізації процесу на тлі нормалізації показників тироглобуліну.
Слід також зазначити, що на основі даних доказової медицини (рівень 1-А) препарат Нексавар® (сорафеніб) включений до схеми лікування метастатичного прогресуючого ДРЩЗ, рефрактерного до лікування радіоактивним йодом, у 2014 р. згідно з американськими рекомендаціями Національної мережі багатопрофільних онкологічних закладів США (National Comprehensive Cancer Network — NCCN).
Так, стан проблеми лікування та післятерапевтичного моніторингу пацієнтів з йод-негативними формами ДРЩЗ наразі залишається недостатньо вивченим, що і зумовило мету дослідження — розробити та впровадити спосіб лікування йод-негативних метастазів ДРЩЗ.
МАТЕРІАЛИ ТА МЕТОДИ дослідження
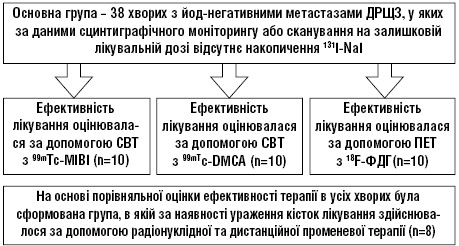
Проліковано 38 хворих з йод-негативними метастазами ДРЩЗ, з яких у 10 ефективність лікування оцінювали за допомогою СВТ з 99mTc-MIBI; у 10 — з 99mTc-DMCA; у 10 хворих безпосередні результати лікування інгібіторами тирозинкінази оцінювали за допомогою ПЕТ з 18F-ФДГ; група, в якій за наявності ураження кісток лікування здійснювалося за допомогою радіонуклідної та дистанційної променевої терапії, охоплювала 8 пацієнтів.
Для розв’язання поставлених завдань був проведений ретроспективний аналіз результатів комплексного лікування 8 хворих на йод-рефрактерний ДРЩЗ з кістковими метастазами, що отримували РЙТ у науково-клінічному вiддiленні радiонуклiдної дiагностики та терапії з лiжками для лiкування РФП у вiдкритому вигляді Державного некомерційного підприємства «Національний інститут раку» у 2015–2020 рр.
У цю групу залучено 4 жінок і 4 чоловіків віком від 43 до 76, середній вік — (57,8+3,9) роки, медіана — 30,8 року. Стадія T2N1M1 визначена у 2 хворих, T3N0M1 — у 1, T4N0M1 — у 2, T4N1M1 — у 2, TхNхM1 — у 1.
Метастазування тільки в кістки виявлено у 1 хворого, у кістки та легені — у 6, у кістки і головний мозок — у 1. У всіх пацієнтів кісткові метастази зафіксовано при первинній діагностиці. Патогістологічно папілярний рак діагностовано у 5 осіб, фолікулярний — у 3, папілярно-фолікулярний — у 1.
Схема виконання першого етапу наведена на рис. 1.
Методика лікування сорафенібом. Застосування препарату сорафеніб (Нексавар®) в якості пероральної таргетної монотерапії у пацієнтів з ДРЩЗ, рефрактерним до РЙТ, проводиться в дозі 800 мг/добу (2 таблетки по 200 мг 2 р/добу), що сприяє досягненню позитивного результату лікування з передбачуваним та керованим профілем побічних явищ. Механізм дії препарату Нексавар® базується на тому, що він є інгібітором низки ферментів із групи кіназ, який знижує проліферацію пухлинних клітин in vitro. Доведено, що сорафеніб інгібує численні внутрішньоклітинні кінази (c-CRAF, BRAF та мутовану BRAF) та кінази клітинної поверхні (KIT, FLT-3, RET, VEGFR-1, VEGFR-2, VEGFR-3, PDGFR-β).
Основним критерієм ефективності препарату була оцінка за результатами радіологічних обстежень та контролем над захворюванням за даними динаміки рівнів онкомаркера — тироглобуліну.
Оцінювання ефективності лікування сорафенібом у першій групі проводилося з 99mTc-MIBI в індикаторній дозі 450–500 МБк.
Препарат вводився внутрішньовенно. Дослідження проводилися на гама-камері з використанням низькоенергетичного паралельного коліматора високої роздільної здатності при налаштуванні на фотопік 140 кеВ і шириною вікна дискримінації 10%. Запис діагностичного зображення здійснювався через 40–60 хв після внутрішньовенного введення 450–500 МБк з 99mТс-MIBI.
У другій групі порівняння оцінювання ефективності лікування сорафенібом проводилося з 99mTc- DMCA в індикаторній дозі 450–500 МБк. Препарат вводився внутрішньовенно. Дослідження проводилися на гама-камері з використанням низькоенергетичного паралельного коліматора високої роздільної здатності при налаштуванні на фотопік 140 кеВ і шириною вікна дискримінації 10%. Запис діагностичного зображення здійснювався через 40–60 хв після внутрішньовенного введення 450–500 МБк з 99mТс-DMCA.
Отримані дані оброблялися за допомогою комп’ютерного забезпечення «Syngo» (фірма «Siemens Healthcare»). Комп’ютерна обробка включала стандартні операції контрастування зображень, кадрової алгебри, побудову «зон інтересу», кривих «активність — час», визначення коефіцієнтів відносного накопичення РФП «осередок / фон». Побудова кривих «активність — час» дозволяла виявити оптимальні інтервали для сумації кадрів, а проведення статичної сцинтиграфії в декількох проєкціях або однофотонної емісійної комп’ютерної томографії (ОФЕКТ) — підвищити точність топографічної діагностики. При виявленні осередкових ділянок гіперфіксації РФП в зоні шиї та середостіння за даними динамічної та статичної сцинтиграфій оцінювали результати радіонуклідної ангіографії. У разі гіперваскуляризації осередків гіперфіксації РФП в ангіографічну фазу діагностували наявність йод-негативних метастазів.
Коефіцієнт відносного накопичення РФП у метастатичних осередках визначався за формулою:
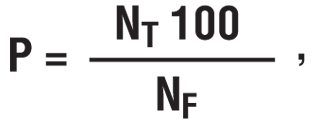
де Р — коефіцієнт відносного накопичення РФП в метастатичних осередках, %;
NT — кількість імпульсів на 1 піксель у «зоні інтересу», побудованій на осередку метастазу;
NF — кількість імпульсів на 1 піксель у «зоні інтересу», побудованій на симетричній ділянці нормальної тканини.
Перед виконанням комплексного радіонуклідного дослідження всім хворим проводилися контрольна сцинтиграфія з 131I, ультразвукова діагностика (УЗД), комп’ютерна томографія (КТ).
КТ шиї та органів грудної порожнини виконували у 25 хворих згідно зі стандартною методикою з обов’язковим контрастуванням.
Усім хворим радіонуклідні дослідження виконували на дводетекторній гама-камері фірми «Mediso» (Угорщина) та однофотонному емісійному комп’ютерному томографі «E. CAM 180» фірми «Siemens» (Німеччина).
У третій групі порівняння оцінювання ефективності лікування сорафенібом проводилося за допомогою ПЕТ- / КТ-обстеження. Останнє складається з декількох етапів: консультативний запис пацієнта та визначення протоколу обстеження; підготовка пацієнта до ПЕТ / КТ; проведення ПЕТ- / КТ-обстеження; аналіз результатів; відпочинок пацієнта після обстеження і видача висновку у вигляді твердої копії.
Перед обстеженням проводиться вимірювання зросту та маси тіла пацієнта. Останні повинні бути визначені точно, оскільки на основі них визначається рівень накопичення РФП.
Перед дослідженням проводиться контроль рівня глюкози в плазмі крові, і лише після встановлення допустимих показників <11 ммоль/л або <200 мг/дл дослідження ПЕТ з 18F-ФДГ може бути виконаним. Якщо рівень глюкози в плазмі крові становить >11 ммоль/л, дослідження має бути перенесене. Аналіз крові на глюкозу повинен бути виконаний за допомогою каліброваного і затвердженого методу, оскільки використовується в якості поправки при визначенні рівня накопичення РФП. Для клінічних досліджень рекомендовані верхні показники рівня глюкози від 7 ммоль/л до 8,3 ммоль/л.
Дозування РФП здійснюється стандартним методом з огляду на масу тіла пацієнта. Введення препарату здійснюється внутрішньовенно з подальшим промиванням місця ін’єкції 10 мл фізіологічного розчину.
Під час ін’єкції 18F-ФДГ і подальшої фази поглинання РФП пацієнт повинен сидіти або лежати спокійно, щоб мінімізувати накопичення 18F-ФДГ в м’язах. З метою мінімізації накопичення 18F-ФДГ в «бурій жировій тканині» пацієнт має постійно перебувати в теплому приміщенні.
Для хворих на цукровий діабет (ЦД) визначається особливий протокол залежно від типу захворювання. При I типі ЦД дослідження може бути заплановане на пізній ранок чи опівдні. Для пацієнтів, що знаходяться на безперервній інфузії інсуліну, обстеження має бути заплановане на ранній ранок. При II типі ЦД ПЕТ-дослідження рекомендується проводити пізнім ранком.
Показник активності 18F-ФДГ визначається за типом сканування та розраховується згідно з масою тіла. Так, у разі 2D-сканування — 5 МБк/кг маси тіла, у разі 3D-сканування — 2,5 МБк/кг маси тіла. У середньому при масі тіла 75–80 кг і введеній активності 180 МБк ефективна доза опромінення при ПЕТ-дослідженні становитиме близько 6–11 мЗв. Складова від 18F-ФДГ дорівнює близько 3–4 мЗв, решта належить до КТ.
Рекомендований інтервал між часом введення 18F-ФДГ та початком сканування становить 60 хв. Зміни часового інтервалу повинні чітко фіксуватися, тому що від цього залежить вимірювання показників накопичення РФП.
Стандартна діагностична КТ з внутрішньовенним введенням контрастної речовини здійснюється відповідно до затверджених методик: після низькодозової КТ та ПЕТ-збору даних.
Лікар з ядерної медицини оцінює зображення ПЕТ та КТ на екрані спеціалізованої робочої станції. Пакети програмного забезпечення дозволяють візуалізувати зображення ПЕТ, КТ та ПЕТ / КТ, поєднувати їх в аксіальній, коронарній та сагітальній площинах. Наявність або відсутність аномального накопичення 18F-ФДГ оцінюється поєднано з його розміром та інтенсивністю. Стандартизований показник накопичення (SUV) використовується як додаток до візуальної оцінки і розраховується за формулою:

де Actvoi – активність, виміряна в обсязі інтересу;
Actadministered – введена активність з поправкою на фізичний розпад 18F-ФДГ;
BW – маса тіла.
При виконанні ПЕТ / КТ потрібно враховувати, що між попереднім курсом лікування та діагностичним дослідженням має бути певний інтервал: хімієтерапія і ПЕТ — термін не менше ніж 21 день. Ефект променевої терапії є більш тривалим, тому ПЕТ з 18F-ФДГ доцільно проводити не раніше ніж за 3 міс після завершення лікування.
18F-ФДГ-накопичення може бути описане як легке, помірне та інтенсивне порівняно з фоновим поглинанням. Наприклад, у паренхімі печінки середній показник SUV становить 2,0–3,0, максимальний 3,0–4,0. Однак критерії для візуальної інтерпретації повинні бути визначені для кожного протоколу дослідження або типу раку, тому що вони можуть відрізнятися для різних місць та типів пухлин.
Статистична обробка отриманих даних виконувалася за допомогою пакетів програм «Axum v 5.0», «Statistica v 5.0».
ОТРИМАНІ РЕЗУЛЬТАТИ ТА ЇХ ОБГОВОРЕННЯ
Обстежено 10 хворих з ДРЩЗ, у яких до початку терапії проведено СВТ з 99mTc-MIBI з метою оцінки діагностичної ефективності сцинтиграфічного зображення.
Наводимо клінічний приклад СВТ з 99mTc-MIBI у пацієнта з йодрефрактерністю за результатами останніх постлікувальних сканувань (рис. 2).
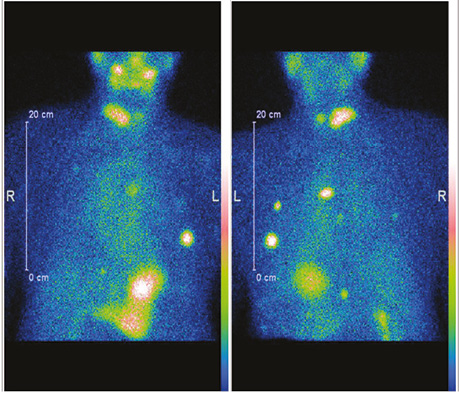
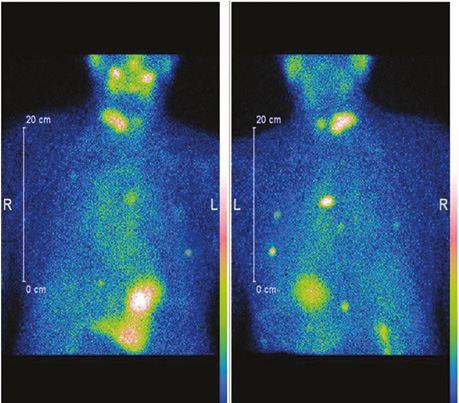
Після проведення діагностичного обстеження пацієнту призначено таргетну терапію препаратом Нексавар® згідно з протоколом лікування. Досягнуто регресії вогнища в легенях в межах 70% (рис. 3). Подальший моніторинг ефективності протипухлинного лікування проводився за допомогою СВТ з 99mTc-MIBI.
10 пацієнтів, яким діагностичне дослідження провели з ПЕТ / КТ з 18F-ФДГ, також були проліковані за допомогою таргетної терапії препаратом Нексавар®.
В якості ілюстрації наводимо клінічні випадки виконання ПЕТ / КТ з 18F-ФДГ у хворих з йод-негативними вогнищами ДРЩЗ з метою діагностики та постлікувального моніторингу.
Хворий А., папілярний рак щитоподібної залози, 4 курси РЙТ, відсутність накопичення 131I-NaI на постлікувальному скані після 3-го курсу. За даними УЗД та КТ обстеження — підозра на можливі вогнища в зоні шиї та легень. Хворому назначено ПЕТ / КТ з 18F-ФДГ (рис. 4, 5).
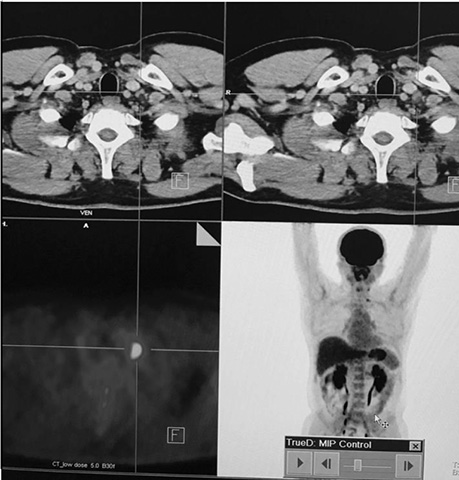
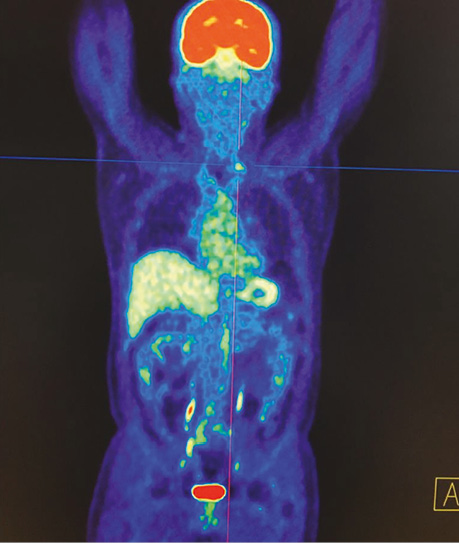
За даними ПЕТ / КТ з 18F-ФДГ у цього пацієнта підтверджено наявність вогнища гіперфіксації РФП в зоні шиї, водночас не виявлено ознак пролонгації процесу в легенях. Вірогідно, ідентифіковані вогнища за даними КТ відповідають фіброзним змінам після перенесених запальних процесів.
Після проведення діагностичного обстеження хворому призначено таргетну терапію препаратом Нексавар® згідно з протоколом лікування.
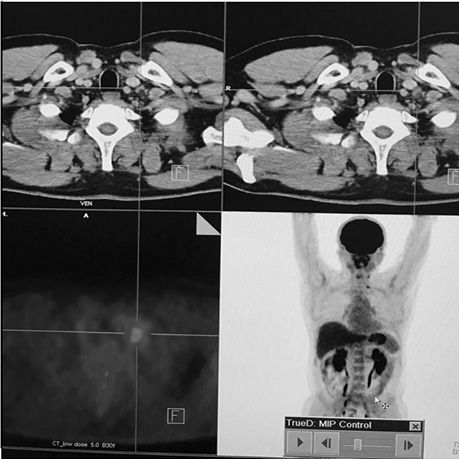
Діагностичне сканування з 18F-ФДГ допомогло виявити зниження функціональної активності вогнища в зоні шиї (SUV — 6,9–4,2). Зменшення розміру вогнища не відмічалося (рис. 6).
У пацієнта Б. з фолікулярною формою ДРЩЗ на постлікувальному скані після 5 курсу РЙТ відмічалася відсутність накопичення 131I-NaI. При цьому за даними КТ та високими показниками ТГ можна було передбачити можливість метастазування. Хворому рекомендовано ПЕТ / КТ з 18F-ФДГ (рис. 7).
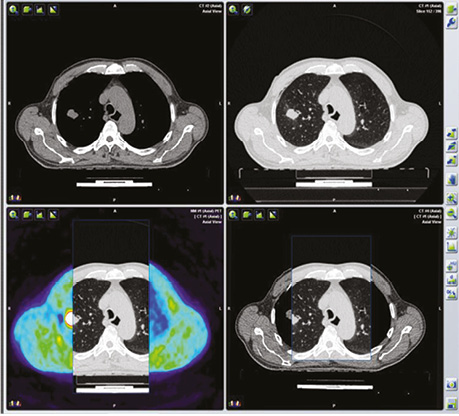
На КТ-зображенні відмічається чітке вогнище в лівій легені, яке збігається при накладанні метаболічного ПЕТ-скану. Інші дрібні вогнища відповідають фіброзним та кальцинатним утворенням.
Отже, на етапі одержання структурного зображення вже була отримана інформація про наявність метастатичного вогнища в легені, яка була підтверджена за допомогою 3D-трансформації (рис. 8).
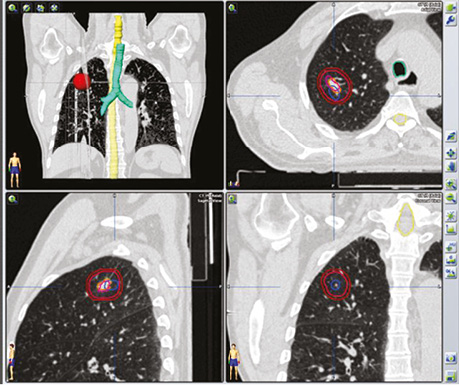
Наступним етапом була таргетна терапія йод-негативного метастатичного вогнища в легені. Для оцінки результативності лікування проведено ПЕТ / КТ з 18F-ФДГ. За даними метаболічного сканування достовірних змін як щодо розмірів вогнища, так і ступеня його функціональної активності не виявлено.
Так, проведення досліджень з одержанням метаболічних зображень у пацієнтів з йод-негативною формою ДРЩЗ до та після проведення таргетної терапії дозволило оцінити її ефективність як за розмірами метастатичного вогнища, так і рівнем його функціональної активності.
ВИСНОВКИ
1. Лікування йод-негативних метастазів ДРЩЗ за допомогою інгібіторів тирозинкінази супроводжувалося зменшенням кількості метастатичних вогнищ та зниженням рівня їх функціональної активності.
2. Проведені дослідження підтвердили можливість використання методик з нейодними РФП (99mTc-MIBI, 99mTc-DMCA) для оцінки ефективності лікування йод-негативних метастазів ДРЩЗ.
3. ПЕТ / КТ з 18F-ФДГ є високоінформативною методикою для оцінки впливу інгібіторів тирозинкінази на функціональну активність метастатичних вогнищ за даними метаболічного сканування при лікуванні йод-негативних метастазів ДРЩЗ.
список ВИКОРИСТАНОЇ ЛІТЕРАТУРИ
1. Schlumberger, M., Brose, M., Elisei, R., Leboulleux, S., Luster, M., Pitoia, F., & Pacini, F. (2014). Definition and management of radioactive iodine-refractory differentiated thyroid cancer. Lancet Diabetes & Endocrinology, 2, 356–358. doi: 10.1016/S2213-8587(13)70215-8.
2. Schlumberger, M., Pacini, F., & Tuttle, R. M. (2015). Thyroid tumors. TCgraphite, 430.
3. Rothenberg, S. M., McFadden, D. G., & Palmer, E. L. (2015). Redifferentiation of iodine-refractory BRAF V600E-mutant metastatic papillary thyroid cancer with dabrafenib. Clinical Cancer Research, 21(24), 5640–5641. doi: 10.1158/1078-0432.CCR-15-2298.
4. Зелінська, Г. В., Кулиніченко, Г. М., & Устименко, Г. Я. (2016). Субклональна структура популяції тироцитів радіойодрефрактерних та радіойодчутливих метастазів папілярного раку щитоподібної залози. Український радіологічний журнал, 3, 15–18. [Zelinska, G. V., Kulynichenko, G. M., & Ustymenko, G. Ya. (2016). Subclonal structure of the population of thyrocytes in radioiodine-refractory and radioiodine-sensitive metastases of papillary thyroid carcinoma. Ukrainian Radiological Journal, 3, 15–18. Ukrainіan].
5. Ozkan, E., Aras, G., & Kucuk, N. O. (2013). Correlation 18F-FDG PET/CT findings with histopathological results in differentiated thyroid cancer patients who have increased thyroglobulin or antithyroglobulin antibody levels and negative 131I whole-body scan results. Clinical Nuclear Medicine, 38(5), 326–331. doi: 10.1097/RLU.0b013e318286827b.
6. Trybek, T., Kowalska, A., Lesiak, J., & Młynarczyk, J. (2014). The role of 18F-fluorodeoxyglucose positron emission tomography in patients with suspected recurrence or metastatic differentiated thyroid carcinoma with elevated serum thyroglobulin and negative I-131 whole body scan. Nuclear Medicine Review, 17(2), 87–93. doi: 10.5603/NMR.2014.0023.
7. Rosenbaum-Krumme, S. J., Görges, R., Bockisch, A., & Binse, I. (2012). 18FDG-PET/CT changes therapy in high-risk DTC after first radioiodine. European Journal of Nuclear Medicine and Molecular Imaging, 39(9), 1373–1380. doi: 10.1007/s00259-012-2065-4.
8. Avram, A. M. (2012). Radioiodine scintigraphy with SPECT/KT: an important diagnostic tool for thyroid cancer staging and risk stratification. Journal of Nuclear Medicine, 53, 754–764. doi: 10.2967/jnumed.111.104133.
9. Amin, A., Badwey, A., & El-Fatah, S. (2014). Differentiated thyroid carcinoma: an analysis of 249 patients undergoing therapy and aftercare at a single institution. Clinical Nuclear Medicine, 39(2), 142–146. doi: 10.1097/RLU.0000000000000324.
10. Eustatia-Rutten, C. F., Corssmit, E. P., Biermasz, N. R., Pereira, A. M., Romijn, J.A., & Smit, J. W. (2006). Survival and death causes in differentiated thyroid carcinoma. Journal of Clinical Endocrinology & Metabolism, 91(1), 313–319. doi: 10.1210/jc.2005-1322.
11. Durante, C., Haddy, N., Baudin, E., Leboulleux, S., Hartl, D., Travagli, J. P., … Schlumberger, M. (2006). Long-term outcome of 444 patients with distant metastases from papillary and follicular thyroid carcinoma: benefits and limits of radioiodine therapy. Journal of Clinical Endocrinology & Metabolism, 91(8), 2892–2899. doi: 10.1210/jc.2005-2838.
12. Schlumberger, M., Tahara, M., Wirth, L. J., Robinson, B., Brose, M. S., Elisei, R., … Sherman, S. I. (2015). Lenvatinib versus Placebo in Radioiodine-Refractory Thyroid. Cancer, 372(7), 621–630. doi: 10.1056/NEJMoa1406470.
13. Czepczyriski, R., Gryczyriska, M., & Ruchala, M. (2016). 99mTc-EDDA/HYNIC-TOC in the diagnosis of differentiated thyroid carcinoma refractory to radioiodine treatment. Nuclear Medicine Review, 19(2), 67–73. doi: 10.5603/NMR.2016.0015.
14. Bannas, P., Derlin, T., Growth, M., Apostolova, I., Adam, G., Mester, J., & Klutmann, S. (2012). Can (18)F-FDG PET/CT be generally recommended in patients with differentiated thyroid carcinoma and elevated thyroglobulin levels but negative 131I whole-body scan? Annals of Nuclear Medicine, 26(1), 77–85. doi: 10.1007/s12149-011-0545-4.
Адреса для листування:
Солодянникова Оксана Іванівна
03022, Київ, вул. Здановської Юлії, 33/43
Державне некомерційне підприємство «Національний інститут раку»
E-mail: oik2000@ukr.net
Correspondence:
Solodyannikova Oksana
33/43 Yulii Zdanovskoi str., Kyiv, 03022
Nonprofit Organization National Cancer Institute
E-mail: oik2000@ukr.net














Leave a comment