Особливості перебігу інвазивного раку грудної залози у хворих з метаболічним синдромом
Щепотін І.Б.1, Зотов О.С.2, Любота І.І.3, Любота Р.В.2
- 1Національний інститут раку, Київ
- 2Національний медичний університет ім. О.О. Богомольца, Київ
- 3Київський міський клінічний онкологічний центр, Київ
Резюме. Обстежено 100 хворих від 27 до 82 років (середній вік 56±12 років), які в 2008 р. знаходилися на лікуванні з приводу раку грудної залози в клініці онкології Національного медичного університету ім. О.О. Богомольця на базі хірургічного відділення Київської міської онкологічної лікарні. До основної групи увійшли 64 жінки, у яких виявлено рак грудної залози та метаболічний синдром , а до контрольної — 36 жінок, хворих на рак грудної залози без метаболічного синдрому. Встановлено, що наявність метаболічного синдрому у хворих на рак грудної залози асоціюється з наявністю прогностично несприятливих факторів перебігу останнього.
Обследовано 100 больных в возрасте от 27 до 82 лет (средний возраст 56±12 лет), которые в 2008 г. проходили лечение по поводу рака грудной железы в клинике кафедры онкологии Национального медицинского университета им. А.А. Богомольца на базе хирургического отделения Киевской городской онкологической больницы. В основную группу вошли 64 женщины, у которых выявлен рак грудной железы и метаболический синдром, а в контрольную — 36 женщин, больных раком грудной железы без метаболического синдрома. Установлено, что наличие метаболического синдрома у больных раком грудной железы ассоциируется с наличием прогностически неблагоприятных факторов течения последнего.

Введение
В 2005 г. Международная федерация диабета (IDF) назвала метаболический синдром (МС) одной из главных проблем современной медицины, которая приводит к повышению общей смертности населения. Распространенность МС в экономически развитых странах составляет 25–35% населения, а в возрастной категории старше 60 лет повышается до 42–43,5% [18].
МС (синдром Reaven, синдром резистентности к инсулину, метаболический синдром X) является сочетанием абдоминального ожирения, инсулинорезистентности, гипергликемии, дислипидемии, артериальной гипертензии, нарушения системы гемостаза и хронического субклинического воспаления (IDF, 2005) [18, 31].
МС и связанные с ним инсулинорезистентность и гиперинсулинемия ассоциируются с повышенным риском возникновения и/или худшим прогнозом течения злокачественных новообразований (колоректальный и почечноклеточный рак, рак желчного пузыря и эндометрия, грудной, поджелудочной и предстательной железы, неходжкинские лимфомы) [32]. Несмотря на то что молекулярные механизмы, влияющие на развитие рака у больных с МС, на данный момент недостаточно изучены, существует большое количество публикаций, которые раскрывают роль различных факторов МС, принимающих участие в канцерогенезе. К ним относятся инсулин (гиперинсулинемия), инсулиноподобный фактор роста (IGF)-I, лептин, фактор некроза опухоли-α, трансформирующий фактор роста β, ароматаза и другие.
Инсулин. После связывания инсулина с инсулиновым рецептором активируются два пути — метаболический, приводящий к инициации синтеза белков, гликогена, утилизации жиров, а также к торможению апоптоза, преимущественно через активацию инсулин-рецепторного субстрата (IRS); и митотический, способствующий пролиферации клеток. Митогенное действие инсулина реализуется через сложную цепь сигнальных событий: активация цАМФ-зависимой протеинкиназы → фосфорилирование и активирование фактора транскрипции в ядре → индукция экспрессии цАМФ-зависимых генов → стимуляция синтеза ДНК и белков → стимуляция пролиферации клеток [4].
Инсулиноподобные факторы роста (IGF) или соматомедины. IGF образуются в основном в печени, мышцах и жировой ткани под действием соматотропного гормона. Различают два вида IGF: IGF-I и IGF-II. Оба IGF участвуют в развитии плода; в постэмбриональный период основное значение в регуляции роста имеет IGF-I. Физиологическая роль IGF-II в развитии детей и во взрослом организме пока не выяснена. IGF-I осуществляет эндокринную, аутокринную и паракринную регуляцию процессов роста, развития и дифференцировки клеток и тканей организма. Уровень IGF-І в крови зависит не только от уровня соматотропного гормона, но и от глюкокортикоидов, инсулина, половых и тиреоидных гормонов. При этом инсулин, андрогены и эстрогены повышают секрецию IGF-І клетками печени, мышечной и жировой ткани, а глюкокортикоиды ее снижают. Это является одной из причин синергизма инсулина, соматотропина, половых и тиреоидных гормонов в отношении процессов роста и развития организма, роста и дифференцировки клеток, а также одной из причин характерного тормозящего действия глюкокортикоидов на вышеперечисленные процессы. Инсулин и IGF очень похожи по своей молекулярной структуре, поэтому возможно как прямое, так и перекрестное взаимодействие с рецепторами. Тем не менее инсулин и IGF-І обладают наиболее высоким сродством к собственным (специфическим) рецепторам, а перекрестное взаимодействие возможно только при очень высоких концентрациях. Так, аффинность инсулина к инсулиновым рецепторам в 100–1000 раз выше, чем к IGF-рецепторам, то есть с IGF-рецепторами инсулин может связываться, находясь в очень высокой концентрации. Аффинность IGF-І и IGF-ІІ к IGF-рецепторам в 100–1000 раз выше, чем для инсулиновых рецепторов, но IGF-І также может связываться с инсулиновыми рецепторами в высокой концентрации. Однако и метаболические, и митогенные эффекты максимально реализуются при связывании со своими специфическими рецепторами. При гиперинсулинемии снижается также синтез IGF-связывающего протеина гепатоцитами [16].
Лептин — гормон голода — это одноцепочечный полипептидный гормон, который секретируется в основном в жировой ткани, хотя небольшое его количество образуется также в мышцах и плаценте. Лептин действует на центры голода и насыщения в гипоталамусе, участвует в мозговой регуляции энергетического гомеостаза и контролирует массу тела путем снижения синтеза и высвобождения нейропептида Y, вызывающего чувство голода. При ожирении возникает компенсаторная резистентность гипоталамуса к центральному действию лептина, что в дальнейшем по механизму отрицательной обратной связи приводит к гиперлептинемии. Предполагают, что лептин является связующим звеном между адипоцитами и β-клетками поджелудочной железы и стимулирует секрецию инсулина при снижении чувствительности к нему. В исследованиях in vitro и in vivo было установлено, что лептин обладает свойствами фактора роста, а именно: стимулирует ангиогенез, пролиферацию гемопоэтических клеток и β-клеток поджелудочной железы, увеличивает уровень эстрогенов в тканях грудной железы. Кроме того, подавляя синтез нейропептида Y в гипоталамусе, лептин стимулирует секрецию гормона роста клетками гипофиза. Лептин также стимулирует ситез Е-кадгерина (E-cadherin) — внутриклеточной молекулы, ответственной за формирование клеточных конгломератов, которая под действием лептина и эстрадиола способствует опухолевой трансформации и стимулирует увеличение массы опухоли [1,5].
Ароматаза — изоформа цитохрома P450, синтезируется главным образом в яичниках, надпочечниках, жировой и мышечной ткани. Ароматаза — фермент, превращающий циркулирующие в крови андрогены в эстрогены. Известно, что экспрессия ароматазы в период менопаузы в ткани грудной железы неравномерна. Имеются данные о прямой корреляция между повышенной ферментативной активностью ароматазы в определенных участках грудной железы и, следовательно, локальным хроническим повышением уровня эстрогенов в этих участках с развитием в них опухоли [12].
В настоящее время появляется все больше доказательств о влиянии ряда метаболических нарушений на риск возникновения [6, 15, 22] и прогрессирования [19, 23, 26] рака грудной железы (РГЖ). К ним относятся: абдоминальное ожирение, гипергликемия, дислипидемия (высокий уровень триглицеридов или низкий уровень холестерина липопротеинов высокой плотности (ЛПВП)) и артериальная гипертензия. Перечисленные выше нарушения являются компонентами МС [7, 8], в основе патогенеза которого лежит инсулинорезистентность и вызванная последней гиперинсулинемия [3].
Цель исследования — оценить влияние метаболических нарушений на прогноз течения РГЖ у больных с МС.
Объект и методы исследования
В исследование включено 100 больных РГЖ в возрасте от 27 до 82 лет (средний возраст 56±12 лет), которые проходили лечение в клинике онкологии Национального медицинского университета им. А.А. Богомольца на базе хирургического отделения Киевской городской онкологической больницы в течение 4 мес (сентябрь – декабрь) 2008 г. Всем больным, наряду с исследованиями, регламентируемыми стандартами диагностики РГЖ, проводили исследования, направленные на выявление МС. Для диагностики МС применяли рабочие критерии комитета экспертов Национальной образовательной программы США по холестерину, посвященной выявлению, оценке и лечению высокого уровня холестерина крови у взрослых (Adult Treatment Panel III, ATP III), опубликованные в 2001 г. [14], которые в большей степени отвечают как клиническим нуждам, так и эпидемиологическим требованиям. Основные компоненты МС по критериям ATP III представлены в табл. 1. Из перечисленных ниже критериев определяли наличие абдоминального ожирения (окружность талии), уровень артериального давления и гликемию натощак, а также рост и массу тела больных. Диагноз МС устанавливали при наличии у пациентки всех 3 указанных признаков.
| Критерий | Показатель |
|---|---|
| Абдоминальное ожирение (окружность талии) | Мужчины >102 см |
| Женщины >88 см | |
| Триглицериды | ≥150 мг/дл (1,69 ммоль/л) |
| Холестерин ЛПВП | Мужчины |
| Женщины | |
| Артериальное давление | ≥130/≥85 мм рт.ст. |
| Глюкоза крови натощак | ≥110 мг/дл (6,1 ммоль/л) |
Всех больных разделили на 2 группы — основную и контрольную. В основную группу вошли 64 женщины, у которых выявлен РГЖ и МС, а в контрольную — 36 женщин, больных РГЖ без МС.
Для изучения послеоперационного материала была использована стандартная методика приготовления препаратов. Затем материал обрабатывали с применением моноклональных антител. Интерпретацию результатов иммуногистохимической реакции проводили с использованием качественной оценки ядерной реакции: отрицательная «–», слабоположительная «+», умеренно положительная «++», резко положительная «+++» — и количественной системы оценки реакций окрашенных опухолевых клеток (в %) .
При оценке экспрессии Her2/neu отмечали выраженность окрашивания цитоплазматической базальной мембраны: реакция «−», «+» — отсутствие гиперэкспрессии; реакция «+++» — гиперэкспрессия Her2/neu. Наличие гиперэкспрессии Her2/neu в случаях реакции «++» определяли с помощью метода гибридизации in situ при использовании флуоресцентной метки FISH (флуоресцентная in situ гибридизация). Морфологическое исследование выполнялось сотрудниками патогистологической лаборатории Киевской городской онкологической больницы (заведующая лабораторией — кандидат медицинских наук Л.М. Захарцева).
В качестве прогностически неблагоприятных при РГЖ нами были выбраны факторы, которые по степени клинической значимости отнесены Коллегией американских патологов (САР) к І категории (табл. 2): размер опухоли, статус регионарных лимфатических узлов (ЛУ), степень дифференцировки опухоли (G), наличие рецепторов к эстрогенам (ER) и прогестерону (РR), а также степень экспрессии Her2/neu опухолевыми клетками [28].
| Степень клинической значимости | Прогностические факторы |
|---|---|
| I категория | Размер опухоли, статус регионарных ЛУ, гистологическая форма и степень дифференцировки опухоли, количество митотических фигур, определение рецепторов к эстрогенам и прогестерону |
| II категория | Экспрессия EGF, p53-онкопротеина, маркера пролиферации Ki-67, наличие инвазии в лимфатические или кровеносные сосуды |
| III категория | Показатели плоидности опухоли, активность ангиогенеза, экспрессия pS2-протеина, bcl-2-онкопротеина, катепсина D, EFGF |
Для оценки результатов исследования применяли программу MS Excel. После проверки данных на нормальность распределения использовали однофакторный дисперсионный анализ (ANOVA), анализ четырехклеточных таблиц сопряженности и таблиц КхL. За нулевую гипотезу принимали отсутствие влияния МС на прогноз течения РГЖ. Нулевая гипотеза об отсутствии влияния МС на прогноз течения РГЖ отклонялась при уровне значимости (р)
Результаты
Распределение больных в зависимости от стадии РГЖ и объема оперативного вмешательства представлено в табл. 3 и 4 соответственно.
| Группы обследованных | Стадия заболевания | |||||
|---|---|---|---|---|---|---|
| І стадия(T1N0M0) | ІІА стадия(TisN1M0, T1N1M0, T2N0M0) | ІІБ стадия(T2N1M0, T3N0M0) | ІІІА стадия(TisN2M0, T1N2M0, T2N2M0, T3N1M0, T3N2M0) | ІІІБ стадия(T4N0M0, T4N1M0, T4N2M0) | ІV стадия(любое T и N + M1) | |
| Основная | 6* (9%) | 34* (53%) | 18 (28%) | 3 (5%) | 3 (5%) | 0 |
| Контрольная | 14* (39%) | 13* (36%) | 6 (17%) | 3 (8%) | 0 | 0 |
| Группы обследованныхОбъем оперативного вмешательства | Основная группа |
Контрольная группа |
|---|---|---|
| Органосохраняющая операция (ламп- или квадрантэктомия) | 18 (28%) | 14 (39%) |
| Радикальная мастэктомия по Маддену | 38 (59%) | 15 (42%) |
| Радикальная мастэктомия по Пейти ? Дайсону | 5 (8%) | 3 (8%) |
| Подкожная мастэктомия с одномоментным эндопротезированием | 3 (5%) | 4 (11%) |
| Всего | 64 (100%) | 36 (100%) |
В основной группе только у 9% больных выявлен РГЖ I стадии против 39% — в контрольной, а у 38% больных основной группы РГЖ был диагностирован во IIБ и более распространенной стадии против 25% больных РГЖ без МС. В контрольной группе выполнены органосохраняющие операции 39% больным, а в основной — 28%.
Результаты клинического обследования пациентов представлены в табл. 5.
| Группы обследованных | Клинические показатели | |||||
|---|---|---|---|---|---|---|
| Возраст | Гликемия натощак (ммоль/л) |
Рост (см) |
Масса тела (кг) | Окружность талии (см) | Артериальное давление(мм рт. ст.) | |
| Основная | 61±11 | 7,1±0,9 | 161±6 | 82±11 | 101±11 | 149±17/92±8 |
| Контрольная | 48±10 | 5,5±0,7 | 161±5 | 63±7 | 86±10 | 126±13/80±8 |
Распределение больных в зависимости от наличия неблагоприятных факторов течения РГЖ представлено в табл. 6.
| Факторы прогноза | Основная группа | Контрольная группа | Уровень значимости (Р) |
||
|---|---|---|---|---|---|
| n | % | n | % | ||
| Размер опухоли | |||||
| 16 | 25 | 18 | 50 | ||
| 2–5 см | 44 | 69 | 17 | 47 | |
| >5 см | 4 | 6 | 1 | 3 | |
| Степень дифференцировки опухоли | |||||
| G1 | 1 | 2 | 3 | 8 | >0,05 |
| G2 | 42 | 66 | 24 | 67 | |
| G3,G4 | 21 | 32 | 9 | 25 | |
| Статус регионарных ЛУ | |||||
| Метастазы в ЛУ отсутствуют | 22 | 34 | 23 | 64 | |
| Метастазы в 1–3 ЛУ | 21 | 33 | 11 | 31 | |
| Метастазы в 4 и более ЛУ | 21 | 33 | 2 | 5 | |
| Рецепторный статус опухоли | |||||
| ER+ | 39 | 72 | 28 | 78 | >0,05 |
| ER- | 15 | 28 | 8 | 22 | |
| PR+ | 32 | 59 | 23 | 64 | |
| PR- | 22 | 41 | 13 | 36 | |
| Экспрессия Her2/neu | |||||
| Гиперэкспрессия | 38 | 70 | 27 | 75 | >0,05 |
| Отсутствие гиперэкспрессии | 16 | 30 | 9 | 25 | |
У половины женщин без МС размер опухоли не превышал 2 см, при этом только у 1 пациентки из контрольной группы опухоль была >5 см. У больных с МС лишь в четверти случаев определялась опухоль категории Т1 по классификации TNM и у 4 пациенток опухоль была >5 см. Кроме того, в основной группе в 66% случаев отмечалось метастатическое поражение регионарных ЛУ против 36% случаев в контрольной группе.
При оценке влияния степени дифференцировки, рецепторного статуса опухоли и гиперэкспрессии Her2/neu достоверных различий между исследуемыми группами получено не было.
Молекулярный подтип существенно влияет на прогноз течения РГЖ. Наиболее прогностически благоприятным считается Luminal A молекулярный подтип РГЖ, наименее благоприятным — Triple negative. Распределение больных в зависимости от молекулярного подтипа РГЖ представлено в табл. 7.
| Группы обследованных | Молекулярный подтип РГЖ | Всего | |||
|---|---|---|---|---|---|
| Luminal A(ER+, PR+, Her2/neu-) | Luminal B(ER+, PR+, Her2/neu+) | Her2 type(ER-, PR-, Her2/neu+) | Triple negative(ER-, PR-, Her2/neu-) | ||
| Основная | 28* (52%) | 12 (21%) | 4 (8%) | 10* (19%) | 54 (100%) |
| Контрольная | 23* (64%) | 6 (17%) | 3 (8%) | 4* (11%) | 36 (100%) |
В основной группе Luminal A молекулярный подтип РГЖ выявляется на 12% реже, чем в контрольной группе, а Triple negative — на 8% чаще. При проведении статистической оценки полученных данных применяли однофакторный дисперсионный анализ. Различия между группами признаны достоверными при уровне значимости р
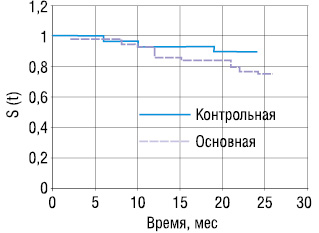
На рисунке представлены кривые 2-летней безрецидивной выживаемости больных основной и контрольной группы. В контрольной группе 2-летняя выживаемость без признаков рецидивирования РГЖ составляла 89,6%, в то время как у больных основной группы — 73%.
При наблюдении за больными в течении 2 лет установлено, что 20% пациентов с МС умерли от РГЖ, а все больные контрольной группы живы.
Обсуждение
Полученные в этой работе результаты позволяют рассматривать метаболические нарушения при МС как факторы, обусловливающие неблагоприятный прогноз течения РГЖ. Механизмы негативного влияния компонентов МС на течение РГЖ изучены недостаточно хорошо. Вероятно, определенную роль играет влияние инсулина на биодоступность половых гормонов и факторов роста [10, 17, 21], а также избыточного веса и инсулинорезистентности на биодоступность провоспалительных цитокинов [34]. Инсулин, в частности, имеет гонадотропный эффект [27]. Он стимулирует продукцию андрогенов яичниками, которые после ароматизации в периферических тканях являются основным источником эстрогенов у женщин в постменопаузе [9]. Инсулин также повышает активность ароматазы [24], стимулирует синтез рецепторов к гормону роста (GHR) [20, 33] и снижает синтез глобулина, связывающего половые гормоны (SHBG), а также белков, связывающих IGF-І и IGF-ІІ (IGFBP1 и IGFBP2) в печени, увеличивая тем самым биодоступность половых гормонов и IGF-I [11, 25, 29]. Все это приводит к пролиферации эпителия грудной железы [13]. При МС повышается уровень провоспалительных цитокинов и лептина, которые с помощью различных механизмов способны стимулировать клеточную пролиферацию [30].
Таким образом, наличие МС у больных РГЖ является фактором, определяющим неблагоприятный прогноз течения последнего. Дальнейшие исследования должны быть направлены на уточнение молекулярных механизмов, лежащих в основе отягощяющего влияния метаболических нарушений на течение РГЖ и определение связи между МС и 5-летней общей и безрецидивной выживаемостью больных РГЖ. При выявлении такой связи адекватная коррекция метаболических нарушений может улучшить прогноз течения РГЖ.
Выводы
Наличие МС у больных РГЖ ассоциируется с менее благоприятным прогнозом течения последнего.
В данном исследовании РГЖ І стадии в 30% случаев чаще определялся у больных без признаков МС.
У больных с МС достоверно чаще регистрируются опухоли >2 см в диаметре и с более выраженным метастатическим потенциалом по сравнению с больными без метаболических нарушений, связанных с МС.
Метаболические нарушения, вызванные МС, существенно не влияют на степень дифференцировки, рецепторный статус опухоли и экспрессию Her2/neu.
У больных с МС в 8% случаев чаще регистрируется Triple negative и в 12% реже Luminal A молекулярный подтип РГЖ.
Двухлетняя безрецидивная выживаемость у больных РГЖ и с МС Х в 17% случаев меньше, чем у больных без признаков последнего.
В контрольной группе общая 2-летняя выживаемость на 20% выше в сравнении с основной группой.
Адекватная коррекция МС может быть дополнительным направлением специального лечения, а также первичной и вторичной профилактики РГЖ.
Литература
- 1. Ковалева О.Н., Амбросова Т.Н., Ащеулова Т.В., и др. (2009) Адипокины: биологические, патофизиологические и метаболические эффекты. Внутрішня медицина. 3(15): 42–47.
- 2. Лапач С.Н., Чубенко А.В., Бабич П.Н. (2002 ) Статистика в науке и бизнесе. МОРИОН, К., 640 с.
- 3. Целуйко В.И., Чернышов В.А., Малая Л.Т. (2002) Метаболический синдром Х. Гриф, Харьков, 250 с.
- 4. Перцева М.Н. (1999) Вклад эволюционной эндокринологии в изучение структуры и механизмов действия инсулина. Ж. эвол. биохим. и физиол., 35: 175–186.
- 5. Щепотин И.Б., Зотов А.С., Любота Р.В. и др. (2009) Клинические и лабораторные показатели синдрома инсулинорезистентности как факторы прогноза течения рака молочной железы. Науковий вісник НМУ ім. О.О. Богомольця, 2: 168–173.
- 6. Agnoli C., Berrino F., Abagnato C.A. et al. (2010) Metabolic syndrome and postmenopausal breast cancer in the ORDET cohort: a nested case-control study. Nutr. Metab. Cardiovasc. Dis., 20(1): 41–48.
- 7. Alberti K.G., Eckel R.H., Grundy S.M. et al. (2009 ) Harmonizing the metabolic syndrome: a joint interim statement of the International Diabetes Federation Task Force on Epidemiology and Prevention; National Heart, Lung, and Blood Institute; American Heart Association; World Heart Federation; International Atherosclerosis Society; and International Association for the Study of Obesity. Circulation, 120(4): 1640–1645.
- 8. Alberti K.G., Zimmet P., Shaw J. (2005) The metabolic syndrome – a new worldwide definition. Lancet, 366(9491): 1059–1062.
- 9. Berrino F., Muti P., Micheli A. et al. (1996) Serum sex hormone levels after menopause and subsequent breast cancer. J. Natl. Cancer Inst., 88(5): 291–296.
- 10. Berrino F., Villarini A., De Petris M. et al. (2006) Adjuvant diet to improve hormonal and metabolic factors affecting breast cancer prognosis. Ann. NY Acad. Sci., 1089(3): 110–118.
- 11. Brismar K., Hilding A., Lindgren B. (1995) Regulation of IGFBP-1 in humans. Prog. Growth Factor Res., 6(2): 449–456.
- 12. Bulun S., Simpson E. (1994) Breast cancer and expression of aromatase in breast adipose tissue . Trends Endocrinol. Metab., 5: 113–120.
- 13. Campagnoli C., Pasanisi P., Peris C. et al. (2008) Breast Cancer: Prognosis, Treatment and Prevention. 2. Insulin-like Growth Factor-I and Breast Cancer: Epidemiological and Clinical Data.
- 14. Executive summary of the Third Report of the National Cholesterol Education Program (NCEP) (2001) Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III). JAMA, 285(19): 2486–2497.
- 15. Furberg A.S., Veierod M.B., Wilsgaard T. et al. (2004) Serum high-density lipoprotein cholesterol, metabolic profile, and breast cancer risk. J. Natl. Cancer Inst., 96(5): 1152–1160.
- 16. Giovannucci E., Harlan D.M., Archer M.C. et al. (2010) Diabetes and cancer: a consensus report. CA Cancer J. Clin., 60(4): 207–221.
- 17. Golden S.H., Ding J., Szklo M. et al. (2004) Glucose and insulin components of the metabolic syndrome are associated with hyperandrogenism in postmenopausal women: the atherosclerosis risk in communities study. Am. J. Epidemiol., 160: 540–548.
- 18. International Diabetes Federation Epidemiology Task Force Consensus Group. The IDF consensus world wide definition of the metabolic syndrome. International Diabetes Federation. Brussels: 2005 (Available at: www.idf.org/webdata/docs/IDF Metasyndrome definition. pdf).
- 19. Irwin M.L., McTiernan A., Bernstein L. et al. (2005) Relationship of obesity and physical activity with C-peptide, leptin, and insulin-like growth factors in breast cancer survivors. Cancer Epidemiol. Biomarkers Prev., 14(12): 2881–2888.
- 20. Hanaire-Broutin H., Sallerin-Caute B., Poncet M.F. et al. (1996) Insulin therapy and GH-IGF-I axis disorders in diabetes: impact of glycaemic control and hepatic insulinization. Diabetes Metab., 22: 245–250.
- 21. Kaaks R. (1996) Nutrition, hormones, and breast cancer: is insulin the missing link? Cancer Causes Control., 7: 605–625.
- 22. Lipscombe L.L., Goodwin P.J., Zinman B. et al. (2006) Diabetes mellitus and breast cancer: a retrospective population-based cohort study. Breast Cancer Res. Treat., 98(3): 349–356.
- 23. Lipscombe L.L., Goodwin P.J., Zinman B. et al. (2008) The impact of diabetes on survival following breast cancer. Breast Cancer Res. Treat., 109(2): 389–395.
- 24. McTernan P.G., Anwar A., Eggo M.C. et al. (2000) Gender differences in the regulation of P450 aromatase expression and activity in human adipose tissue. Int. J. Obes. Relat. Metab. Disord., 24: 875–881.
- 25. Norat T., Dossus L., Rinaldi S. et al. (2007) Diet, serum insulin-like growth factor-I and IGF-binding protein-3 in European women. Eur. J. Clin. Nutr., 61: 91–98.
- 26. Pasanisi P., Berrino F., De Petris M. et al. (2006) Metabolic syndrome as a prognostic factor for breast cancer recurrences. Int. J. Cancer., 119: 236–238.
- 27. Poretsky L., Cataldo N.A., Rosenwaks Z. et al. (1999) The insulin-related ovarian regulatory system in health and disease. Endocr. Rev., 20: 535–582.
- 28. Fitzgibbons M.D., Page D.L., Weaver D. et al. (2000) Prognostic Factors in Breast Cancer. Arch. Pathol. Lab. Med., 124: 966–978.
- 29. Sherif K., Kushner H., Falkner B.E. (1998) Sex hormone-binding globulin and insulin resistance in African-American women. Metabolism, 47: 70–74.
- 30. Sieminska L., Wojciechowska C., Foltyn W. et al. (2006) The relation of serum adiponectin and leptin levels to metabolic syndrome in women before and after the menopause. Endokryn. Pol., 57: 15–22.
- 31. Standl E. (2005) Aetiology and consequences of the metabolic syndrome. Europ. Heart J., 7(D): 10–13.
- 32. Vigneri P., Frasca F., Sciacca L. et al. (2009) Diabetes and cancer. Endocrine-Related Cancer, 16(4): 1103–1123.
- 33. Tollet P., Enberg B., Mode A. (1990) Growth hormone (GH) regulation of cytochrome P-450IIC12, insulin-like growth factor-I (IGF-I), and GH receptor messenger RNA expression in primary rat hepatocytes: a hormonal interplay with insulin, IGF-I, and thyroid hormone. Mol. Endocrinol., 4: 1934–1942.
- 34. Vona-Davis L., Howard-McNatt M., Rose D.P. (2007) Adiposity, type 2 diabetes and the metabolic syndrome in breast cancer. Obes Rev., 8: 395–408.














Leave a comment