Нарушение эндокринной функции тимуса при меланоме кожи: связь с изменением функционирования периферического звена иммунной системы (обзор литературы и результатов собственных исследований)
Резюме. В обзоре представлены данные, свидетельствующие о наличии связи нарушений функций центрального органа иммунной системы тимуса и ее периферического звена, а также зависимости их изменений от биологических свойств меланомы. Приводятся данные об эффективности терапии больных локализованной и метастатической формами меланомы биологически активными факторами тимуса и препаратами с индукторными свойствами по отношению к эндокринной функции тимуса. Обосновывается важность изучения у больных меланомой эндокринной функции тимуса с целью объективизации оценки функционального состояния иммунной системы и его изменений после основного лечения и использованных методов иммунотерапии.

Эпидемиология меланомы кожи. Меланома кожи ранее считалась относительно редким онкологическим заболеванием, однако в последнее время отмечен устойчивый и повсеместный рост заболеваемости этим видом рака [1, 20]. Показано, что заболеваемость населения планеты меланомой кожи удваивается каждые 10 лет; в Украине за последние 25 лет ежегодный прирост этого показателя составляет +5,4%. Меланома относится к одной из наиболее злокачественных опухолей человека и характеризуется инфильтративным ростом, ранним метастазированием в регионарные лимфатические узлы и отдаленные органы [3, 19]. Особенности клинического течения меланомы, отсутствие в ряде случаев положительных результатов от основных методов ее лечения — хирургического и комбинированного — определяют необходимость дальнейшего изучения патогенеза заболевания и разработки на этой основе подходов к повышению эффективности его терапии.
В настоящее время в схемах основного лечения больных меланомой все больше внимания уделяют использованию методов биотерапии, включающих и иммунотерапию, что объясняется ролью иммунных факторов в патогенезе этого заболевания [5, 8, 27].
Функциональное состояние иммунной системы при меланоме кожи. Возможность развития при меланоме активных специфических иммунных реакций подтверждают данные литературы о более высокой частоте спонтанной регрессии этой опухоли по сравнению с другими злокачественными новообразованиями, наличии опухолеассоциированных антигенов, а также результаты исследований у больных состояния иммунной системы [5]. В частности, в периферической крови больных меланомой удается выявить Т-лимфоциты, специфически сенсибилизированные к опухолевым антигенам, и цитотоксины, активные по отношению к этим антигенам. У больных отмечают развитие реакции гиперчувствительности замедленного типа (РГЗТ) в ответ на внутрикожное введение полисахаридной фракции антигена меланомы.
В то же время большинство авторов отмечают, что уже при локализованной форме меланомы развиваются изменения противоопухолевых иммунных реакций, которые усугубляются при распространении опухолевого процесса [30, 43]. Так, установлено, что у больных меланомой уменьшается общее количество лимфоцитов, их Т-популяции, СD4+– и СD8+ субпопуляций Т-лимфоцитов, увеличивается доля нулевых Т-клеток. При локализованной форме меланомы растет количество CD4+CD25+-клеток, в состав которых входят и регуляторные Т-лимфоциты, проявляющие иммуносупрессивные свойства. Изменения при меланоме функциональных свойств Т-лимфоцитов характеризуются ослаблением не только РГЗТ на введение 2,4-динитрохлорбензола, но и пролиферативного потенциала этих клеток на действие митогенов; у больных уменьшается количество и функциональная активность естественных клеток-киллеров (ЕКК) и макрофагов; в сыворотке крови увеличивается количество иммуноглобулина (Ig) класса G и циркулирующих иммунных комплексов (ЦИК), обладающих блокирующими свойствами. Уже на начальной стадии заболевания выявляются признаки активационной дисфункции иммунной системы: увеличивается доля лимфоцитов, экспрессирующих активационные антигены HLA-DR и CD25+, а с прогрессированием болезни повышается содержание СD69+– и СD95+-лимфоцитов.
Известно, что функционирование периферического звена иммунной системы находится под регулирующим влиянием ее центрального органа — тимуса (вилочковая железа) [2, 16–18, 45]. Как эндокринный орган тимус продуцирует целый спектр гормонов, к которым принадлежит тимический сывороточный фактор (ТСФ), или тимулин, тимозин-альфа1, тимопоэтин II [2, 37, 38]. Гормоны тимуса влияют на антигеннезависимый и антигензависимый этапы дифференцировки Т-лимфоцитов, созревание регуляторных субпопуляций Т-лимфоцитов в тимусе, функциональные свойства Т-лимфоцитов, активность макрофагов и т.д. (рис. 1) [16].
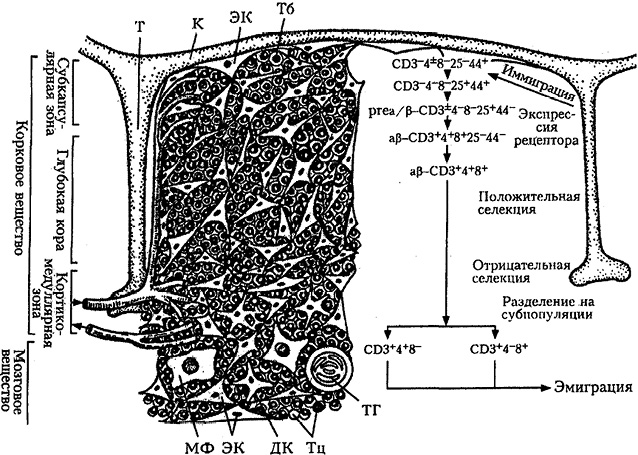
Среди гормонов тимуса особое внимание привлекает высокоактивный ТСФ, объединяющий в себе свойства всех тимических гормонов [37, 38]. Активная форма ТСФ связана с ионами Zn2+. У человека и животных ТСФ синтезируется исключительно в тимусе, в его эпителиальных клетках, и секретируется в кровь. Иммунобиологическая активность ТСФ проявляется во влиянии на все этапы дифференцировки Т-лимфоцитов (костный мозг, тимус, периферические лимфоидные органы), а также на их функции. Так, в костном мозгу субоптимальные дозы ТСФ влияют на экспрессию Thy-1 антигена, маркеров CD2, CD5 и CD7 на предшественниках Т-лимфоцитов, тем самым способствуя их переходу в более «зрелые» клетки. ТСФ выступает в качестве хемотаксического сигнала, который, наряду с другими факторами (хемокиновые рецепторы CXCR4 и CCR9, P-selectin и его лиганд PSGL-1), имеет значение для миграции предшественников Т-лимфоцитов из костного мозга в тимус. В самом тимусе ТСФ действует на экспрессию в тимоцитах Thy-1, CD3 антигенов, баланс регуляторных Т-субпопуляций, синтез цитокинов CD4+-тимоцитами, трансформацию кортизолчувствительных тимоцитов в кортизолрезистентные. На периферии ТСФ усиливает пролиферативный ответ Т-лимфоцитов на митогены, контролирует баланс Т-супрессоров и Т-хелперов, Т-хелперов 1-го и 2-го типа, а также продукцию Т-хелперами цитокинов и активность ЕКК.
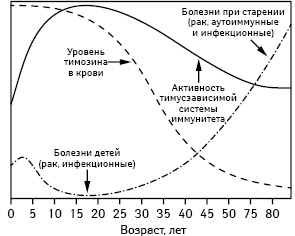
При ряде злокачественных новообразований (опухоли грудной железы, опорно-двигательного аппарата и т.д.) содержание в крови ТСФ уменьшается; в то же время подходы, направленные на восстановление или активацию эндокринной функции тимуса, улучшают клиническое течение опухолевого процесса [18]. Известно, что инволюция тимуса сопровождается снижением сывороточной тимической активности, что сопряжено с повышением частоты развития злокачественных новообразований (рис. 2) [18].
Поэтому нам представилось важным изучить особенности эндокринной функции тимуса у больных меланомой с учетом биологических свойств опухоли (размер первичного очага опухоли, уровень ее инвазии в дерму, наличие регионарных метастазов в лимфоузлах), а также выявить взаимосвязь изменений эндокринной функции тимуса и значений иммунологических показателей. Кроме того, при анализе характера изменений показателей мы учитывали пол больных. Как установлено, у мужчин, больных меланобластомой, изменения функциональных свойств Т-клеток развиваются раньше и выражены в большей степени, чем у женщин [29]. Показана более выраженная митотическая активность клеток меланомы у больных мужского пола [4], что указывает на большую злокачественность опухолевого роста и худший прогноз у них.
Нами обследованы 145 больных мужчин и женщин с меланомой кожи, имевших I клиническую стадию заболевания (только первичная опухоль), и 64 больных обоего пола со II клинической стадией (первичная опухоль + метастазы в регионарных лимфоузлах) в возрасте от 20 до 62 лет. Контрольную группу составили 106 практически здоровых людей того же возраста [11]. Диагноз меланомы и наличие метастазов подтверждены гистологически. У больных локализованной формой меланомы диагностировали I–V уровень инвазии опухоли в дерму, метастатической формой — III–IV уровень [28].
Эндокринную функцию тимуса исследовали по титру (log2) ТСФ [39]. Состояние клеточного и гуморального звеньев иммунной системы изучали с помощью общепринятых методик [9]. В периферической крови определяли количество Т- и В-лимфоцитов, Т-лимфоцитов с супрессорными и хелперными функциями, содержание Ig классов M, G, A и ЦИК; оценивали чувствительность Т-лимфоцитов периферической крови in vitro к тимостимулину (1 мг/мл) в реакции спонтанного розеткоообразования с эритроцитами барана; при постановке реакции торможения миграции лейкоцитов в качестве антигена применяли аутоплазму больных.
При оценке связи между исследованными показателями использовали коэффициент корреляционного отношения η, который характеризует не только ее силу, но и форму [26].
Эндокринная функция тимуса при меланоме. Установлено, что у больных уже с локализованной формой меланомы титр ТСФ существенно (р<0,05) уменьшается по отношению к здоровым людям; причем число больных со сниженным уровнем тимического гормона при меланоме Т2 больше, чем при Т1 (в 75% случаев против 54,5%) [10, 12]. При этом у больных мужского пола уменьшение титра ТСФ регистрируют чаще, чем у женщин (соответственно в 100 и 65% случаев, р<0,002).
Установлена зависимость снижения титра ТСФ от уровня инвазии меланомы в дерму [28]. Если при III уровне инвазии значения показателя снижаются в 1,7 раза по сравнению с нормой, то при IV — уже в 2,9 раза. Одновременно увеличивается количество больных с уровнем тимического гормона, меньшим нижней границы его колебаний у здоровых лиц (с III уровнем инвазии — 46,6% случаев, с IV — уже 83,3% случаев).
При появлении метастазов меланомы в регионарных лимфоузлах титр ТСФ снижается значительнее, чем при локализованной форме опухоли (свыше 4 раз, p<0,05) [25]. При этом значения показателя, которые ниже пределов его нормальных колебаний, встречаются практически у всех обследованных больных, что является более частым (р<0,05), чем у больных локализованной формой меланомы.
Таким образом, по нашим данным, при злокачественной меланоме кожи эндокринная функция тимуса угнетается. Степень нарушения функции железы находится в прямой зависимости от биологических свойств опухоли: размера ее первичного очага, глубины инвазии в дерму и наличия метастазов в регионарных лимфоузлах. Гипофункция тимуса более выражена у больных мужчин. Все это указывает на то, что снижение эндокринной функции тимуса — объективный критерий неблагоприятного прогноза течения этого заболевания.
Нарушение функции тимуса у больных меланомой может быть связано с развитием дистрофических изменений в его эпителиальном компоненте и обусловлено непосредственным влиянием на него продуктов нарушенного обмена и роста опухоли. Снижение уровня гормонов тимуса при меланоме может быть также сопряжено с активацией у больных глюкокортикоидной функции коры надпочечников, которая, по нашим данным, более выражена у больных мужского пола [23]. Хорошо известно, что глюкокортикоиды в высокой концентрации оказывают угнетающее влияние на структуру и эндокринную функцию тимуса, действуя через рецепторы в эпителиальном компоненте органа [18, 42, 50].
Связь нарушений функционирования тимуса и периферического звена иммунной системы при меланоме. Нами у больных меланомой установлена согласованность характера и степени выраженности нарушений эндокринной функции тимуса, с одной стороны, и дисфункции периферического звена иммунной системы, с другой. Так, подобная сопряженность исследованных показателей выявлена при локализованной форме меланомы с разным уровнем ее инвазии в дерму [28]. Показано, что снижение содержания Т-лимфоцитов в периферической крови больных с IV–V уровнем инвазии меланомы в дерму значительнее, чем с III уровнем (p<0,05) При этом отмечено, что относительное количество Т-лимфоцитов у больных (III–IV уровень инвазии) повышается после инкубации in vitro с тимостимулином (р<0,05). Эти результаты свидетельствуют о том, что в периферической крови таких больных циркулируют незрелые (нерозеткообразующие) формы лимфоцитов, которые обладают повышенной чувствительностью к дифференцировочным факторам тимуса.
Нарушение соотношения количества Т-субпопуляций лимфоцитов с хелперными и супрессорными свойствами у больных меланомой с III и IV уровнем инвазии характеризуется накоплением последних (значения иммунорегуляторного индекса составляют 2,1:1,0 и 2,7:1,0 при норме 3,5:1,0). Как известно, чрезмерная активация Т-супрессоров в условиях опухолевого роста может иметь важное значение в патогенезе опухолевого прогрессирования, в том числе и при меланоме [7, 48]. Учитывая важную роль гормонов тимуса в дифференцировке Т-хелперов и Т-супрессоров, а также контроле их количественного соотношения и функциональной активности, можно полагать, что снижение уровня ТСФ при меланоме — важное условие изменения у больных как баланса этих субпопуляций Т-лимфоцитов, так и их функций. Нами также в эксперименте установлено, что в норме в условиях активации эндокринной функции тимуса количество CD4+25+-клеток в тимусе уменьшается [22].
Содержание ЦИК в сыворотке крови больных меланомой при IV уровне инвазии опухоли в дерму выше, чем при III (по сравнению с нормой соответственно в 1,7 и 1,3 раза) [28]. Известно активирующее влияние гормонов тимуса на количество и функциональное состояние макрофагов, в частности, в печени, роль которой в удалении иммунных комплексов из циркуляции существенна [18, 47]. Поэтому недостаток тимических гормонов при меланоме способствует накоплению в крови больных повышенной концентрации комплексов «антиген-антитело», длительная циркуляция которых способствует развитию в организме иммунодепресcии.
При этом у больных меланомой в условиях накопления в крови иммунных комплексов повышается частота проявления эффекта усиленной миграции лейкоцитов [6, 13]. Если торможение миграции лейкоцитов свидетельствует о сохранении способности сенсибилизированных Т-лимфоцитов вырабатывать фактор, ингибирующий миграцию (ФИМ), то ее усиление — о наличии в плазме крови факторов, блокирующих формирование клеточно-опосредованных иммунных реакций. По нашим данным, у 40% больных с III уровнем инвазии меланомы в дерму и у 47% больных с IV уровнем индекс миграции лейкоцитов (ИМЛ) был выше 110%. Важно отметить, что снижение титра ТСФ более выражено именно у больных меланомой с усиленной миграцией лейкоцитов. Поскольку тимические гормоны модулируют выработку ФИМ сенсибилизированными Т-лимфоцитами, можно сделать заключение о значении снижения функции тимуса для угнетения выработки этого медиатора лимфоцитами больных меланомой и накоплении в крови блокирующих факторов.
Итак, установленная нами при локализованной форме меланомы зависимость выраженности нарушений функций иммунной системы от уровня инвазии опухоли в дерму может быть обусловлена степенью снижения у больных уровня тимического гормона.
При появлении метастазов меланомы в регионарных лимфатических узлах дисфункция периферического звена иммунной системы, как и тимуса, еще более усугубляется [25]. Так, в периферической крови больных метастатической формой меланомы по сравнению с локализованной формой более выражено накапливаются «О»-клетки и снижается число Т-лимфоцитов, которые в тесте in vitro проявляют повышенную чувствительность к тимическим дифференцировочным факторам. Содержание иммунных комплексов в крови больных меланомой с метастазами становится выше, чем у больных без метастазов. Причем при метастатической форме меланомы увеличивается число больных, у которых в условиях накопления иммунных комплексов проявляется эффект усиления миграции лейкоцитов (67% больных против 46% при локализованной форме, р<0,05). В крови больных меланомой с метастазами растет уровень IgА и IgG (р<0,05). Показано, что, наряду с ЦИК, Ig не только класса G, но и А могут обладать свойствами, блокирующими клеточно-опосредованные иммунные реакции [9]. В то же время при локализованной форме меланомы ЦИК связаны в основном с IgM, который входит в состав комплексов «антиген-антитело», повышенное образование которых при иммунном ответе важно для регуляции динамики выработки IgА и IgG.
При анализе степени изменений значений некоторых иммунологических показателей у больных меланомой с разным размером опухоли установлены различия в зависимости от пола больных. Так, степень снижения общего количества лимфоцитов, Т- и В- популяций лимфоцитов при меланоме Т2 по сравнению с меланомой Т1 значительнее у больных мужчин, чем у женщин. Концентрация IgМ оказывается существенно повышенной по сравнению с нормой только у больных женщин (р<0,05). Не исключено, что у больных мужчин более выраженный недостаток тимических гормонов, наряду с уменьшением количества Т- и В-лимфоцитов, обусловливает аномальную кооперацию этих популяций лимфоцитов в процессе синтеза IgМ плазматическими клетками.
Таким образом, результаты проведенных нами исследований позволяют считать, что количественные и функциональные нарушения периферического звена иммунной системы как при локализованной, так и метастатической форме меланомы, в значительной степени связаны с гормональной дисфункцией тимуса. Доказательством связи между нарушением функционирования центрального (тимус) и периферических органов иммунной системы при меланоме может быть наличие корреляции между значениями исследованных показателей (таблица) [13].
Таблица Значения коэффициента корреляционного отношения (η), характеризующие степень связи показателей иммунной системы у больных меланомой в разных клинических стадиях
| Стадия | Тимус | Степень зависимости значений иммунологических показателей от уровня тимического гормона | |||
|---|---|---|---|---|---|
| Число Т-клеток | Число Т-хелперов | Значения ИМЛ | Уровень ЦИК | ||
| I | ТСФ | +0,46±0,17* | +0,48±0,15* | –0,45±0,16** | –0,52±0,15** |
| II | ТСФ | +0,75±0,15* | +0,50±0,15* | –0,56±0,20* | –0,51±0,23* |
Достоверность связи титра ТСФ и иммунологических показателей: *p<0,05, **p<0,01; (+/–) — направление связи показателей
Использование методов биотерапии в планах основного лечения больных меланомой
Влияние основного лечения на состояние иммунной системы больных меланомой. Из данных литературы известно, что у больных меланомой после оперативного удаления опухоли происходит дальнейшее уменьшение в периферической крови абсолютного содержания лимфоцитов и их Т-популяции, снижение частоты положительных результатов в реакции торможения миграции лейкоцитов на опухолевый антиген, ослабление реакции бласттрансформации лимфоцитов под действием фитогемагглютинина, нарушение способности лимфоцитов формировать РГЗТ в ответ на введение полисахаридного антигенного комплекса из ткани меланомы [19, 21]. Включение в схему лечения больных меланомой химиотерапевтических препаратов также в большинстве случаев сопровождается снижением в периферической крови абсолютного содержания Т-лимфоцитов, уменьшением цитотоксического эффекта лимфоцитов на клетки опухоли [36].
Как установлено нами, изменения ряда иммунологических показателей после хирургического и комбинированного методов (операция + полихимиотерапия — ПХТ) лечения связаны с дальнейшим истощением эндокринной функции тимуса у таких больных [14]. Так, у больных меланомой на фоне значительного падения титра ТСФ после оперативного, и особенно комбинированного, методов лечения существенно повышается частота регистрации сниженных уровней Т-лимфоцитов (р<0,05). При этом между снижением в крови титра ТСФ и уменьшением количества Т-клеток существует значительная прямая связь (η = 0,57±0,27; р<0,05). У пациентов после лечения отмечают дальнейшее повышение уровня в крови ЦИК и значений ИМЛ. Кроме того, по нашим данным, после применения ПХТ в крови больных растет концентрация кортизола, что может быть одним из патогенетических причин усугубления дисфункции тимуса и Т-клеточного звена иммунной системы при меланоме [24].
Подходы к иммунотерапии при меланоме. По современным представлениям иммунотерапия, которую применяют при новообразованиях, делится на неспецифическую, оказывающую влияние на иммунную систему организма в целом, и специфическую, индуцирующую развитие противоопухолевых реакций иммунной системой [7, 8, 34]. Различают также активную и пассивную иммунотерапию. При меланобластоме наиболее полно изучена эффективность влияния на иммунную систему методов активной специфической и неспецифической иммунотерапии.
Так, из методов активной специфической иммунотерапии у больных локализованной формой меланомы исследователи использовали вакцинотерапию на основе опухолевых клеток и опухолеассоциированных антигенов [46]. Авторами отмечено улучшение показателей Т-клеточного звена иммунной системы; подобные изменения коррелировали с клиническим течением заболевания. Повышения эффективности противоопухолевой терапии при меланоме можно достигнуть при использовании вакцинотерапии в сочетании с мощным адъювантом — дендритными клетками [32, 33, 49, 51].
Из методов активной неспецифической иммунотерапии при меланоме использовали различные модификаторы биологических реакций (цитокины, вакцину БЦЖ (BCG — Bacillus Calmette —Guérin), левамизол, экстракт селезенки крупного рогатого скота, биологически активные факторы тимуса и т.д.). Так, показана эффективность применения БЦЖ у больных локализованной формой меланомы для профилактики развития рецидивов и метастазов [5, 36]. У пациентов с первично-локализованной меланомой кожи конечностей и туловища (I–II стадия заболевания) с целью профилактики развития метастазов авторы использовали курсовое введение (в течение 1 года) рекомбинантных интерферона α-2b и интерлейкина (ИЛ)-2 в схемах основного лечения больных [20, 31]. Установлено повышение 3-летней выживаемости больных, особенно на фоне комбинированного применения интерферона и ИЛ-2, что сочеталось с положительными изменениями показателей, характеризующих состояние иммунной системы.
В литературе есть данные, которые свидетельствуют об эффективности применения при меланоме биологически активных факторов тимуса. Как отмечают исследователи, основное преимущество иммунотерапии факторами тимуса заключается в их способности к коррекции нарушенной при канцерогенезе дифференцировки лимфоидных клеток, индукции их созревания, регуляции активности функционирующих лимфоцитов, включении в зависимости от исходного состояния иммунной системы хелперной, цитотоксической и супрессорной функций лимфоцитов [18, 44, 45, 47].
У больных с неметастатической формой меланомы с низким содержанием в крови Т-лимфоцитов применяли основное лечение (операция или химиотерапия) или самостоятельно тимостимулин [40]. Отмечено, что у всех больных после приема тимостимулина количество общих и активных Е-розеткообразующих Т-лимфоцитов увеличилось до нормальных значений. Такие изменения показателей сочетались с отсутствием у больных метастазов в течение 34 мес, в то время как у 87% больных после химиотерапии DTIC и у 81% после операции они появились.
G. Trevisan и соавторы у больных меланомой кожи без метастазов и с проявлениями иммунодефицита после операции применяли тимопентин [52]. Иммунологические исследования проводили каждые 3 мес в течение 29 мес. Авторы наблюдали повышение на 40% содержания в периферической крови СD3+-, СD4+-лимфоцитов и ЕКК. Только у 3 из 33 пациентов в конце строка наблюдения регистрировали появление регионарных метастазов.
Исследованиями B. Bodey и соавторов показано снижение гематопоэтической токсичности химиопрепаратов в случае их сочетания с факторами тимуса по сравнению с применением только одной ПХТ [41].
При одновременном использовании Т-активина и химиопрепаратов у пациентов с метастатической формой меланомы авторы отмечали снижение частоты лейкопений, тромбоцитопений, а также проявлений аллергических реакций [35].
После приема тимозина альфа 1 пациентами с метастазирующей формой меланомы на фоне комбинации DTIC с интерфероном и ИЛ-2 растет уровень Т-клеток, активность ЕКК, что сочетается с повышением выживаемости больных [44]. По мнению авторов, одним из путей положительного влияния тимозина альфа 1 на иммунную систему при новообразованиях является увеличение количества рецепторов к цитокинам на Т-клетках, а также усиление продукции цитокинов. В то же время есть данные, свидетельствующие о том, что у больных с метастатической формой меланомы с низким уровнем Т-лимфоцитов применение тимостимулина на фоне DTIC не повлияло на их уровень, а уровень выживаемости больных не отличался от значений показателя после самостоятельного приема DTIC [40].
По нашим данным, применение препарата с индукторными свойствами в отношении эндокринной функции тимуса (биологический препарат селезенки крупного рогатого скота) в схемах основного лечения больных с локализованной формой меланомы приводит к улучшению состояния иммунной системы [14]. Если после хирургического и комбинированного (операция и ПХТ) методов лечения титр ТСФ существенно (p<0,05) снижался по сравнению с исходными значениями (с 1,38±0,17 до 0,36±0,1 и 0,67±0,3 5 соответственно), то после включения экстракта селезенки крупного рогатого скота в план хирургического и комбинированного методов лечения больных его значения существенно увеличились (соответственно до 5,06±0,8 и 4,0±0,61; p<0,05). При этом уровень ТСФ не отличался от такового у практически здоровых людей (p>0,05). Применение экстракта селезенки крупного рогатого скота в схемах основного лечения больных приводит к значительному повышению абсолютного содержания Т-лимфоцитов, а частота выявления сниженных уровней Т-клеток существенно снижается по сравнению с частотой у больных, не получавших этот препарат (соответственно 23% и 85%; p<0,05). Под влиянием экстракта селезенки повышенный после основного лечения уровень иммунных комплексов снижается до значений, регистрируемых у здоровых людей (p>0,05). Также уменьшается количество больных с усиленной миграцией лейкоцитов.
Итак, можно заключить, что положительные изменения клеточных и гуморальных иммунных реакций у больных меланомой, получавших экстракт селезенки, в значительной степени связаны с повышением у них уровня тимического гормона. Экстракт селезенки крупного рогатого скота оказывает иммуномодулирующее влияние только при наличии отклонений в иммунном статусе. Известно, что биологически активные вещества селезенки могут индуцировать появление Т-клеточных маркеров на лимфоцитах. Иммуномодулирующей активностью также обладает его аналог — комплекс природных небелковых низкомолекулярных органических соединений негормонального происхождения, полученных из животной эмбриональной ткани.
Представляют также интерес полученные нами экспериментальные данные об изучении механизма антиметастатического влияния факторов тимуса при меланоме [15]. Установлено, что у мышей с меланомой В16, получавших факторы тимуса (экстракт вилочковой железы крупного рогатого скота), повышается уровень ТСФ и усиливается способность организма к выработке интерферона. Последний факт имеет значение для усиления цитотоксической активности макрофагов и ЕКК.
Заключение
Таким образом, приведенные данные свидетельствуют о важности исследования эндокринной функции тимуса при локализованной и метастатической форме меланомы, что даст возможность объективизировать оценку у больных исходного состояния иммунной системы и его изменений в процессе основного лечения. Изучение функции тимуса также является необходимым условием не только при проведении иммунотерапии факторами тимуса (экстракт вилочковой железы крупного рогатого скота), но и использовании подходов активной неспецифической и специфической иммунотерапии. Это связано с тем, что результативность их влияния на клеточное и гуморальное звено иммунной системы при меланоме зависит от его исходного состояния, которое, в свою очередь, в значительной степени определяется состоянием эндокринной и цитокринной функции тимуса [37]. Следует отметить, что без анализа эндокринной функции тимуса трудно рассчитывать на получение объективных выводов о функциональном состоянии периферического звена иммунной системы и при других формах злокачественных новообразований.
Список использованной литературы
1. Анисимов В.Н., Барчук А.С., Вагнер Р.И. (2004) Базалиома, рак кожи и меланома кожи у лиц пожилого возраста. В кн.: Рак у пожилых. Под ред.: проф. В.Н. Анисимова, проф. В.М. Моисеенко, акад. РАМН К.П. Хансона. Издательство Н-Л, СПб.: 168–179.
2. Арион В.Я., Зимина И.В., Москвина С.Н. (2008) Иммунобиологические свойства и клиническое применение тимозинов и других препаратов тимуса. В кн.: Иммунопатол. аллергол. и инфектол., 1: 26–40.
3. Балицкий К.П. (1985) Патогенетические аспекты метастазирования. Эксперим. онкология, 6: 16–20.
4. Ганина К.П., Налескина Л.А., Полищук Л.З. и др. (1978) Морфология, гистохимия и цитогенетика пигментных новообразований человека. К.: Наукова думка, 185 с.
5. Городилова В.В., Боева М.Н. (1983) Иммунобиология опухолевого роста. Медицина, Москва, 240 с.
6. Гриневич Ю.А. (1988) Взаимосвязи нарушений в эндокринной и иммунной системах больных злокачественной меланомой. Эксперим. онкология, 10(3): 51–54.
7. Гриневич Ю.А. (2001) Основные принципы использования иммунотерапии при лечении больных со злокачественными новообразованиями. Онкология, 3(2–3): 216–219.
8. Гриневич Ю.А. (2008) Современные подходы к иммунотерапии в онкологии. В кн.: Специфічна імунотерапія в онкології. За ред.: Ю.Я. Гріневича. Здоров’я, Київ, 13–20.
9. Гриневич Ю.А., Каменец Л.Я. (1986) Основы клинической иммунологии опухолей. Здоров’я, Київ, 160 с.
10. Гриневич Ю.А., Лабунец И.Ф. (1983) Эндокринная функция вилочковой железы у больных меланобластомой кожи. Врачебное дело, 5: 87–89.
11. Гриневич Ю.А., Лабунец И.Ф. (1985) Возрастные особенности функционального состояния вилочковой железы, эпифиза и коры надпочечников у практически здоровых людей. Физиол. журнал, 31(3): 356–359.
12. Гриневич Ю.А., Лабунец И.Ф. (1987) Гормональная функция вилочковой железы при злокачественной меланоме кожи: взаимосвязь с нарушениями иммунной системы. Вопр. онкологии, 33(6): 46–52.
13. Гриневич Ю.А., Лабунец И.Ф. (1990) Возрастные особенности эндокринной и иммунной систем организма при меланоме. Физиология человека, 16(5): 103–110.
14. Гриневич Ю.А., Лабунец И.Ф., Василюк А.Н. (1987) Модулирующее влияние спленина на иммунную систему больных меланомой кожи. В кн.: Клиническая онкология. Республ. межвед. сб. Здоров’я, Киев, 7: 67–75.
15. Гриневич Ю.А., Бендюг Г.Д., Каменец Л.Я. и др. (1992) Влияние биологически активных факторов тимуса на рост и метастазирование меланомы В16 у мышей линии С57Bl/6. Эксперим. онкология, 14(4): 53–56.
16. Гриневич Ю.А., Демина Э.А. (2006) Иммунные и цитогенетические эффекты плотно- и редкоионизирующих излучений. Здоров’я, Киев, 200 с.
17. Дранник Г.Н., Гриневич Ю.А., Дизик Г.М. (1994) Иммунотропные препараты. Здоров’я, Киев, 288 с.
18. Иммунобиология гормонов тимуса (1989). Под ред.: Ю. А. Гриневича, В. Ф. Чеботарева. Здоров’я, Киев, 152 с.
19. Кныш И.Т., Гриневич Ю.А., Дзюбко Н.Я. и др. (1984) Влияние применяемых лечебных факторов на иммунокомпетентность организма при злокачественных новообразованиях костной системы и мягких тканей. В кн.: Опухоли опорно-двигательного аппарата. Сб. научн. трудов. Москва, 9: 136–139.
20. Коровин С.И., Гулак Л.О., Федоренко З.П. и др. (2010) Проблема меланомы кожи в Украине. Онкология, 12(1): 46–52.
21. Коростелева Т.А., Рыжков В.Л., Вересова О.В. и др. (1982) Показатели клеточного и гуморального иммунитета у больных меланобластомой. Вопр. онкологии, 28(9): 19–23.
22. Лабунець І.Ф. (2012) Роль епіфіза в регуляції біоритмів функцій імунної системи при старінні. Автореф. дис. … д-ра мед. наук. Київ, 39 с.
23. Лабунец И.Ф., Гриневич Ю.А., Кныш И.Т. и др. (1984) Особенности функций некоторых эндокринных желез у больных меланомой кожи. Вопр. онкологии, 30(2): 14–19.
24. Лабунец И.Ф., Никольський И.С., Кононенко Н.Г. (1984) Изменение функционального состояния вилочковой железы и коры надпочечников у онкологических больных под влиянием химиотерапии. В кн.: Современные возможности клинической химиотерапии злокачественных новообразований. Материалы IV Всесоюз. конф. Вильнюс, 226–228.
25. Лабунец И.Ф., Гриневич Ю.А., Толстопятов Б.А. (1989) Нарушения функций иммунной системы и их коррекция при меланомах с регионарными метастазами. Вопр. онкологии, 35(4): 416–423.
26. Лакин Г. Ф. (1990) Биометрия. Высшая школа, Москва, 343 с.
27. Муцениеце А.Я., Волрат А.А., Попена Б.А. и др. (1983) Изучение иммунологической реактивности у больных меланомой кожи. Вопр. онкологии, 29(4): 34–38.
28. Налескина Л.А., Ганина К.П., Лабунец И.Ф. (1996) Сопоставление морфо-функциональных особенностей лимфоцитов периферической крови и иммунного статуса у больных злокачественной меланомой кожи. Цитология и генетика, 30(5): 16–22.
29. Соколова И.И., Бергут Ф.А., Репина Ф.Б. (1980) Лимфоциты и фибринолиз у мужчин и женщин, больных меланомой кожи. Вестн. дерматологии и венерологии, 7: 15–19.
30. Фільчаков Ф.В., Кукушкіна С.М., Шуміліна К.С. та ін. (2011) Особливості імунного статусу у хворих на меланому шкіри на різних стадіях пухлинного процесу. Клиническая онкология, 2(2): 36–40.
31. Фільчаков Ф.В., Шуміліна К.С., Кукушкіна С.М. та ін. (2012) Особливості імунореактивності організму хворих на меланому шкіри з метастазами в регіонарні лімфовузли в умовах дії різних схем інтерферонотерапії. Клиническая онкология, 4(4): 102–106.
32. Храновська Н.М. (2010) Стратегія створення та результати терапевтичного застосування протипухлинних аутовакцин нового покоління на основі дендритних клітин. Онкология, 12(1): 134–139.
33. Храновская Н.Н., Гриневич Ю.А. (2008) Антигенпредставляющие дендритные клетки миелоидного происхождения: фенотип, функции, противоопухолевая активность, использование в специфической иммунотерапии больных со злокачественными новообразованиями. В кн..: Специфічна імунотерапія в онкології. За ред.: Ю.Я. Гріневича. Здоров’я, Київ: 81–144.
34. Чоп’як В.В. (2008) Про стан надання імуноонкологічної допомоги в Україні. В кн..: Специфічна імунотерапія в онкології. За ред.: Ю.Я. Гріневича. Здоров’я, Київ: 5–12.
35. Яворский В.В., Токарева З.И., Арион В.Я. (1984) О применении Т-активина у больных меланомой кожи. В кн.: Опухоли опорно-двигательного аппарата. Сб. научн. трудов. Вып. 9, Москва: 177–179.
36. Яворский В.В., Токарева З.И., Мусатов В.К. и др. (1984) Основные вопросы иммунотерапии меланомы кожи. В кн.: Опухоли опорно-двигательного аппарата. Сб. научн. трудов. Вып. 9, Москва: 130–135.
37. Ярилин А.А., Пинчук В.Г., Гриневич Ю.А. (1991) Структура тимуса и дифференцировка Т-лимфоцитов. Наук. думка, Киев, 248 с.
38. Ярилин А.А., Беляков И.М. (1996) Тимус как орган эдокринной секреции. Иммунология, 1: 4–10.
39. Bach J.F., Dardenne M., Bach M.A. (1973) Demonstration of a circulation thymic hormone in mouse and in man. Transplant. proc. 1(1): 99–104.
40. Bernengo M.G., Fra P., Lisa F. et al. (1983) Thymostimulin therapy in melanoma patients: correlation of immunologic effect with clinical course. Clin. Immunol. Immunopathol., 28(3): 311–324.
41. Bodey B. (2001) Thymic hormones in cancer diagnostics and treatment. Expert. Opin. Biol. Th., 1(1): 93–107.
42. Bodey B. (2007) Thymic reticulo-epithelial cells: key cells of neuroendocrine regulation. Expert. Opin. Biol. Th., 7(7): 477–484.
43. Cesana G.C., DeRaffela G., Cohen S. et al. (2006) Characterization of CD4+CD25+ regulatory T cells in patients treated with high-dose interleukin-2 for metastatic melanoma or renal cell carcinoma. J. Clin. Oncol., 24 (7): 1169–1177.
44. Goldstein A.L. (1998) Advances in our understanding of the chemistry, biology and clinical applications of the thymosins with special emphasis on hepatitis, cancer and wound healing. Int. J. Immunorehabilit., 9: 34.
45. Goya R.G., Bolognani F. (1999) Homeostasis, thymic hormones and aging. Gerontology, 45(3): 174–178.
46. Hollinshead A., Arlen M., Yonemoto R. et al. (1982) Pilot studies usin melanoma tumor-associated antigens (TAA) in specific-active immunotherapy of malignant melanoma. Cancer, 49(7): 1387–1404.
47. Lunin S.M., Novoselova E.G. (2010) Thymus hormones as a prospective anti-inflamatory agents. Expert. Opin. Ther. Targets, 14(8): 775–786.
48. Minassian A.A., Kadagidze Z.G. (1983) Suppressor cells in melanoma and lung cancer-correlation with clinical stage. Neoplasma, 30(2): 153–158.
49. Rosenberg S.A., Yang J.C., Restifo N.P. (2004) Cancer immunotherapy: moving beyond current vaccines. Nature Medicine, 10(9): 909–915.
50. Savino W., Dardenne M. (2000) Neuroendocrine control of thymus physiology. Endocr. Rev., 21(4): 412–443.
51. Terando A.M., Faries M.B., Morton D.L. (2007) Vaccine therapy for melanoma: current status and future directions. Vaccine, 25S: 4–16.
52. Trevisan G., Agolzer A. (1989) Thymopentin in the treatment of cutaneous melanoma. J. Ital. Dermatol. Venereol., 124 (5): 245–249.
Порушення ендокринної функції тимуса при меланомі шкіри: зв’язок зі змінами функціонування периферичної ланки імунної системи (огляд літератури та результатів власних досліджень)
Резюме. В огляді наведено дані щодо наявності зв’язку порушень функцій центрального органа імунної системи тимуса та її периферичної ланки, а також залежності їх змін від біологічних властивостей меланоми. Наводяться дані щодо ефективності терапії хворих із локалізованою та метастатичною формами меланоми біологічно активними факторами тимуса та препаратами з індукторними властивостями відносно ендокринної функції тимуса. Обґрунтовується важливість вивчення у хворих на меланому ендокринної функції тимуса з метою об’єктивізації оцінки функціонального стану імунної системи та його змін після основного лікування та застосованих методів імунотерапії.
Ключевые слова: гормони тимуса, імунна система, меланома шкіри, біотерапія.
Thymus endocrine function disturbances in skin melanoma: association with change of functioning of the immune system peripheral link (review of published and authors’ own research data)
Summary. This review presents data evidencing for the association of disturbances of the functions of the key organ of the immune system, thymus, and its peripheral link, as well as the dependence of their change upon melanoma biological properties. It was shown the results of treatment melanoma patients of thymic biological factors and preparations with activated influence endocrine function of thymus. Substantiation has been given for the significance of study of thymus endocrine function in patients with melanoma for objective evaluation of the immune system functioning and its changes after main treatment with the use of immune therapy methods.
Key words: thymic hormones, immune system, skin melanoma, biotherapy.














Leave a comment