Шийна лімфодисекція з виявленням сторожового лімфатичного вузла у хворих на рак порожнини рота та ротоглотки
Процык В.С.1, Кравец О.В.2, Трембач А.М.1, Коробко Е.В.1, Руденко Д.Н. 1, Петренко Л.И.1, Чичула Р.Е.2
Резюме. У статті представлено клінічний досвід інтраопераційної індикації сторожового лімфатичного вузла за допомогою барвника метиленового синього, використання якого дозволило індивідуалізувати обсяг хірургічного втручання на шляхах лімфовідтоку та провести у 55,4% хворих на рак ротової порожнини та ротоглотки функціонально-зберігальну селективну шийну лімфодисекцію.

Вступ
Злоякісні пухлини голови та шиї в структурі онкологічної захворюваності становлять 15–20%. Найбільш поширеним (>90%) морфологічним видом новоутворень цієї локалізації є плоскоклітинний рак [1, 2]. Рак голови та шиї, особливо ротової порожнини і ротоглотки, характеризується високою частотою (до 50–70%) метастазування в лімфатичні вузли шиї [3].
Наявність регіонарних метастазів є одним із найважливіших прогностичних факторів у хворих на плоскоклітинний рак голови та шиї, який достовірно впливає на загальну виживаність і локорегіонарне виліковування [4].
Основним методом лікування пацієнтів із регіонарними метастазами є шийна лімфодисекція, яку виконують, як правило, при метастатичному ураженні (N+) лімфатичних вузлів одночасно з видаленням первинної пухлини. Найбільш ефективним методом усунення шийних метастазів є радикальна шийна дисекція, або операція Крайля. Однак значний обсяг видалених тканин при радикальній шийній дисекції досить часто призводить до порушень функцій плеча та деформацій шиї. Фасціально-футлярне висічення клітковини шиї представлено різними варіантами — повним, верхнім, щитоподібним, гортанним тощо [5].
За останні два десятиріччя шийна дисекція стала настільки різноманітною, що в 2002 р. в Японії створено групу JNDSG із 22 спеціалістів, завданням якої стало вивчення варіантів цього виду оперативного втручання у різних госпіталях і клініках країни. Проведено стандартизацію 20 деталей хірургічного лікування та видано спеціальний посібник «Стандартні хірургічні дії для кожної деталі шийної дисекції» [6].
Більш чітко визначити обсяг операції, диференційовано підійти до вибору та проведення різних варіантів шийної лімфаденектомії дозволив розподіл шийних лімфодисекцій на радикальну, модифіковану радикальну та селективну шийну дисекцію, а також виділення 6 основних груп шийних лімфатичних вузлів [6].
Нині стандартними методами шийної дисекції є модифікована радикальна та селективна шийна дисекція, які дозволяють зберегти більшість структур, що раніше підлягали видаленню [7].
Найбільш важливими питаннями при плануванні шийної лімфодисекції є виявлення та визначення локалізації метастатично ураженого лімфатичного вузла.
Сучасні методи діагностики, такі як комп’ютерна томографія, магнітно-резонансна томографія, позитронно-емісійна томографія, ультразвукове дослідження достатньо інформативні для диференціювання збільшених метастатично уражених лімфатичних вузлів, однак недостатньо чутливі для виявлення прихованих метастазів у шийних лімфатичних вузлах [8, 9]. Враховуючи невисоку в такому випадку чутливість перелічених методів, для діагностики прихованих метастазів та визначення шляхів метастазування у хворих на рак ротової порожнини та ротоглотки запропоновано виконувати біопсію сторожового лімфатичного вузла [10, 11].
Діагностика сторожового лімфатичного вузла базується на концепції, що злоякісні клітини з первинної пухлини поширюються у один або групу лімфовузлів (сторожових) перед переходом до іншої частини лімфатичних вузлів басейну [12]. Для виявлення сторожового лімфовузла використовують радіоізотопний метод і барвники [13].
Сторожовий лімфатичний вузол визначають як перший фільтр, через який проходить лімфовідтік від первинного вогнища утворення. Вважається, що відсутність ознак ураження сигнальних лімфатичних вузлів вказує на відсутність метастазів в інших регіонарних лімфатичних вузлах. Для виявлення сторожового лімфатичного вузла у хворих на рак грудної залози в Японії частіше застосовують індигокармін або синьку на основі ізосульфана. Використовують також сироватковий альбумін людини або колоїдний розчин, мічений технецієм 99m (99mTc). Сторожовий лімфатичний вузол виявляють після детекції регіонарної зони за допомогою радіозонда. На жаль, більшість проблем у його діагностиці ще не вирішені. Основна перешкода широкому застосуванню цієї методики — це висока вартість ізотопного етапу дослідження. Автори вважають, що такий принцип виявлення та біопсії сторожового лімфатичного вузла у хворих на рак грудної залози може бути розповсюджений і на інші локалізації, що дозволить індивідуалізувати підхід до вибору обсягу лікування у кожного конкретного хворого [14].
Матеріали та методи дослідження
Матеріали досліджень базуються на вивчені результатів комбінованого та комплексного лікування 56 хворих на плоскоклітинний рак ротової порожнини та ротоглотки у віці від 32 до 74 років.
Серед пацієнтів, залучених у дослідження, осіб чоловічої статі було 38 (67,9%), жіночої — 18 (32,1%). У всіх хворих діагностовано регіонарні метастази.
Розподіл хворих залежно від локалізації первинної пухлини представлено в табл. 1.
Таблиця 1. Розподіл хворих залежно від локалізації первинної пухлини
| Локалізація пухлини | Кількість хворих | |
| n | % | |
| Язик | 21 | 37,5 |
| Ротоглотка | 18 | 32,2 |
| Дно ротової порожнини | 9 | 16,1 |
| Ретромолярна ділянка | 4 | 7,1 |
| Щока | 4 | 7,1 |
| Усього | 56 | 100,0 |
Усі хворі на рак вищезазначених локалізацій одержали комбіноване лікування, яке включало у 32 (57,1%) осіб поліхіміотерапію та променеву терапію на первинну пухлину та регіонарні метастази. 24 (42,9%) пацієнти отримали тільки променеву терапію.
До схеми поліхіміотерапії входили цисплатин 100 мг/м2 у 1-й день і флуороурацил 1000 мг/м2 з 1-го по 5-й день. Передопераційну дистанційну променеву терапію здійснювали методом дрібного фракціонування на первинну пухлину та регіонарні метастази у разовій вогнищевій дозі 2 Гр, що становило 10 Гр на тиждень до сумарної вогнищевої дози 60–65 Гр.
У хворих застосовували клінічні методи дослідження. Проводили аналіз скарг, анамнезу захворювання, результатів об’єктивних методів дослідження: оро- і риноскопії, пальпації м’яких тканин ротової порожнини, ротової частини глотки з визначенням розповсюдженості пухлинного процесу, його взаємодії з прилеглими тканинами та стану регіонарних лімфатичних вузлів.
При пальпації шиї виконували бімануальне обстеження дна ротової порожнини, підпідборідної, піднижньощелепної та защелепної ділянок.
Проводили рентгенографію (ортопантомографію) щелеп при кісткових ураженнях.
Для виключення наявності віддалених метастазів й оцінки загального стану всім хворим виконували такі дослідження: великокадрову флюорографію органів грудної порожнини, фіброгастродуоденоскопію, ультразвукове дослідження шиї та органів черевної порожнини. При екстракапсулярному розповсюдженні метастатичної пухлини проводили комп’ютерну томографію.
До та впродовж лікування хворим призначали лабораторні дослідження: загальний аналіз крові, біохімічне дослідження показників крові, загальний аналіз сечі та електрокардіографію.
Результати досліджень
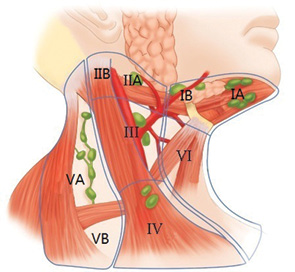
Для вивчення клініко-анатомічних особливостей регіонарного метастазування застосовано класифікацію K.T. Robbins [6], за якою виділяють 6 основних груп вузлів (рис. 1).
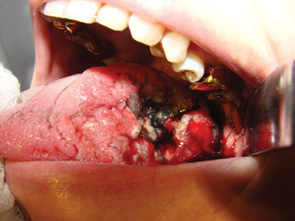
Для виявлення сторожових лімфатичних вузлів використовували 1% метиленовий синій. За 15–20 хв до початку операції вводили підслизово по периферії первинної пухлини 2–3 мл барвника (рис. 2, 3). Після введення хворого в наркоз проводили розтин шкіри та підшкірного м’яза на шиї по ходу кивального м’яза від соскоподібного відростка до надключичної ділянки. Шкірні клапті відсепаровували вперед до серединної лінії шиї та назад до рівня трапецієподібного м’яза. Після видалення кивального м’яза із фасціального ложа оцінювали стан лімфатичних вузлів.

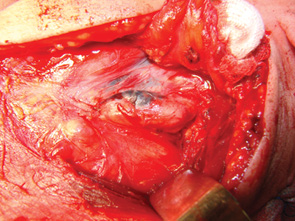
Забарвлений у синій колір лімфатичний вузол вважали сторожовим (рис. 4). З урахуванням локалізації сторожового лімфатичного вузла визначали обсяг шийної дисекції та приналежність видалених лімфатичних вузлів до певної групи (рис. 5). Видалені сторожові лімфатичні вузли направляли на гістологічне дослідження.
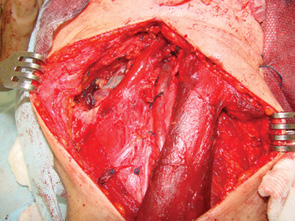
При виконанні шийної лімфодисекції відмічали групи видалених лімфатичних вузлів за класифікацією K.T. Robbins (див. рис. 1).
У 5 хворих не ідентифіковано сторожовий лімфатичний вузол, що було зумовлено фіброзними змінами в зоні пухлини після проведеної променевої терапії.
Частоту метастазування згідно з анатомічними групами лімфатичних вузлів у хворих на рак ротової порожнини представлено на рис. 6.
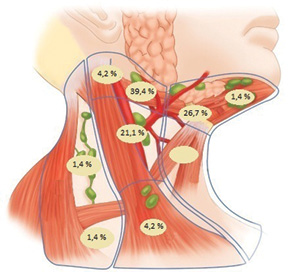
Для хворих на рак слизової оболонки порожнини рота було характерним ураження IB, IIA і III груп лімфатичних вузлів шиї. Найчастіше, у 39,4% випадків, діагностовано ураження югулярної IIA групи, у 26,7% — підщелепної IB групи та в 21,1% — медіоюгулярної III групи.
Метастазування у лімфатичні вузли IV та V груп відзначалося рідко та становило 4,2 і 2,8% відповідно.
Частоту метастазування згідно з анатомічними групами лімфатичних вузлів у хворих на рак ротоглотки представлено на рис. 7.
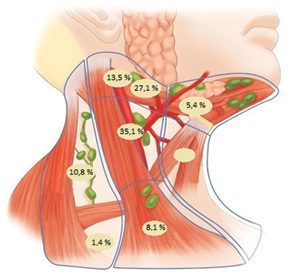
У хворих на рак ротоглотки із практично однаковою високою частотою діагностовано ураження IIA (27,1%), IІB (13,5%) і III (35,1%) груп лімфатичних вузлів шиї.
У хворих на рак ротоглотки метастази в VA задньошийній групі лімфатичних вузлів виявлено у 10,8% випадків.
У 8 пацієнтів констатовано ураження тільки однієї групи лімфатичних вузлів шиї, у 9 — 2 груп та у 1 хворого — 4 груп.
Розподіл хворих на рак голови та шиї залежно від стадії захворювання за класифікацією TNM представлено в табл. 2.
Таблиця 2. Розподіл хворих на рак голови та шиї залежно від стадії захворювання за класифікацією TNM
| Стадія | TNM | Кількість хворих | |
| n | % | ||
| ІІІ | T2N1M0 | 15 | 26,8 |
| T3N1M0 | 13 | 23,2 | |
| IVA | T2N2M0 | 8 | 14,3 |
| T3N2M0 | 15 | 26,8 | |
| T4N2M0 | 2 | 3,5 | |
| IVB | T2N3M0 | 3 | 5,4 |
| Усього | 56 | 100,0 | |
Захворювання в ІІІ і IV стадії зареєстровано в однакової кількості хворих, включених у дослідження.
Розподіл хворих на рак ротової порожнини та ротоглотки відповідно до обсягу шийної лімфодисекції та ступеня ураження лімфатичних вузлів продемонстровано в табл. 3.
Таблиця 3. Розподіл хворих на рак голови та шиї залежно від обсягу шийної лімфодисекції та ступеня ураження лімфатичних вузлів
| Категорія N | Кількість хворих, n | Тип шийної лімфодисекції | |||||||
| Селективна | Радикальна модифікована | Радикальна (операція Крайля) | Розширена радикальна | ||||||
| n | % | n | % | n | % | n | % | ||
| N1 | 28 | 21 | 75,0 | 7 | 25,0 | – | – | – | – |
| N2 | 25 | 10 | 40,0 | 11 | 44,0 | 4 | 16,0 | – | – |
| N3 | 3 | – | – | – | – | 1 | 33,3 | 2 | 66,7 |
| Усього | 56 | 31 | 55,4 | 18 | 32,1 | 5 | 8,9 | 2 | 3,6 |
У 75% хворих із ІІІ стадією (T2–3N1M0) пухлинного процесу виконано органозберігаючі функціональні селективні та у 25,0% — модифіковані радикальні шийні лімфодисекції.
Серед пацієнтів із IVA (T1–3N2M0) стадією захворювання селективну шийну лімфодисекцію проведено у 40,0% осіб, у 44,0% хворих обсяг шийної лімфодисекції відповідав модифікованій радикальній лімфодисекції, у 16,0% випадків виконано радикальну шийну лімфодисекцію.
Із 3 хворих з IVB стадією (T1–3N3M0) раку у 2 з екстракапсулярним розповсюдженням метастатичної пухлини та ураженням м’яких тканин і шкіри шиї проведено розширені радикальні шийні лімфодисекції з одночасною пластичною реконструкцією післяопераційних дефектів васкуляризованими шкірно-м’язовими клаптями; у 1 хворого — радикальну шийну лімфодисекцію (операція Крайля).
Таким чином, селективну функціонально-зберігальну шийну лімфодисекцію застосовано більш ніж у половини (55,4%) обстежених хворих, радикальну модифіковану шийну лімфодисекцію — майже у третини
(32,1%), радикальну шийну лімфодисекцію (операція Крайля) — у 8,9% та у 3,6% пацієнтів — розширену радикальну шийну лімфодисекцію.
Висновки
Виявлення сторожового лімфатичного вузла у хворих на рак порожнини рота та ротоглотки за допомогою барвника метиленового синього є найбільш простим, доступним, дешевим інформативним методом, який не потребує застосування складної апаратури.
Інтраопераційне визначення сторожового лімфатичного вузла дозволило індивідуалізувати підходи до обсягу хірургічного втручання на шляхах лімфовідтоку та провести більш ніж у половини (55,4%) хворих на рак порожнини рота та ротоглотки функціонально-зберігальну селективну шийну лімфодисекцію.
Список використаної літератури
- Пачес А.И. (2000) Опухоли головы и шеи. Медицина, Москва, 480 с.
- Deepak K. (2007) Oral cancer. Mayo Сlin. Proc. 82(7): 878–887.
- Remmert S., Rottman M., Reichenbach M. et al. (2001) Einfluss der Tumorlokalisation, der T. Kategorie und des Differenzierungsgrades von Kopf-Halstumoren auf die lokoregionäre Metastasierung. Focus MVL. 18(3): 178–186.
- Rivelli V., Luebbers H., Weber F. et al. (2011) Screening recurrence and lymph node metastases in head and neck cancer: the role computer tomography in follow-up. Head and Neck Onclogy, 18(3): 64–69.
- Образцов И.Г. (2003) Хирургическое лечение лиц со злокачественными опухолями головы и шеи при наличии метастазов в регионарные лимфатические узлы. Журн. вуш. нос. і горл. хвороб, 3: 63–66.
- Robbins K.T., Shaha A.R., Medina E.J. et al. (1991) Standardizing neck dissection terminology official report of the Academy’s Committee for Head and Surgery and Oncology. Arch. Otolaryngol. Head, Neck Surg. 117(6): 601–605.
- Saikawa M. (2010) Neck dissection revisited. Int. Clin. Oncol. 15(1): 2–4.
- Haberal I., Celik H., Gocmen H. et al. (2004) Which is important in the evaluation of metastatic lymph nodes in head and neck cancer: palpation, ultrasonography, or computed tomography? Otolaryngol. Head Neck Surg., 130: 197–201.
- Vadala G., Sangani G., Gentile F. et al. (2009) Cervical noodles and mass: Diagnosis and treatment. Acta Chir. Mediterr., 25(1): 17–23.
- Stoeckli S., Alkureishi W., Ross G. (2009) Sentinel node biopsy for early oral and oropharyngeal squamous cell carcinoma. Eur. Arch. Otorhinolaryngol., 266: 787–793.
- Coughlin A., Resto A. (2010) Oral cavity squamous cell carcinoma and the clinically N0 neck: The past, present, and future of sentinel lymph node biopsy. Curr. Oncol. Rep., 12: 129–135.
- Goda H., Nakashiro K.I., Oka R. et al. (2012) One-step nucleic acid amplification for detecting lymph node metastasis of head and neck squamous cell carcinoma. Oral Oncol. Epub. ahead of print. 18(3): 36–41.
- Vermeeren L., Olmos V.R., Klop W.M. et al. (2010) A Portable γ-Camera for Intraoperative Detection of Sentinel Nodes in the Head and Neck Region. J. of nuclear Medicine, 51(5): 164–168.
- Shigeu I., Satoshi E., Moriyama M. (2002) Is sentinel node biopsy practical? Benefits and Limitations. JMAJ. Jap. Med. Assoc. J., 45(10): 444–448.
Шейная лимфодиссекция с выявлением сторожевого лимфатического узла у больных раком полости рта и ротоглотки
2Коммунальное учреждение «Черкасский областной онкологический диспансер»
Резюме. В статье представлен клинический опыт интраоперационной индикации сторожевого лимфатического узла с помощью красителя метиленового синего, использование которого позволило индивидуализировать объем хирургического вмешательства на путях лимфооттока и провести у 55,4% больных раком полости рта и ротоглотки функционально-сохранную селективную шейную лимфодиссекцию.
Ключевые слова: рак полости рта и ротоглотки, сторожевой лимфатический узел, лимфодиссекция.
Neck dissection with sentinel lymphatic node identification in oral and oropharynx cancer patients
Summary. In this article clinical experience of intraoperational sentinel lymphatic node identification with blueprint is presented. Usage of this method allowed to individualize the volume of surgical operation on ways of lymphatic drain and to accomplish functional preservative neck dissection in 55,4% oral and oropharynx cancer patients.
Key words: oral and oropharynx cancer, sentinel lymphatic node, neck dissection.














Leave a comment