Вибір реконструктивної методики у хворих на рак слизової оболонки ретромолярного трикутника
Кравець О.В.1, Процик В.С.2, Хлинін О.В. 1
Резюме. Проведено ретроспективний аналіз реконструктивного лікування 16 хворих на рак слизової оболонки ретромолярного трикутника II–IV стадій. Показано, що застосування палатинального слизово-окісного клаптя та клаптя поверхневої скронево-тім’яної фасції дозволяє вирішити проблему пластичного заміщення більшості післяопераційних дефектів ретромолярного трикутника. Відзначено високі показники приживлення клаптів, функціональної реабілітації та мінімальні порушення у донорських зонах.

ВСТУП
Ретромоляний трикутник (РМТ) є невеликою частиною порожнини рота відповідної форми, що знаходиться позаду третього нижнього моляра. Слизова оболонка РМТ покриває передню частину гілки нижньої щелепи та медіально обмежена передньою піднебінною дужкою, а латерально — щічно-ясенною борозною. Плоскоклітинний рак трапляється у більшості хворих. Досить часто злоякісні новоутворення слизової оболонки РМТ поширюються на м’яке піднебіння, піднебінний мигдалик, слизову оболонку щоки або альвеолярного відростка нижньої щелепи [1].
На початкових стадіях захворювання, як правило, проводиться променева терапія. Лікування хворих на рак слизової оболонки РМТ у III–IV стадії потребує поєднання хірургічного втручання та променевої чи одночасної хіміопроменевої терапії [2]. Видалення первинної пухлини вимагає пластичного заміщення дефекту із застосуванням місцевих, регіонарних та вільних клаптів. Залежно від розмірів дефекту РМТ застосовують різні реконструктивні методики. Для усунення невеликих та середніх за розміром дефектів використовують місцеві тканини, палатинальний слизово-окісний клапоть [3, 4] та клапоть жирового тіла щоки [5–7]. Пластичне заміщення великих дефектів РМТ, що поширюються на суміжні анатомічні ділянки, проводять із застосуванням клаптя поверхневої скроневої фасції [8–10] та вільного шкірно-фасціального аутотрансплантата передпліччя [11–13].
Метою даного дослідження було вивчення можливостей використання палатинального слизово-окісного клаптя та клаптя поверхневої скронево-тім’яної фасції при пластичному заміщенні середніх та великих дефектів РМТ.
ОБ’ЄКТ І МЕТОДИ ДОСЛІДЖЕННЯ
Проведено ретроспективний аналіз реконструктивно-відновного лікування 16 пацієнтів із раком слизової оболонки РМТ II–IV стадії, з яких чоловіків — 15 (93,6%), жінок — 1 (6,4%). Вік хворих коливався від 46 до 72 років. Плоскоклітинний рак різного ступеня диференціювання діагностовано в усіх 16 пацієнтів.
Пластичне заміщення дефектів РМТ проводили із застосуванням палатинального слизово-окісного клаптя, поверхневої скронево-тім’яної фасції та вільного шкірно-фасціального аутотрансплантата передпліччя. У дослідження не включали пацієнтів, які потребували одночасного усунення сегментарних дефектів гілки та тіла нижньої щелепи. Вивчали післяопераційні ускладнення, функціональні результати, а також порушення у донорській зоні.
ХІРУРГІЧА АНАТОМІЯ ТА ТЕХНІКА ЗАБОРУ ПАЛАТИНАЛЬНОГО СЛИЗОВО-ОКІСНОГО КЛАПТЯ
Тверде піднебіння покрите слизовою обоолнкою, яка щільно прилягає до окістя. Кровопостачання слизової оболонки й окістя твердого піднебіння здійснюється за рахунок парних великих піднебінних артерій, які є продовженням низхідних піднебінних із басейну внутрішньої верхньощелепної артерії (рис. 1). Судинно-нервові пучки виходять із великих піднебінних отворів, розміщених навпроти другого моляра. Іннервація слизової оболонки здійснюється гілками трійчастого нерва.
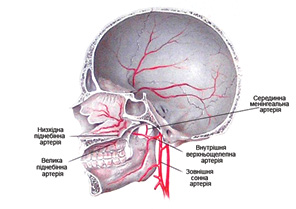
При викроюванні слизово-окісного клаптя розрізи можуть бути зроблені на межі твердого і м’якого піднебіння та на відстані 5 мм від ясенного краю зубів. Судинна ніжка клаптя проходить у кістковому каналі, який обмежує дугу його ротації. Резекція гачка крилоподібної пластинки дозволяє збільшити довжину судинної ніжки, якщо в цьому є необхідність. Одна судинна ніжка забезпечує кровопостачання усієї слизової оболонки та окістя твердого піднебіння. Клапоть на одній великій піднебінній артерії може включати до 90% площі слизової оболонки піднебіння. Загоєння донорської зони проходить вторинним натягом.
ХІРУРГІЧА АНАТОМІЯ ТА ТЕХНІКА ЗАБОРУ КЛАПТЯ ПОВЕРХНЕВОЇ СКРОНЕВО-ТІМ’ЯНОЇ ФАСЦІЇ
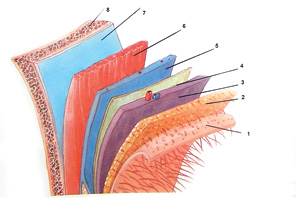
Поверхнева скронево-тім’яна фасція розміщена безпосередньо під шкірою та підшкірною клітковиною відповідної ділянки. Вона представлена шаром сполучної тканини розміром від 2 до 4 мм та є продовженням поверхневої м’язово-апоневротичної системи обличчя. Під поверхневою скронево-тім’яною фасцією знаходиться шар пухкої ареолярної тканини, а глибше — глибока скронева фасція та скроневий м’яз (рис. 2).
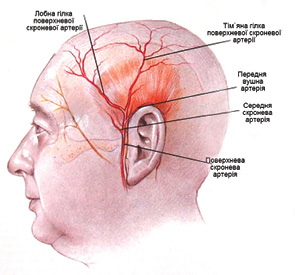
Кровопостачання поверхневої скронево-тім’яної фасції здійснює поверхнева скронева артерія, яка є кінцевою гілкою зовнішньої сонної артерії. Поверхнева скронева артерія утворює три головні гілки: середню скроневу, лобну та тім’яну (рис. 3).
При заборі клаптя поверхневої скронево-тім’яної фасції використовують T- або Y-подібні розрізи шкіри. Шкіру відділяють від підлеглих тканин безпосередньо під волосяними фолікулами. Клапоть може бути до 14–17 см у висоту та до 10 см у ширину. Препарування клаптя здійснюється над глибокою скроневою фасцією. Після ідентифікації поверхневої скроневої артерії та вени основа клаптя звужується до 2–2,5 см. Під виличною дугою формується тунель, через який трансплантат підводиться до дефекту. Донорська зона ушивається та активно дренується.
РЕЗУЛЬТАТИ ТА ЇХ ОБГОВОРЕННЯ
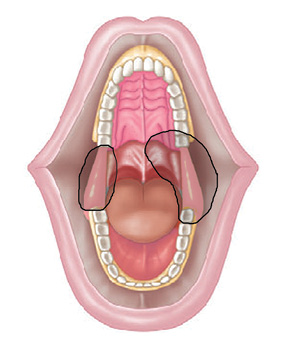
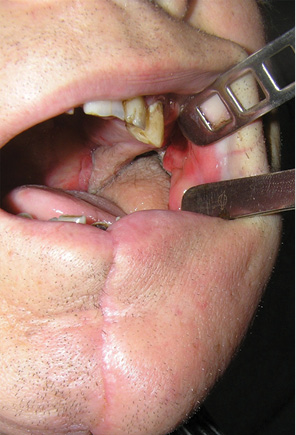
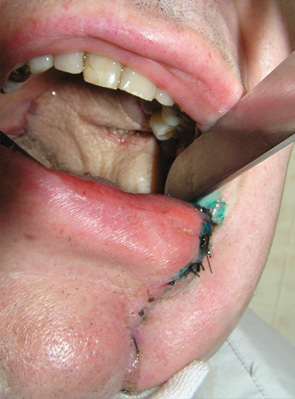
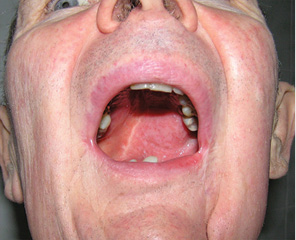
Пластичне заміщення дефектів РМТ проводили з урахуванням їх розмірів та локалізації. Схематичне зображення дефектів РМТ показано на рис. 4. Палатинальний слизово-окісний клапоть використали для усунення невеликих та середніх дефектів РМТ до 20 см2 у 5 хворих. Етапи пластики дефекту РМТ показано на рис. 5–7. Нами не відмічено некрозів клаптя, розходження швів післяопераційної рани, інфекційних ускладнень у жодного хворого. Харчування через рот було відновлено у всіх 5 пацієнтів на 10-ту добу. Відкривання рота у повному обсязі досягнуто у всіх хворих. Повна епітелізація донорської зони завершилася через 4 тиж. Жодних порушень у місці забору клаптя ми не відзначили.
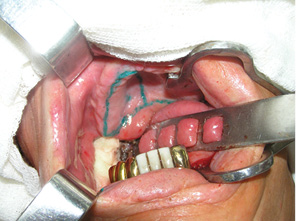
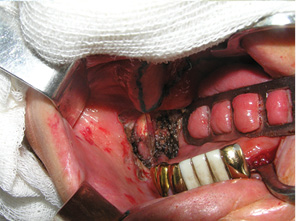
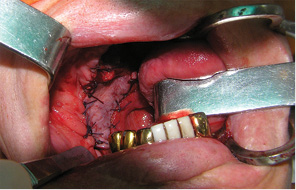
Клапоть поверхневої скронево-тім’яної фасції був застосований при великих дефектах РМТ >20 см2 у 9 хворих. Етапи пластичного заміщення дефектів
показано на рис. 8–13. Повного некрозу клаптя не спостерігали у жодному випадку. Частковий некроз клаптя відмічено у 1 хворого. Розходження швів післяопераційної рани, пошкодження гілок лицевого нерва та інфекційних ускладнень ми не відзначали. Харчування через рот відновлено у всіх 9 пацієнтів на 10–14-ту добу. Відкривання рота у повному обсязі забезпечено у всіх хворих. У 2 пацієнтів у донорській зоні відмічено вогнищеву алопецію, що пов’язано із травмуванням волосяних фолікулів під час препарування шкірних клаптів. Вогнища облисіння були невеликими, тому легко маскувалися оточуючим волоссям.
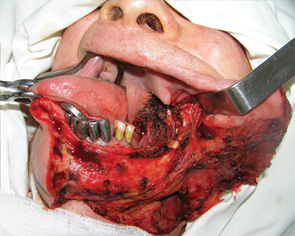
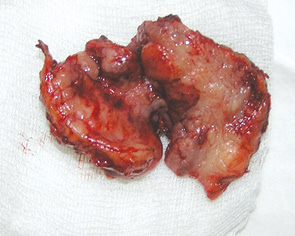
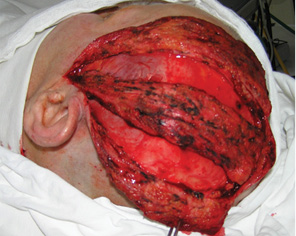
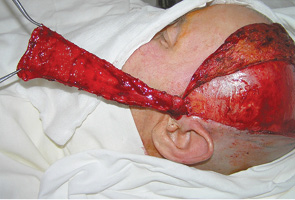
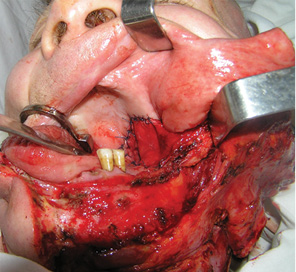
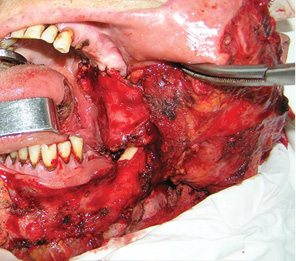
У 2 клінічних випадках для пластичного заміщення великих післяопераційних дефектів РМТ виникла необхідність використати вільний шкірно-фасціальний клапоть передпліччя. У одного пацієнта попередньо проведено операцію з приводу новоутворення шкіри скроневої ділянки, тому була висока ймовірність порушення кровопостачання скронево-тім’яної фасції. Результат пластики великого дефекту РМТ із застосуванням шкірно-фасціального клаптя передпліччя показано на рис. 14. У іншого хворого було відмічено значне поширення пухлинного процесу на м’яке піднебіння, що вимагало його субтотальної резекції. Оскільки обсяг резекції включав тканини щоки, РМТ, бічної стінки ротоглотки та практично все м’яке піднебіння, ширини клаптя скронево-тім’яної фасції було б недостатньо, тому для заміщення дефекту нами використано шкірно-фасціальний променевий аутотрансплантат. Результат пластики великого дефекту РМТ зі значним поширенням на м’яке піднебіння показано на рис. 15, 16.
Реконструктивна хірургія порожнини рота за останні десятиріччя значно змінилася. Нині існують численні методики пластичного заміщення післяопераційних дефектів порожнини рота із застосуванням регіонарних та вільних клаптів. Мікрохірургічна пересадка тканин значно розширила спектр реконструктивних методик, проте, на нашу думку, у першу чергу перевагу слід надавати простішим методикам, які здатні забезпечити оптимальне відновлення форми та функції при мінімальних порушеннях у донорській зоні. РМТ є саме тією ділянкою порожнини рота, в якій при більшості післяопераційних дефектів можливе застосування регіонарних клаптів із забезпеченням вищеперелічених принципів. На противагу цьому при половинних, субтотальних та тотальних післяопераційних дефектах язика застосування регіонарних клаптів досить обмежене, більш прийнятними є вільні аутотрансплантати.
Палатинальний слизово-окісний клапоть дозволяє
усунути середні дефекти РМТ, забезпечуючи високі показники функціональної реабілітації. Застосування палатинального клаптя при невеликих дефектах є також обґрунтованим, оскільки загоєння вторинним натягом у цій зоні призводить до грубого рубцювання та розвитку контрактури нижньої щелепи. E. Genden та співавтори повідомляють про повне приживлення вищезгаданого клаптя у 95–100% випадків та відсутність будь-яких порушень у донорській зоні [3], що підтверджено і в нашому дослідженні. Протипоказаннями до забору палатинального клаптя є вік хворих до 5 років (оскільки ще не завершився розвиток верхньої щелепи), попередні операції на твердому піднебінні та перев’язка зовнішньої сонної артерії.
Клапоть поверхневої скронево-тім’яної фасції широко застосовують для пластичного заміщення дефектів вуха, обличчя, порожнини рота та ротоглотки. У реконструктивній хірургії порожнини рота найкращі результати були досягнуті при усуненні дефектів РМТ. Про дещо гірші результати повідомляють при заміщенні дефектів дна порожнини рота [14]. Важливою умовою підйому цього клаптя є збереження волосяних фолікулів і поверхневої скроневої артерії та вени. Вогнищева алопеція залишається єдиним потенційним ускладненням у донорській зоні. Протипоказаннями до забору клаптя поверхневої скронево-тім’яної фасції є попередні операції у відповідній ділянці та перев’язка зовнішньої сонної артерії.
ВИСНОВКИ
Застосування палатинального слизово-окісного клаптя та клаптя поверхневої скронево-тім’яної фасції дозволяє вирішити проблему пластичного заміщення більшості післяопераційних дефектів РМТ.
Вільні аутотрансплантати застосовують за наявності протипоказань до забору регіонарних клаптів.
СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ
1. Ayad T., Gelinas M., Guertin L. et al. (2005) Retromolar trigone carcinoma treated by primary radiation therapy. Arch. Otolaryn. Head Neck Surg., 131: 576–582.
2. Mendenhall W., Morris C., Amdur R. et al. (2005) Retromolar trigone squamous cell carcinoma treated with radiotherapy alone or combined with surgery. Cancer, 103: 2320–2325.
3. Genden E., Lee B., Urken M. (2001) The palatal island flap for reconstruction of palatal and retromolar trigone defects revisited. Arch. Otolaryn. Head Neck Surg., 127: 837–841.
4. Ducic Y., Herford A. (2001) The use of palatal island flaps as an adjunct to microvascular free tissue transfer for reconstruction of complex oromandibular defects. Laryngoscope, 111: 1666–1669.
5. Colella G., Tartaro G., Giudice A. (2004) The buccal fat pad in oral reconstruction. Brit. J. Plast. Surg., 57(4): 326–329.
6. Chakrabarti J., Tekriwal R., Ganguli A. et al. (2009) Pedicled buccal fat pad flap for intraoral malignant defects: A series of 29 cases. Indian J. Plast. Sug., 42(1): 36–42.
7. Rapidis A., Alexandridis C., Eleftheriadis E. et al. (2000) The use of the buccal fat pad for reconstruction of oral defects: review of literature and report of 15 cases. J. Oral Maxillofac. Surg., 58: 158–163.
8. Nayak V., Deschler D. (2004) Redicled temporoparietal fascial flap reconstruction of select intraoral defects. Laryngoscope, 114(9): 1545–1548.
9. Demirdover C., Sahin B., Vayvada H. et al. (2011) The versatile use of temporoparietal fascial flap. Int. J. Med. Sci., 8(5): 362–368.
10. Beeby M., Artigot J., Zuloaga A. (2001) Vascularised temporoparietal fascial flap for closure of an orocutaneous fistula. Br. J. Plast. Surg., 54: 275–276.
11. Kang H., Park M., Lim H. et al. (2013) Modified folding radial forearm flap in soft palate and tonsillar fossa reconstruction. J. Craniofac. Surg., 24(2): 458–460.
12. Wei F., Celik N., Yang W. et al. (2003) Complications after reconstruction by plate and soft-tissue free flap in composite mandibular defects and secondary salvage reconstruction with osteocutaneous flap. Plast. Reconstr. Surg., 112(1): 37–42.
13. Biglioli F., Brusati R. (2008) The folded radial forearm flap in soft-palate and tonsillary fossa reconstruction: technical note. Int. J. Oral. Maxillofac. Surg., 37(1): 76–81.
14. Pinto F., Magalhaes R., Durazzo M. et al. (2008) Galeal flap based on superficial temporal vessels for oral cavity and pharynx reconstruction — an anatomical study. Clinics, 63(1): 97–102.
Выбор реконструктивной методики у больных раком слизистой оболочки ретромолярного треугольника
Резюме. Проведен ретроспективный анализ реконструктивного лечения 16 больных раком слизистой оболочки ретромолярного треугольника II–IV стадий. Показано, что применение палатинального слизисто-надкостничного лоскута и лоскута поверхностной височно-теменной фасции позволяет решить проблему пластического замещения большинства послеоперационных дефектов ретромолярного треугольника. Отмечены высокие показатели приживления лоскутов, функциональной реабилитации и минимальные нарушения в донорских зонах.
ретромолярной треугольник, пластическое замещение дефектов.














Leave a comment