Використання підгіоїдного шкірно-м’язового клаптя в хірургії раку порожнини рота
Кравец О.В.1, Процык В.С.2, Коробко Е.В.2, Хлынин А.В. 1
Резюме. Проаналізовано результати реконструктивно-відновного лікування 24 хворих на рак порожнини рота II–III стадії з використанням підгіоїдного шкірно-м’язового клаптя. Досягнуто хороших показників функціональної реабілітації хворих. Показано, що застосування даного клаптя після радикальних доз променевої терапії пов’язане з високим ризиком некротичних ускладнень.

ВСТУП
Вперше методику формування складного шкірно-м’язового клаптя зі включенням передніх довгих м’язів шиї описано у 1986 р. Wong et al. [1].
Питання кровопостачання підгіоїдних м’язів та шкіри шиї детально висвітлено в роботах Eliachar et al. [2], Rabson et al. [3]. Підгіоїдний шкірно-м’язовий клапоть (ПШМК) застосовують для пластичного усунення середніх за розміром дефектів порожнини рота (ПР), нижньої зони обличчя [4–6], глотки [7–9]. Не дивлячись на його значні переваги (тонкий, пластичний, простий у виділенні, може бути використаний у пацієнтів похилого віку), застосування ПШМК досить обмежене [10].
На сьогодні для усунення середніх за розміром післяопераційних дефектів ПР є доступним досить широкий вибір пластичного матеріалу. Це шкірно-м’язові клапті кивального [11], трапецієподібного та підшкірного м’яза [12], носо-губний [13], променевий передпліччя [14], латеральний плеча [15] та інші клапті. Вказані трансплантати мають як переваги, так і суттєві недоліки, тому триває пошук нових та вдосконалення існуючих реконструктивних методик. Метою даного дослідження було вивчення можливостей застосування ПШМК в хірургії раку ПР.
ОБ’ЄКТ І МЕТОДИ ДОСЛІДЖЕННЯ
У роботі проаналізовано результати реконструктивно-відновного лікування 24 пацієнтів з раком ПР II–III стадії, з яких чоловіків — 23 (95,83%), жінок — 1 (4,17%). Вік пацієнтів коливався від 39 до 76 років. У 10 (41,67%) хворих діагностовано рак слизової дна ПР, у 7 (29,17%) — рак рухомої частини язика, у 5 (20,83 %) — рак слизової альвеолярного відростка нижньої щелепи, у 2 (8,33%) — рак слизової щоки. Для верифікації діагнозу проводили морфологічне дослідження біопсійного матеріалу, отриманого під час проведення інцизійної біопсії пухлини. За гістологічною класифікацією плоскоклітинний рак різного ступеня диференціювання діагностовано у всіх 24 (100%) хворих.
Усі пацієнти розподілені на 2 групи. До основної групи увійшли 10 пацієнтів, що отримали курс променевої терапії у сумарній вогнищевій дозі (СВД) 40 Гр, контрольну групу становили 14 хворих, яким проведена променева терапія із СВД 60–64 Гр. Оперативне лікування проводили через 3–4 тиж після завершення променевого лікування. Реконструктивно-відновний етап виконували одномоментно з операцією на первинному вогнищі та зонах регіонарного метастазування. Резекція нижньої щелепи зі збереженням безперервності виконана у 11 (45,83%) пацієнтів. Для пластичного усунення дефектів ПР використано ПШМК розмірами 3–4 на 5–7 см.
Вивчали ускладнення після реконструктивних операцій, а також функціональні результати пластики за шкалою Performance Status Scale for Head and Neck Cancer Patients (PSSHN).
Хірургічна анатомія та техніка забору клаптя
ПШМК включає груднино-під’язикові, щитопід’язикові, груднино-щитоподібні м’язи, підшкірний м’яз шиї та фрагмент шкіри в проекції щитоподібного та перстнеподібного хрящів. Основою кровопостачання клаптя є підпідгіоїдна гілка верхньої щитоподібної артерії. Венозний дренаж трансплантата здійснюється за рахунок передньої яремної вени та верхньої щитоподібної вени [2]. Шкірна викроєна частина клаптя може мати розміри 5 на 10 см (рис. 1).
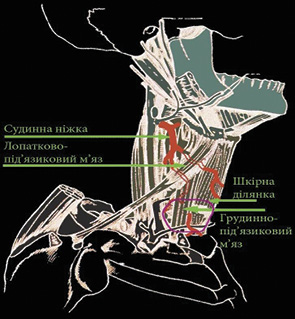
На передній поверхні шиї, над яремною вирізкою грудини, викроюється шкірний клапоть відповідно до розмірів дефекту ПР (рис. 2). Перетинаються підгіоїдні м’язи, шкірний фрагмент клаптя підшивається до м’язів з метою уникнення пошкодження шкірних перфорантів при виділенні трансплантата. Дисекція клаптя проводиться над фасцією щитоподібної залози до рівня під’язикової кістки з виділенням підпідгіоїдних гілок верхньої щитоподібної артерії. По можливості слід зберегти колатеральні вени (язикову, лицеву) як доповнення до верхньої щитоподібної вени для кращого венозного дренажу [10]. Також виділяють гілку нерва, що відходить від петлі під’язикового нерва. Відсічення підгіоїдних м’язів від під’язикової кістки проводиться ззаду наперед, щоб зберегти окістя, яке також відіграє значну роль в мікроциркуляції крові в тканинах трансплантата. Клапоть на судинних ніжках переносять в дефект ПР та пошарово ушивають. Дефект шкіри донорської зони відновлюється місцевими тканинами.
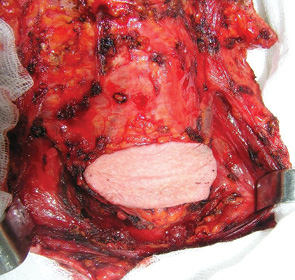
РЕЗУЛЬТАТИ ДОСЛІДЖЕНЬ ТА ЇХ ОБГОВОРЕННЯ
Головними показниками при реабілітації хворих на рак ПР є відновлення здатності приймати їжу без додаткових засобів та неприродних стом, а також функції жування, мовлення, дихання.
ПШМК використали для реконструкції слизової щоки, дна ПР, альвеолярного відростка нижньої щелепи, рухомої частини язика. Розміри дефектів після радикального хірургічного лікування раку ПР становили 3–4 на 5–6 см. Метою реконструктивного етапу операції було:
- відновлення дефекту тканин;
- запобігання обмеження рухомості язика;
- покриття резектованого фрагмента кістки васкуляризованими тканинами клаптя з метою профілактики остеомієліту нижньої щелепи.
У основній групі ускладнення у вигляді повного некрозу клаптя відзначено у 1 (10%) хворого. У 1 (10%) пацієнта мав місце частковий некроз трансплантата. Розходження швів в донорській зоні не виявлено.
У контрольній групі повний некроз клаптя відмічено у 4 (28,6%) пацієнтів, частковий — у 5 (35,7%) хворих. У 1 (7,14%) пацієнта виявлено значне розходження швів у донорській зоні, що потребувало проведення додаткового хірургічного втручання.
Слід зазначити, що у пацієнтів як основної, так і контрольної груп частковий некроз стосувався лише шкірної частини клаптя, що не приводило до формування стійкої оростоми. Після проведення некректомії м’язова частина трансплантата епітелізувалася протягом 12–14 діб. Завершеність пластики при використанні ПШМК у хворих основної групи становила 90%, у пацієнтів контрольної — 71,4%. Результати пластичного усунення різних дефектів ПР показано на рис. 3, 4. Повторні реконструктивні операції виконані у 1 пацієнта основної групи та 4 — контрольної.
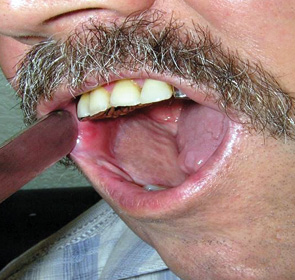
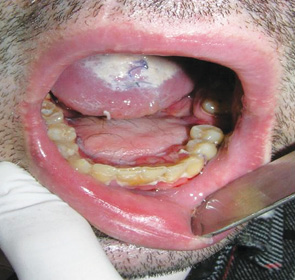
За шкалою PSSHN у 80% хворих основної та 64,3% контрольної групи відзначено хороші показники нормальності дієти, харчування на людях та зрозумілості мови.
Підвищення частоти ускладнень при використанні ПШМК після радикального курсу променевої терапії відзначають й інші автори. Так, за даними Magrin et al., рівень успішності даного клаптя знижується з 90 до 53% після радикального курсу променевої терапії [16]. Таким чином, на нашу думку, необхідне правильне планування променевої терапії та оцінка ефекту передопераційних доз з метою уникнення невиправданого доведення СВД до радикальної у групі хворих з високою вірогідністю хірургічного етапу лікування.
ВИСНОВКИ
Використання ПШМК для пластичного усунення середніх за розміром дефектів ПР дозволяє досягти хороших показників функціональної реабілітації хворих.
Променева терапія у СВД вищій 40 Гр може привести до порушення кровообігу у тканинах трансплантата, тому застосування даного клаптя після радикальних доз опромінення пов’язано з високим ризиком некротичних ускладнень.
ЛІТЕРАТУРА
1. Wang H.S., Shen J.W., Ma D.B. et al. (1986) The infrahyoid myocutaneous flap for reconstruction after resection of head and neck cancer. Cancer, 57: 663–668.
2. Eliachar I., Marcovich A., Har Shai Y. et al. (1984) Arterial blood supply of the infrahyoid muscles: an anatomical study. Head Neck Surg., 7: 8–14.
3. Rabson J.A., Hurwitz D.J., Futrell J.W. (1985) The cutaneous blood suppy of neck: relevance to incision planning and surgical reconstruction. Br. J. Plast. Surg., 38: 208–219.
4. Verhulst J., Souza Leao R. (2004) The infrahyoid musculocutaneous flap: experience of 153 cases in the reconstruction of the oropharynx and oral cavity after tumoral excision. Rev. Laryngol. Otol. Rhinol. (Bord), 125: 49–53.
5. Deganello A., Manciocco V., Dolivet G. et al. (2007) Infrahyoid fascio-myocutaneous flap as an alternative to free radial forearm flap in head and neck reconstruction. Head Neck, 29: 285–291.
6. Zhao Y.F., Zhang W.F., Zhao J.H. (2001) Reconstruction of intraoral defects after cancer surgery using cervical pedicle flaps. J. Oral Maxillofac. Surg., 59: 1142–1146.
7. Gangloff P., Deganello A., Lacave M.L. et al. (2006) Use of the infra hyoid musculo-cutaneous flap in soft palate reconstruction. J. of Cancer Surg.; 32: 1165–1169.
8. Zuydam A.C., Love D., Brovn J.S. et al. (2005) Predictors of speech and swallowing function following primary surgery for oral and oropharyngeal cancer. Clin. Otolaryngol., 30: 428–437.
9. van der Sloot P.G. (2003) Hard and soft palate reconstruction. Curr. Opin. Otolaryngol. Head Neck Surg., 11: 225–229.
10. Mirghani H., Meyer G., Hans S. et al. (2012) The musculocutaneous infrahyoid flap: surgical key points. Eur. Arch. Otorhinolaryngol., 269: 1213–1217.
11. Kumar V., Gaud U., Shukla M. et al. (2009) Sternocleidomastoid island flap preserving the branch from superior thyroid artery for the reconstruction following resection of oral cancer. J. Cancer Surg., 35: 1011–1015.
12. Пачес А.И. (2000) Опухоли головы и шеи. Медицина, Москва, 480 с.
13. Неробеев А.И., Плотников Н.А. (1997) Восстановительная хирургия мягких тканей челюстно-лицевой области. М.: Медицина, 288 с.
14. Su W.F., Hsia Y.J., Chang Y.C. et al. (2003) Functional comparison after reconstruction with a radial
forearm free flap or a pectoralis major flap for cancer
of the tongue. Otolaryngol. Head Neck Surg., 128(3): 412–
418.
15. Gellrich N.C., Kwon T.G., Lauer G. et al. (2000) The lateral upper arm free flap for intraoral reconstruction. J. Oral Maxillofac. Surg., 29: 104–111.
16. Magrin J., Kowalski L.P., Santo G.E. et al. (1993) Infrahyoid myocutaneous flap in head and neck reconstruction. Head Neck, 15: 522–525.
Использование подгиоидного кожно-мышечного лоскута в хирургии рака полости рта
2Национальный институт рака, Киев
Резюме. Проанализированы результаты реконструктивно-восстановительного лечения 24 больных раком полости рта II–III стадии с использованием подгиоидного кожно-мышечного лоскута. Достигнуты хорошие показатели функциональной реабилитации больных. Показано, что использование данного лоскута после радикальных доз лучевой терапии сопряжено с высоким риском некротических осложнений.
Ключевые слова: подгиоидный кожно-мышечный лоскут, рак полости рта.
The infrahyoid myocutaneous flap in oral cancer surgery
2National Cancer Institute, Kyiv
Summary. The study analyzed the results of reconstructive treatment and recovery of 24 patients with oral cancer stages II–III using infrahyoid myocutaneous flap. High levels of functional rehabilitation in patients has been reached. It is shown that application of the flap after radical radiotherapy doses associated with a high risk of necrotic complications.
Key words: infrahyoid myocutaneous flap, oral cancer.














Leave a comment