Онкохірургічний і дерматологічний підходи до діагностики та лікувальної тактики у хворих на меланому шкіри
Галайчук І.Й.1, Бабанли Ш.Р.2, Данилків І.С.2, Шкробот Л.В.2
- 1Тернопільський державний медичний університет ім. І.Я. Горбачевського
- 2КУТОР «Тернопільський обласний клінічний онкологічний диспансер»
Резюме. У статті описано і критично проаналізовано онкохірургічний (вітчизняний) і дерматологічний (західноєвропейський) алгоритми лікування хворих на меланому шкіри. Методика онкохірургічного підходу полягає у комплексній передопераційній діагностиці, яка включає клінічний огляд, дерматоскопію, ультразвукове вимірювання товщини і об’єму меланомоподібної пухлини, цитологічну верифікацію. Після встановлення діагнозу виконують радикальну операцію — широке вирізання меланоми шкіри. Дерматологічний підхід складається з таких етапів: клінічний огляд, дерматоскопія, ексцизійна біопсія меланомоподібного утворення. Після гістологічної верифікації меланоми проводять повторну операцію — радикальне висічення післябіопсійного рубця шкіри та діагностичне видалення сторожового лімфатичного вузла. Гістологічно у свіжій рубцевій тканині ознак меланоми не виявляють, що й створює ілюзію того, що межі видалення меланоми не мають значення. При цьому майже у чверті хворих відмічено метастатичне ураження лімфатичних колекторів, що свідчить про те, що ексцизійна біопсія ініціює механізми метастазування меланоми. Проведене зіставлення діагностично-лікувальних алгоритмів показало доцільність з клінічної точки зору одномоментного радикального видалення меланоми порівняно з двохетапним хірургічним втручанням.

Протягом останнього десятиріччя в Україні впроваджуються міжнародні стандарти діагностики та лікування хворих зі злоякісними пухлинами [1, 2]. Проте у зв’язку з відмінностями у структурі онкологічної допомоги між Україною та Західною Європою виникають незвичні для вітчизняних онкологів інтерпретації тих чи інших діагностичних моментів або лікувальної тактики. Ці відмінності наочно продемонстровано на прикладі меланомоподібних пігментних утворень шкіри.
Хірургічний підхід до лікування меланоми суттєво відрізняється тому, що злоякісні пухлини шкіри у нас лікують онкологи-хірурги, а на Заході — дерматологи або дерматоонкологи. Європейський консенсус щодо діагностики і лікування меланоми базується на рекомендаціях дерматологічних клінік Німеччини, Франції, Італії, Великої Британії, а у США — Американської академії дерматологів [5, 10–12]. Логічно, що дерматологи та онкохірурги мають неоднакове розуміння таких клінічних понять, як радикальність операції, абластика, антибластика, зональність і футлярність. Для дерматологів це перш за все косметичний ефект, мінімально інвазивні процедури, органозберігаючі операції, а гістологічна товщина меланоми — це єдиний визначальний критерій для прийняття рішення про межі її хірургічного видалення. Нині у дерматологічних клініках Європи ексцизійна діагностична біопсія з подальшою (через 4–8 тиж) реоперацією — широким вирізанням післябіопсійного рубця — є хірургічним стандартом у лікуванні первинних пацієнтів із меланомою шкіри [5, 6, 8].
Мета: на основі власних досліджень і даних літератури порівняти онкохірургічний і дерматологічний підходи до діагностики і лікування хворих на меланому шкіри.
Об’єкт і методи дослідження
Термін «онкохірургічний» ми використовуємо на позначення одномоментного радикального видалення меланоми шкіри (операція, яку донедавна практикувала вітчизняна школа онкологів). Останнім часом наполегливо пропагують алгоритм діагностики, який застосовують дерматологи США та Європи, що ми назвали «дерматологічним». Порівняльній характеристиці зазначених підходів присвячена ця стаття.
У нашій клініці діагностичний алгоритм у разі наявності пігментного утворення з підозрою на меланому складається з таких послідовних кроків (рис. 1, а): клінічний огляд (правило ABCD), дерматоскопія (×10; ABCD), ультразвукове дослідження (УЗД) пухлини, поверхнева (скарифікаційна) біопсія з цитологічною верифікацією меланоми.
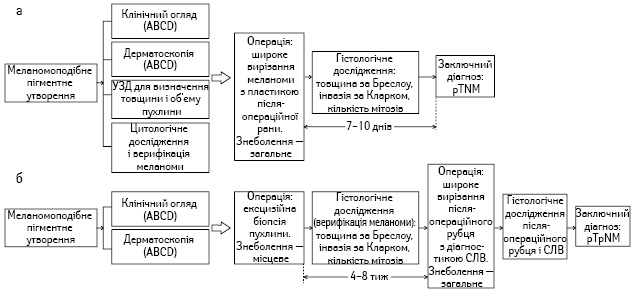
Рис. 1. Діагностично-лікувальний алгоритм у хворих на меланому шкіри при онкохірургічному (а) і дерматологічному (б) підходах
Для епілюмінесцентної дерматоскопії поверхневих пігментних утворень застосовували ручний дерматоскоп EpiScope («WelchAllyn», США). Клінічні та дерматоскопічні зображення пухлин документували. УЗД з визначенням горизонтальних розмірів, товщини та об’єму пігментної пухлини проводили лінійним датчиком L10-5 апарата «Siemens Sonoline G60S».
Матеріал з пухлини для цитологічного дослідження брали кінчиком скальпеля з-під епідермісу, який покривав пігментне утворення. Мазки забарвлювали за методом Романовського. Результат цитологічної діагностики з верифікацією меланоми отримували протягом години.
На основі цих досліджень встановлювали клінічний (cTNM) передопераційний діагноз «меланома». Операцію виконували під загальним знеболенням, пухлину видаляли в межах здорових тканин (на 2,0–3,0 см), враховуючи сонографічну товщину меланоми та її об’єм. Радикальну операцію здійснювали з використанням онкопластичних методик закриття післяопераційних ран за Лімбергом, Шрудде або за способами, розробленими в нашій клініці. Патогістологічне дослідження проводили з визначенням товщини меланоми за Бреслоу та глибини її інвазії в дерму за Кларком; імуногістохімічно визначали Кі-67 як маркер проліферації. Таким чином, заключний клініко-морфологічний діагноз (pTNM) встановлювали через 7–10 днів після операції (див. рис. 1, а).
Дерматологічні клініки Європи і США дотримуються іншого діагностичного алгоритму (рис. 1, б). Після клінічного огляду і дерматоскопії дерматолог (дерматоонколог або лікар загальної практики) виконує під місцевою анестезією ексцизійну біопсію меланомоподібного утворення, відступивши від його краю на 1–3 мм [5, 10]. У разі меланоми патогістолог вказує на товщину пухлини за Бреслоу, рівень інвазії за Кларком, мітотичний індекс тощо. Далі проводять обстеження пацієнта (комп’ютерна томографія, УЗД, позитронно-емісійна томографія — ПЕТ, аналізи крові) і протягом 4–8 тиж виконують повторну, так звану радикальну операцію — широке вирізання післябіопсійного рубця в межах 1,0 або 2,0 см неураженої шкіри, залежно від товщини меланоми за Бреслоу (1,0 або 2,0 мм). Таку операцію, як правило, проводять разом з діагностичною біопсією сторожового лімфатичного вузла (СЛВ) регіонарного лімфатичного колектора. Після патогістологічного дослідження рубця і СЛВ встановлюють заключний діагноз (pTpNM0) (див. рис. 1, б).
Характеристика клінічного матеріалу.
Ретроспективно нами оцінено перебіг захворювання у 99 пацієнтів із меланомою шкіри T2–T4N0M0, які отримали комбіноване лікування в обласному онкологічному диспансері. Чоловіків було 35 (35,4%), жінок — 64 (64,6%). 80,0% хворих були у віковій групі 40–70 років. На шкірі тулуба меланома локалізувалася у 31,3%, на нижніх кінцівках — у 44,4%, на голові та верхніх кінцівках — у 24,3% пацієнтів. Меланома з вузловим характером росту (Т4) була у 48 (48,5%) пацієнтів. Діагностичні маніпуляції здійснювали згідно з описаним алгоритмом. Після цитологічного підтвердження діагнозу хворі отримували інтенсивний курс променевої терапії (45–50 Гр-екв.) на зону росту пухлини. Під час широкого (на 2–3 см) вирізання меланоми видаляли всю опромінену перитуморальну ділянку. Операцію виконували з дотриманням правил абластики і антибластики, утворену рану закривали шкірно-жировими клаптями із застосуванням методів транспозиційної пластики. Пацієнти з високим прогностичним ризиком (T4b) пролонгації хвороби отримували ад’ювантні курси хіміотерапії (CVD), інші — інтерферонотерапію. Ультразвуковий моніторинг регіонарних лімфатичних колекторів здійснювали кожні 3 міс. Завдяки цьому у 10 (10,1%) хворих виявлено метастатичне ураження лімфатичних вузлів (ЛВ) і виконано регіонарну лімфаденектомію. Загальна 3-річна виживаність хворих становила 78,8% (67,0–90,1%), а 5-річна — 61,6% (47,8–75,1%).Таким чином, проведене дослідження показало, що після радикального одномоментного видалення меланоми шкіри регіонарні лімфатичні колектори уражаються метастазами в 10% випадків і є доступними для контролю сонографічним скануванням.
Для ілюстрації онкохірургічного підходу наводимо клінічний приклад. Пацієнт Р., 43 років, звернувся до онколога зі скаргою на помітний ріст пігментного утворення на шкірі грудної клітки. Анамнез захворювання — приблизно 3 роки. Клінічно справа від грудини — асиметричне площинне пігментне утворення розміром 15×19 мм неправильної форми, із зазубреними краями, з ділянками депігментації, тобто позитивними критеріями А+, В+, С+, D+. При дерматоскопічному дослідженні (рис. 2) виявлено ще додаткові ознаки меланоми: ділянки гіпер- і депігментації, «блакитна вуаль», «обрубані псевдоподії». За результатами УЗД: товщина шкіри в ділянці пігментного утворення 2,0 мм; у підключичних і надключичних ділянках збільшених ЛВ не виявлено, пахвові ЛВ розміром до 1,0 см із жировим заміщенням. Проведено скарифікаційну біопсію пігментного утворення (рис. 3), цитологічно отримано верифікацію — «невусоподібна меланома» (рис. 4). Встановлено клінічний діагноз: меланома шкіри передньої поверхні грудної клітки сТ2аN0M0, ІВ стадія. Лікування: передопераційний курс променевої терапії на пухлину (5,0 Гр протягом 5 днів), операція — широке (в межах 2 см) вирізання електроножем меланоми шкіри з пластикою рани за Лімбергом (рис. 5–8). Патогістологічний висновок від 14.07.2011 р. № 11460-1: меланома, II ступінь інвазії за Кларком, товщина за Бреслоу 1,4 мм. Заключний діагноз: меланома шкіри передньої поверхні грудної клітки рТ2аN0M0, ІВ стадія. У післяопераційний період хворий отримав курс інтерферону альфа 90 млн од. Динамічний ультразвуковий контроль регіонарних лімфатичних колекторів проводили кожні 3 міс. Через 3 роки після операції ознак ураження ЛВ та рецидиву пухлини немає (рис. 9).
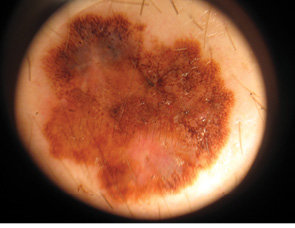
Рис. 2. Дерматоскопія пігментного утворення: асиметрія (А+), зазубреність країв (B+), ділянки гіпер- і депігментації, «блакитна вуаль» (C+), «обрубані псевдоподії». Висновок: меланома шкіри
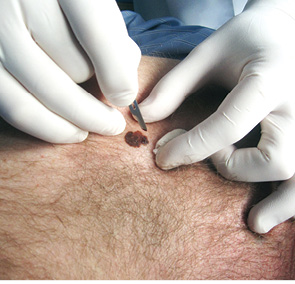
Рис. 3. Поверхнева (скарифікаційна) біопсія пігментного утворення
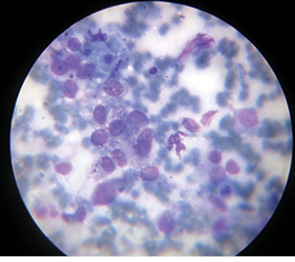
Рис. 4. Цитологічне дослідження: у центрі — скупчення клітин меланоми. Забарвлення за Романовським, ×400
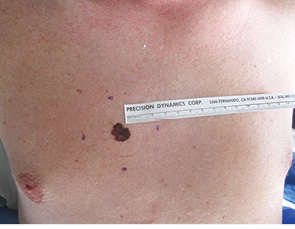
Рис. 5. Розмітка межі (2 см) хірургічного видалення меланоми
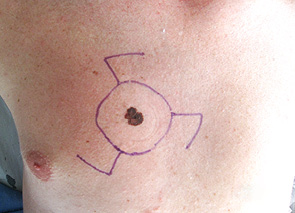
Рис. 6. Схема операції: широке видалення меланоми шкіри з пластикою післяопераційної рани за Лімбергом

Рис. 7. Товщина меланоми на розрізі операційного макропрепарату
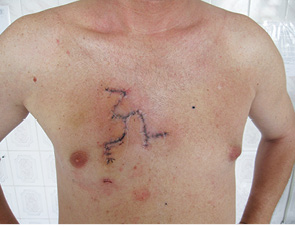
Рис. 8. Через 7 днів після операції; на швах прозорі гідрогелеві пов’язки
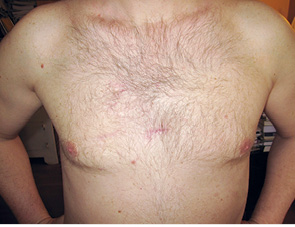
Рис. 9. Через 3 роки після операції
Результати та їх обговорення
На основі опублікованих результатів міжнародних досліджень, рекомендацій ESMO і ASCO створюється ілюзія, що межі хірургічного видалення меланоми шкіри не мають значення, адже виживаність у порівнювальних групах майже однакова [3, 6, 7, 14–15]. Таке враження складається, якщо читати лише резюме цих публікацій. Ґрунтовний аналіз повних текстів показує, що такі методологічні особливості притаманні усім дослідженням. По-перше, хворим виконували ексцизійну біопсію меланоми шкіри в межах 1–3 мм від краю пухлини під місцевою анестезією. По-друге, повторна операція — широке місцеве вирізання (wide local excision) меланоми на відстані 2,0 або 4,0 см не мала нічого спільного з меланомою з тієї простої причини, що її вже видалили 4–6–8 тиж до того. Насправді мало місце висічення лінійного рубця, який утворився після ексцизійної біопсії меланоми. Отже, якщо вирізали не меланому, а рубець, то як можна говорити про ширину резекції на 2,0 або 4,0 см саме меланоми? По-третє, при такому методологічному підході можна спрогнозувати, що результати лікування не будуть кардинально відрізнятися. Такі дані й було отримано у більшості клінічних досліджень з 1988 р. (U. Veronesi) по 2011 р. (P. Gillgren).
Постає питання: невже ніхто не усвідомлював того, що вимірювати відстань резекції потрібно від первинної пухлини in vivo, а не від її віртуального сліду — післябіопсійного рубця? Проте Американська академія дерматологів та Європейська асоціація дерматоонкологів вважають цей підхід єдино правильним і рекомендують його у своїх настановах [5, 10]. Очевидно, що онкохірурги і дерматологи по-різному оцінюють наявність меланомоподібної пухлини на шкірі пацієнта. Дерматоонкологи насамперед видаляють пігментне утворення на відстані 1–3 мм, застосовуючи місцеву анестезію (фактично, це ексцизійна біопсія). У разі патогістологічного підтвердження меланоми і визначення її товщини за Бреслоу готують пацієнта до наступного хірургічного втручання, яке полягає у широкому (на 2,0 або 4,0 см) вирізанні післябіопсійного рубця шкіри та біопсії СЛВ (див. рис. 1, б). Варто зазначити, що інтервал між першою і другою операцією може становити від 4 до 8 тиж. Зазвичай патогістолог не виявляє у свіжій рубцевій тканині ознак меланоми. Це й створює ілюзію того, що межі видалення первинної меланоми не мають значення: 2,0 або 4,0 см; 1,0 або 3,0 см [3, 6, 7, 14]. Однак у 20–35% хворих на меланому в ІІ стадії (T2b, T3a/b, T4a/b) відмічено метастатичне ураження регіонарних лімфатичних колекторів [4, 6], що й підтверджує опосередковано той факт, що ексцизійна біопсія ініціює механізми метастазування меланоми.
Так, за даними Balch та співавторів (2014), із 3044 хворих на меланому шкіри категорії Т3–T4 у 945 (31,0%) виявлено метастатичні СЛВ. У пацієнтів віком 30–60 років при пухлинах Т3а позитивні СЛВ реєстрували у 20%, а при Т4b — у 48% випадків. П’ятирічна виживаність хворих віком 40–60 років з пухлинним процесом у ІІ клінічній стадії становила 68%.
Скандинавське рандомізоване клінічне дослідження [6] з метою порівняння 2- і 4-сантиметрового вирізання післябіопсійного рубця показало такі результати при середній товщині меланоми 3,1 мм і стадії ІІА–ІІС. У групі 465 хворих з «вузьким» (2 см) висіченням меланоми протягом періоду спостереження метастатичне ураження регіонарних ЛВ виявлено у 100 (21,5%) пацієнтів, місцевий рецидив — у 20 (4,3%), а проміжні метастази — у 19 (4,1%). Серед 471 хворого з «широким» (4 см) вирізанням меланоми аналогічна статистика: 114 (24,2%), 9 (1,9%) і 15 (3,2%) випадків відповідно. При цьому нодулярну форму росту меланоми діагностовано у 53,0% пацієнтів, а загальна 5-річна виживаність становила 65,0% в обох групах.
Після зіставлення онкохірургічного і дерматологічного підходів виникають такі запитання:
1. Чому не вимірюють сонографічно товщину меланоми ще до операції, застосовуючи сучасне ультразвукове обладнання (20 МГц), водночас визначаючи межі резекції пухлини?
2. Чому не використовують цитологічне дослідження для верифікації первинної меланоми? Адже цитологічна служба розвинута в Україні й представлена у кожному онкодиспансері.
3. Що ми виграємо при онкохірургічному підході (?):
- перша операція стає радикальним хірургічним втручанням при первинній меланомі шкіри;
- запобігання ятрогенній дисемінації злоякісних клітин у регіонарні ЛВ завдяки невиконанню ексцизійної біопсії під місцевою анестезією;
- скорочується час встановлення заключного діагнозу до 7–10 днів (замість 4–8 тиж).
Однак справедливо постає ще одне питання: а як же біопсія СЛВ, яку вважають стандартом у стадіюванні первинної меланоми? Відповідь така: нині ретельний ультразвуковий моніторинг зони регіонарного лімфатичного колектора дозволяє вчасно діагностувати метастатичне переродження 1–2 ЛВ ще на доклінічній стадії. Це і буде показанням до регіонарної лімфаденектомії. У клініках, оснащених позитронно-емісійними томографами, зміни в ЛВ, виявлені на підставі УЗД, доцільно підтвердити за допомогою ПЕТ напередодні операції.
Прийнятність такої діагностично-лікувальної тактики виходить з того, що поки не встановлено істотної переваги у виживаності тих хворих, яким було виконано регіонарну лімфаденектомію на основі мікроскопічного метастатичного ураження СЛВ, порівняно з групою спостереження, яким виконували відстрочену терапевтичну лімфаденектомією [9, 13].
Таким чином, проведене зіставлення діагностично-лікувальних алгоритмів у хворих на меланому шкіри показало, що з клінічної точки зору онкохірургічний підхід є логічним, доцільним та ефективним і відображає традиції вітчизняної онкологічної школи.
Висновки
Діагностику первинних хворих на меланому шкіри слід проводити за таким алгоритмом: дерматоскопія, in vivo УЗД товщини та об’єму пухлини, цитологічна верифікація діагнозу, — все це надає підстави для встановлення меж хірургічного видалення меланоми.
Хірургічний етап лікування має складатися з одномоментної радикальної онкопластичної операції — широкого вирізання меланоми шкіри з пластикою операційної рани.
На етапі диспансерного спостереження хворому необхідно проводити ультразвуковий моніторинг регіонарного лімфатичного колектора і при виявленні ознак його метастатичного ураження вирішувати питання щодо лімфаденектомії.
Список використаної літератури
1. Коровин С.И. (2010) Хирургическое лечение при первичном очаге меланомы кожи. Онкологія, 12 (1): 90–92.
2. Стандарти діагностики і лікування онкологічних хворих (2008). Онкологія, 10 (№1 додаток): 80 с.
3. Balch C.M., Soong S.J., Smith T. et al. (2001) Long-term results of a prospective surgical trial comparing 2 cm vs. 4 cm excision margins for 740 patients with 1–4 mm melanomas. Ann.Surg. Oncol.; 8: 101–108.
4. Balch C.M., Thompson J.F., Gershenwald J.E., et al. (2014) Age as predictor of sentinel node metastasis among patients with localized melanoma: an inverse correlation of melanoma mortality and incidence of sentinel node metastasis among young and old patients. Ann. Surg. Oncol., 21 (4): 1075–1081.
5. Garbe C., Peris K., Hauschild A. et al. (2010) Diagnosis and treatment of melanoma: European consensus-based interdisciplinary guideline. Eur. J. Cancer, 46: 270–283.
6. Gillgren P., Drzewiecki K.T., Niin M. et al. (2011) 2-cm versus 4-cm surgical excision margins for primary cutaneous melanoma thicker than 2 mm: a randomised, multicentre trial. Lancet, 378: 1635–1642.
7. Khayat D., Rixe O., Martin G. et al. (2003) Surgical margins in cutaneous melanoma (2 cm versus 5 cm for lesions measuring less than 2.1-mm thick). Cancer, 97: 1941–1946.
8. Lens M.B., Nathan P., Bataille V. (2007) Excision margins for primary cutaneous melanoma: updated pooled analysis of randomized controlled trials. Arch. Surg.,142: 885–891.
9. Morton D.L., Thompson J.F., Cochran A.J. et al. (2006) Sentinel-node biopsy or nodal observation in melanoma. N. Engl. J. Med., 355 (13): 1307–1317.
10. NCCN Guidelines. Version 3.2012 Updates. Melanoma // http://www.nccn.org.
11. Testori А., Rutkowski P., Marsden J. et al. (2009) Surgery and radiotherapy in the treatment of cutaneous melanoma. Ann. Oncol., 20 (Suppl. 6): vi22–vi29.
12. Thomas J.M., Newton-Bishop J., A’Hern R. et al. (2004) Excision margins in high-risk malignant melanoma. N. Engl. J. Med., 350: 757–766.
13. van der Ploeg A.P., Haydu L.E., Spillane A.J. et al. (2014) Outcome following sentinel node biopsy plus wide local excision versus wide local excision only for primary cutaneous melanoma. Analysis of 5840 Patients Treated at a Single Institution. Ann. Surg., 260(1): 149–157.
14. Veronesi U., Cascinelli N., Adamus J. et al. (1988) Thin stage I primary cutaneous malignant melanoma. Comparison of excision with margins of 1 or 3 cm. N. Engl. J. Med., 318: 1159–1162.
15. Wong J.Y., Sondak V.K. (2012) Unanswered questions about margin recommendations for primary cutaneous melanoma. J. Nat. Compr. Cancer Netw., 10 (3): 357–365.
Онкохирургический и дерматологический подходы к диагностике и лечебной тактике у больных меланомой кожи
Тернопольский государственный медицинский университет им. И.Я. Горбачевского
КУТОС «Тернопольский областной клинический онкологический диспансер»
Резюме. В статье описаны и критически проанализированы онкохирургический (отечественный) и дерматологический (западноевропейский) алгоритмы лечения больных меланомой кожи. Методика онкохирургического подхода заключается в комплексной предоперационной диагностике, которая включает клинический осмотр, дерматоскопию, ультразвуковое измерение толщины и объема меланомоподобной опухоли, цитологическую верификацию. После установления диагноза выполняют радикальную операцию — широкое иссечение меланомы кожи. Дерматологический подход состоит из таких этапов: клинический осмотр, дерматоскопия, эксцизионная биопсия меланомоподобного образования. После гистологической верификации меланомы осуществляют повторную операцию — радикальное иссечение послебиопсийного рубца кожи и диагностическое удаление сторожевого лимфатического узла. Гистологически в свежей рубцовой ткани признаков меланомы не выявляют, что и создает иллюзию того, что границы удаления меланомы не имеют значения. При этом почти у четверти больных отмечено метастатическое поражение лимфатических коллекторов, что свидетельствует о том, что эксцизионная биопсия инициирует механизмы метастазирования меланомы. Проведенное сравнение диагностических и лечебных алгоритмов показало целесообразность с клинической точки зрения одномоментного радикального удаления меланомы по сравнению с двухэтапным хирургическим вмешательством.
меланома кожи, диагностический алгоритм, хирургическое лечение.














Leave a comment