Локальна імунна відповідь у хворих на меланому шкіри: зв’язок з ефективністю інтерферонотерапії
Фильчаков Ф.В., Грабовой А.Н., Лён А.Д., Кукушкина С.Н., Коровин С.И., Кукушкина М.Н., Весельская В.Н., Таран Л.Н.
Резюме. За допомогою імуногістохімічного методу вивчено фенотипічні особливості лімфоцитів, що інфільтрують первинну меланому шкіри, у 12 пацієнтів із IB–IIC стадією захворювання. Показано, що клітини запального інфільтрату експресують CD3-, CD8-, CD45RA-, CD45RO- та CD20-антигени. У всіх випадках клітини лімфоїдного інфільтрату в стромі та паренхімі були представлені Т-лімфоцитами (CD3) і тільки в 3 із 12 випадків, крім CD3-клітин, виявлено В-лімфоцити (CD20). Усі Т-лімфоцити експресували виключно корецептор CD8, що дозволило віднести їх до субпопуляції цитотоксичних Т-лімфоцитів. Більшість цитотоксичних Т-лімфоцитів локалізувалися у стромі пухлини і були представлені як наївними Т-клітинами (CD45RA), так і клітинами імунологічної пам’яті (CD45RO). При ретроспективному аналізі, проведеному залежно від ефективності ад’ювантної інтерферонотерапії (ІФН-терапії), встановлено, що у хворих зі сприятливим перебігом захворювання, на відміну від пацієнтів із рецидивом меланоми шкіри, який розвинувся у 4 з 12 пацієнтів протягом першого року після видалення первинної пухлини, реєструється більш виражена інфільтрація строми пухлини CD45RO-клітинами, а паренхіми — CD8-лімфоцитами. Отримані результати відкривають нові можливості застосування імунологічних параметрів у прогнозуванні відповіді на ІФН-терапію у хворих на первинно-локалізовану меланому шкіри.
Резюме. При помощи иммуногистохимического метода изучены фенотипические особенности лимфоцитов, инфильтрирующих первичную меланому кожи, у 12 пациентов с IB–IIC стадией заболевания. Показано, что клетки воспалительного инфильтрата экспрессируют CD3-, CD8-, CD45RA-, CD45RO- и CD20-антигены. Во всех случаях клетки лимфоидного инфильтрата в строме и паренхиме были представлены Т-лимфоцитами (CD3+) и только в 3 из 12 случаев, помимо CD3+-клеток, выявлены В-лимфоциты (CD20+). Все Т-лимфоциты экспрессировали исключительно корецептор CD8, что позволило отнести их к субпопуляции цитотоксических Т-лимфоцитов. Большинство цитотоксических Т-лимфоцитов локализовались в строме опухоли и были представлены как наивными Т-клетками (CD45RA+), так и клетками иммунологической памяти (CD45RO+). При ретроспективном анализе, проведенном в зависимости от эффективности адъювантной интерферонотерапии (ИФН-терапии), установлено, что у больных с благоприятным течением заболевания, в отличие от пациентов с рецидивом меланомы кожи, развившимся у 4 из 12 пациентов в течение первого года после иссечения первичной опухоли, регистрируется более выраженная инфильтрация стромы опухоли CD45RO+-клетками, а паренхимы — CD8+-лимфоцитами. Полученные результаты открывают новые возможности применения иммунологических параметров в прогнозировании ответа на ИФН-терапию у больных первично-локализованной меланомой кожи.
Введение
Предположения о ведущей роли иммунологических механизмов в регрессии меланомы кожи, косвенным свидетельством которых является выраженная лимфоидно-клеточная инфильтрация первичной опухоли, ученые высказывали достаточно давно [1–3]. В частности, показано, что рецидив заболевания реже развивается у пациентов с выраженной местной лимфоидно-плазмоцитарной реакцией в строме опухоли, выявляемой в 37% случаев первично-локализованной меланомы кожи [2]. В исследовании C.G. Clemente и соавторов [3], проведенном на большом клиническом материале, установлено, что лимфоидно-клеточная инфильтрация первичной меланомы кожи является независимым благоприятным прогностическим фактором.
В настоящее время признано, что доминирующая клеточная популяция воспалительного инфильтрата в строме меланомы кожи представлена Т-лимфоцитами, и наличие CD8-клеток в ее паренхиме является важным прогностическим критерием лучшей выживаемости больных [4]. Однако является ли этот факт свидетельством элиминации опухолевых клеток или признаком торможения роста опухоли — вопрос дискуссионный.
В дальнейшем продемонстрировано, что не только первичная опухоль, но и вторичные метастатические поражения несут свидетельства иммунологического контроля их роста. На основании анализа транскрипционного профиля генов врожденного и адаптивного иммунного ответа удалось выделить варианты метастазов меланомы кожи с иммунологически активным и неактивным («бессимптомным») фенотипами [5–7].
Исследование биоптатов метастатических поражений у этих больных в динамике иммунотерапии показало переход профиля транскрипционных факторов от иммунологически неактивного к активному [6]. Авторы цитируемой работы высказали предположение, что на поздних стадиях заболевания экспрессия дифференцировочных антигенов меланомы обусловлена активацией иммуносвязанных транскрипционных факторов, поддерживающих дедифференцировку опухолевых клеток [7]. Выявление интерферон-регулирующего фактора 1 (IRF-1) в этих образцах коррелировало с лучшей выживаемостью больных [8, 9]. Кроме того, в опухолях пациентов, ответивших на иммунотерапию, выявлены признаки развития выраженной воспалительной реакции на фоне активации интерферон-стимулирующих генов (ISGs) и индукции γ-интерферона (γ-ИФН). Привлечение Т-лимфоцитов в очаг воспаления обусловлено продукцией хемокинов, что, в свою очередь, коррелирует с интенсивной инфильтрацией паренхимы опухоли CD8 Т-лимфоцитами [10].
Таким образом, по мнению большинства исследователей, лимфоидно-клеточная инфильтрация и/или индукция транскрипционных факторов генов иммунного ответа свидетельствует об активации противоопухолевой иммунной защиты, что коррелирует с благоприятным прогнозом у больных меланомой кожи.
Этим аспектам взаимоотношений опухоли и организма с учетом системных иммунных реакций в настоящее время уделяется особое внимание, что связано с полученными данными о прогностической ценности различных иммунологических параметров у больных злокачественными новообразованиями и разработкой стандартизованных подходов к их определению [11–13]. В связи с этим обсуждается возможность включения иммунологических критериев в параметры стадирования онкологических заболеваний [14, 15] и применения в ряде случаев иммунозависимых критериев (irRC) при оценке результатов иммунотерапии [14].
Статья посвящена изучению при помощи иммуногистохимического (ИГХ) метода локализации лимфоцитов, их фенотипических характеристик и выраженности инфильтрации ткани первичной опухоли с целью уточнения прогностической ценности этих показателей при проведении адъювантной ИФН-терапии у больных первично-локализованной меланомой кожи.
Объект и методы исследования
В исследование включено 12 больных меланомой кожи ІВ–ІІС стадии (средний возраст 57,7±3,7 года), находившихся на лечении в отделении опухолей кожи и мягких тканей Национального института рака в 2009–2012 гг. Пациенты получали стандартную терапию, включающую хирургическое лечение (широкое иссечение первичной опухоли) и адъювантную α-ИФН-терапию (α-2b-ИФН подкожно по 3 млн МЕ 3 раза в неделю в течение 12 мес). Возникновение рецидива на протяжении первого года после удаления первичной опухоли расценивали в данном исследовании как неблагоприятное течение заболевания, соответственно, отсутствие рецидива — как благоприятное. Все больные дали информированное согласие на участие в исследовании, одобренное локальной Комиссией по вопросам этики.
Характеристика больных в зависимости от пола, возраста, локализации и патогистологических особенностей первичной меланомы (средняя толщина опухоли по Breslow 3,1±0,4 мм) с учетом течения заболевания представлена в таблице.
Таблица. Характеристика больных
| Показатели | Количество больных (с благоприятным/неблагоприятным течением заболевания) | |
| Пол | Женский | 8 (5/3) |
| Мужской | 4 (3/1) | |
| Возраст, лет | 31–50 | 3 (1/2) |
| >50 | 9 (7/2) | |
| Локализация опухоли | Конечности | 7 (4/3) |
| Туловище | 5 (4/1) | |
| Гистологический тип опухоли | Эпителиоидный | 8 (4/4) |
| Веретеноклеточный | 1 (1/0) | |
| Смешанный | 3 (3/0) | |
| Изъязвление опухоли | Есть | 8 (4/4) |
| Нет | 4 (4/0) | |
| Толщина опухоли по Breslow, мм | 1,1–2,0 | 2 (1/1) |
| 2,1–4,0 | 8 (7/1) | |
| >4,0 | 2 (0/2) | |
| Всего больных | 12 (8/4) | |
ИГХ исследование первичной опухоли проведено на материале, полученном при хирургическом лечении больных. Операционный материал фиксировали в забуференном 10% растворе формалина (pH 7,4) и уплотняли в парапласт с применением гистиопроцессора Histos-5 («Milestone», Италия). Из парафиновых блоков изготовляли гистологические срезы толщиной 5 мкм с помощью микротома Microm НМ325 («Thermo Scientific», Германия). Для общей оценки новообразований срезы окрашивали гематоксилином и эозином.
ИГХ реакции проводили с антителами против антигенов человека: поликлональным CD3, моноклональными CD8 (сlone C8/144B), CD4 (сlone 4B12), CD20cy (сlone L26), CD56 (сlone 123C3), CD45RO (сlone UCHL1) («Dako», Дания) в соответствии с рекомендациями производителя, а также CD45RA (сlone ALB11) («Beckman Coulter», США), HLA-DR (сlone G46-6 (L243)), CD25 (сlone M-A251), CD95 (сlone DX2) («Becton Dickinson», США).
Для визуализации продуктов ИГХ реакции применяли систему детекции EnVision™ FLEX («Dako», Дания) с использованием в качестве хромогена 3-амино-9-этилкарбазола (Mono AEC; «DBS», США). Срезы докрашивали гематоксилином Gill. В качестве положительного контроля использовали тканевые образцы с определенной положительной реактивностью, а для отрицательного контроля проводили процедуру без применения первичных антител.
Полученные препараты изучали и фотографировали при помощи микроскопа Nikon Eclipse 80i с камерой DS-5SMc/L2. Оценку содержания меченых клеток в препаратах производили полуколичественно: «0» — отсутствие, «1+» — единичные клетки, «2+» — 10–30 клеток, «3+» — более 30 клеток в поле зрения, выражая результаты в условных единицах от 0 до 3.
Статистическую обработку полученных данных проводили с использованием программ Excel (MS Office 2003, XP) и Statіstіca 6.0 («StatSoft Inc.», США). Результаты исследования представляли в виде медианы с минимальным и максимальным значениями. Для определения достоверности различий показателей в группах использовали критерий Манна — Уитни. Различия оценивали как достоверные при р<0,05.
Результаты и их обсуждение
Среди изученных лейкоцитарных антигенов (CD3, CD8, CD4, CD20, CD56, CD45RA, CD45RO, CD95, CD25, HLA-DR) в процессе ИГХ выявления признаков иммунного воспаления в ткани первичной меланомы кожи была подтверждена экспрессия только пяти (CD3, CD8, CD45RA, CD45RO, CD20) (рис. 1).
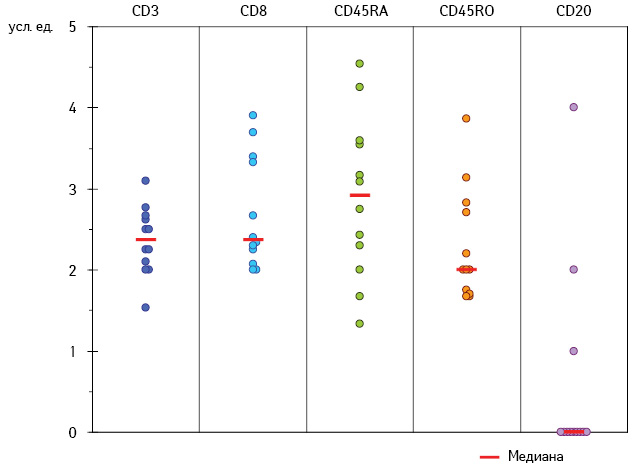
Как свидетельствуют данные рис. 1, во всех случаях клетки лимфоидного инфильтрата в строме и паренхиме меланомы были представлены Т-лимфоцитами (CD3) и только у 3 из 12 пациентов, помимо CD3-клеток, выявлены В-лимфоциты (CD20). Кроме того, все Т-лимфоциты экспрессировали исключительно корецептор CD8, что позволило отнести эти клетки к субпопуляции цитотоксических Т-лимфоцитов (ЦТЛ). Большинство ЦТЛ локализовались в строме опухоли (соответственно 2,10 (1,25; 2,50) против 0,62 (0; 1,40) усл. ед. в ее паренхиме; p<0,05). При этом инфильтрация паренхимы меланомы CD8-лимфоцитами выявлена у 9 из 12 пациентов.
Субпопуляция CD8 Т-лимфоцитов была представлена как наивными Т-клетками, экспрессирующими изоформу тирозинфосфатазы CD45RA, так и клетками иммунологической памяти (CD45RO). При детальном анализе оказалось, что в строме опухоли во всех изученных случаях присутствуют и наивные CD8-лимфоциты, и клетки иммунологической памяти (соответственно 2,28 (1,33; 2,88) и 2,00 (1,67; 2,86) усл. ед.).
Напротив, паренхима меланомы в 8 из 12 случаев инфильтрирована CD45RA-лимфоцитами, тогда как CD45RO-клетки выявлены только у 4 из 12 пациентов (соответственно 0,57 (0; 2,00) и 0 (0; 1,00) усл. ед). Важно то, что в этих 4 случаях отмечены как CD45RA-, так и CD45RO-клетки, что не исключает экспрессию обеих изоформ тирозинфосфатазы на CD8 Т-лимфоцитах иммунного воспаления при первичной меланоме кожи.
Полученные результаты не противоречат ранее описанным данным [3, 6, 9], свидетельствующим о преобладании CD8-лимфоцитов среди клеток лимфоидного инфильтрата в ткани первичной меланомы кожи. Идентификация фенотипических различий этих клеток позволяет предположить, что формирование местных противоопухолевых иммунных реакций может происходить не только за счет активации наивных ЦТЛ в микроокружении опухоли с последующей инфильтрацией ее паренхимы, но и генерации меланомаспецифических ЦТЛ из эффекторных Т-клеток иммунологической памяти.
В настоящее время инфильтрация первичной опухоли CD845RO-лимфоцитами рассматривается при некоторых злокачественных новообразованиях как один из важнейших прогностических признаков, ассоциированный с благоприятным течением заболевания [8, 9, 13].
Нами проведен ретроспективный анализ экспрессии наиболее информативных лейкоцитарных антигенов, описанных выше, в ткани первичной меланомы кожи в зависимости от эффективности ИФН-терапии в адъювантном режиме у этих больных. Учитывая, что в условиях применения α-ИФН в течение первого года после иссечения первичной меланомы кожи прогрессирование заболевания зарегистрировано у 4 из 12 пациентов, для анализа данных сформированы две группы — с благоприятным и неблагоприятным течением заболевания (рис. 2).
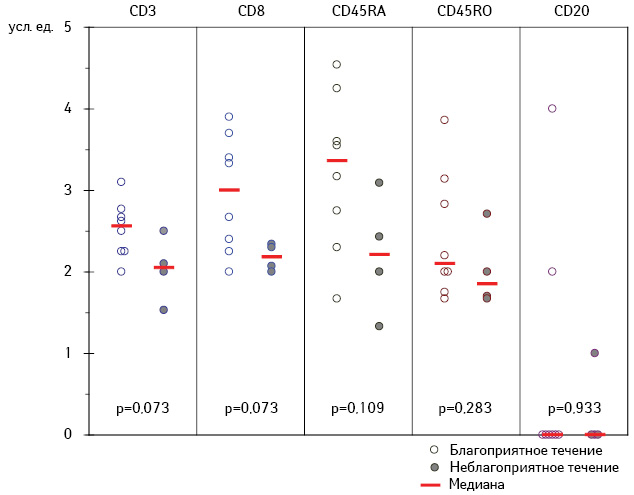
Как видно из данных, представленных на рис. 2, интенсивность инфильтрации (суммарная доля окрашенных клеток в строме и паренхиме опухоли) первичной меланомы кожи различными популяциями лимфоцитов (CD3-, CD8-, CD45RA-, CD45RO- и CD20-клетками) у пациентов с благоприятным и неблагоприятным течением заболевания на фоне ИФН-терапии существенно не отличается (p>0,05).
Обращает внимание выраженная тенденция к увеличению доли CD8- и CD45RA-клеток в воспалительном инфильтрате у больных с благоприятным течением заболевания (рис. 3), а также малая доля и, соответственно, низкая информативность выявления В-лимфоцитов в контексте их прогностической ценности при первичной меланоме кожи.
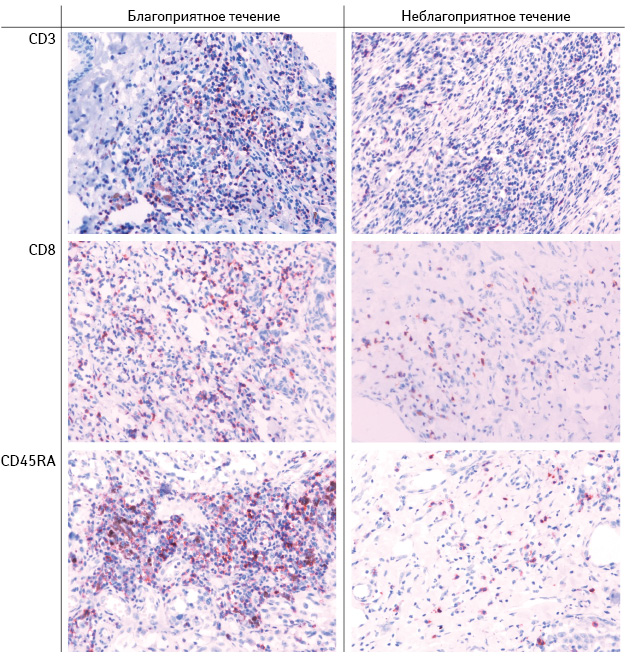
Поэтому проведен анализ субпопуляционного состава Т-лимфоцитов, инфильтрирующих отдельно строму или паренхиму первичной опухоли. Оказалось, что у больных с благоприятным течением заболевания, в отличие от пациентов с прогрессированием меланомы кожи более выражена инфильтрация стромы опухоли CD45RO-клетками (соответственно 2,10 (1,67; 2,86) и 1,85 (1,67; 2,00) усл. ед.; p<0,05), а паренхимы — CD8-лимфоцитами (соответственно 1,0 (0; 1,4) и 0,07 (0; 0,57) усл. ед.; p<0,05).
Эти результаты свидетельствуют о том, что увеличение доли ЦТЛ и/или эффекторных Т-клеток памяти среди лимфоцитов иммунного воспаления у больных первично-локализованной меланомой кожи связано с благоприятным течением заболевания на фоне адъювантной ИФН-терапии.
Можно предположить, что клетки иммунологической памяти, сенсибилизированные к антигенам меланомы на ранних стадиях опухолевого роста, способны формировать местный противоопухолевый иммунный ответ, играющий ключевую роль в предотвращении рецидива заболевания. Клиническое значение иммунологического феномена накопления CD8- и CD45RO-клеток в ткани опухоли установлено ранее при других злокачественных новообразованиях [9, 13, 16].
С другой стороны, известно, что подавление противоопухолевых функций у ЦТЛ одного клона в микроокружении опухоли за счет механизмов иммуносупрессии [17] приводит к возникновению условий формирования эффекторов других клонов, в частности, в результате активации наивных Т-лимфоцитов [18–20]. Этим можно пояснить повышенное содержание CD45RА-клеток в опухоли у большинства обследованных больных, что, по-видимому, предопределяет благоприятное течение заболевания у пациентов с высоким содержанием CD8-клеток в паренхиме меланомы кожи.
В дополнение к полученным результатам можно привести описанные нами ранее [21] клинико-лабораторные критерии прогноза прогрессирования заболевания у больных первично-локализованной меланомой кожи, основанные на выявлении изменения показателей системного иммунитета при проведении адъювантной ИФН-терапии. По-нашему мнению, эти иммунологические критерии в сочетании с оценкой локального противоопухолевого иммунного ответа помогут определить индивидуальные особенности течения заболевания, прогнозировать реакцию организма на иммунотерапию и таким образом оптимизировать тактику лечения этой категории больных.
Дальнейшее развитие и усовершенствование этого подхода к прогнозированию течения заболевания у пациентов со злокачественными новообразованиями связано с гармонизацией в лабораторной диагностике. На этом пути важно преодолеть неизбежные сложности, обусловленные использованием в лабораториях разных реагентов, особенностями качественного и полуколичественного учета выраженности лимфоидно-клеточного инфильтрата, а также разными критериями выбора его локализации в ткани опухоли.
Разработка стандартного лабораторного протокола будет способствовать широкому внедрению иммунологических критериев в лабораторно-диагностический комплекс в онкологии.
Список использованной литературы
1. Lloyd O.C. (1969) Regression of malignant melanoma as a manifestation of a cellular immunity response. Proc. R. Soc. Med., 62: 543–545.
2. Cochran A.J. (1969) Histology and prognosis in malignant melanoma. J. Pathol., 97: 459–468.
3. Clemente C.G., Mihm M.C.J., Bufalino R. et al. (1996) Prognostic value of tumor infiltrating lymphocytes in the vertical growth phase of primary cutaneous melanoma. Cancer, 77: 1303–1310.
4. Bindea G., Mlecnik B., Fridman W.H. et al. (2011) The prognostic impact of anti-cancer immune response: a novel classification of cancer patients. Semin. Immunopathol., 33: 335–340.
5. Marincola F.M., Wang E., Herlyn M. et al. (2003) Tumors as elusive targets of T cell-based active immunotherapy. Trends Immunol., 24: 335–342.
6. Wang E., Miller L.D., Ohnmacht G.A. et al. (2002) Prospective molecular profiling of subcutaneous melanoma metastases suggests classifiers of immune responsiveness. Cancer Res., 62: 3581–3586.
7. Wang E., Panelli M.C., Zavaglia K. et al. (2004) Melanoma-restricted genes. J. Transl. Med., 2: 34–40.
8. Galon J., Costes A., Sanchez-Cabo F. et al. (2006) Type, density and location of immune cells within human colorectal tumors predict clinical outcome. Science, 313: 1960–1964.
9. Ascierto M.L., De Giorgi V., Liu Q. et al. (2011) An immunologic portrait of cancer. J. Translat. Med., 9: 146–159.
10. Harlin H., Meng Y., Peterson A.C. et al. (2009) Chemokine expression in melanoma metastases associated with CD8+ T-cell recruitment. Cancer Res., 69: 3077–3085.
11. Fox B.A., Schendel D.J., Butterfield L.H. et al. (2011) Defining the critical hundles in cancer immunotherapy. J. Translat. Med., 9: 214–253.
12. Bindea G., Mlecnik B., Fridman W.H. et al. (2010) Natural immunity to cancer in humans. Curr. Opin. Immunol., 22: 215–222.
13. Pages F., Galon J., Dieu-Nosjean M.C. et al. (2010) Immune infiltration in human tumors: a prognostic factor that should not be ignored. Oncogene, 29: 1093–1102.
14. Wolchok J.D., Hoos A., O’Day S.,et al. (2009) Guidelines for the evaluation of immune therapy activity in solid tumors: immune-related response criteria. Clin. Cancer Res., 15(23): 7412–7420.
15. Mlecnik B., Bindea G., Pages F.et al. (2011) Tumor immunosurveillance in human cancers. Cancer Metastasis Rev., 30: 5–12.
16. Pages F., Kirilovsky A., Mlecnik B. et al. (2009) In situ cytotoxic and memory T cells predict outcome in patients with early-stage colorectal cancer. J. Clin. Oncol., 27: 5944–5951.
17. Wieërs G., Demotte N., Godelaine D. et al. (2011) Immune suppression in tumors as a surmountable obstacle to clinical efficacy of cancer vaccines. Cancers, 3: 2904–2954.
18. Lurquin C., Lethé B., Corbière V. et al. (2005) Contrasting frequencies of anti-tumor and anti-vaccine T cells in metastases of a melanoma patient vaccinated with a MAGE tumor antigen. J. Exp. Med., 201: 249–257.
19. Carrasco J., Van Pel A., Neyns B. et al. (2008) Vaccination of a melanoma patient with mature dendritic cells pulsed with MAGE-3 peptides triggers the activity of nonvaccine anti-tumor cells. J. Immunol., 180: 3585–3593.
20. Corbière V., Chapiro J., Stroobant V. et al. (2011) Antigen spreading contributes to MAGE vaccination-induced regression of melanoma metastases. Cancer Res., 71: 1253–1262.
21. Фільчаков Ф.В., Шуміліна К.С., Кукушкіна С.М. та ін. (2012) Імунологічні критерії прогнозу ефективності ад’ювантної інтерферонотерапії хворих на первинно-локалізовану меланому шкіри. Клин. онкол., 8(4): 120–125.
Адрес:
Фильчаков Феодосий Викторович
03022, Киев, ул. Ломоносова, 33/43
Национальный институт рака
Тел.: (044) 259-01-84
E-mail: labklimmun@i.ua















Leave a comment