Лікування хворих на генералізовану меланому шкіри: сучасні підходи та перспективи
Кукушкина М.Н., Коровин С.И., Паливец А.Ю., Остафийчук В.В., Бойчук С.И.
Резюме. У статті представлено сучасні підходи до терапії при генералізованій меланомі шкіри та проаналізовано дані останніх клінічних досліджень, що дозволили істотно поліпшити результати лікування.
Резюме. В статье представлены современные подходы к терапии при генерализованной меланоме кожи и проанализированы данные последних клинических исследований, позволивших существенно улучшить результаты лечения.

По данным Национального канцер-регистра, в 2012 г. в Украине выявлено 3289 новых случаев меланомы кожи (МК). При этом у 2,8% пациентов на момент установления диагноза отмечено IV стадию заболевания, а почти у 45% — ІІ и ІІІ стадии, при которых вероятность прогрессирования крайне высока [1].
Прогноз при наличии отдаленных метастазов крайне неблагоприятный: общая 1-летняя выживаемость при метастазах в коже, подкожной клетчатке и нерегионарных лимфатических узлах, что соответствует критерию М1а по классификации American Joint Committee on Cancer (AJCC), составляет 62%, при метастазах в легких (M1b) — 53%; при других висцеральных метастазах либо при повышении уровня лактатдегидрогеназы (М1с) — 33% [2].
Несмотря на длинный исторический путь развития, лечение при генерализованной МК до настоящего времени остается открытой проблемой.
Хирургическое лечение
Хирургический метод — один из самых эффективных способов лечения пациентов с генерализованной МК. Показаниями к его применению являются:
- солитарные метастазы во внутренних органах;
- солитарные метастазы в коже и мягких тканях при отсутствии поражения внутренних органов;
- костные метастазы, не чувствительные к лучевой терапии, либо угроза патологического перелома;
- состояния, угрожающие жизни пациента (кишечная непроходимость, кровотечение);
- симптоматические метастазы диаметром >3,5 см в головном мозгу.
Доказанными предикторами успешного оперативного лечения являются длительное время до наступления прогрессирования заболевания, отсутствие висцеральных метастазов, поражение не более 1–2 органов [3]. Преимущество хирургического лечения по сравнению с системной терапией заключается в возможности гистологического подтверждения диагноза, незначительной токсичности, невысокой стоимости; кроме того, доказана целесообразность применения хирургического лечения у больных, получающих таргетную терапию, в случае прогрессирования в пределах одного органа [4].
Примером эффективности хирургического лечения при МК может служить исследование SWOG-9430, в рамках которого 77 больным генерализованной МК выполняли радикальное хирургическое вмешательство. По данным авторов, общая 3-летняя выживаемость составила 36%, общая 4-летняя — 31%, общая 7-летняя — 15%, хотя медиана безрецидивной выживаемости достигла только 6 мес [5].
В 2011 г. J.A. Sosman опубликовал результаты хирургического лечения 64 больных МК IV стадии. Медиана продолжительности жизни составила 21 мес, 4-летняя общая выживаемость — 31%, а 4-летняя безрецидивная — 13%, при этом у ⅔ больных отмечено прогрессирование заболевания в течение 1 года жизни после радикального оперативного вмешательства. Таким образом, по мнению автора, хирургический метод остается актуальным при лечении пациентов с МК IV стадии. При использовании данного метода требуются оценка динамики роста опухоли и тщательный отбор больных [6].
Химиотерапевтическое лечение
Возможности хирургического метода остаются весьма ограниченными ввиду частой диссеминации заболевания и поражения жизненно важных органов. В связи с этим на протяжении многих лет единственным методом лечения при генерализованной МК оставалась системная химиотерапия, золотым стандартом которой является дакарбазин. В первых клинических исследованиях, проведенных в 70-х годах прошлого столетия, авторами задекларированы относительно хорошие результаты лечения (25–30% объективных ответов), однако в дальнейших рандомизированных исследованиях показано, что эффективность дакарбазина не превышает 10–12% [7].
На протяжении последующих лет велись непрерывные поиски новых медикаментозных средств и их комбинаций. Широко применяли различные схемы полихимиотерапии с цитокинами и гормональными препаратами. Одной из самых интересных разработок стал так называемый Дартмутский режим (Dartmouth regimen). В пилотном исследовании комбинация четырех препаратов — цисплатина, кармустина, дакарбазина (DTIC), тамоксифена (CDBT) — вызывала 46% ответов опухоли. Однако в рандомизированном исследовании III фазы (1999 г.) эти данные не были воспроизведены. Количество ответов монотерапии DTIC составило 10,2%, CDBT — 18,5%. Медиана выживаемости оказалась практически одинаковой (7 мес), при этом токсичность комбинированного режима была значительно выше [8].
Другим химиотерапевтическим агентом, применявшимся в качестве первой линии терапии, стал темозоломид, родственный дакарбазину по химической структуре и механизму действия. Его важным преимуществом стала возможность проникновения через гематоэнцефалический барьер, а также удобство применения в виде пероральной формы. Однако эффективность лечения темозоломидом оказалась сопоставимой с дакарбазином, за исключением случаев поражения головного мозга [7].
Прорыв в лечении больных генерализованной МК произошел в 2011 г., когда FDA (Food and Drug Administration) были одобрены сразу 2 препарата для лечения заболевания в IV стадии: ингибитор BRAF-мутации вемурафениб и блокатор анти-CTLA4 ипилимумаб. 2013 год ознаменовался одобрением BRAF-ингибитора дабрафениба и МЕК-ингибитора траметиниба, а 2014 год — регистрацией анти-PD1 пембролизумаба.
Таргетная терапия
Основанием для разработки ингибиторов BRAF-мутации являлось наличие данного вида мутации у 50% больных МК, что приводит к активации митоген-активированного протеинкиназного пути (МАПК), регулирующего клеточную пролиферацию, выживаемость, миграцию и ангиогенез (рис. 1). Молекулярные альтерации в генах, кодирующих ключевые компоненты пути (так называемые BRAF- и NRAS-мутации) либо вышележащих альтераций рецепторов клеточной поверхности (так называемые KIT), приводят к неконтролируемой клеточной пролиферации и нарушению апоптоза [9].
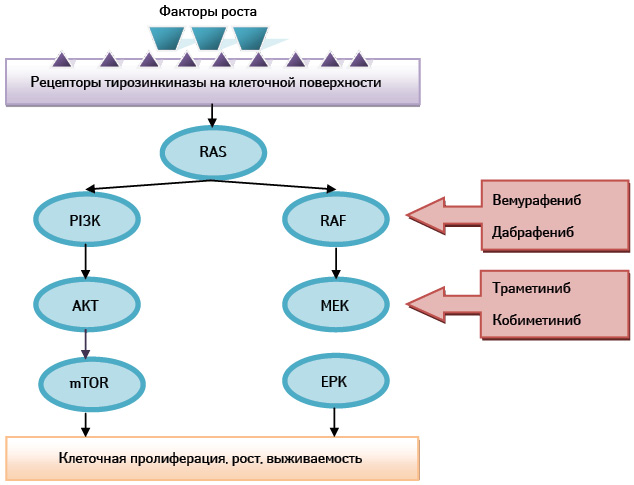
Частота распространенности BRAF-мутаций обратно пропорциональна возрасту пациентов. Чаще всего мутации выявляются в экзоне 15 кодоне 600 (V600) и в 75% случаев характеризуются заменой валина глутамином (V600Е). К более редким мутациям относят V600К (замена валина лизином, 10–30%), V600R (замена валина аргинином, 1–7%) и К601Е (замена лизина глутамином, 1–4%). Меланомы с V600Е ассоциируются с более молодым возрастом больных, локализацией первичной опухоли на коже туловища и отсутствием хронического солнечного повреждения. Меланомы с V600К, напротив, ассоциируются с пожилым возрастом, локализацией первичной опухоли на голове и шее и хроническим ультрафиолетовым повреждением.
При акральных меланомах и меланомах слизистых оболочек частота BRAF-мутаций значительно ниже, а при увеальных меланомах этот вид мутации не отмечают вообще. NRAS- и KIT-мутации возникают при МК гораздо реже и составляют 20 и <5% соответственно. Увеальная меланома характеризуется мутациями в GNAQ/GNA11.
Кроме того, некоторые другие пути (PI3K, Wnt, NF-kB) могут активироваться либо патологически активироваться при меланомах [10].
На сегодня завершена III фаза клинических исследований 2 селективных ингибиторов BRAF-мутации, продемонстрировавшая высокую частоту объективного ответа и повышение выживаемости по сравнению с химиотерапией у пациентов с положительной BRAF-мутацией: вемурафениб и дабрафениб. В отличие от предшествующих неселективных ингибиторов (сорафениб), которые связывают инактивированную киназу (тип 2 киназных ингибиторов), эти препараты ингибируют активированную киназу и специфически ингибируют мутацию BRAF (тип 1 киназных ингибиторов).
Вемурафениб получил одобрение в результате исследования BRIM-3, в ходе которого больных с нерезектабельной МК IIIC–IV стадии рандомизировали в 2 группы: первая получала вемурафениб в дозе 960 мг перорально 2 раза в сутки, вторая — дакарбазин по 1000 мг/м внутривенно в качестве первой линии терапии. Объективный ответ отмечен у 48,4% больных, получавших вемурафениб (у 1,0% — полная, у 47,4% — частичная регрессия), и у 5%, получавших дакарбазин (у всех — частичная регрессия). Медиана общей выживаемости в первой группе составила 13,6 мес, во второй — 9,7 мес. Медиана выживаемости без прогрессирования — соответственно 6,9 и 1,6 мес [11, 12].
Анализ общей выживаемости при лечении вемурафенибом проведен в исследовании МО25515, в котором продемонстрировано, что медиана общей выживаемости больных составляет 12 мес, при наличии метастазов в головном мозгу и повышении уровня лактатдегидрогеназы — 7,7–7,8 мес, а при статусе ECOG >2 — 4,9 мес.
Дабрафениб получил одобрение FDA в 2013 г. для лечения нерезектабельной и метастатической меланомы у пациентов с V600Е BRAF-мутацией в результате исследования BREAK-3, в котором у 51% больных, получавших дабрафениб в дозе 150 мг 2 раза в сутки перорально, отмечен объективный ответ, а медиана выживаемости без прогрессирования составила 5,1 мес [13].
Несмотря на то что вемурафениб и дабрафениб отличались в ранних фазах исследований по выбору терапевтических доз (для вемурафениба в основу положена максимальная переносимая терапевтическая доза, а для дабрафениба — фармакокинетика/фармакодинамика и эффективность) и генотипу BRAF-мутаций (для вемурафениба V600Е- или COBAS-положительный, а для дабрафениба — несколько генотипов), их эффективность практически одинакова при МК с положительной BRAF-мутацией. У пациентов с V600Е BRAF-мутацией оба препарата вызывают объективный ответ согласно критериям RECIST примерно в 50% случаев, а медиана выживаемости без прогрессирования составляет около 7 мес. Для вемурафениба, кроме того, доказано повышение общей выживаемости по сравнению с химиотерапией.
Интересно, что, несмотря на схожую эффективность препаратов, их токсические эффекты, развивающиеся в результате парадоксальной активации МАПК пути в клетках с диким типом BRAF, существенно отличаются. Например, для обоих препаратов характерны следующие побочные эффекты: гиперкератоз, плоскоклеточный рак кожи и алопеция. Однако индукция плоскоклеточного рака кожи зарегистрирована при лечении вемурафенибом у 19% пациентов, а при лечении дабрафенибом — у 5%. Артралгия относится к часто встречающимся токсическим эффектам при использовании вемурафениба и редко — при лечении дабрафенибом. Специфичными для вемурафениба являются повышение трансаминаз и фоточувствительность (III степень токсичности зарегистрирована у 10 и 4% больных соответственно), для дабрафениба — лихорадка (3% — для III степени). В целом токсичность ингибиторов BRAF-мутации оценивается как средняя и управляемая, редко требующая прекращения лечения [10–13].
Как отмечено, у подавляющего большинства больных, получающих ингибиторы BRAF-мутации, изначально регистрируют впечатляющий лечебный эффект, однако он преимущественно частичный, гетерогенный и преходящий. В связи с этим внимание исследователей сосредоточено на преодолении резистентности к BRAF-ингибиторам, которую чаще всего связывают с изменениями непосредственно в МАПК пути, в частности с новыми аберрациями в NRAS, BRAF и МЕК, что приводит к реактивации пути [14].
МЕК-ингибиторы были созданы до BRAF-ингибиторов с целью подавления сигналов МАПК пути после получения данных о том, что этот путь активируется более чем в 80% при МК. Первые исследования МЕК-ингибиторов показали их низкую эффективность, так как терапию назначали независимо от статуса BRAF-мутации пациента. В более поздние проспективные исследования включали пациентов с положительными BRAF- и NRAS-мутациями.
Первым препаратом, завершившим III фазу клинических исследований, стал траметиниб, лечение которым приводило к 25% объективных ответов и медиане выживаемости без прогрессирования 4,8 мес у пациентов с V600 BRAF-мутацией, не получавших ранее терапию BRAF-ингибиторами. В то же время у больных, ранее леченных BRAF-ингибиторами, терапия траметинибом была неэффективной [15].
Позже было доказано, что траметиниб повышает медиану выживаемости без прогрессирования до 4,8 мес по сравнению с дакарбазином, при лечении которым этот показатель составляет 1,5 мес [16].
Типичными токсическими проявлениями для МЕК-ингибиторов являются сыпь (включая акнеформную), артериальная гипертензия, диарея, отеки, преходящая кардиальная дисфункция, повышение уровня креатинкиназы, а также офтальмотоксичность (хориоретинопатия, центральная серозная ретинопатия и редко — окклюзия центральной вены сетчатки) [15, 16].
Впервые комбинация BRAF- и МЕК-ингибиторов изучена при сравнении эффективности дабрафениба и траметиниба с монотерапией дабрафенибом в рамках исследования CombiDT. Комбинированное использование BRAF- и МЕК-ингибиторов преследует две цели: 1) продление выживаемости без прогрессирования путем профилактики развития МАПК-зависимых путей резистентности; 2) предотвращение типичной для BRAF-ингибиторов токсичности, развивающейся в результате парадоксальной активации МАПК-пути в немеланомных клетках с диким типом BRAF-мутации.
Данные исследования подтвердили более высокую частоту объективного ответа при одновременном использовании BRAF- и МЕК-ингибиторов по сравнению с монотерапией BRAF-ингибиторами (объективный ответ составил 76 и 54%, a медиана выживаемости без прогрессирования — 9,4 и 5,8 мес соответственнo). В то же время только 19% больных, у которых развилось прогрессирование заболевания на фоне монотерапии BRAF-ингибиторами, ответили на комбинацию лечения.
Проявления токсичности, включающие гиперкератоз, алопецию, артралгию и сыпь, характерные для BRAF-ингибиторов, отмечали гораздо реже в случае комбинации с МЕК-ингибиторами. Примечательно, что плоскоклеточный рак кожи у больных, получавших лечение дабрафенибом, развивался в 19% случаев, а у пациентов, у которых применяли комбинированное лечение, — в 7%. Наиболее частым осложнением при комбинированной терапии (у 70% пациентов) была гипертермия, в то время как при монотерапии дабрафенибом она отмечена только у 26% больных. Гипертермия, патогенез которой остается до конца не выясненным, появляется достаточно рано, хорошо купируется кратковременным прерыванием лечения и назначением кортикостероидов в случае повторного развития [17].
В исследовании BRIM-7 изучена эффективность комбинированной терапии еще двумя BRAF- и МЕК-ингибиторами — вемурафенибом и кобиметинибом — по сравнению с монотерапией вемурафенибом. Объективный ответ при комбинированной терапии больных, ранее не леченных BRAF-ингибиторами, составил 73%, при этом медиана выживаемости без прогрессирования не достигнута. У пациентов, получавших BRAF-ингибиторы, объективный ответ составил 14%, а медиана выживаемости без прогрессирования — 2,8 мес. Наиболее частыми побочными эффектами лечения были сыпь (87%), диарея (83%), утомляемость (70%), фоточувствительность (67%). Плоскоклеточный рак кожи зафиксирован только у 1,4% больных [18].
Иммунотерапия
Иммунотерапия при МК имеет длинный и подчас разочаровывающий путь развития. Вакцинотерапия потерпела неудачу при клинических исследованиях. Лечение интерлейкином-2 и адоптивная Т-клеточная терапия могут приводить к полной регрессии опухоли, однако они применимы у весьма ограниченного контингента больных, а также являются высокотоксичными, что оставляет их применение в пределах экспериментальных препаратов. Прорыв в иммунотерапии, произошедший в последние годы, связан с пониманием механизмов Т-клеточной регуляции и созданием препаратов, избирательно действующих на компоненты этого процесса.
Регуляция иммунной системы весьма сложна. Т-клетки экспрессируют на своей поверхности множество рецепторов, которые взаимодействуют с антиген-презентирующими клетками (АПК), что приводит к активации либо инактивации Т-клеток через процесс, известный как checkpoint block. Активация Т-клеток может осуществляться двумя путями: 1) АПК презентируют антигены (в том числе опухолевые) Т-клеточным рецепторам; 2) АПК экспрессируют молекулы В7, которые http://lipitoronline-generic.net/ взаимодействуют с CD28 рецептором Т-клетки. Конкурентная активация Т-клеточных рецепторов и CD28 приводит к стимулированию сигналов в ядре Т-клетки и ее активации.
Сразу же после активации Т-клеток происходит их инактивация несколькими путями для предотвращения распространенных аутоиммунных процессов. Один из процессов инактивации состоит в экспрессии CTLA-4 (cytotoxic lymphocyte antigen 4) рецепторов на поверхности Т-клеток, которые связываются с В7 на АПК, подавляя таким образом сигналы к ядру Т-клеток. Другой процесс инактивации заключается в экспрессии PD-1 на поверхности Т-клетки, которые затем связываются с PD-L1 в опухолевой ткани, что вызывает инактивацию Т-клеток (рис. 2). Таким образом, CTLA-4 играет важную роль в ранней фазе иммунного ответа и взаимодействует с АПК, в то время как PD-1 приобретает свое значение в более поздней фазе и взаимодействует непосредственно с периферическими тканями. Подавление (checkpoint blockade) CTLA-4, либо PD-1, либо PD-L1 может стимулировать противоопухолевый иммунитет [19].

Ипилимумаб (полностью человеческое IgG1 анти-CTLA-4 антитело) — первый препарат, вызвавший повышение общей выживаемости пациентов с генерализованной формой меланомы в рандомизированных исследованиях III фазы. Препарат одобрен FDA для лечения метастатической или нерезектабельной меланомы в 2011 г. на основании исследования MDX010-20, в котором пациентов рандомизировали в 3 группы. Первая группа получала ипилимумаб в дозе 3 мг/кг внутривенно каждые 3 нед 4 раза, вторая — пептидную вакцину gp100, третья — оба препарата. Объективный ответ отмечен у 10,5% больных, получавших ипилимумаб, 1,5% — в группе, получавшей вакцину, и 5,7% — в группе, в которой применяли оба препарата. При этом у части пациентов имело место прогрессирование заболевания на фоне терапии ипилимумабом с последующей регрессией опухолевых очагов. Обнадеживающим является тот факт, что среди больных, ответивших на лечение, в 60% случаев его продолжительность превышала 24 мес. Также впечатляющим оказался уровень выживаемости пациентов, получавших монотерапию ипилимумабом: 1-летняя выживаемость составила 45,6%, а 2-летняя — 23,5% [20].
Аутоиммунная токсичность при лечении ипилимумабом развивается более чем в 60% случаев и включает аутоиммунное поражение кожи, желудочно-кишечного тракта и органов эндокринной системы. В процессе лечения отмечена четкая корреляция между возникновением аутоиммунных побочных реакций и ответом опухоли на проводимую терапию. В 15% случаев аутоиммунные побочные явления достигали III–IV степени. Для их разрешения требовалось применение кортикостероидов, что, однако, не препятствовало развитию противоопухолевого ответа. Таким образом, применение ипилимумаба вызывает длительный объективный ответ опухоли, при этом аутоиммунная токсичность коррелирует с регрессией опухоли, а применение кортикостероидов не препятствует ее развитию [20, 21].
Данный вид лечения оказался эффективным и при метастазах меланомы в головном мозгу: 1- и 2-летняя выживаемость пациентов c асимптоматическими метастазами составила 31 и 26% соответственно, а с симптоматическими — 19 и 10% соответственно [22].
Представляют интерес данные о повторном применении ипилимумаба при генерализованной МК. Среди 855 пациентов, включенных в исследование ЕАР, у 51 (6%) отмечено прогрессирование заболевания после предшествующей стабилизации либо регрессии. После повторной терапии ипилимумабом у 6 (12,8%) из них развилась частичная регрессия, а у 19 (40,8%) — заболевание стабилизировалось [23].
Несмотря на отсутствие общепринятых биомаркеров, предиктирующих ответ на лечение ипилимумабом, во многих исследованиях продемонстрировано, что наличие в сыворотке крови больных до и во время лечения антител к антигену меланомы NY-ESO-1 и увеличение абсолютного числа лимфоцитов во время лечения ассоциируются с более высокой вероятностью ответа [24, 25].
Тремелимумаб (другое анти-CTLA-4 антитело) показал длительный объективный ответ у 10% больных, в некоторых случаях продолжающийся более 5 лет, однако в III фазе клинических исследований не доказано преимущества в общей выживаемости по сравнению с химиотерапией (12,6 и 10,7 мес соответственно; р=0,127) [26]. Тонкие различия в исследованиях III фазы применения тремелимумаба и ипилимумаба, к примеру в схеме и дозировании, могли сыграть роль в том, что преимущества в лечении тремелимумабом не были статистически значимыми [10]. Токсичность тремелимумаба очень схожа с токсичностью ипилимумаба по своим проявлениям, частоте, степени тяжести и способам коррекции.
Новый класс иммунных препаратов направлен на увеличение противоопухолевого Т-клеточного ответа на опухолеспецифическом уровне путем блокирования взаимодействия PD-1 (programmed death) — на Т-клетках и PD-L1 (programmed death ligand) — на опухолевых клетках и предотвращения Т-клеточной инактивации на опухолевом уровне.
Первое исследование полностью человеческого IgG4 моноклонального PD-1 антитела, получившего название ниволумаб, включало 107 больных, 25% которых получили 3 и более линии предшествующей системной терапии. Лечение назначали в дозах от 0,1 до 10 мг/кг в виде инфузий каждые 2 нед в 8-недельном лечебном цикле. Частота объективного ответа составила 31%, а у больных, получавших 3 мг/кг, — 41%. Примерно в 5% случаев до начала регрессии опухолевых очагов развилось прогрессирование заболевания. Примечательно, что у ряда больных (12 из 17), которым лечение было прекращено по причинам, отличным от прогрессирования заболевания, продолжалась регрессия опухоли даже после прекращения терапии. Медиана выживаемости без прогрессирования составила 3,7 мес (9,7 мес при дозе 3 мг/кг), медиана продолжительности ответа — 24 мес (17,3 мес при дозе 3 мг/кг), а медиана общей выживаемости — 16,8 мес (20,3 мес при дозе 3 мг/кг).
Токсические явления отмечены у 82% больных и включали усталость, сыпь, зуд и диарею. У 21% пациентов развивалась токсичность III–IV степени в виде лимфопении, усталости, тошноты, диареи и анемии. Не отмечено четкой зависимости между дозировкой препарата и его токсичностью, однако доза 3 мг/кг была выбрана как наиболее эффективная для исследования III фазы по сравнению ниволумаба и дакарбазина в качестве первой линии терапии [27].
Другим исследуемым PD-1 антителом является ламбролизумаб. В исследование I фазы включено 135 больных с генерализованной меланомой, получавших препарат в дозе 2 либо 10 мг/кг каждые 2–3 нед. Регрессию опухоли отмечено у 38% пациентов; при этом наибольшая частота объективного ответа (52%) зафиксирована у больных, получавших 10 мг/кг каждые 2 нед. Интересно, что ответ развивался с одинаковой частотой как у леченных ранее ипилимумабом, так и у нелеченых пациентов (38 и 37% соответственно). Большинство ответов зафиксировано уже во время первого оценочного визита на 12-й неделе, при этом медиана продолжительности ответа не достигнута при медиане наблюдения 11 мес.
Нежелательные явления при терапии ламбролизумабом отмечены у 79% пациентов, при этом у 13% — III–IV степени. Чаще всего возникали усталость, гипертермия, озноб, миалгия; у 9% больных отмечено витилиго. Аутоиммунные осложнения (пневмониты, гипотиреоидизм, повышение уровня трансаминаз, почечная и надпочечниковая недостаточность) развивались нечасто, обычно не превышали I–II степени и хорошо купировались путем прекращения лечения с/без назначения кортикостероидов [28].
В сентябре 2014 г. FDA одобрила пембролизумаб — первое анти-PD1 антитело в качестве второй линии терапии для больных с нерезектабельной и генерализованной МК. Предполагается, что данный вид терапии может быть использован в случае прогрессирования заболевания на фоне предшествующей терапии ипилимумабом и ингибиторами BRAF-мутации.
Препарат зарегистрирован на основании исследования с участием 173 больных генерализованной МК с прогрессированием опухолевого процесса на фоне предшествующих линий терапии, которые получали пембролизумаб в дозе 2 и 10 мг/кг каждые 3 нед. Объективный ответ отмечен у 26% больных, независимо от дозировки; эффект лечения сохранялся не менее 1,5–8,5 мес и в большинстве случаев продолжался в дальнейшем.
В рекомендуемой дозировке (2 и 10 мг/кг каждые 3 нед) нежелательные и серьезные нежелательные явления обнаружены у 6 и 36% больных соответственно. Наиболее распространенными проявлениями токсичности были: утомляемость, кашель, тошнота, сыпь, зуд, снижение аппетита, запор, понос и артралгия. Кроме того, в некоторых случаях развивались аутоиммунные поражения легких, печени, кишечника, желез внутренней секреции [29].
В исследовании I фазы BMS-936559 впервые было изучено полностью человеческое IgG4 PD-L1 антитело. 55 пациентов с генерализованной МК получали препарат 1 раз в 2 нед в дозе 0,3–10 мг/кг. Регрессия опухоли отмечена в 17% случаев, с наибольшей частотой — при дозировке 3 мг/кг. Среди 9 больных, ответивших на лечение, у 5 ответ продолжался более года. Из всей когорты пациентов с солидными опухолями, включенными в исследование, у 39% пациентов отмечены аутоиммунные осложнения в виде сыпи, гипотиреоидизма, гепатита, саркоидоза, эндофтальмита, диабета, миастении, редко — пневмонита; токсичность III степени имела место в 9% случаев [30].
Таким образом, второе поколение иммунотерапевтических препаратов кажется более эффективным и менее токсичным, чем ипилимумаб, что, вероятно, связано с более опухолеспецифичным способом иммунной активации. Аутоиммунные проявления также встречаются реже и требуют меньше иммуносупрессоров. Более того, экспрессия опухолью PD-L1 может быть потенциальным предиктивным биомаркером ответа. В исследовании, посвященном эффективности ниволумаба при солидных опухолях, показано, что отсутствие экспрессии PD-L1 ассоциируется с отсутствием объективного ответа на проводимое лечение. В частности, ни у одного из 17 больных с отрицательной экспрессией PD-L1 не отмечено признаков регрессии заболевания, в то время как у 9 из 25 пациентов, имевших положительную экспрессию, констатировано регрессию [31]. В последующих исследованиях продемонстрировано, что пациенты с генерализованной меланомой могут отвечать на лечение анти-PD1 и анти-PD-L1, несмотря на отсутствие экспрессии PD-L1, однако объективный ответ в подобных случаях развивается реже [32].
Хотя МАПК-ингибиторы и новые иммунотерапевтические препараты продемонстрировали свое преимущество перед химиотерапией, результаты лечения при генерализованной МК далеки от удовлетворительных. В связи с этим вполне естественными являются попытки комбинации МАПК-ингибиторов, иммунотерапевтических и химиотерапевтических препаратов.
Первое иссследование по изучению комбинации вемурафениба и ипилимумаба было досрочно прекращено из-за гепатотоксичности, характерной для обоих препаратов при использовании в монорежиме, однако продолжается исследование комбинации дабрафениба с/без траметиниба и ипилимумаба.
Ряд исследований направлено на изучение lipitor generic комбинации ипилимумаба с различными химиопрепаратами. В исследовании СА184024 больных генерализованной МК рандомизировали в 2 группы: одна из них получала ипилимумаб и дакарбазин, другая — дакарбазин и плацебо. Общая 3-летняя выживаемость в первой группе составила 20,8%, во второй — 12,2% [33].
Недавно представленные данные исследования комбинации ипилимумаба и ниволумаба продемонстрировали разницу при одновременном и последовательном назначении препаратов. В частности, при одновременном применении регрессия опухоли >80% зафиксирована у 40% больных, при этом в 17% случаев отмечена полная регрессия; 1-летняя выживаемость составила 82%. Токсические проявления терапии были аналогичны токсичности, возникающей при монотерапии ипилимумабом, однако развивались раньше, протекали тяжелее, поэтому требовалось прекращение лечения в 20% случаев. При последовательном назначении ипилимумаба и ниволумаба результаты оказались более скромными, объективный ответ выявлен только у 20% пациентов, но и токсичность III–IV степени отмечена только у 18% пациентов [34].
Таким образом, в течение последних 4 лет произошли серьезные изменения в подходах к лечению пациентов с генерализованной МК, связанные с развитием молекулярной биологии, пониманием механизмов Т-клеточной регуляции и созданием препаратов, избирательно действующих на компоненты этих процессов. Однако медиана общей выживаемости больных остается низкой, что требует дальнейших исследований комбинации существующих препаратов и поисков новых лекарственных средств.
Список использованной литературы
1. Щепотін І.Б., Федоренко З.П., Гулак Л.О. та ін. (2013) Рак в Україні, 2011–2012. Захворюваність, смертність, показники діяльності онкологічної служби. Бюл. Нац. канцер-реєстру України, № 14. 104 с.
2. Balch C.M., Gershenwald J.E., Soong S.J. (2009) Final version of 2009 AJCC melanoma staging and classification. J. Clin. Oncol., 27(36): 6199–6206.
3. Wasif N., Bagaria S.P., Ray P. et al. (2011) Does metastasectomy improve survival in patients with Stage IV melanoma? A cancer registry analysis of outcomes. J. Surg. Oncol., 104(2): 111–5.
4. Eggermont A.M., Spatz A., Robert C. (2014) Cutaneous melanoma. Lancet, 383: 816–27.
5. Sondak V.K., Liu P.Y., Warneke J. et al. (2006) Surgical resection for stage IV melanoma: A Southwest Oncology Group trial (S9430) J. Clin.Oncol. ASCO Annual Meeting Proceeding, 24(18S): 8019.
6. Sosman J.A. (2011) SWOG S9430: Complete surgical resection associated with prolonged OS in stage IV melanoma. Cancer, 117: 4740–4746.
7. Middleton M.R., Grob J.J., Aaronson N. et al. (2000) Randomized phase III study of temozolomide versus dacarbazine in the treatment of patients with advanced metastatic malignant melanoma. J. Clin. Oncol., 18 (1): 158–166.
8. Eggermont A.M., Kirkwood J.M. (2004) Re-evaluating of the role of dacarbazine in metastatic melanoma: what have we lerned in 30 years ? Eur. J. Cancer, 40: 1825–1836.
9. Davies H., Bignell G.R., Cox C. et al. (2002) Mutations of the BRAF gene in human cancer. Nature, 417: 949–54.
10. Menzies A.M., Long G.V. (2013) Recent advances in melanoma systemic therapy. BRAF inhibitors, CTLA4 antibodies and beyond. Eur. J.Cancer, 49(15): 3229–41.
11. Chapman P.B., Hauschild A., Robert C. (2011) Improved Survival with Vemurafenib in Melanoma with BRAF V600E Mutation. N. Engl. J. Med., 364(26): 2507–16.
12. McArthur G.A., Chapman P.B., Robert C. (2014) Safety and efficacy of vemurafenib in BRAF(V600E) and BRAF(V600K) mutation-positive melanoma (BRIM-3): extended follow-up of a phase 3, randomised, open-label study. Lancet Oncol., 15(3): 323–32.
13. Hauschild A., Grob J.J., Demidov L.V. et al. (2012) Dabrafenib in BRAF-mutated metastatic melanoma: a multicentre, open-label, phase 3 randomised controlled trial. Lancet, 380 (9839): 358–365.
14. Wagle N., Emery C., Wang Q. et al. (2010) Melanomas acquire resistance to B-RAF (V600E) inhibition by RTK or N-RAS up regulation. Nature, 468: 973–7.
15. Kim K.B., Kefford R., Pavlick A.C. et al. (2013) Phase II study of the MEK1/MEK2 inhibitor Trametinib in patients with metastatic BRAF-mutant cutaneous melanoma previously treated with or without a BRAF inhibitor. Clin. Oncol., 31(4):
482–9.
16. Flaherty K.T., Robert C., Hersey P. et al. (2012) Improved Survival with MEK Inhibition in BRAF-Mutated Melanoma. N. Engl. J. Med., 367: 107–114.
17. Flaherty K.T., Infante J.R., Daud A. et al. (2012) Combined BRAF and MEK inhibition in melanoma with BRAF V600 mutations. N. Engl. J. Med., 367: 1694–1703.
18. McArthur G., Gonzalez R., Paulick A. et al. (2013) Vemurafenib and MEK inhibitor, cobimetinib (GDC-0973) in advanced BRAF V600-mutated melanoma (BRIM7): Dose-escalation and expansion results of a phase IB study. European Cancer Congress. Abstract 3703.
19. Topalian S.L., Drake C.G., Pardoll D.M. (2012) Targeting the PD-1/B7-H1(PD-L1) pathway to activate anti-tumor immunity. Curr. Opin. Immunol., 24(2): 207–12.
20. Hodi F.S., O’Day S.J., McDermott D.F. et al. (2010) Improved survival with ipilimumab in patients with metastatic melanoma. N. Engl. J. Med., 363(8): 711–23.
21. McDermott D., Haanen J., Chen T.T. et al. (2013) Efficacy and safety of ipilimumab in metastatic melanoma patients surviving more than 2 years following treatment in a phase III trial (MDX010-20). Ann. Oncol., 24(10): 2694–8.
22. Margolin K., Hodi F.S., McDermott D.F. et al. (2011) Safety and efficacy of ipilimumab-treated patients with melanoma and brain metastases. Proceedings of the European Multidisciplinary Cancer Congress, abstract 9306, Stockholm, Sweden, September 2011.
23. Ascierto P.A., Simeone E., Sileni V.C. (2014) Clinical experience with ipilimumab 3 mg/kg: real-world efficacy and safety data from an expanded access programme cohort. J. Transl. Med., 12: 116.
24. Yuan J., Adamow M., Ginsberg B.A., Rasalan T.S. et al. (2011) Integrated NY-ESO-1 antibody and CD8+ T-cell responses correlate with clinical benefit in advanced melanoma patients treated with ipilimumab. Proc. Natl. Acad. Sci. U S A, 108: 16723–16728.
25. Berman D.M., Wolchok J., Weber J. et al. (2009) Association of peripheral blood absolute lymphocyte count (ALC) and clinical activity in patients with advanced melanoma treated with ipilimumab [abstract]. J. Clin. Oncol., 27(Suppl 15s): 3020.
26. Ribas A., Kefford R., Marshall M.A. (2013) Phase III randomized clinical trial comparing tremelimumab with standard-of-care chemotherapy in patients with advanced melanoma. J. Clin. Oncol., 31(5): 616–22.
27. Sznol M., Kluger H.M., Hodi F.S. et al. (2013) Survival and long-term follow-up of safety and response in patients (pts) with advanced melanoma (MEL) in a phase I trial of nivolumab (anti-PD-1; BMS-936558; ONO-4538). J. Clin. Oncol., 31 (suppl; abstr. CRA9006).
28. Hamid O., Robert C., Daud A. et al. (2013) Safety and tumor responses with lambrolizumab (anti-PD-1) in melanoma. N. Engl. J. Med., 369(2): 134–44.
29. Robert C., Ribas A., Wolchok J.D. et al. (2014) Anti-programmed-death-receptor-1 treatment with pembrolizumab in ipilimumab-refractory advanced melanoma: a randomised dose-comparison cohort of a phase 1 trial. The Lancet, 384: 1109–1117.
30. Brahmer J.R., Tykodi S.S., Chow L.Q. (2012) Safety and activity of anti-PD-L1 antibody in patients with advanced cancer. N. Engl. J. Med., 366(26): 2455–65.
31. Topalian S.L., Hodi F.S., Brahmer J.R. et al. (2012) Safety, activity, and immune correlates of anti-PD-1 antibody in cancer. N. Engl. J. Med., 366(26): 2443–54.
32. Grosso J., Horak C.E., Inzunza D. et al. (2013) Association of tumor PD-L1 expression and immune biomarkers with clinical activity in patients (pts) with advanced solid tumors treated with nivolumab (anti-PD-1; BMS-936558; ONO-4538). J. Clin. Oncol., 31 (suppl; abstr 3016).
33. Robert C., Thomas L., Bondarenko I. et al. (2011) Ipilimumab plus dacarbazine for previously untreated metastatic melanoma. N. Engl. J. Med., 364(26): 2517–26.
34. Wolchok J.D., Kluger H., Callahan M.K. et al. (2013) Nivolumab plus ipilimumab in advanced melanoma. N. Engl. J. Med., 369(2): 122–33.
35. Pardoll D.M. (2012) The blockade of immune checkpoints in cancer immunotherapy. Nat. Rev. Cancer, 12: 252–264.
Адрес:
Кукушкина Мария Николаевна
Национальный институт рака
03022, Киев, ул. Ломоносова, 33/43
Тел.: (044) 257-99-46 (раб.);
E-mail: kukushkina_07@mail.ru














Leave a comment