Ацетилсалициловая кислота как средство химиопрофилактики рака грудной железы (обзор литературы)
Верещако Р.И., Зотов А.С., Самусева А.А.
Резюме. Анализ данных современной литературы относительно химиопрофилактики рака грудной железы (РГЖ) нестероидными противовоспалительными препаратами, в частности ацетилсалициловой кислотой, показал, что в ряде исследований выявлено свойство при длительном применении предупреждать развитие РГЖ, что делает ацетилсалициловую кислоту потенциальным профилактическим средством. Неоднозначность и противоречивость результатов отдельных исследований, их разная статистическая мощность указывают на необходимость проведения дальнейших исследований для окончательных выводов.
 Введение
Введение
Вопреки распространенному мнению, что рак грудной железы (РГЖ) является проблемой экономически развитых государств, по данным Всемирной организации здравоохранения, большинство (70%) случаев заболевания регистрируют в развивающихся странах.
Так же разительно отличаются и результаты лечения — общая выживаемость, составляющая ≥80% в Северной Америке, Японии, Западной Европе, снижается до 60% в странах со средним уровнем доходов и составляет <40% — при низком доходе на душу населения. В Украине те, кто не прожил 1 года, из числа впервые заболевших, в 2011 г. составляли 10,8% [1].
Низкая выживаемость объясняется отсутствием государственных программ раннего выявления РГЖ, недоступностью современных средств и оборудования для диагностики и лечения.
Перспективным путем влияния на неблагоприятную ситуацию является химиопрофилактика РГЖ. Термин «химиопрофилактика» ввел в онкологический лексикон M. Sporn в 1976 г. при публикации экспериментов по исследованию влияния на канцерогенез ретиноидов [2].
По определению Международного агентства по изучению рака, химиопрофилактика онкологических заболеваний — это использование фармакологических или натуральных агентов с целью предотвращения возникновения рака.
Химиопрофилактика может быть первичной (предупреждение возникновения неоплазий), вторичной (препятствование прогрессии опухолевого процесса, в том числе трансформации предопухолевых состояний в злокачественные опухоли) и третичной (предупреждение рецидивов и метастазов).
Лекарственные средства, предлагаемые для химиопрофилактики, в идеале должны соответствовать ряду требований — доказанная эффективность, нетоксичность (или низкая токсичность), невысокая стоимость. Значение последних двух требований обусловлено тем, что превентивные средства необходимо применять в течение весьма длительного периода в достаточной для проявления эффекта дозе.
Достаточно часто в качестве средств химиопрофилактики рассматриваются конвенциальные лекарственные средства, то есть применяемые по другим показаниям (например витамины). Перспективными в этом отношении являются нестероидные противовоспалительные препараты (НПВП) и ингибиторы циклооксигеназы (ЦОГ), что обусловлено механизмом их действия, широким применением и доступностью.
История изучения онкопрофилактических свойств НПВП начинается с 1983 г., когда появилось первое сообщение о случае регрессии аденоматозных полипов прямой кишки у больного семейным аденоматозным полипозом толстой кишки, длительно и регулярно принимавшего индометацин и сулиндак для купирования боли, вызываемой артритом.
Терапевтические эффекты НПВП связаны с их способностью ингибирования биосинтеза простагландинов (ПГ) путем блокирования ЦОГ. Последняя имеет не менее двух изоферментов: ЦОГ-1 отвечает за выработку ПГ, участвующих в защите слизистой оболочки желудочно-кишечного тракта, регуляции функций тромбоцитов и почечного кровотока; ЦОГ-2 участвует в синтезе ПГ при воспалении. В здоровых тканях (за исключением головного мозга) ЦОГ-2 отсутствует и образуется под влиянием тканевых факторов (цитокинов и др.), запускающих воспалительную реакцию. В опухолевых тканях отмечается индукция в основном изофермента ЦОГ-2 [3]. Наличие у ЦОГ пероксидазной активности может обусловить превращение проканцерогенов в канцерогены.
НПВП различают по их способности ингибировать ЦОГ-1 или -2 при различных концентрациях и в разных тканях. Например, ацетилсалициловая кислота является относительно селективным ингибитором ЦОГ-1 при применении в дозе 50–100 мг/сут, но ингибирует ЦОГ-2 при приеме в более высокой дозе и достижении концентрации в плазме крови >0,5 ммоль. Другие НПВП, такие как ибупрофен, сулиндак и индометацин, ингибируют ЦОГ-1 и -2 в равной степени [4]. Существует новый класс НПВП, названный коксибами, которые селективно ингибируют ЦОГ-2 [5].
Исследования показали, что многие опухоли (грудной железы, предстательной железы, легкого) характеризуются более высоким образованием ПГ (ПГЕ2, ПГI2) [6], чем нормальная ткань.
Способность НПВП ингибировать ЦОГ дает возможность предполагать, что НПВП могут быть эффективными средствами против рака.
Возможные механизмы действия
Выводы ряда обзоров свидетельствуют, что НПВП могут быть перспективны в качестве противораковых препаратов [7–9]. Согласно существующим данным, стимуляция апоптоза и ингибирование ангиогенеза могут быть одними из механизмов действия НПВП в подавлении злокачественной трансформации и роста опухоли.
Показательной является работа M.J. Thun и соавторов [4], в которой рассматриваются возможные пути влияния НПВП на злокачественные клетки на примере семейного аденоматозного полипоза (рисунок).
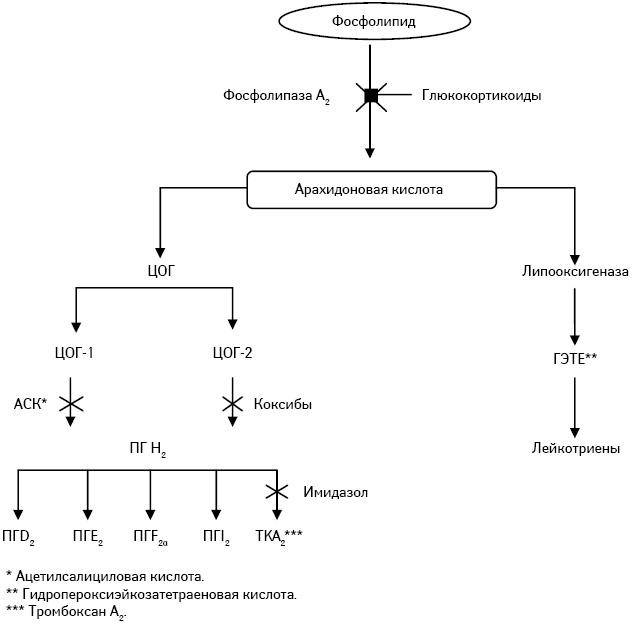
Теоретическим обоснованием применения ацетилсалициловой кислоты как модификатора специального лечения послужили различные исследования in vitro и in vivo.
В исследованиях in vitro, выполненных A. Bennett и соавторами, установлено, что клетки рака в грудной железе продуцируют больше ПГ, чем нормальные клетки грудной железы [10]. Также в исследованиях in vitro выявлено, что ацетилсалициловая кислота может ингибировать рост и уменьшать количество цитокинов (интерлейкинов-6 и -11), участвующих в метастазировании в кости [11], и способен стимулировать иммунную реактивность [12].
В исследованиях N. Kundu и соавторов на мышах установлено повышение ЦОГ-2-активности в клетках РГЖ [13]. В исследовании C.S. Williams и соавторов рост опухоли у мышей, получавших НПВП (целекоксиб), был меньшим, чем у мышей, не получавших НПВП [14].
С. Duggan и соавторы, проведя рандомизированное контролируемое клиническое исследование, предположили, что ацетилсалициловая кислота может влиять на риск развития РГЖ путем снижения уровня эстрогена в сыворотке крови и глобулина, связывающего половые гормоны (ГСПГ) [15].
Ацетилсалициловая кислота и риск развития РГЖ
В результате анализа опубликованной клинической, экспериментальной и эпидемиологической литературы следует заключить, что полученные данные относительно связи НПВП, в частности ацетилсалициловой кислоты, с риском развития РГЖ неоднозначны. Некоторые когортные исследования показали снижение риска РГЖ в связи с применением ацетилсалициловой кислоты, в ряде других же такая связь не выявлена или даже установлено повышение риска развития РГЖ. Однако НПВП обладают химиопрофилактическим эффектом в отношении РГЖ на мышиных моделях.
Выполнено несколько метаанализов, но все они имеют методологические ограничения и не являются исчерпывающими (таблица).
Таблица. Характеристика исследований влияния ацетилсалициловой кислоты на РГЖ
| Название исследования | Дизайн исследования | Результат |
| Nurses Health Study (NHS) (1976) [16] | Участники, 121 700 медсестер в возрасте 30–55 лет, анкетировались каждые 2 года. Участники принимали от 3 до 15 таблеток в неделю ацетилсалициловой кислоты | Отсутствие связи между применением НПВП и риском развития РГЖ (RR 1,00; 95% CI 0,71–1,41) |
| Women’s Health Initiative Study (1991) [17] | В исследовании продолжительностью 15 лет участвовали 80 741 женщина в возрасте 50–79 лет | Регулярное применение ацетилсалициловой кислоты (325 мг) снижает риск развития РГЖ у женщин, принимавших ≥2 таблеток в неделю:- в течение 5–9 лет — риск был снижен на 21% (RR 0,79; 95% CI 0,60–1,04); – ≥10 лет — на 28% (RR 0,79; 95% CI 0,56–0,91).Применение ацетилсалициловой кислоты в дозе <100 мг/сут не снижало риск развития РГЖ |
| Cancer Prevention Study II Nutrition Cohort (1992) [18] | В исследовании в 1992–2001 гг. принимали участие 77 413 женщин | Длительное (≥5 лет) и регулярное применение ацетилсалициловой кислоты (≥325 мг/сут) или других НПВП не влияет на риск развития РГЖ (RR 0,83; 95% CI 0,63–1,10) |
| Rodríguez L.A.G., González-Pérez A. (2004) [19] |
В исследовании принимали участие 734 899 женщин в возрасте 30–69 лет, среди которых диагностировано 3708 случаев РГЖ в 1995–2001 гг. Применявшиеся препараты: ацетилсалициловая кислота, неаспириновые НПВП, парацетамол и стероидные препараты (преднизолон). Участников распределили на группы: в зависимости от суточной дозы ацетилсалициловой кислоты (75; 150; 300 мг) и от времени ее применения (прием в настоящее время (краткосрочное — <1 года, длительное — >1 года), прием в прошлом (окончание приема препаратов за ≥1 год до исследования) и группа не принимавших препараты) | Ацетилсалициловая кислота связана со снижением риска развития РГЖ. Женщины, принимающие ацетилсалициловую кислоту ≥1 год имели RR 0,77 (95% CI 0,62–0,95) по сравнению с теми, кто не принимал ацетилсалициловую кислоту. Наблюдаемый эффект был более выражен среди женщин, принимавших 75 мг/сут |
| Women Health Study [20] (1993) | В исследовании участвовали 39 876 женщин в возрасте ≥45 лет. Сравнивали эффекты от применения ацетилсалициловой кислоты (100 мг) или плацебо через день, в течении 10,1 года | Влияния ацетилсалициловой кислоты на общее число раковых заболеваний (RR 1,01; 95% CI 0,94–1,08), а также РГЖ (RR 0,98; 95%CI 0,87–1,09) не выявлено |
| California Teachers Study (2005) [21] | В исследовании участвовали 114 460 женщин в возрасте 22–85 лет, из которых РГЖ в 1995–2001 гг. возник у 2391 женщины. В исследовании анализировали анкеты участниц, принимавших ацетилсалициловую кислоту, ибупрофен или ацетаминофен. Анкеты были распределены на группы по длительности приема (≤5 лет и >5 лет) и частоте (нерегулярно, ежедневно или 1–6 дней в неделю) | Tолько длительный период (>5 лет) ежедневного применения ацетилсалициловой кислоты обусловил некоторое снижение частоты РГЖ (RR 0,80), что статистически недостоверно и относилось к ER+ и PR+ опухолям |
| Iowa Women’s Health Study (1992) [22] | В исследовании принимали участие 26 580 женщин в возрасте 59–77 лет, к 2005 г. у 1581 диагностирован РГЖ. Проведен анализ данных опросников, использовавшихся в IWHS. В опросник входили вопросы об ацетилсалициловой кислоте и ибупрофену. В зависимости от частоты применения ацетилсалициловой кислоты или ибупрофена данные опросников были распределены на группы: никогда не принимали; реже 1 раза в неделю; 2–5 раз в неделю; ≥6 раз в неделю | У женщин, регулярно применявших ацетилсалициловую кислоту, риск РГЖ был ниже на 20% (RR 0,80; 95% CI 0,71–0,90), чем у непринимавших ацетилсалициловую кислоту. Отмечено, что риск снижался с повышением частоты приема ацетилсалициловой кислоты. У женщин, применявших ацетилсалициловую кислоту ≥6 раз в неделю, риск развития РГЖ был ниже на 29% по сравнению с теми, кто не принимал ацетилсалициловую кислоту вообще (RR 0,71). Применение других НПВП не показало связи с риском развития РГЖ (RR 0,95; 95% CI 0,85–1,07) |
| Duggan C. et al. (2005) [7] | В рандомизированном плацебо-контролируемом исследовании участвовали 144 женщины в постменопаузальный период. Изучали влияние ацетилсалициловой кислоты на эстроген в сыворотке крови и ГСПГ. Исследование длилось 6 мес, участницы одной группы принимали ацетилсалициловую кислоту в дозе 325 мг/сут, а другой — плацебо. Индекс массы тела участниц исследования в среднем — 26,4 кг/м2 | Ежедневное применение ацетилсалициловой кислоты в дозе 325 мг в течение 6 мес не оказывает никакого влияния на уровни эстрогена в сыворотке крови и ГСПГ у женщин в постменопаузальный период |
Несмотря на существование большого количества работ, которые свидетельствуют о снижении риска злокачественного новообразования при регулярном и длительном применении НПВП, только для целекоксиба имеется зарегистрированное в Food and Drug Administration показание для его клинического применения с целью лечения при предраковом заболевании семейного аденоматозного полипоза.
Ацетилсалициловая кислота и выживаемость
Примечательным является исследование M.D. Holmes и соавторов [23], которые в своей работе предположили, что применение ацетилсалициловой кислоты после установления диагноза связано со снижением риска смерти от РГЖ и риска отдаленных метастазов у женщин с РГЖ I–III стадии. Авторы изучили медицинскую документацию женщин, участвовавших в NHS. Из исследования исключили анкеты женщин, у которых не была указана дата рождения или дата установления диагноза, женщин с РГЖ IV стадии и по некоторым другим критериям. Было отобрано 4164 участницы и проведено подробный анализ их медицинских данных.
Выявлено, что применение ацетилсалициловой кислоты после установленного диагноза РГЖ связано со снижением риска отдаленных метастазов, смерти от РГЖ и смерти от других причин.
Life After Cancer Epidemiology (LACE) Study показало, что применение ибупрофена снижает риск рецидива РГЖ (RR 0,56; 95% CI 0,32–0,98), но не показало связи между ацетилсалициловой кислотой и снижением риска (RR 1,09; 95% CI 0,74–1,61). Отсутствие результата применения ацетилсалициловой кислоты в этом исследовании может объясняться коротким периодом наблюдения (<5 лет).
C.K. Blair и соавторы сообщают о пограничном снижении риска смерти от РГЖ (RR 0,64; 95% CI 0,39–1,05) при применении НПВП у 591 женщины в постменопаузальный период с РГЖ в Iowa Women’s Health Study [24]. Ацетилсалициловую кислоту принимали 43% участвующих в этом исследовании.
L. Huang и соавторы синтезировали новое производное ацетилсалициловой кислоты — фосфоаспирин (ФА-2), путем химической модификации с целью повышения эффективности ацетилсалициловой кислоты и уменьшения ее токсического действия на желудочно-кишечный тракт. В своем исследовании ученые оценивали его химиотерапевтическую и химиопрофилактическую эффективность в доклинических моделях triple negative РГЖ [25]. Исследование проводили in vitro и in vivo на мышах. Мышам давали ФА-2 в дозе 120 мг/кг массы тела или ацетилсалициловую кислоту 40 мг/кг перорально в кукурузном масле. В результате указанной работы выявлено, что ФА-2 ингибирует рост клеток triple negative РГЖ сильнее, чем ацетилсалициловая кислота. Также ФА-2 ингибирует активацию рецептора эпидермального фактора роста, индуцирует ацетилирование р53 и оксидативный стресс.
Исследование L. Huang и соавторов [25] — пример того, что на сегодняшний день синтезирование новых производных ацетилсалициловой кислоты и модернизация существующих лекарственных форм является перспективным направлением, поскольку это дает возможность минимизировать риски, связанные с применением препарата, и повысить его эффективность.
Ацетилсалициловая кислота оказывает менее выраженные побочные действия в сравнении с химиотерапевтическими препаратами, а также обусловливает профилактический эффект в отношении сердечно-сосудистых заболеваний, однако необходимы дальнейшие исследования для определения возможных механизмов действия ацетилсалициловой кислоты и получения более весомой доказательной базы ее влияния на выживаемость женщин с РГЖ.
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ
1. Щепотин И.Б., Федоренко З.П., Михайлович Ю.И. (2013) Рак в Украине, 2011–2012. Бюллетень Национального канцер-регистра Украины, 14: 46.
2. Sporn M.B. (1976) Approaches to prevention of epithelial cancer during the preneoplastic period. Cancer Res., 36: 2699–2702.
3. Ristimaki A., Sivula A., Lundin J. et al. (2002) Prognostic significance of elevated cyclooxygenase-2 expression in breast cancer. Cancer Res., 62(3): 632–635.
4. Thun M.J., Henley S.J., Patrono C. (2002) Nonsteroidal anti-inflammatory drugs as anticancer agents: mechanistic, pharmacologic, and clinical issues. J. Natl Cancer Inst., 94(4): 252–266.
5. Willoughby D.A., Moore A.R., Colville-Nash P.R. (2000) COX-1, COX-2, and COX-3 and the future treatment of chronic inflammatory disease. Lancet, 355(9204): 646–648.
6. Gately S., Li W.W. (2004) Multiple roles of COX-2 in tumor angiogenesis: a target for antiangiogenic therapy. Semin. Oncol., 31: 2–11.
7. Taketo M. (1998) Cyclooxygenase-2 inhibitors in tumorigenesis (part I). J. Natl Cancer Inst., 90(20): 1529–1536.
8. Taketo M. (1998) Cyclooxygenase-2 inhibitors in tumorigenesis (part II). J. Natl Cancer Inst., 90(21): 1609–1620.
9. Janne P.A., Mayer R.J. (2000) Chemoprevention of colorectal cancer. N. Engl. J. Med., 342: 1960–1968.
10. Bennett A., Charlier E.M., McDonald A.M. et al. (1977) Prostaglandins and breast cancer. Lancet, 310(8039): 624–626.
11. Sotiriou C., Lacroix M., Lagneaux L. et al. (1999) The aspirin metabolite salicylate inhibits breast cancer cells growth and their synthesis of the osteolytic cytokines interleukins-6 and -11. Anticancer Res., 19: 2997–3006.
12. Blomgren H., Rotstein S., Wasserman J.et al. (1990) In vitro capacity of various cyclooxygenase inhibitors to revert immune suppression caused by radiation therapy for breast cancer. Radiother. Oncol., 19(4): 329–335.
13. Kundu N., Yang Q., Dorsey R. et al. (2001) Increased cyclooxygenase-2 (cox-2) expression and activity in a murine model of metastatic breast cancer. Int. J. Cancer, 93(5): 681–686.
14. Williams C.S., Tsujii M., Reese J. et al. (2000) Host cyclooxygenase-2 modulates carcinoma growth. J. Clin. Invest., 105(11): 1589–1594.
15. Duggan C., Wang C.Y., Xiao L. et al. (2014) Aspirin and serum estrogens in postmenopausal women: a randomized controlled clinical trial. Cancer Prev. Res. (Phila), 7(9): 906–912.
16. Egan K.M., Stampfer M.J., Giovannucci E. et al. (1996) Prospective study of regular aspirin use and the risk of breast cancer. J. Natl. Cancer Inst., 88 (14): 988–993.
17. Harris R.E., Chlebowski R.T., Jackson R.D. et al. (2003) Breast cancer and nonsteroidal anti-inflammatory drugs: prospective results from the women’s health initiative. Cancer Res., 63(18): 6096–6101.
18. Jacobs E.J., Thun M.J., Bain E.B. et al. (2007) A large cohort study of long term daily use of adult-strength aspirin cancer incidence. JNCI J. Natl Cancer Inst., 99(8): 608–615.
19. Rodríguez L.A.G., González-Pérez A. (2004) Risk of breast cancer among users of aspirin and other anti-inflammatory drugs. Br. J. Cancer, 91(3): 525–529.
20. Cook N.R., Lee I.M., Gaziano J.M. et al. (2005) Low-dose aspirin in the primary prevention of cancer: the Women’s Health Study: a randomized controlled trial. JAMA,294(1): 47–55.
21. Marshall S.F., Bernstein L., Anton-Culver H. et al. (2005) Nonsteroidal anti-inflammatory drug use and breast cancer risk by stage and hormone receptor status. J. Natl Cancer Inst., 97(11): 805–812.
22. Bardia A., Olson J.E., Vachon C.M. et al. (2011) Effect of aspirin and other NSAIDs on postmenopausal breast cancer incidence by hormone receptor status: results from a prospective cohort study. Breast Cancer Res. Treat., 126(1): 149–155.
23. Holmes M.D., Chen W.Y., Li L. et al.
(2010) Aspirin intake and survival after breast cancer. J. Clin. Oncol., 28(9): 1467–1472.
24. Blair C.K., Sweeney C., Anderson K.E. et al. (2007) NSAID use and survival after breast cancer diagnosis in post-menopausal women. Breast Cancer Res. Treat., 101(2): 191–197.
25. Huang L., Wong C.C., Mackenzie G.G. et al. (2014) Phospho-aspirin (MDC-22) inhibits breast cancer in preclinical animal models: an effect mediated by EGFR inhibition, p53 acetylation and oxidative stress. BMC Cancer, 14: 141.
Ацетилсаліцилова кислота як засіб хіміопрофілактики раку грудної залози (огляд літератури)
Національний медичний університет ім. О.О. Богомольця, Київ
Резюме. Аналіз даних сучасної літератури щодо хіміопрофілактики раку грудної залози (РГЗ) нестероїдними протизапальними препаратами, зокрема ацетилсаліциловою кислотою, показав, що в ряді досліджень виявлено властивість при тривалому застосуванні запобігати розвитку РГЗ, що робить ацетилсаліцилову кислоту потенційним профілактичним засобом. Неоднозначність і суперечливість результатів окремих досліджень, їх різна статистична потужність свідчать про необхідність проведення подальших досліджень для остаточних висновків.
Ключові слова: рак грудної залози, ацетилсаліцилова кислота, хіміопрофілактика, нестероїдні протизапальні препарати, інгібітори циклооксигенази.
Acetylsalicylic acid as an agent of breast cancer chemoprevention (review)
Bogomolets National Medical University, Kyiv
Summary. The paper studies some clinical trials and modern publications dedicated using acetylsalicylic acid and others nonsteroidal anti-inflammatory drugs for breast cancer chemoprevention. Acetylsalicylic acid’s property to prevent the breast cancer has been established by some investigators. Nevertheless, the ambiguity and contradictoriness of evidences, differences in statistic power of investigations make it possible to conclude that, a new reliable and accurate trials are necessary.
Key words: breast cancer, acetylsalicylic acid, chemoprevention, nonsteroidal anti-inflammatory drugs, cyclooxygenase inhibitors.
Адрес:
Анастасия Самусева
01601, Киев, бульв. Т. Шевченко, 13
Национальный медицинский
университет им. А.А. Богомольца
E-mail: a_samusieva@yahoo.com














Leave a comment