Клініко-біологічні особливості тричі негативного раку грудної залози
Щепотин И.Б.1, Зотов А.С.2, Любота Р.В.2, Аникусько Н.Ф.3, Любота И.И.3
- 1Національний інститут раку, Київ
- 2Національний медичний університет ім. О.О. Богомольца, Київ
- 3Київський міський клінічний онкологічний центр, Київ
Резюме. Рак грудної залози — гетерогенне захворювання, яке істотно розрізняється за клінічним перебігом, морфологічною та молекулярною будовою і вимагає різних підходів до діагностики та лікування. Метою цього дослідження було вивчення клінічних та біологічних особливостей тричі негативного раку грудної залози. У дослідження включено 259 хворих віком від 27 до 82 (55±1,1) років, які проходили лікування з приводу раку грудної залози у клініці кафедри онкології Національного медичного університету ім. О.О. Богомольця в 2005 р. У ході цього дослідження отримано такі клінічно-біологічні особливості тричі негативного раку грудної залози: молодий вік хворих, наявність ожиріння, низький ступінь диференціювання пухлини, метастатичне ураження лімфатичних вузлів незалежно від розміру пухлини в молочній залозі.
Резюме. Рак грудной железы — гетерогенное заболевание, которое существенно различается по клиническому течению, морфологическому и молекулярному строению и требует различных подходов к диагностике и лечению. Целью настоящего исследования явилось изучение клинических и биологических особенностей трижды негативного рака грудной железы. В исследование включено 259 больных возрастом от 27 до 82 (55±1,1) лет, которые проходили лечение по поводу рака грудной железы в клинике кафедры онкологии Национального медицинского университета им. А.А. Богомольца в 2005 г. В настоящем исследовании получены следующие клинико-биологические особенности трижды негативного рака грудной железы: молодой возраст больных, наличие ожирения, низкая степень дифференцировки опухоли, метастатическое поражение лимфатических узлов независимо от размера опухоли в грудной железе.
Введение

В начале тысячелетия эмпирические представления онкологов-клиницистов о раке грудной железы (РГЖ) как гетерогенном заболевании получили конкретное морфологическое доказательство.
На основании работ предшественников Charles M. Perou и соавторы в 2000 г. предложили молекулярно-генетическую классификацию РГЖ, основанную на корреляции вариаций набора экспрессируемых генов с результатами лечения. В рамках этого исследования была прослежена зависимость между экспрессией 1753 генов и продолжительностью жизни больных РГЖ и установлено, что влияние на последнюю имеют 264 гена.
Дальнейшими работами этой группы авторов из США и Норвегии были уточнены количество подгрупп РГЖ и их характеристики, что нашло отражение в серии публикаций Therese Sorlie и соавторов (2001–2003) [5, 8, 9]. Техническая сложность и стоимость высокотехнологичных методов анализа множества фрагментов ДНК опухолевых клеток с целью идентификации того или иного генетического набора не позволяет использовать ее в повседневной клинической практике. Современная молекулярно-генетическая классификация, удобная для клинического использования, основывается на иммуногистохимическом анализе операционного материала и предусматривает выделение 4 фенотипов РГЖ табл. 1 [10, 11].
Таблица 1. Иммуногистохимический фенотип молекулярных подтипов РГЖ
| Молекулярный фенотип | Иммуногистохимический портрет | Встречаемость | ||||
|---|---|---|---|---|---|---|
| ER* | PR* | HER2/neu* | CK 5/6* | EGFR* | ||
| Luminal A | + | + | – | – | – | 56–61% |
| Luminal B | + | + | + | – | – | 9–16% |
| Her2-positive | – | – | + | – | – | 8–16% |
| Basal-like (Triple negative) | – | – | – | + | + | 8–20% |
*ER — рецепторы к эстрогенам; PR – рецепторы к прогестерону; HER2/neu – рецепторы эпидермального фактора роста II типа; CK – цитокератин; EGFR – рецептор эпидермального фактора роста.
Эта классификация широко используется в последние годы для выбора адекватной тактики лечения и определения прогноза заболевания. Ее популярность связана с тем, что молекулярные подтипы отображают не только важные различия в этиологии и патогенезе РГЖ, но и особенности клинического течения и исхода заболевания.
Такие результаты иммуногистохимического анализа опухоли, как ER, PR и HER2/neu являются факторами, учитываемыми в планировании адъювантного лечения в рамках Сент-Галленского консенсуса.
Все большее количество публикаций в последние годы посвящается так называемому трижды негативному (triple negative) РГЖ (ТН РГЖ) — фенотипу, характеризующемуся отсутствием экспрессии стероидных рецепторов (эстрогенов и прогестерона) и рецепторов эпидермального фактора роста II типа (Erb-B2/EGFR-2, HER2/neu).
Данный подтип опухоли встречается у 8–20% больных РГЖ, чаще у женщин в пременопаузе [7]. ТН РГЖ развивается из базального эпителия и относится к низкодифференцированным опухолям с высоким митотическим индексом и метастатическим потенциалом; характеризуется агрессивностью течения и отсутствием молекулярных мишеней, воздействие на которые могло бы обеспечить клинический эффект терапии.
Термин «базальноподобный» (базалиоидный, basal-like) РГЖ, употреблявшийся ранее как синоним ТН РГЖ, как было показано дальнейшими исследованиями, не всегда является таковым. Только 70% ТН РГЖ являются истинно базальноподобными (БП), остальные 30% представляют собой другие фенотипические варианты. Тройной негативный фенотип могут демонстрировать и опухоли с более благоприятным прогнозом — метапластический, аденокистозный, медуллярный рак и др. Около 5% БП РГЖ экспрессируют ER и PR, а 6–12% — HER2/neu. Если учесть определенную частоту ложноотрицательных результатов при иммуногистохимическом определении стероидных рецепторов, то следует признать, что ТН фенотип является суррогатным (и не идеальным) маркером, который может использоваться для идентификации БП РГЖ с известной долей условности. Проблема поиска более надежных маркеров БП РГЖ остается актуальной и привлекающей пристальное внимание исследователей. В качестве таковых, в дополнение к ТН фенотипу, обсуждаются рецептор эпидермального фактора роста (EGFR), цитокератины (СК 5/6 и 8/18), с-KIT, NGFR, белки р63, ламинил, остеонектин, виментил и ряд других. Необходимо отметить, что свое название БП фенотип получил благодаря отличительной экспрессии цитокератинов 5/6 и 17, характерной для базального слоя эпителия кожи и выстилки дыхательных путей.
Хотя в большинстве случаев ТН/БП РГЖ имеет спорадический характер, часть этих опухолей связана с мутацией гена BRCA1. Около ¾ BRCA1-положительных РГЖ имеют БП фенотип, особенно среди молодых пациенток и женщин с наследственным анамнезом РГЖ, с опухолями, экспрессирующими мутантный р53. С другой стороны, в исследовании M.J. Kandel и соавторов [4], в когорте из 177 пациентов с ТН РГЖ в 11,3% случаях идентифицирована мутация BRCA1. Среди пациенток моложе 40 лет частота выявления мутации BRCA1 выше и составляет 11–29% [14]. У пациенток моложе 50 лет БП фенотип опухоли повышает риск обнаружения мутации BRCA1 в 10 раз.
Следующей разновидностью ТН РГЖ является claudin-low подтип, получивший название в соответствии с определяющей его особенностью — низкой экспрессией множества генов, кодирующих синтез белков семейства клаудинов (в том числе их типы) [3, 4, 7].
Клаудины были открыты в 1998 г. японскими исследователями из Киотского университета Mikio Furuse и Shoichiro Tsukita и получили свое название от латинского глагола claudo (замыкать, сплачивать, закрывать), как отражение их барьерной функции [3]. Описано по меньшей мере 24 белка этого семейства, являющихся молекулами межклеточной адгезии и принимающих участие (наряду с Е-кадгерином) в тесных межклеточных взаимодействиях. Кроме того, в указанных опухолях наблюдается также низкая экспрессия Erb-B2, ESR1, что с учетом незначительного числа мишеней для медикаментозного воздействия, подразумевает и низкий ответ на терапию [13].
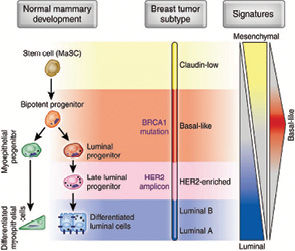
Cтремительно увеличивающееся количество работ, посвященных молекулярной биологии РГЖ, настоятельно требовало упорядочения накопленных данных в более-менее стройную патогенетическую схему. Обоснованным представляется соотношение молекулярных подтипов с этапами дифференцировки эпителиальных клеток грудной железы (рисунок) [6]. Так, опухоли claudin-low подтипа являются наименее дифференцированными, имеющими черты сходства со стволовыми клетками грудной железы. Клетки следующего этапа дифференцировки — предшественники люминальных эпителиальных клеток — могут быть источником БП РГЖ. Мутации BRCA1 могут блокировать последующую дифференцировку и приводить к задержке клеток на этом этапе. Люминальные же подтипы происходят из эпителиоцитов наиболее высокой степени дифференцировки.
Целью настоящего исследования явилось изучение клинических и биологических особенностей ТН РГЖ.
Материалы и методы исследования
Пациенты
В исследование включено 259 больных возрастом от 27 до 82 (55±1,1) лет, которые проходили лечение в соответствии с клиническими протоколами лечения РГЖ в клинике кафедры онкологии Национального медицинского университета им. А.А. Богомольца на базе Киевского городского клинического онкологического центра в 2005 г.
У всех больных оценивали следующие данные: стадию заболевания, возраст на момент постановки диагноза, ИМТ, размер, гистологический тип и степень дифференцировки опухоли, а также наличие метастазов в регионарных лимфатических узлах.
Размер опухоли оценивали после измерения ее максимального диаметра и классифицировали как Т1 (<2 см), Т2 (2–5 см), или Т3 (≥5 см). Индекс массы тела (ИМТ) рассчитывали по формуле:
I=m/h,
где: m — масса тела в килограммах, h — рост в метрах.
Согласно этим подсчетам больных распределили в соответствии с критериями ВОЗ: <25 — нормальная или дефицит массы тела; от 25 до 29,9 — избыточная масса тела; ≥30 — ожирение.
Исследование рецепторного статуса
Материал для патогистологического исследования был получен во время оперативного вмешательства. Приготовление препаратов осуществляли по методике, описанной в наших предыдущих публикациях [2]. Интерпретацию результатов иммуногистохимической реакции проводили с использованием качественной оценки ядерной реакции — отрицательная «−», слабо положительная «+», умеренно положительная «++», сильно положительная «+++» — и количественной системы оценки реакций в процентах окрашенных опухолевых клеток.
При оценке экспрессии Her-2/neu отмечали выраженность окрашивания цитоплазматической базальной мембраны: реакция «−», «+» — отсутствие гиперэкспрессии, реакция «+++» — гиперэкспрессия Her-2/neu. Оценку гиперэкспрессии Her2/neu в случаях реакции «++» проводили с помощью метода гибридизации in situ при использовании флюоресцентной метки FISH (флюоресцентная in situ гибридизация). Исследования проводили в патогистологической лаборатории Киевского городского клинического онкологического центра (зав. лабораторией — д-р мед. наук Захарцева).
Статистический анализ
Для оценки результатов исследования использовали программу MS Exсel. После проверки данных на нормальность распределения использовали однофакторный дисперсионный анализ (ANOVA) и анализ таблиц сопряженности вида 2×К. Различия между сравниваемыми группами считались достоверными при уровне значимости (р) меньше 0,05 [1].
Результаты
Всех больных разделили на 2 группы: ТН РГЖ и НТН РГЖ. К группе ТН РГЖ отнесли 54 пациентки с ТН РГЖ, а в группу НТН РГЖ — 205 больных с другими молекулярными подтипами РГЖ (не трижды негативный).
Распределение больных в зависимости от стадии заболевания представлено в табл. 2.
Таблица 2. Распределение больных в зависимости от стадии РГЖ
| Группы обследованных | Стадия заболевания | |||||
|---|---|---|---|---|---|---|
| І стадия | ІІА стадия | ІІБ стадия | ІІІА стадия | ІІІБ стадия | Всего | |
| (T1N0M0) | (TisN1M0, T1N1M0, T2N0M0) | (T2N1M0, T3N0M0) | (TisN2M0, T1N2M0, T2N2M0, T3N1M0, T3N2M0) | (T4N0M0, T4N1M0, T4N2M0) | ||
| ТН РГЖ | 12 | 25 | 15 | 1 | 1 | 54 |
| 22% | 46% | 28% | 2% | 2% | 100% | |
| НТН РГЖ | 60 | 70 | 65 | 6 | 4 | 205 |
| 29% | 34% | 32% | 3% | 2% | 100% | |
Различия между исследуемыми группами статистически не достоверны, что свидетельствует в пользу равномерного распределения больных по стадии заболевания.
В табл. 3 представлены результаты распределения больных в зависимости от молекулярного подтипа РГЖ и ИМТ.
Таблица 3. Разделение больных в зависимости от молекулярного подтипа первичной опухоли и ИМТ
| ИМТ | Молекулярный подтип РГЖ | Всего | |||
|---|---|---|---|---|---|
| (кг/м²) | Luminal A (ER+, PR+, Her2/neu-) |
Luminal B (ER+, PR+, Her2/neu+) |
Her2-positive (ER-, PR-, Her2/neu+) |
Triple negative (ER-, PR-, Her2/neu-) |
|
| До 25 | 52 | 11 | 6 | 9 | 78 |
| 67% | 14% | 7,50% | 11,50% | 100% | |
| 25–29,99 | 63 | 7 | 4 | 19 | 93 |
| 68% | 7,50% | 4% | 20,50% | 100% | |
| Более 30 | 51 | 7 | 4 | 26 | 88 |
| 58% | 8% | 4,50% | 29,50% | 100% | |
| Всего | 166 | 25 | 14 | 54 | 259 |
| 64% | 9,50% | 5,50% | 21% | 100% | |
Среди всех больных РГЖ у 20,5% пациенток с избыточной массой тела диагностируют ТН молекулярный подтип, а среди женщин с ожирением эта цифра достигает 29,5%.
Однофакторный анализ клинико-биологических особенностей РГЖ у исследуемых больных представлен в табл. 4.
Таблица 4. Однофакторный анализ клинико-биологических особенностей РГЖ
| Клинико-биологические факторы | ТН РГЖ | НТН РГЖ | p | ||
|---|---|---|---|---|---|
| n | % | n | % | ||
| Возраст на момент постановки диагноза | <0,05 | ||||
| До 50 лет | 23 | 42,5 | 54 | 26 | |
| 50–69 лет | 26 | 48 | 121 | 59 | |
| 70 и более лет | 5 | 9,5 | 30 | 15 | |
| Индекс массы тела (кг/м²) | <0,05 | ||||
| Менее 25 | 9 | 17 | 69 | 34 | |
| 25–29,99 | 19 | 35 | 74 | 36 | |
| Более 30 | 26 | 48 | 62 | 30 | |
| Размер опухоли | >0,05 | ||||
| До 2 см | 23 | 42,5 | 84 | 41 | |
| 2–5 см | 29 | 54 | 113 | 55 | |
| Более 5см | 2 | 3,5 | 8 | 4 | |
| Степень дифференцировки опухоли | <0,01 | ||||
| G1 | 4 | 7,5 | 10 | 5 | |
| G2 | 23 | 42,5 | 160 | 78 | |
| G3, G4 | 27 | 50 | 35 | 17 | |
| Статус регионарных лимфоузлов | >0,05 | ||||
| Метастазы в лимфоузлах отсутствуют | 28 | 52 | 109 | 53 | |
| Метастазы в лимфоузлах | 26 | 48 | 96 | 47 | |
| Гистологический тип опухоли | >0,05 | ||||
| Протоковый | 34 | 63 | 145 | 71 | |
| Дольковый | 9 | 17 | 42 | 20 | |
| Смешанный (дольковый/протоковый) | 4 | 7 | 11 | 5,5 | |
| Другие* | 7 | 13 | 7 | 3,5 | |
*слизистая, медуллярная и папиллярная карциномы.
В обеих группах размер и морфологический тип опухоли, а также наличие метастазов в регионарных лимфатических узлах статистически достоверно не отличались. ТН молекулярный подтип РГЖ диагностируют у женщин до 50 лет в 42,5% случаев против 26% — среди пациенток из группы НТН РГЖ. Ожирение выявлено у 48% больных ТН РГЖ и у 30% пациенток с другими молекулярными подтипами РГЖ. В группе ТН РГЖ в 50% случаев выявлена низкая (G3, G4) дифференцировка опухоли, а в группе НТН РГЖ такие опухоли встречаются только у 17% больных.
Данные о наличии метастазов в регионарных лимфоузлах в зависимости от размера опухоли представлены в табл. 5.
Таблица 5. Размер опухоли при наличии метастазов в регионарных лимфатических узлах
| Размер опухоли |
ТН РГЖ | НТН РГЖ | Всего |
|---|---|---|---|
| Т1 (до 2 см) | 11/23 | 23/84 | 34/107 |
| 48% | 27% | 32% | |
| Т2 (2–5 см) | 14/29 | 67/113 | 81/142 |
| 48% | 59% | 57% | |
| Т3 (более 5 см) | 1/2 | 6/8 | 7/9 |
| 50% | 75% | 70% | |
| Всего | 26/54 | 96/205 | 122/259 |
| 48% | 47% | 47% |
У больных с ТН РГЖ метастатическое поражение регионарных лимфатических узлов встречается в 48% случаев независимо от размера опухоли. А у пациенток из НТН РГЖ группы частота выявления метастазов в регионарных лимфоузлах прямо пропорциональна размеру опухоли.
Выводы
У больных РГЖ с избыточной массой тела и ожирением наиболее частой формой является люминальный А подтип; на долю ТН РГЖ приходится 20,5 и 29,5% от общего числа этих пациенток (второй по частоте подтип РГЖ).
Среди больных ТН РГЖ ожирение встречается на 18% чаще, чем в группе НТН РГЖ.
Статистически достоверных различий между исследуемыми группами в зависимости от стадии заболевания, размера и гистологического типа опухоли, а также наличия метастазов в регионарных лимфоузлах не получено.
Низкая степень дифференцировки опухоли (G3, G4) на 33% чаще встречается при ТН РГЖ.
Метастазы в регионарные лимфоузлы при ТН РГЖ встречаются почти у половины пациенток и не зависят от размера опухоли в грудной железе.
Литература
1. Лапач С.Н., Чубенко А.В., Бабич П.Н. (2002) Статистика в науке и бизнесе. К.: МОРИОН,195–207.
2. Щепотин И.Б., Зотов А.С., Любота И.И., Любота Р.В., Зайчук В.В., Захарцева Л.М. (2010) Факторы риска развития местных рецидивов инвазивного рака грудной железы. Онкология, 4(12): 347–350.
3. Furuse M., Fujita K., Hiiragi T., Fujimoto K., Tsukita S. (1998) Claudin-1 and -2: novel integral membrane proteins localizing at tight junctions with no sequence similarity to occludin. J. Cell Biol., 7(141): 1539–1550.
4. Kandel M.J., Stadler Z., Masciari S. et al. (2006)Prevalence of BRCA1 mutations in triple negative breast cancer (BC). J Clin Oncol (Meeting Abstracts), 24. (Abstr 508).
5. Perou C.M., Sorlie T., Eisen M.B. et al. (2000) Molecular portraits of human breast tumours. Nature, 406: 747–752.
6. Prat A., Perou C.M. (2009) Mammary development meets cancer genomics. Nat Med., 15: 842–844.
7. Rouzier R., Perou C., Symmans W. et al. (2005) Breast cancer molecular subtypes respond differently to preoperative chemotherapy. Clin. Cancer Res., 11: 5678–85.
8. Sorlie T., Perou C.M., Tibshirani R. et al. (2001) Gene expression patterns of breast carcinomas distinguish tumor subclasses with clinical implications. Proc Natl Acad Sci USA, 98: 10869–10874.
9. Sorlie T., Tibshirani R., Parker J. et al. (2003) Repeated observation of breast tumor subtypes in independent gene expression data sets. Proc Natl Acad Sci USA, 100: 8418–8423.
10. Sotiriou C., Neo S.Y., McShane L.M. et al. (2003)Breast cancer classification and prognosis based on gene expression profiles from a population based study. Proc Natl Acad Sci USA, 100: 10393–10398.
11. Tang P., Skinner K.A., Hicks D.G. (2009) Molecular classification of breast carcinomas by immunohistochemical analysis: are we ready? Diagn Mol Pathol., 18: 125–132.
12. Tischkowitz M., Brunet J.S., Begin L.R. et al. (2007) Use of immunohistochemical markers can refine prognosis in triple negative breast cancer. BMC Cancer, 1(7): 134.
13. Voduc D., Cheang M.C., Prat A. et al. (2011) The other triple-negative breast cancer: Immunohistochemical and clinicopathologic characterization of the Claudin-low subtype. J Clin Oncol., 29. (suppl; abstr 1129).
14. Young S., Pilarski R., Donenberg T. et al. (2009) The prevalence of BRCA mutations among young women with triple-negative breast cancer. BMC Cancer, 1(9): 86–91.














Leave a comment