Авастин®. Новое показание к применению препарата: данные доказательной медицины
Дайджест
Авастин® (бевацизумаб) зарегистрирован в Украине как препарат, показанный для лечения пациентов с распространенным эпителиальным раком яичника в качестве I линии терапии, а также в терапии больных с первым рецидивом эпителиального рака яичника, чувствительного к лечению препаратами платины в комбинации с карбоплатином и гемцитабином. В конце августа текущего года в инcтрукцию по медицинскому применению препарата Авастин® (бевацизумаб) было внесено новое показание. Так, теперь Авастин® в комбинации с паклитакселом, топотеканом или пегилированным липосомальным доксорубицином у взрослых рекомендован в качестве метода лечения больных рецидивирующим эпителиальным раком яичника, фаллопиевой трубы и первичным раком брюшины, резистентным к терапии препаратами платины. Данное показание было одобрено Европейским агентством по лекарственным средствам (European Medicines Agency — EMA) и Управлением по контролю за пищевыми продуктами и лекарственными средствами США (US Food and Drug Administration — FDA) годом ранее. В данной публикации приведены результаты исследований эффективности применения бевацизумаба в качестве дополнения к стандартной химиотерапии I линии, а также при платинорезистентном раке яичника.
Рак яичника (РЯ) удерживает 4-е место по уровню смертности среди всех онкологических заболеваний у женщин. Так, ежегодно диагностируют порядка 200 тыс. новых случаев РЯ и 125 тыс. летальных исходов вследствие этой болезни во всем мире. Летальность пациентов с данной патологией на первом году после установления диагноза составляет 35%. Проблема РЯ имеет огромное медико-социальное значение. По сводным данным популяционных раковых регистров стран Европы, 1-летняя выживаемость больных РЯ составляет 63%, 3-летняя — 41%, 5-летняя — 35% [1].
В течение последних 10 лет стандартной терапией для женщин с распространенным РЯ были хирургическое удаление опухоли и последующая химиотерапия препаратами платины [2–5]. Несмотря на то что РЯ принадлежит к одной из наиболее чувствительных к химиотерапии опухолей, у
около 40% пациенток это заболевание оказывается первично резистентным к платиносодержащей химиотерапии. Даже при выполнении оптимальной циторедуктивной операции и дальнейшем назначении химиотерапии препаратами платины (химиотерапия I линии) с достижением эффекта полной регрессии и нормализации уровней опухолевых маркеров 5-летняя выживаемость больных РЯ III стадии составляет 20–25%, а IV стадии — не превышает 10%. Это означает, что, несмотря на отсутствие клинических признаков заболевания, у большинства пациенток в первые 2–3 года после окончания химиотерапии І линии происходит прогрессирование заболевания. Частота объективного эффекта колеблется в пределах 10–25%, а медиана продолжительности жизни составляет 7–18 мес [1, 6].
В развитии РЯ задействован широкий спектр различных сигнальных молекул, одной из которых является фактор роста эндотелия сосудов (vascular endothelial growth factor —VEGF), который играет особую роль в механизмах ауто- и паракринной регуляции репродуктивной системы, прежде всего — овариальной функции. Высокая экспрессия VEGF, задействованного в процессах неоангиогенеза, в опухолевых клетках яичника является фактором агрессивного течения и неблагоприятного прогноза заболевания [7]. При этом неоангиогенез является необходимым условием роста солидной опухоли и метастазирования [8, 9]. Клеточные линии эпителиального РЯ часто экспрессируют VEGF [10]. Снижение уровня экспрессии VEGF связано с уменьшением активности васкуляризации и неоангиогенеза в опухоли наряду с увеличением выживаемости [11].
Бевацизумаб (Авастин®) является препаратом на основе моноклональных антител, которые связывают все изоформы лиганда VEGF-рецептора — VEGF А, и обладает доказанной эффективностью при метастатическом колоректальном раке и раке легкого, а также проявляет свою активность при раке почки, грудной железы и мозга [12–14].
Исследования III фазы продемонстрировали эффективность бевацизумаба по показателям ответа на лечение и задержки прогрессирования заболевания у женщин с РЯ [15–17].
Исследование ICON7: добавление бевацизумаба к стандартной химиотерапии I линии
Исследование ICON7 (The Gynecologic Cancer InterGroup (GCIG) International Collaboration on Ovarian Neoplasms) проведено с целью изучить, каким образом добавление бевацизумаба к стандартной химиотерапии І линии при РЯ влияет на результаты лечения [18]. Отличительной чертой данного исследования по сравнению с предшествующими стала сниженная дозировка бевацизумаба до 7,5 мг/кг.
В исследовании приняли участие 1528 женщин из 11 стран. Медиана возраста пациенток составила 57 лет, у 90% из них был диагностирован эпителиальный РЯ. Больных рандомизировали на 2 группы (1:1): первая получала карбоплатин (AUC 5–6) и паклитаксел (175 мг/м2) каждые 3 нед по 6 циклов, вторая — тот же режим, но с добавлением бевацизумаба (7,5 мг/кг) каждые 3 нед по 5–6 циклов и еще дополнительно 12 циклов или до прогрессирования заболевания. В качестве первичной конечной точки была выбрана выживаемость без прогрессирования заболевания (ВБП).
Результаты исследования по итогам 42 мес после рандомизации пациентов
Долгосрочное улучшение ВБП отмечали в группе бевацизумаба по прошествии 42 мес после рандомизации пациентов. Так, медиана ВБП в группе, дополнительно к стандартной терапии получавшей бевацизумаб, составила 19,8 и 17,4 мес (ОР 0,87; 95% ДИ 0,77–0,99; р=0,04) — у пациенток, у которых применяли стандартное лечение. Показано, что выраженность эффекта от применения бевацизумаба отличалась у пациенток с высоким риском прогрессирования заболевания и остальной части участниц исследования (p=0,06).
У пациенток с высоким риском прогрессирования РЯ зафиксировано преимущество от применения бевацизумаба в отношении ВБП по сравнению со стандартной терапией. Так, медиана ВБП достигла 16,0 и 10,5 мес соответственно через 42 мес после рандомизации (ОР 0,73; 95% ДИ 0,60–0,93; p=0,002). Кривые ВБП были аналогичны полученным в ходе основного анализа после 24 мес наблюдения (рис. 1).
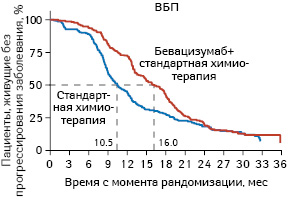
Рис. 1. ВБП у пациентов с высоким риском прогрессирования
Адаптировано из: Perren T.J., Swart A.M., Pfisterer J. et al., 2011 [18]
Бевацизумаб высокоэффективен у пациентов с высоким риском прогрессирования заболевания (рис. 2). Медиана общей выживаемости (ОВ) составила 28,8 мес в группе, в которой применяли стандартную терапию, и 36,6 мес — в группе, дополнительно к стандартной схеме лечения получавшей бевацизумаб (ОР 0,64; 95% ДИ 0,48–0,85; р=0,002).
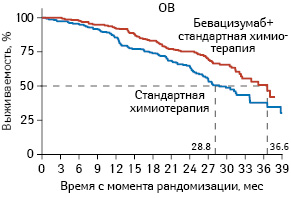
Рис. 2. ОВ у пациентов с высоким риском прогрессирования
Адаптировано из: Perren T.J., Swart A.M., Pfisterer J. et al., 2011 [18]
Таким образом, применение бевацизумаба (7,5 мг/кг) наряду с 5 или 6 циклами платиносодержащей химиотерапии и продолжающееся в течение дополнительных 12 циклов приводит к улучшению ВБП примерно на 2 мес и повышению уровня ответа на терапию на 20%. Эти данные свидетельствуют о биологической активности бевацизумаба с максимальным улучшением ВБП РЯ примерно на 15% через 12 мес лечения. Медиана ВБП и ОВ были достоверно высокие у пациентов с повышенным риском прогрессирования заболевания по сравнению с пациентами с низким риском.
Исследование AURELIA: применение бевацизумаба при платинорезистентном раке яичника
Интервал без назначения платиносодержащих препаратов является сильным предиктором успеха лечения при рецидивирующем РЯ [19]. В зависимости от сроков прогрессирования болезни принято различать такие типы опухолей: платинорефрактерные (прогрессирующие во время химиотерапии І линии с включением препарата платины), платинорезистентные (прогрессирующие в течение 6 мес после окончания химиотерапии І линии с включением препарата платины) и платиночувствительные (прогрессирующие через более чем 6 мес после окончания химиотерапии І линии) [1]. При первом рецидиве примерно у 25% больных отмечают платинорезистентный РЯ; почти у всех пациенток с рецидивирующей болезнью, в конечном счете, развивается резистентность к препаратам платины.
При лечении пациенток с платинорезистентным РЯ наиболее активными являются пегилированный липосомальный доксорубицин (PLD), паклитаксел и топотекан [20–24]. Несколько исследований в этой сфере продемонстрировали, что сочетание этих агентов в ходе химиотерапии повышает токсичность без улучшения эффективности [20, 25, 26]. Таким образом, прогноз течения заболевания у пациенток остается неблагоприятным, а медиана ОВ составляет примерно 12 мес [27], что делает особенно актуальной разработку новых стратегий лечения для таких больных.
Эффективность новой стратегии с применением бевацизумаба изучена в ходе клинического исследования AURELIA (Avastin Use in Platinum-Resistant Epithelial Ovarian Cancer) [28]. Это первое открытое рандомизированное исследование III фазы по оценке эффективности применения комбинации бевацизумаба и химиотерапии у пациентов с платинорезистентным рецидивирующим РЯ. В качестве первичной конечной точки была выбрана ВБП.
В исследовании приняли участие 361 пациентка, рандомизированные в две группы: первая (n=182) получала монохимиотерапию (пегилированный липосомальный доксорубицин, паклитаксел или топотекан), вторая (n=179) — монохимиотерапию в сочетании с бевацизумабом (10 мг/кг каждые 2 нед или 15 мг/кг каждые 3 нед).
Согласно результатам исследования медиана ВБП составила 3,4 мес (95% ДИ 2,2–3,7) для группы, в которой проводили только химиотерапию, по сравнению с 6,7 мес (95% ДИ 5,7–7,9) для группы, получавшей химиотерапию в сочетании с бевацизумабом (рис. 3). Таким образом, применение бевацизумаба позволяет увеличить медиану ВБП практически вдвое — до 6,7 мес (p<0,001; ОР 0,48).
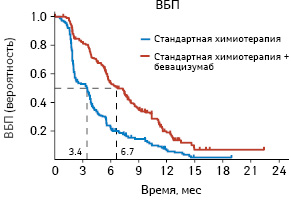
Рис. 3. ВБП у пациенток с платинорезистентным РЯ
Адаптировано из: Pujade-Lauraine E., Hilpert F., Weber B. et al., 2014 [28]
Уровень общего ответа составил 12,6% в группе применения только химиотерапии по сравнению с 30,9% в группе, участницы которой получали химиотерапию в сочетании с бевацизумабом.
ОВ по состоянию на 25 января 2013 г. для обеих групп не имела статистически достоверного различия (ОР 0,85; 95% ДИ 0,66–1,08; р<0,174).
Побочные эффекты, представляющие особый интерес (отмечавшиеся в более ранних исследованиях бевацизумаба), регистрировали у 40,3% пациенток в группе, получавшей только химиотерапию, и у 57,0% больных в группе, в которой применяли химиотерапию в сочетании с бевацизумабом. Так, зафиксирована повышенная частота развития артериальной гипертензии и протеинурии II степени. У 2,2% пациенток диагностировано развитие желудочно-кишечной перфорации. Гематологическая токсичность III степени возникала в обеих группах с сопоставимой частотой.
Таким образом, в исследовании AURELIA продемонстрировано статистически достоверное значительное повышение ВБП с 3,4 до 6,7 мес (p<0,001; ОР 0,48; 95% ДИ 0,38–0,60) путем добавления к химиотерапии бевацизумаба у пациенток с платинорезистентным РЯ. При этом повышение данного показателя отмечали для всех подгрупп. Особенно это примечательно для пациенток с асцитом и неблагоприятным прогнозом течения болезни. Кроме того, полученные данные свидетельствуют, что добавление бевацизумаба к терапии позволяет улучшить контроль асцита. Это, вероятно, связано с ролью VEGF в развитии асцита.
Результаты исследования AURELIA подтверждают ведущую роль бевацизумаба в лечении больных РЯ. Таким образом, включение бевацизумаба в качестве І линии терапии позволяет пациенту получить при рецидиве больше курсов химиотерапии на основе препаратов платины, оставаясь чувствительным к ним.
Руководство по клинической практике ESMO (European Society for Medical Oncology) [29] рекомендует включение дополнительно бевацизумаба в терапию пациентов с распространенным РЯ с неблагоприятным прогнозом, в частности с IV стадией или субоптимальной циторедукцией, как определено в ICON-7. Бевацизумаб следует назначать с паклитакселом или карбоплатином с длительностью лечения 1 год. Также Руководство NCCN (National Comprehensive Cancer Network) [30] рекомендует применение бевацизумаба в сочетании с гемцитабином или карбоплатином в качестве первичной химиотерапии при II–IV стадии заболевания (категория 3 рекомендаций) при РЯ, раке фаллопиевой трубы, брюшины в дозе 7,5 мг/кг в сочетании с паклитакселом (175 мг/м2) и карбоплатином (AUC 6) каждые 3 нед 5–6 циклов, затем продолжить до 12 циклов бевацизумабом (3-я категория). Со второго цикла возможно применение бевацизумаба в дозировке 15 мг/кг каждые 3 нед до 22 циклов (3-я категория). При платиночувствительном РЯ применение бевацизумаба рекомендовано в сочетании с карбоплатином и гемцитабином (категория 2В), а при платинорезистентном раке — в комбинации с липосомальным доксорубицином или паклитакселом либо топотеканом.
Список использованной литературы
1. Дубініна В.Г., Рибін А.І., Лисенко М.А., Кузнецова О.В. (2014) Аналіз цитогенетичних характеристик у хворих на платинорефрактерний рак яєчника. Клин. онкол., 2(14): 70–74.
2. Bookman M.A., Brady M.F., McGuire W.P. et al. (2009) Evaluation of new platinum-based treatment regimens in advanced-stage ovarian cancer: a Phase III Trial of the Gynecologic Cancer Intergroup. J. Clin. Oncol., 27: 1419–1425 [Erratum, J. Clin. Oncol. 2009; 27: 2305].
3. du Bois A., Weber B., Rochon J. et al. (2006) Addition of epirubicin as a third drug to carboplatin-paclitaxel in first-line treatment of advanced ovarian cancer: a prospectively randomized gynecologic cancer intergroup trial by the Arbeitsgemeinschaft Gynaekologische Onkologie Ovarian Cancer Study Group and the Groupe d’Investigateurs Nationaux pour l’Etude des Cancers Ovariens. J. Clin. Oncol., 24: 1127–1135.
4. Pfisterer J., Weber B., Reuss A. et al. (2006) Randomized phase III trial of topotecan following carboplatin and paclitaxel in first-line treatment of advanced ovarian cancer: a gynecologic cancer intergroup trial of the AGO-OVAR and GINECO. J. Natl. Cancer Inst., 98:1036–1045.
5. Hoskins P., Vergote I., Cervantes A. et al. (2010) Advanced ovarian cancer: phase III randomized study of sequential cisplatin-topotecan and carboplatin-paclitaxel vs. carboplatinpaclitaxel. J. Natl. Cancer Inst., 102: 1547–1556.
6. Fleming J.S., Beaugie C.R., Haviv I. (2006) Incescant ovulation, inflammation and epithelial ovarian cancerogenesis: Revisiting old hypothesis. Mol. Cell. Endocrinol., 247: 4–21.
7. Ткаля Ю.Г., Воробьева Л.И., Свинцицкий В.С. та ін. (2014) Особенности гормонального рецепторного статуса, экспрессии VEGF, HER2/neu в серозном раке и функциональных кистах яичника. Гормональный гомеостаз у больных с рецидивом серозного рака яичника. Клин. онкол., 4(16): 81–89.
8. Folkman J. (1972) Anti-angiogenesis: new concept for therapy of solid tumors. Ann. Surg., 175: 409–416.
9. Folkman J. (1990) What is the evidence that tumors are angiogenesis dependent? J. Natl. Cancer Inst., 82: 4–6.
10. Yoneda J., Kuniyasu H., Crispens M.A. et al. (1998) Expression of angiogenesis-related genes and progression of human ovarian carcinomas in nude mice. J. Natl. Cancer Inst., 90: 447–454.
11. Huang S., Robinson J.B., Deguzman A. et al. (2000) Blockade of nuclear factor-kappaB signaling inhibits angiogenesis and tumorigenicity of human ovarian cancer cells by suppressing expression of vascular endothelial growth factor and interleukin 8. Cancer Res., 60: 5334–5339.
12. Hurwitz H., Fehrenbacher L., Novotny W. et al. (2004) Bevacizumab plus irinotecan, fluorouracil, and leucovorin for metastatic colorectal cancer. N. Engl. J. Med., 350: 2335–2342.
13. Sandler A., Gray R., Brahmer J. (2005) Randomised phase II/III trial of paclitaxel (P) plus carboplatin (C) with or without bevacizumab (NSC #704865) in patients with advanced non-squamous non-small cell lung cancer (NSCLC): an Eastern Cooperative Oncology Group (ECOG) trial. Presented at the 41st Annual Meeting of the American Society of Clinical Oncology, Orlando, FL, May 13–17, 2005. abstract.
14. Eskens F.A., Sleijfer S. (2008) The use of bevacizumab in colorectal, lung, breast, renal and ovarian cancer: where does it fit? Eur. J. Cancer, 44: 2350–2356.
15. Burger R.A., Sill M.W., Monk B.J. et al. (2007) Phase II trial of bevacizumab in persistent or recurrent epithelial ovarian cancer or primary peritoneal cancer: a Gynecologic Oncology Group study. J. Clin. Oncol., 25: 5165–5171.
16. Cannistra S.A., Matulonis U.A., Penson R.T. et al. (2007) Phase II study of bevacizumab in patients with platinum-resistant ovarian cancer or peritoneal serous cancer. J. Clin. Oncol., 25: 5180–5186 [Erratum, J. Clin. Oncol. 2008; 26: 1773].
17. Garcia A.A., Hirte H., Fleming G. et al. (2008) Phase II clinical trial of bevacizumab and low-dose metronomic oral cyclophosphamide in recurrent ovarian cancer: a trial of the California, Chicago, and Princess Margaret Hospital Phase II Consortia. J. Clin. Oncol., 26: 76–82.
18. Perren T.J., Swart A.M., Pfisterer J. et al. (2011) A phase 3 trial of bevacizumab in ovarian cancer. New Engl. J. Med., 365(26): 2484–2496.
19. Pujade-Lauraine E., Alexandre J.L. (2011) Update of randomized trials in recurrent disease. Ann. Oncol., 22: viii61–viii64 (suppl. 8).
20. Buda A., Floriani I., Rossi R. et al. (2004) Randomised controlled trial comparing single agent paclitaxel vs epidoxorubicin plus paclitaxel in patients with advanced ovarian cancer in early progression after platinum-based chemotherapy: An Italian collaborative study from the Mario Negri Institute, Milan, GONO (Gruppo Oncologico Nord Ovest) group and IOR (Istituto Oncologico Romagnolo) group. Br. J. Cancer, 90: 2112–2117.
21. Gordon A.N., Fleagle J.T., Guthrie D. et al. (2001)Recurrent epithelial ovarian carcinoma: a randomized phase III study of pegylated liposomal doxorubicin versus topotecan. J. Clin. Oncol., 19: 3312–3322.
22. Vergote I., Finkler N., del Campo J. et al. (2009) ASSIST-1 study group: Phase 3 randomised study of canfosfamide (Telcyta, TLK286) versus pegylated liposomal doxorubicin or topotecan as third-line therapy in patients with platinum-refractory or -resistant ovarian cancer. Eur. J. Cancer, 45: 2324–2332.
23. Mutch D.G., Orlando M., Goss T. et al. (2007)Randomized phase III trial of gemcitabine compared with pegylated liposomal doxorubicin in patients with platinum-resistant ovarian cancer. J. Clin. Oncol., 25: 2811–2818.
24. ten Bokkel Huinink W., Gore M., Carmichael J. et al. (1997) Topotecan versus paclitaxel for the treatment of recurrent epithelial ovarian cancer. J. Clin. Oncol., 15: 2183–2193.
25. Sehouli J., Stengel D., Oskay-Oezcelik G. et al. (2008) Nonplatinum topotecan combinations versus topotecan alone for recurrent ovarian cancer: Results of a phase III study of the North-Eastern German Society of Gynecological Oncology Ovarian Cancer Study Group. J. Clin. Oncol., 26: 3176–3182.
26. Lortholary A., Largillier R., Weber B. et al. (2012) Weekly paclitaxel as a single agent or in combination with carboplatin or weekly topotecan in patients with resistant ovarian cancer: The CARTAXHY randomized phase II trial from Groupe d’Investigateurs Nationaux pour l’Etude des Cancers Ovariens (GINECO). Ann. Oncol., 23: 346–352.
27. Naumann R.W., Coleman R.L. (2011) Management strategies for recurrent platinum-resistant ovarian cancer. Drugs, 71: 1397–1412.
28. Pujade-Lauraine E., Hilpert F., Weber B. et al. (2014) Bevacizumab combined with chemotherapy for platinum-resistant recurrent ovarian cancer: the AURELIA open-label randomized phase III trial. J. Clin. Oncol., 32(13): 1302–1308.
29. Ledermann J.A., Raja F.A., Fotopoulou C. et al.; on behalf of the ESMO Guidelines Working Group (2013) Newly diagnosed and relapsed epithelial ovarian carcinoma: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann. Oncol., 24 (Suppl. 6): vi24–vi32.
30. NCCN Clinical Practice Guidelines in Oncology Ovarian Cancer Including Fallopian Tube Cancer and Primary Peritoneal Cancer Version 2.2015.














Leave a comment